获取国外协同作用药品价格,使用等信息,最快 24 小时回馈
协同作用
协同作用
什么是Corifact?
Corifact(XIII因子)用于预防因XIII因子缺乏引起的遗传性出血性疾病的出血事件。
XIII因子(十三)是血液中天然存在的蛋白质,有助于血液凝结。缺乏凝血因子会导致无法控制的出血,因为血液无法正常凝结。该药物的作用是暂时提高血液中这些XIII因子的水平,以帮助凝血。
Corifact不会治疗已经开始的出血发作。
Corifact也可用于本用药指南中未列出的目的。
重要信息
如果您对任何由人血浆制成的药物过敏,则不应使用Corifact。
在使用Corifact之前,请告诉医生您是否患有肝脏疾病。
您可能会看到如何在家中使用静脉注射。如果您不完全了解如何进行注射并正确处理用过的针头,静脉输液管和其他用于注射药物的物品,请不要自行注射Corifact。
如果您出现新的或恶化的出血事件,突然的麻木或无力,胸痛,咳血,视力或言语问题或疼痛,肿胀,温暖或一只或两只腿发红,请立即致电医生。
在服药之前
如果您对XIII因子或任何由人血浆制成的药物过敏,则不应使用Corifact。
为确保Corifact对您安全,请告知您的医生是否患有:
肝病。
尚不知道Corifact是否会伤害未出生的婴儿。告诉您的医生您是否怀孕或打算在使用该药物时怀孕。
尚不知道XIII因子是否会进入母乳或是否会损害哺乳婴儿。告诉医生您是否正在母乳喂养婴儿。
Corifact是由人血浆(血液的一部分)制成的,血浆中可能含有病毒和其他传染因子。对捐赠的血浆进行了测试和处理,以降低其含有传染病的风险,但仍可能传播疾病。与您的医生讨论使用这种药物的风险和益处。
我应该如何服用Corifact?
Corifact通过静脉注射入静脉。您可能会看到如何在家中使用静脉注射。如果您不完全了解如何进行注射以及正确处置用过的针头,静脉输液管和其他用于注射药物的物品,请勿自行注射该药物。
Corifact通常每4周给予一次。请非常仔细地遵循医生的剂量说明。
Corifact是一种粉末药物,使用前必须与液体(稀释剂)混合。如果您在家中使用注射剂,请确保您了解如何正确混合和储存药物。
进行注射前,让混合物达到室温。使用前请勿加热药物。
Corifact外观应清晰或略带黄色。如果药物已变色或有颗粒,请勿使用。致电您的医生以获取新处方。
请勿在同一IV线中将Corifact与其他可注射药物混合。
该药的每次使用小瓶(瓶)仅供一次使用。一次使用后扔掉,即使在注射剂量后仍剩一些药物。
只能使用一次性针头一次。请遵守任何州或地方有关丢弃用过的针头和注射器的法律。使用防刺穿的“利器”处理容器(询问您的药剂师哪里可以拿到它以及如何丢弃它)。请将此容器放在儿童和宠物接触不到的地方。
使用这种药物时,您可能需要经常进行血液检查。
将未混合的Corifact存放在冰箱中,请勿冷冻。将药物保存在其原始容器中。
未打开的小瓶也可以在室温下保存六个月,远离湿气,热量和光线。不要冷藏已在室温下保存的未打开的小瓶。
与稀释剂混合后,在室温下保存并在4小时内使用。不要冷藏或冷冻。
标签上的有效期限过后,请丢弃所有未使用的Corifact。
如果我错过剂量怎么办?
如果您错过一定剂量的Corifact,请致电您的医生以获取指导。
如果我服药过量怎么办?
寻求紧急医疗护理或致电1-800-222-1222,拨打毒药帮助热线。
服用Corifact时应该避免什么?
关于食物,饮料或活动的任何限制,请遵循医生的指示。
Corifact副作用
如果您对Corifact有过敏反应,请寻求紧急医疗救助。呼吸困难;头晕脸,嘴唇,舌头或喉咙肿胀。
如果您有以下情况,请立即致电您的医生:
新的或恶化的出血发作;
不寻常的瘀伤;
中风迹象-突然的麻木或虚弱(尤其是在身体的一侧),突然的剧烈头痛,言语不清,视力或平衡问题;
肺部有血块迹象-胸痛,突然咳嗽,喘息,呼吸急促,咳血;要么
腿上有血块的迹象-一只或两只腿疼痛,肿胀,发热或发红。
常见的Corifact副作用可能包括:
发烧,发冷,流感症状;
胃痛,呕吐,腹泻,
头痛;
关节痛;
轻度皮疹或瘙痒;要么
感冒症状,如鼻塞,打喷嚏,喉咙痛。
这不是副作用的完整列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响Corifact?
其他药物可能与XIII因子相互作用,包括处方药和非处方药,维生素和草药产品。向您的每个医疗保健提供者告知您现在使用的所有药物以及您开始或停止使用的任何药物。
版权所有1996-2020 Cerner Multum,Inc.版本:1.05。
注意:本文档包含有关因子XIII的副作用信息。此页面上列出的某些剂型可能不适用于Corifact品牌。
对于消费者
适用于因子十三:溶液用静脉粉
需要立即就医的副作用
XIII因子(Corifact中包含的活性成分)及其所需的作用可能会引起一些不良影响。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用因子XIII时,请立即与您的医生或护士联系,检查是否出现以下任何副作用:
比较普遍;普遍上
- 鼻子流血
- 挫伤
- 皮肤下的血液收集
- 深,深紫色的瘀伤
- 发热
- 瘙痒,疼痛,发红或肿胀
发病率未知
- 胸痛
- 咳嗽
- 头晕或昏厥
- 麻疹
- 胸部,腹股沟或腿部特别是小腿疼痛
- 眼睑或眼睛,面部,嘴唇或舌头周围浮肿或肿胀
- 皮肤的红色,鳞状,肿胀或脱皮
- 严重,突然头痛
- 气促
- 患处有压痛,疼痛,肿胀,发热,皮肤变色和明显的浅表静脉
- 异常疲倦或虚弱
不需要立即就医的副作用
XIII因子的某些副作用可能会发生,通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 搬家困难
- 普遍感到不适或生病
- 头痛
- 关节痛
- 肌肉酸痛
对于医疗保健专业人员
适用于因子XIII:静脉注射粉剂
过敏症
常见(1%至10%):过敏
罕见(0.1%至1%):严重的超敏反应[参考]
心血管的
罕见(0.1%至1%):急性缺血[参考]
免疫学的
常见(1%至10%):凝血酶-抗凝血酶水平升高
罕见(0.1%至1%):中和针对因子XIII的抗体[参考]
肌肉骨骼
常见(1%至10%):关节发炎,关节痛[Ref]
皮肤科
常见(1%至10%):皮疹,瘙痒,红斑,血肿[参考]
神经系统
常见(1%至10%):头痛[参考]
新陈代谢
常见(1%至10%):血液乳酸脱氢酶增加[参考]
参考文献
1.“产品信息。Corifact(因子XIII)。” CSL Behring,宾夕法尼亚州普鲁士国王。
某些副作用可能没有报道。您可以将其报告给FDA。
重组
目视检查重新配制的溶液。只要溶液和容器允许,在给药前应目视检查肠胃外药品是否有颗粒物质和变色。
提供以下程序作为CORIFACT的准备和重组的一般准则。
如下在室温下重构CORIFACT:
- 确保CORIFACT小瓶和稀释瓶在室温下。
- 放置CORIFACT小瓶中,稀释剂的小瓶中,并在平坦表面上推出Mix2Vial®转移集。
- 取下CORIFACT和稀释液瓶盖。用酒精棉签擦拭塞子,让塞子变干,然后再打开Mix2Vial传输套件包装。
- 剥去盖子,打开Mix2Vial传输套件包装(图1)。将Mix2Vial传输设备保留在透明包装中。
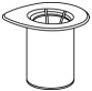
图。1 - 将稀释瓶放在平坦的表面上,并紧紧握住该瓶。抓住Mix2Vial传输装置和透明包装,将Mix2Vial传输装置蓝色端的塑料钉牢牢推入稀释瓶的塞子中心(图2)。
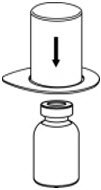
图2 - 小心地从Mix2Vial传输套件中取出透明包装。确保只拉起透明包装,而不拉Mix2Vial传送装置(图3)。
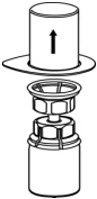
图3 - 将CORIFACT小瓶牢固地放置在平坦的表面上,将稀释的小瓶倒置,并连接Mix2Vial传输套件,然后将透明适配器的塑料钉牢固地推入CORIFACT小瓶的塞子中心(图4)。稀释剂将自动转移到CORIFACT小瓶中。
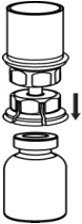
图4 - 将稀释剂和CORIFACT小瓶仍连接到Mix2Vial传输套件上,轻轻旋转CORIFACT小瓶以确保CORIFACT完全溶解(图5)。不要摇动小瓶。
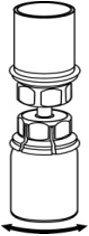
图5 - 一只手握住Mix2Vial转移装置的CORIFACT一侧,另一只手握住Mix2Vial转移装置的蓝色稀释剂一侧,然后将其拧松成两片(图6)。
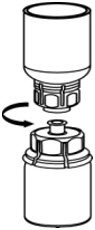
图6 - 将空气吸入空的无菌注射器中。将CORIFACT小瓶直立时,将注射器拧到Mix2Vial传输套件上。将空气注入CORIFACT小瓶。按住注射器柱塞的同时,将系统倒置,并通过缓慢向后拉柱塞将浓缩液吸入注射器(图7)。
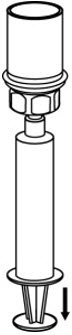
图7 - 现在将浓缩物转移到注射器中,牢牢抓住注射器的枪管(保持柱塞朝下),然后从Mix2Vial转移装置上拧下注射器(图8)。将注射器连接到合适的静脉内给药装置上。
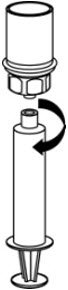
图8 - 如果患者需要多个药瓶,请将多个药瓶的内容物汇集到一个注射器中。为每个产品瓶使用单独的未使用的Mix2Vial传输套件。
- CORIFACT仅可单次使用。不含防腐剂。产品必须在重新配制后的4小时内使用。请勿冷藏或冷冻重新配制的溶液。丢弃部分用过的小瓶。
Corifact的适应症和用法
Corifact是XIII因子浓缩物,适用于成人和小儿先天性FXIII缺乏症的常规预防性治疗和围手术期处理的外科手术出血。
协同剂量和给药
剂量
- 每公斤体重40国际单位(IU),每分钟不超过4毫升
- 调整剂量每公斤±5 IU,以保持FXIII活性的5%至20%谷值水平,如下例所示
| FXIII活性谷水平(%) | 剂量变更 |
|---|---|
| 一谷水平<5% | 每公斤增加5 IU |
| 谷值水平为5%至20% | 没变化 |
| 两个波谷水平> 20% | 每公斤减少5 IU |
| 一谷水平> 25% | 每公斤减少5 IU |
行政
- 以每分钟不超过4毫升的速度进行管理
- 常规预防,每28天服用一次
- 对于手术出血的围手术期处理:
- 剂量应根据患者的FXIII活性水平,手术类型和临床反应进行个性化
- 在手术期间和之后监测患者的FXIII活性水平
- 以下是参考患者的最后预防剂量进行围手术期管理的剂量调整示例:
| 自上次剂量以来的时间 | 剂量 |
|---|---|
| 7天内 | 可能不需要额外剂量 |
| 8 – 21天 | 根据FXIII活性水平,可能需要额外的部分或全部剂量 |
| 21 – 28天 | 完全预防剂量 |
使用Berichrom活性测定法(以国际血液凝结因子XIII国际标准血浆)为基准,确定以国际单位表示的效价。
重组
目视检查重新配制的溶液。只要溶液和容器允许,在给药前应目视检查肠胃外药品是否有颗粒物质和变色。
提供以下程序作为制备和复配Corifact的一般指南。
按以下步骤在室温下重建Corifact:
- 确保Corifact小瓶和稀释瓶在室温下。
- 放置Corifact小瓶中,稀释剂的小瓶中,并在平坦表面上推出Mix2Vial®转移集。
- 取下Corifact和稀释液小瓶盖。用酒精棉签擦拭塞子,让塞子变干,然后再打开Mix2Vial传输套件包装。
- 剥去盖子,打开Mix2Vial传输套件包装(图1)。将Mix2Vial传输设备保留在透明包装中。

图。1 - 将稀释瓶放在平坦的表面上,并紧紧握住该瓶。抓住Mix2Vial传输装置和透明包装,将Mix2Vial传输装置蓝色端的塑料钉牢牢推入稀释瓶的塞子中心(图2)。

图2 - 小心地从Mix2Vial传输套件中取出透明包装。确保只拉起透明包装,而不拉Mix2Vial传送装置(图3)。

图3 - 将Corifact小瓶牢固地放置在平坦的表面上,将稀释的小瓶倒置,并连接Mix2Vial传输套件,然后将透明适配器的塑料钉牢固地推入Corifact小瓶的塞子中心(图4)。稀释剂将自动转移到Corifact小瓶中。

图4 - 将稀释剂和Corifact小瓶仍连接到Mix2Vial传输装置上,轻轻旋转Corifact小瓶以确保Corifact完全溶解(图5)。不要摇动小瓶。

图5 - 一只手握住Mix2Vial转移套件的Corifact侧,另一只手握住Mix2Vial转移套件的蓝色稀释剂侧,然后将其拧松成两片(图6)。

图6 - 将空气吸入空的无菌注射器中。将Corifact小瓶直立时,将注射器拧到Mix2Vial传输套件上。将空气注入Corifact小瓶中。按住注射器柱塞的同时,将系统倒置,并通过缓慢向后拉柱塞将浓缩液吸入注射器(图7)。

图7 - 现在将浓缩物转移到注射器中,牢牢抓住注射器的枪管(保持柱塞朝下),然后从Mix2Vial转移装置上拧下注射器(图8)。将注射器连接到合适的静脉内给药装置上。

图8 - 如果患者需要多个药瓶,请将多个药瓶的内容物汇集到一个注射器中。为每个产品瓶使用单独的未使用的Mix2Vial传输套件。
- Corifact仅可单次使用。不含防腐剂。产品必须在重新配制后的4小时内使用。请勿冷藏或冷冻重新配制的溶液。丢弃部分用过的小瓶。
剂型和优势
Corifact可作为冻干粉装在单次使用的小瓶中,该小瓶中包含1000-1600单位的XIII浓缩物,以进行重构。提供20毫升小瓶无菌注射用水(USP)进行重构。
FXIII效力的实际单位在每个Corifact小瓶标签和纸箱上都有说明。
禁忌症
对人类血浆来源的产品有已知的过敏性或严重全身性反应的患者禁用Corifact [见说明(11) ] 。
警告和注意事项
过敏症
用Corifact观察到超敏反应。如果出现过敏反应或超敏反应(包括荨麻疹,皮疹,胸闷,喘息,低血压)的体征或症状,请立即停止给药[见患者咨询信息(17) ],并采取适当的治疗措施。
免疫原性
在接受Corifact的患者中已检测到针对FXIII的抑制性抗体的开发。监视患者抑制性抗体的发展。抑制性抗体的存在可能表明对治疗的反应不足。如果未达到预期的血浆FXIII活性水平,或者在接受预防时发生突破性出血,请执行可测量FXIII抑制性抗体浓度的测定。
血栓栓塞风险
血栓栓塞并发症已有报道。监视具有已知血栓事件危险因素的患者。
传染病传播
因为Corifact是由人类血液制成的,因此可能具有传播传染原的风险,例如病毒,变异的Creutzfeldt-Jakob病(vCJD)病原以及理论上的Creutzfeldt-Jakob病(CJD)病原。这也适用于未知或新兴病毒和其他病原体。
医师或其他医疗保健提供者应将医师认为可能由本产品传播的所有感染报告给CSL Behring药物警戒部门(1-866-915-6958)或FDA(1-800-FDA-1088)或www.fda.gov/medwatch 。
监控实验室测试
- 在用Corifact治疗期间监测患者的谷FXIII活性水平[见剂量和用法(2.2) ] 。
- 如果发生突破性出血,或者未达到预期的血浆FXIII峰值活性,请进行研究以确定FXIII抑制性抗体的存在[请参见临床药理学(12.3) ] 。
不良反应
临床试验中报告的最常见不良反应(> 1%)是关节发炎,超敏反应,皮疹,瘙痒,红斑,血肿,关节痛,头痛,凝血酶-抗凝血酶水平升高和血液乳酸脱氢酶升高。
报道的严重不良反应(发生频率为0.5%)为超敏反应,急性缺血和针对FXIII的中和抗体[请参阅警告和注意事项5 ] 。
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
十二项临床研究共包括188名受试者,<16岁以下的有108名受试者[见特定人群的使用(8.4) ] ,研究中总共进行了约4314次Corifact输注。概述了最常见的不良反应,发生率为1-2% [请参阅不良反应(6) ] 。
免疫原性
一项公开招募的临床研究报告了一例中和针对FXIII的抗体的情况。该患者接受了Corifact的预防性治疗长达十年。伴随药物包括用于丙型肝炎感染的干扰素。该患者出现淤青,并且输注后的FXIII水平低于预期。在数周内,FXIII的恢复值下降,因此治疗的剂量和频率增加。检测到针对FXIII的中和抗体,中断干扰素治疗,并对该受试者进行血浆置换。在一个月之内,不再检测到中和抗体,FXIII的恢复水平得到改善,并且恢复了以前的预防方案。
在特定人群中的使用
怀孕
风险摘要
Corifact尚未进行动物繁殖研究。
在美国普通人群中,在临床公认的怀孕中,主要先天缺陷和流产的估计背景风险分别为2-4%和15-20%。
临床注意事项:与疾病相关的母亲和/或胚胎/胎儿风险
流产是先天性FXIII缺乏与在136周妊娠观察而不例程FXIII补充预防的91%的速度和11%在45周妊娠常规FXIII预防1已知的并发症。
哺乳期
风险摘要
没有关于母乳中Corifact的存在,对母乳喂养的孩子的影响或对牛奶产量的影响的信息。应当考虑母乳喂养的发育和健康益处,以及母亲对Corifact的临床需求以及Corifact或潜在的母体状况对母乳喂养的孩子的任何潜在不利影响。
儿科用
在Corifact临床研究的188名受试者中,有108名受试者入选时年龄小于16岁(见表3 )。
| 年龄阶层 | 科目 (n) |
|---|---|
| <1个月 | 2 |
| 1个月至<2年 | 16 |
| 2至11岁 | 60 |
| 12至<16岁 | 30 |
在药代动力学研究中[见临床药理学(12.3) ],这14名受试者中有5名的年龄在2至<16岁之间。小于16岁的受试者的半衰期(5.7±1.00天)和清除率(0.29±0.12 mL / hr / kg)与成人相比(半衰期:7.1±2.74天,清除率:0.22±0.07 mL / kg) hr / kg)。 <16岁的患者可能需要调整剂量。与成人相比,儿童的安全性没有差异。
老人用
Corifact的临床研究未包括65岁及以上的受试者,以确定他们与年轻受试者的反应是否不同。通常,老年患者的剂量选择应谨慎,通常从给药范围的低端开始,这反映出肝,肾或心脏功能下降以及伴随疾病或其他药物治疗的频率更高。
内容描述
Corifact,凝血因子XIII浓缩物(人类),是一种经过热处理的,凝固性凝血因子XIII的冻干浓缩物,可用于静脉内使用。 Corifact(FXIII)由两个A亚基和两个B亚基组成,由合并的人血浆制成。每个小瓶包含1000-1600单位FXIII,120至200 mg的人白蛋白,120至320 mg的总蛋白质,80至120 mg的葡萄糖和140至220 mg的氯化钠。氢氧化钠可能已被用来调节pH值。
制造Corifact的所有血浆均从美国捐助者那里获得,并使用血清学检测方法进行了乙型肝炎表面抗原以及HIV-1 / 2和HCV抗体的测试。血浆用HCV,HIV-1,HAV和HBV的核酸测试(NAT)测试,发现是非反应性(阴性),血浆也用NAT测试了人类细小病毒B19。仅使用通过病毒筛查的血浆进行生产,分馏池中细小病毒B19的限值设置为不超过每毫升10 4国际单位细小病毒B19 DNA。
Corifact是从冷冻后的血浆转化为乙醇沉淀物制成的,然后通过以下四个步骤将其纯化:
- 沉淀/吸附
- 离子交换色谱
- 热处理(在水溶液中+ 60°C持续10小时)
- 通过两个串联的20 nm过滤器进行病毒过滤
将无菌过滤的最终本体溶液填充到小瓶中并冻干。这四个生产步骤在一系列体外实验中得到了独立验证,以证明它们具有灭活或去除包膜和非包膜病毒的能力。表4显示了Corifact制造过程的病毒清除能力,以平均log 10降低因子表示。
| 制造步骤 | 病毒减少因子(log 10 ) | |||||
|---|---|---|---|---|---|---|
| 包膜病毒 | 非包膜病毒 | |||||
| 艾滋病病毒 | BVDV | 西尼 | PRV | 甲肝病毒 | 每次观看费用 | |
| HIV,人类免疫缺陷病毒1型,HIV-1和HIV-2模型 BVDV,牛病毒性腹泻病毒,HCV模型 WNV,西尼罗河病毒 PRV,伪狂犬病病毒,一种大型包膜DNA病毒的模型 HAV,甲型肝炎病毒 CPV,犬细小病毒,B19V模型 B19V,人细小病毒B19 不适用,不适用 nd,未完成 | ||||||
| ||||||
| 的Al(OH)3的吸附/ VITACEL®和去纤维蛋白 | nd | nd | nd | 6.9 | nd | nd |
| 离子交换色谱 | 5.0 | 3.3 | nd | ≥8.0 | 3.4 | 3.7 |
| 热处理 | ≥7.7 | ≥8.1 | ≥7.4 | 不适用* | 4.3 | 1.0 † |
| 20 nm / 20 nm病毒过滤 | ≥6.1 | ≥5.0 | ≥7.4 | ≥6.4 | ≥5.6 | 6.1 |
| 累计减少病毒(日志10 ) | ≥18.8 | ≥16.4 | ≥14.8 | ≥21.3 | ≥13.3 | 10.8 |
Corifact-临床药理学
作用机理
Corifact(FXIII)是一种内源性血浆糖蛋白,由两个A亚基和两个B亚基组成。 FXIIIa促进凝血期间血纤蛋白的交联,对于血凝块的生理保护免受血纤维蛋白溶解至关重要。 FXIIIa是一种转谷氨酰胺酶,可催化血纤蛋白α和γ链的交联以稳定血纤蛋白,并使血纤蛋白凝块更具弹性,并抵抗血纤蛋白溶解。 2,3- FXIIIA也交联α2 -纤溶酶抑制剂与纤维蛋白的α链,从而导致通过纤溶酶降解保护纤维蛋白凝块。交联的纤维蛋白是凝血级联反应的最终结果,并为主要的止血血小板栓塞提供抗张强度。 3
血浆中的B亚基没有酶活性,并充当A亚基的载体分子。它们稳定A亚基的结构并保护其免受蛋白水解。
药效学
先天性FXIII缺乏症患者服用Corifact可以替代凝血因子XIII缺失或水平偏低的情况,从而可以暂时纠正因子缺乏症并纠正出血倾向。没有可以定量评估FXIII体内药效学的标记物。在FXIII缺乏的患者中,标准凝血(基于凝结时间)测试的结果是正常的,因为受影响的血凝块质量是正常的。凝块适合性的定性分析被用作FXIII缺乏症的指标。如果正确执行测试,则仅当样品中的FXIII活性接近零时,测试才为阳性。血栓弹力造影也可能受到FXIII缺乏症的影响。
药代动力学
对7名女性和7名先天性FXIII缺乏的男性进行了为期12周的前瞻性,开放性,多中心药代动力学和安全性研究,年龄从5至42岁(3名儿童,2名青少年,9名成人)。一名成年男性未完成药代动力学研究。
每位受试者每28天静脉接受40单位每千克Corifact静脉注射,共3剂,每分钟约250单位。从患者那里抽取剂量1和2的血样,以确定基线时以及输注后30和60分钟的FXIII活性水平。输注第三剂Corifact后,定期抽血直至28天,以确定药代动力学参数。 FXIII活性水平的平均增加为83%,第三次给药后比基线高48%至114%。表5显示了基于基线调节的FXIII活性(Berichrom分析)的药代动力学参数。
| 参量 | 均值±SD |
|---|---|
| AUC ss, (0-inf) =稳态下从时间0到无穷大的血浆浓度曲线下的面积 C ss,max :稳态下的峰值浓度 C ss,min :稳态槽浓度 T max :达到峰值浓度的时间 CL:间隙 V ss :稳态下的分配量 MRT =平均停留时间 SD =标准偏差 | |
| |
| AUC ss,0-inf(单位∙hr / mL) | 184.0±65.78 |
| C ss,max (单位/ mL) * | 0.9±0.20 |
| C ss,min (单位/ mL) * | 0.05±0.05 |
| 最高温度(hr) | 1.7±1.44 |
| 半衰期[天] | 6.6±2.29 |
| CL [mL / hr / kg] | 0.25±0.09 |
| V ss [mL / kg] | 51.1±12.61 |
| 捷运[天] | 10.0±3.45 |
非临床毒理学
动物毒理学和/或药理学
在小鼠和大鼠的急性毒性研究中对Corifact进行了研究,剂量分别高达3550单位/ kg和1420单位/ kg。在大鼠中研究了重复剂量毒性,每日剂量高达350单位/公斤,持续14天。在单剂量和重复剂量研究中未观察到毒性迹象。
兔子的局部耐受性研究表明,在静脉内,动脉内或静脉内注射Corifact后,注射部位无临床或组织病理学改变。
在兔子中进行血栓形成试验,剂量最高为每公斤350个单位。 Corifact在所测试的剂量下没有显示出血栓形成的潜力。
临床研究
药代动力学研究
Corifact的加速批准基于一项药代动力学研究,该研究在13位先天性FXIII缺乏的受试者中进行了评估,每位受试者每28天以40单位/千克的剂量评估三种剂量。预计将FXIII活性谷水平维持在5%-20%之间可提供临床益处。 13名受试者中有12名(92%)的FXIII谷水平≥5%。基于标准Berichrom分析[见临床药理学(12.3) ] 。
上市后疗效和安全性试验是一项前瞻性,多中心,开放标签的研究,研究对象为41位因先天性FXIII缺乏而接受常规预防性治疗(40 U / kg每28天,共52周)的先天性FXIII缺乏症患者,以验证其临床益处。通过显示FXIII活性的低谷水平与出血结局之间的相关性得出同义。 Corifact的临床益处还通过比较Corifact治疗的受试者与先天性FXIII缺乏的历史对照的出血发生率得到了证明。这项研究包括18岁以下(16%)的受试者(年龄小于16岁)和23岁以上(16%至65岁)的受试者(56%)。 2名受试者的年龄为1个月至<2岁,8名受试者的年龄为2岁至<12岁,8名受试者的年龄为12-16岁。
评估了需要治疗的自发性出血发作的发生率。治疗定义为给予含FXIII的产品以治疗出血发作。发生自发性出血发作(2例鼻出血,2例直肠出血和1例与尿路感染相关的血尿发作,以及留置导尿管)的5名受试者均不需要使用含FXIII的产品进行治疗。
与先天性FXIII缺乏症患者接受急性出血按需治疗的患者的历史年平均出血率2.5 /发作/年相比,确立了每位患者每年自发性出血的年出血率为0。 4
在该试验的52周中,还报告了8次因创伤引起的出血事件,以及1次与手术有关的事件。在因创伤而导致的八次出血事件中,六例不需要使用含FXIII的产品进行治疗,其中两例成功地使用含FXIII的产品进行了治疗(其中一例采用Corifact治疗,另一例采用血浆治疗)。
在患有先天性FXIII缺乏症的受试者中,每28天预防性给予因子XIII浓缩物(人类)的FXIII平均活性水平在5%至20%之间。 FXIII活性在≥97%的受试者中保持在≥5%,在≥85%的受试者中保持在≥10%。在向41位受试者给药的533剂量中,仅需要八次调整剂量,支持每28天40 U / kg是大多数患者的合适剂量。
五名受试者接受了外科手术,其中四名是选择性的,另一名是紧急情况。在四项选择性手术中,三名受试者在手术前(手术前0至7天)接受了Corifact治疗,无术后出血。一名在手术前7天接受Corifact的受试者在拔出所有四只智齿后均流血。口服手术后四小时止血,并补充Corifact剂量(受试者常规剂量的50%)。一名需要急诊手术的受试者接受了血浆预处理。
参考资料
- Sharief,LAT。,Kadir RA .:女性先天性因子XIII缺乏:对血友病的文献的系统综述。 2013; 19:e349-e357。
- Lauer P,Metzner HJ,Zettlmeissl G,Li M等。有针对性的灭活编码凝血因子XIII-A的小鼠基因座:突变小鼠的止血异常和凝血功能障碍的特征。血栓至上。 2002; 88:967-74。
- Dardik R,Loscalzo J,Inbal A.因子XIII(FXIII)和血管生成。 J血栓最重要。 2006; 4:19-25。
- Lusher J,Piper SW,Alexander S,NugentD。使用纤铁蛋白P预防性治疗与出血事件发生率降低相关:一项回顾性研究。血友病。 2009; 1-6。
供应/存储和处理方式
| 介绍 | 纸箱NDC编号 | 组件 |
|---|---|---|
| ||
| 1000-1600单位* | 63833-518-02 |
|
储存和处理
- 在2-8°C(36-46°F)的冰箱中冷藏保留在原始纸箱中以防光照。不要冻结。
- Corifact可以稳定使用36个月,直到纸箱和小瓶标签上的失效日期为止。在有效期内,Corifact可以在不超过25°C(77°F)的室温下保存最多6个月。
- 室温存放后,请勿将产品退回冰箱。在纸箱标签上清楚地标明室温存放的开始日期。
- 请勿在纸箱和小瓶标签上的失效日期之前或室温保存期结束之前(以先到者为准)使用。
- 该产品不含防腐剂,必须在重构后4小时内使用。请勿冷藏或冷冻重新配制的溶液。
病人咨询信息
请参阅FDA批准的患者标签(患者产品信息)
- 告知患者过敏性超敏反应的体征和症状,例如荨麻疹,皮疹,胸闷,喘息,低血压和/或过敏反应,在注射Corifact期间或之后[见警告和注意事项(5.1) ] 。
- 告知患者免疫原性的体征和症状,例如突破性出血[见警告和注意事项(5.2) ]。
- 告知患者血栓形成的体征和症状,例如四肢或腹部肿胀和/或疼痛,胸痛,呼吸急促,感觉或运动能力丧失,意识,视力或语言改变[见警告和注意事项(5.3) ] 。
- 告知患者,因为Corifact是由人血制成的,因此可能具有传播传染病的风险,例如病毒,变异的Creutzfeldt-Jakob病(vCJD)病原以及理论上的Creutzfeldt-Jakob病(CJD)病原[请参阅[警告和注意事项(5.4)和说明(11) ] 。
由制造:
CSL Behring GmbH
35041德国马尔堡
美国许可证号1765
发行人:
CSL Behring LLC
康卡基,IL 60901美国
FDA批准的患者标签–患者产品信息(PPI)
Corifact®
第十三因子浓缩物(人类)
本传单总结了有关Corifact的重要信息。使用Corifact之前和每次补充笔芯之前,请仔细阅读。可能提供了新的信息。该信息不会代替您与医疗保健提供者进行交流,并且不包括有关Corifact的所有重要信息。如果在阅读本文后有任何疑问,请咨询您的医疗保健提供者。
什么是Corifact?
Corifact是可注射药物,用于成人和患有先天性因子XIII(FXIII)缺陷的儿科患者的常规预防性治疗和围手术期处理的外科手术出血。 Corifact是由人血浆制成的凝血FXIII浓缩物,在止血(止血)中具有重要作用。
谁不应该使用Corifact?
如果您发生过超敏性(过敏)反应,包括对人血浆衍生产品的过敏性或严重全身性反应,则不应使用Corifact。
在给予Corifact之前,我应该告诉我的医疗保健提供者什么?
告诉您的医疗保健提供者您所有的医疗状况,包括:
- 如果您正在怀孕或计划怀孕。尚不确定Corifact是否会伤害未出生的婴儿。尚未确定人工和分娩的安全性和有效性。
- 母乳喂养:尚不能确定Corifact是否进入您的乳汁。
告诉您的医疗保健提供者和药剂师您所服用的所有药物,包括所有处方药和非处方药,例如非处方药,补品或草药。
Corifact如何给予?
Corifact注射入您的静脉(静脉注射)。灌注之前,使用包装中提供的无菌水溶解Corifact。您的医疗保健提供者将开出您所处方的剂量。
Corifact可能有哪些副作用?
使用Corifact后,如果您有以下任何症状,请立即致电您的医疗服务提供者或急诊科:
- 气促
- 皮疹
- 瘙痒(痒)
- 红斑(皮肤发红)
- 晕眩/头晕
- 胸痛
- 血液凝块的迹象,包括疼痛,肿胀,发热,发红或双腿或手臂肿块。
其他可能的副作用可能包括:
- 寒冷/温度上升
- 关节痛(关节痛)
- 头痛
- 产生抗Corifact抗体而导致的突破性出血和疼痛。
由于Corifact是由人类血液制成的,因此可能具有传播传染原的风险,例如病毒,变种的Creutzfeldt-Jakob病(vCJD)病原体以及理论上的Creutzfeldt-Jakob(CJD)病原体。
这些并不是Corifact的所有可能的副作用。
告诉您的医疗保健提供者任何困扰您或不会消失的副作用。您也可以致电1-800-FDA-1088向FDA报告副作用。
关于Corifact,我还应该了解什么?
有时出于此处列出以外的目的开出药物。请勿在没有规定的条件下使用Corifact。即使他人有与您相同的症状,也不要与他人共享Corifact。
本传单总结了有关Corifact的最重要信息。如果您想了解更多信息,请咨询您的医疗保健提供者。您可以询问您的医疗保健提供者或药剂师,以了解有关为医疗保健专业人员编写的Corifact的信息。
出行前与您的医疗服务提供者联系。
由制造:
CSL Behring GmbH
35041德国马尔堡
美国许可证号1765
发行人:
CSL Behring LLC
康卡基,IL 60901美国
推出Mix2Vial®是西医药的注册商标。服务IL,Ltd.是West Pharmaceuticals Services,Inc.的子公司。
修订日期:2019年12月
主显示屏-1600 IU样品瓶标签
第十三因子浓缩物(人类)
Corifact®
仅限静脉使用
仅Rx
每个Corifact®单次使用小瓶含1000-1600
冻干凝血因子XIII浓缩物的国际单位(单位)
用20 mL无菌注射用水(USP)配制。
商店Corifact®中在2-8℃(36-46°F)的冰箱。
Corifact®稳定36个月,直至到期日上
纸箱和小瓶标签。如果重新构造请不要使用
溶液浑浊或含有微粒。不要冻结。
避光。不含防腐剂。

主要显示面板-套件纸箱
NDC 63833-518-02
第十三因子浓缩物
(人类)
Corifact®
仅限静脉使用
请参阅包装说明书的剂量和管理部分。
CSL贝林

| 协同作用 xiii因子浓缩(人类)试剂盒 | ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| 贴标机-CSL Behring GmbH(326530474) |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| CSL Behring GmbH | 326530474 | 制造(63833-518) | |
已知总共有1种药物与Corifact(XIII因子)相互作用。
- 1主要药物相互作用
检查互动
已知与Corifact相互作用的药物(因子XIII)
注意:仅显示通用名称。
- 卡非佐米
Corifact(因子XIII)疾病相互作用
与Corifact(因子XIII)有1种疾病相互作用,包括:
- 血栓栓塞并发症
药物相互作用分类
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
美国日本医生

Heather Benjamin MD

Heather Benjamin MD

Suzanne Reitz MD

Heather Miske DO

Heather Miske DO

渡邊剛

村上和成 教授

中山秀章 教授

村田朗
















