获取国外Jetrea药品价格,使用等信息,最快 24 小时回馈
Jetrea
Jetrea
通用名称:ocriplasmin
批准日期:2012年10月17日
公司:ThromboGenics Inc.
治疗:有症状的玻璃体粘连
FDA批准Jetrea
美国食品和药物管理局(FDA)已批准Jetrea(ocriplasmin)用于治疗有症状的玻璃体粘连,这是一种渐进的视力威胁性疾病。 Jetrea是第一种被批准用于该适应症的药物。
批准是基于ThromboGenics的III期计划的数据,其中Jetrea被证明在症状性VMA的治疗中优于安慰剂(26.5%对10.1%; p <0.01)。
Jetrea治疗与一些(主要是短暂的)眼部不良事件有关。据报道,在接受Jetrea治疗的患者中,最常见的副作用包括浮眼;结膜出血,眼睑内衬的组织,覆盖眼睛的白色部分;眼痛;闪光(光敏);模糊的视野;视力不清;视力减退;视网膜水肿(肿胀);和黄斑水肿。
Jetrea的推荐剂量为玻璃体内注射一次至患眼一次的稀释溶液的0.125mg(0.1mL)。 Jetrea是一次性使用的玻璃小瓶,其中含有0.5 mg的0.2mL溶液用于玻璃体内注射(2.5 mg / mL)。
处方信息要点
这些重点内容不包括安全有效地使用Jetrea所需的所有信息。查看Jetrea的完整处方信息。
适应症和用法
Jetrea是一种蛋白水解酶,可用于治疗有症状的玻璃体粘连。
剂量和给药
- 使用前必须稀释。
- 仅用于一次性玻璃体内注射。
- 推荐剂量为0.125 mg(通过玻璃体内注射以0.1毫克的单次剂量向患眼给药的稀释溶液的0.1毫升)。
剂型和优势
一次性使用的玻璃小瓶,其中0.2毫升溶液中含有Jetrea 0.5毫克,用于玻璃体内注射(2.5毫克/毫升)。
禁忌症
没有。
警告和注意事项
- 由于牵拉情况的进展,视力下降可能需要手术干预。应该监测患者并指导他们报告任何症状,不要拖延。
- 玻璃体内注射后可能会发生玻璃体内注射程序相关的影响(眼内炎症/感染,眼内出血和眼压升高)。应该监测患者并指导他们报告任何症状,不要拖延。
- 晶状体半脱位的可能性。
Jetrea副作用
- Jetrea治疗的患者中最常报告的反应(≥5%)是玻璃体漂浮物,结膜出血,眼痛,视光检查,视物模糊,黄斑裂孔,视力下降,视力障碍和视网膜水肿。
要报告可疑的不良反应,请致电1-855-253-7396与ThromboGenics Inc.或致电1-800-FDA-1088与FDA联系,或访问www.fda.gov/medwatch。
注意:本文档包含有关眼泪膜溶蛋白的副作用信息。此页面上列出的某些剂型可能不适用于Jetrea品牌。
综上所述
更常见的副作用包括:视力下降和眼内炎症。有关不良影响的完整列表,请参见下文。
对于消费者
适用于眼泪膜溶蛋白:眼内溶液
需要立即就医的副作用
眼泪溶蛋白(眼泪中所含的活性成分)及其所需的作用可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用眼泪溶血素眼药水时,请立即与您的医生或护士联系,检查是否有以下任何副作用:
比较普遍;普遍上
- 血腥的眼睛
- 视力模糊或其他视力改变
- 视力下降
- 眼痛
- 眼睛发红
- 看到闪光或火花
- 眼睛对光的敏感性
- 撕裂
不常见
- 色觉改变
- 晚上看困难
- 眼睛不适
- 视力丧失
- 在眼前看到浮点,或在视力部分出现面纱或窗帘
- 阵阵疼痛
不需要立即就医的副作用
眼球蛋白血浆的一些副作用可能会发生,通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
不常见
- 眼睛干涩
对于医疗保健专业人员
适用于眼泪膜溶蛋白:玻璃体内溶液
一般
最常报告的副作用包括玻璃体漂浮物,眼痛,光复和视力模糊。 [参考]
眼科
非常常见(10%或更高):玻璃体漂浮物(高达16.8%),眼痛(高达13.1%),光检查(高达11.8%)
常见(1%到10%):色觉异常/ Roth 28色相异常,黄斑反射异常,光学相干断层扫描(OCT)异常,视网膜造影异常,前房细胞,前房耀斑,视力模糊,色度异常,结膜水肿,结膜出血,结膜充血,黄斑囊样水肿,a / b波振幅降低,视力下降,视力下降,干眼症,色盲,视网膜电图(ERG)改变,眼睛刺激,眼瘙痒,眼睑浮肿,眼内异物感,不完整的内段/外段(IS / OS)带,眼内压增高,流泪,眼内出血增加,眼内炎症,虹膜炎,黄斑变性,黄斑水肿,黄斑裂孔(新发/恶化),变态,眼部不适,眼充血,畏光,视力下降,视网膜折断/脱离/撕裂,视网膜变性,视网膜水肿,视网膜出血,视网膜色素上皮病变,亚视网膜液,视野缺损,视力障碍,玻璃体粘连/玻璃体牵引变差,玻璃体粘连,玻璃体脱离,玻璃体出血,玻璃体炎,淡黄色视力
罕见(0.1%至1%):前房炎症,结膜刺激,角膜擦伤,复视,眼睛发炎,前房积血,瞳孔反射减弱,晶状体半脱位,长期视力下降,瞳孔缩小,夜盲症,严重/严重急性视力障碍,短暂性失明,瞳孔不均
未报告频率:白内障,对侧眼部可见视觉症状[参考]
神经系统
常见(1%到10%):Scotoma [参考]
免疫学的
未报告频率:免疫原性[参考]
本地
常见(1%至10%):玻璃体内注射程序的相关影响[参考]
参考文献
1.“产品信息。Jetrea(眼压血浆ocriplasmin)。”新泽西州伊瑟林的ThromboGenics Inc.
2. Cerner Multum,Inc.“英国产品特性摘要”。 00
3. Cerner Multum,Inc.“澳大利亚产品信息”。 00
某些副作用可能没有报道。您可以将其报告给FDA。
行政准备
要为玻璃体内注射,坚持以下说明准备JETREA:
除去从冷冻小瓶(1.25毫克/对应于0.375毫克ocriplasmin毫升),并允许在室温下解冻(在数分钟内)。解冻后立即使用JETREA。在低于25°C(77°F)的温度下,未受光照的原始纸箱中未打开的小瓶最多可以存储8个小时。解冻后的小瓶不要重新冷冻。
一旦完全解冻,除去从药瓶保护用聚丙烯蓝色倒装关闭盖(见图1)。
图1:
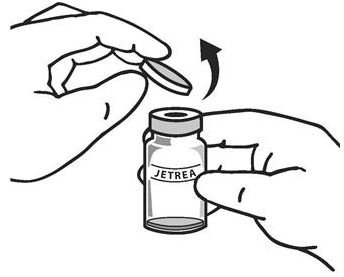
。小瓶顶部应使用酒精擦拭布消毒(参见图2) 。
图2:
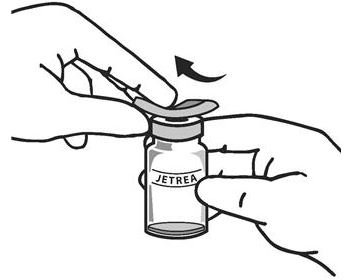
目视检查颗粒物的小瓶。只能使用无色透明,无可见颗粒的溶液。
使用无菌技术,撤回所有使用无菌#19号针头的溶液(稍微倾斜小瓶易于戒断)和小瓶内容撤出后丢弃针(参见图3)。请勿使用该针进行玻璃体内注射。
图3:
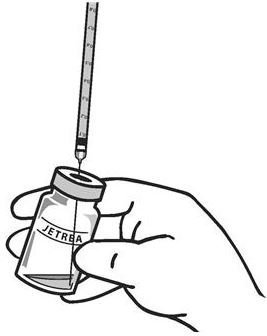
。用无菌的#30号针头替换针头,小心地从注射器中排出气泡和多余的药物,并将剂量调整到注射器上的0.1 mL标记(对应于0.125 mg环孢菌素) (参见图4 ) 。
图4:
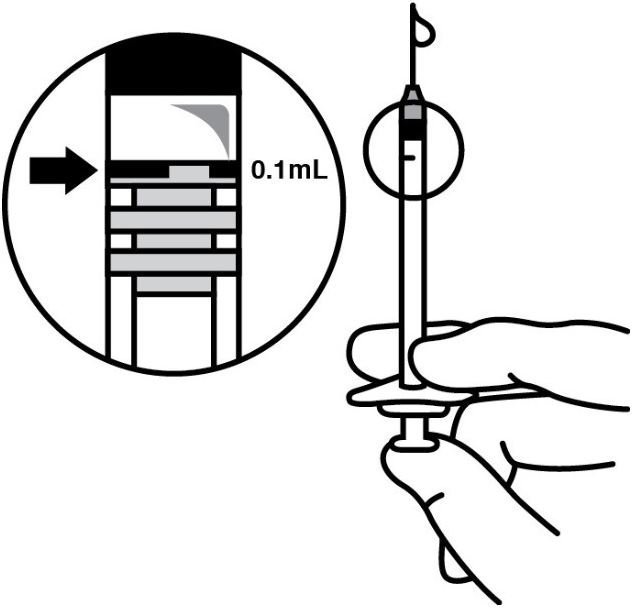
溶液应立即使用,因为它不含防腐剂。
丢弃药瓶和单次使用后的溶液中的任何未使用的部分。
管理与监控
在玻璃体内注射过程应控制无菌条件下,其中包括使用无菌手套,无菌披盖和无菌眼睑窥器(或等同物)下进行。应当根据标准的医学规范进行充分的麻醉和广谱的杀菌剂。
注射针应插入3.5 - 4.0毫米在角膜缘瞄向玻璃体腔的中心,避免了水平子午线。然后将0.1 mL的进样量输送至玻璃体中段。
在玻璃体内注射紧接着,患者应在眼压升高进行监控。适当的监视可能包括检查视神经乳头的灌注或眼压计。如果需要,应使用无菌穿刺针。
。玻璃体内注射后,应立即指导患者报告任何暗示眼内炎或视网膜脱离的症状(例如眼痛,眼睛发红,畏光,视物模糊或下降) [见患者咨询信息(17)] 。
每个小瓶应仅用于提供用于单只眼的治疗中的单次注射。如果对侧眼需要治疗,则应使用新的小瓶,并且在对另一只眼施用JETREA之前,应更换无菌区域,注射器,手套,窗帘,眼睑窥器和注射针头,但是,对另一只眼则应使用JETREA进行治疗不建议在初次注射后的7天内使用眼睛,以监测注射后的过程,包括注射后视力下降的可能性。
不建议在同一眼睛JETREA的重复施用[见非临床毒理学(13.2)]。
注射后,任何未使用的产品必须丢弃。
无特殊剂型修改适用于任何已被研究的人群(如性别,老人)。
Jetrea的适应症和用法
Jetrea®是对症玻璃体粘合性的处理指示的蛋白水解酶。
Jetrea剂量和管理
一般剂量信息
仅用于一次性眼内注射。 Jetrea只能由合格的医生来管理。
Jetrea的这种配方无需稀释。
加药
建议剂量为0.125 mg(溶液的0.1 mL),通过玻璃体内注射单次给药至患眼。
行政准备
要准备进行玻璃体内注射的Jetrea,请遵循以下说明:
从冰箱中取出小瓶(1.25 mg / mL,对应于0.375 mg环孢菌素),并在室温(几分钟内)解冻。解冻后立即使用Jetrea。在低于25°C(77°F)的温度下,未受光照的原始纸箱中未打开的小瓶最多可以存储8个小时。解冻后的小瓶不要重新冷冻。
完全融化后,从小瓶上取下保护性聚丙烯蓝色可翻转盖(请参见图1 ) 。
图1:

。小瓶顶部应用酒精擦拭布消毒(见图2 ) 。
图2:

目视检查小瓶中是否有颗粒物。只能使用无色透明,无可见颗粒的溶液。
使用无菌技术,使用无菌#19号针头取出所有溶液(略微倾斜小瓶以方便取出),并在取出小瓶内容物后丢弃针头(参见图3 ) 。请勿使用该针进行玻璃体内注射。
图3:

。用无菌的#30号针头替换针头,小心地从注射器中排出气泡和多余的药物,并将剂量调整到注射器上的0.1 mL标记(对应于0.125 mg环孢菌素) (参见图4 ) 。
图4:

应立即使用该解决方案,因为它不含任何防腐剂。
一次性使用后,丢弃小瓶和溶液中任何未使用的部分。
管理与监控
玻璃体内注射程序应在可控的无菌条件下进行,包括使用无菌手套,无菌盖布和无菌眼睑窥器(或等效物)。应当根据标准的医学规范进行充分的麻醉和广谱的杀菌剂。
注射针应插入到角膜缘后3.5-4.0 mm处,对准玻璃体腔的中心,避免水平子午线。然后将0.1 mL的进样量输送至玻璃体中段。
玻璃体内注射后,应立即监测患者眼内压的升高。适当的监视可能包括检查视神经乳头的灌注或眼压计。如果需要,应使用无菌穿刺针。
。玻璃体内注射后,应指导患者报告任何暗示眼内炎或视网膜脱离的症状(例如,眼痛,眼睛发红,畏光,视物模糊或视力下降) [见患者咨询信息(17) ] 。
每个小瓶仅可用于提供单次注射以治疗一只眼睛。如果对侧眼需要治疗,则应使用新的小瓶,并在另一只眼睛注射Jetrea之前更换无菌区域,注射器,手套,窗帘,眼睑窥器和注射针头,但是,另一只眼睛则使用Jetrea进行治疗不建议在初次注射后7天内使用眼睛,以监测注射后的过程,包括注射后眼睛视力下降的可能性。
不建议在同一只眼中重复使用Jetrea [见非临床毒理学(13.2) ] 。
注射后,任何未使用的产品必须丢弃。
对于任何已研究的人群(例如性别,老年人),都不需要特殊的剂量调整。
剂型和优势
注射剂:一次性使用的玻璃小瓶,在0.3 mL溶液中包含Jetrea 0.375 mg,用于玻璃体内注射(1.25 mg / mL)。
禁忌症
没有
警告和注意事项
视力下降
在对照试验中,接受Jetrea治疗的患者中有5.6%的患者获得了≥3线的最佳矫正视力(BCVA)降低,而接受了媒介物的患者中则有3.2%的患者获得了最佳矫正视力降低[参见临床研究(14) ]。
这些视力下降的大部分归因于牵引情况的发展以及许多需要的外科手术干预。应适当监测患者[参见剂量和给药方法(2.4) ] 。
玻璃体内注射程序的相关影响
玻璃体内注射与眼内炎症/感染,眼内出血和眼内压升高(IOP)有关。在对照试验中,注射Jetrea的患者中有7.1%发生眼内炎症,而注射媒介物的患者中有3.7%发生眼内炎症。注射后大多数眼内炎症事件是轻度和短暂的。注射Jetrea和媒介物的患者眼内出血分别为2.4%和3.7%。注射Jetrea对比媒介物的患者眼压升高的比例分别为4.1%和5.3%。
晶状体半脱位的可能性
据报道,一名早产儿接受玻璃体内注射0.175 mg(比推荐剂量高1.4倍)时发生晶状体半脱位[见特殊人群的使用(8.4) ]。单次玻璃体内注射后,在三种动物(猴子,兔子,小型猪)中观察到晶状体半脱位,其玻璃体血浆中眼泪溶素的浓度比推荐治疗剂量高1.4倍。相隔28天在猴子中施用第二次玻璃体内剂量后,在100%的治疗眼中晶状体半脱位[见非临床毒理学(13.2) ]。
视网膜断裂
在对照试验中,Jetrea组的视网膜脱离发生率为0.9%,媒介物组为1.6%,而Jetrea组的视网膜撕裂(无脱落)发生率为1.1%,媒介物组为2.7%。两组中大多数发生在玻璃体切除术中或之后。玻璃体切除术前发生视网膜脱离的发生率在Jetrea组中为0.4%,而在媒介物组中则没有,而在玻璃体切除术之前发生的视网膜撕裂(无剥离)的发生率在Jetrea组中为零,在玻璃体切除术中为0.5%。车辆组。
色盲症
据报告,注射Jetrea的所有患者中有2%患有色盲症(通常称为淡黄色视力)。在这些色盲症患者中约有一半还报告了视网膜电图(ERG)改变(a波和b波振幅降低)。
不良反应
下面和标签中其他地方描述了以下不良反应:
- 视力下降[请参阅警告和注意事项(5.1) ]
- 玻璃体内注射程序的相关影响[请参阅警告和注意事项(5.2)和剂量与用法(2.4) ]
- 晶状体半脱位的可能性[请参阅警告和注意事项(5.3) ]
- 视网膜破裂[请参阅警告和注意事项(5.4)和剂量与用法(2.4) ]
- 色盲症[请参阅警告和注意事项(5.5) ]
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此不能将一种药物的一项临床试验中的不良反应率直接与同一药物或另一种药物的临床试验中的不良反应率进行比较,并且可能无法反映实际观察到的不良反应率。
玻璃体内注射Jetrea治疗了大约800名患者。在两项媒介物对照研究(研究1和研究2)中,有465例患者接受玻璃体内注射0.125 mg眼泪溶蛋白(187例接受了媒介物)。
车辆对照临床研究中最常见的不良反应(发生率从5%到20%,从低到高依次列出)是:玻璃体漂浮物,结膜出血,眼痛,光检查,视力模糊,黄斑裂孔,视力下降,视力损伤和视网膜水肿。
在研究中观察到的以Jetrea治疗的患者中频率低于5%的较不常见的不良反应包括黄斑水肿,眼内压升高,前房细胞,畏光,玻璃体脱离,眼部不适,虹膜炎,白内障,干眼症,变态,瞳孔反射受损,结膜充血,视网膜变性和对侧眼中可见的视觉症状。
据报告,注射Jetrea的患者中有2%患有色盲症,其中大部分病例来自两项未经控制的临床研究。在这些色盲症患者中约有一半还报告了视网膜电图(ERG)改变(a波和b波振幅降低)。
免疫原性
与所有治疗性蛋白质一样,具有免疫原性的潜力。该产品的免疫原性尚未评估。
上市后经验
在批准批准使用Jetrea的过程中发现了夜盲症。由于这些反应是从不确定大小的人群中自愿报告的,因此并非总是能够可靠地估计其发生频率或建立与药物暴露的因果关系。
在特定人群中的使用
怀孕
致畸作用
妊娠C类。尚未使用ocriplasmin进行动物繁殖研究。孕妇对ocriplasmin的研究尚无充分且对照良好的研究。尚不知道当向孕妇服用环孢菌素是否会引起胎儿伤害或会影响生殖能力。玻璃体腔内单次注射0.125 mg剂量后,对眼球蛋白的全身暴露预计较低。假设全身吸收率为100%(血浆体积为2700 mL),则估计血浆浓度为46 ng / mL。仅在明确需要时,才应将Jetrea给予孕妇。
护理母亲
还不知道吗啡肽是否会在人乳中排泄。由于许多药物会从人乳中排出,并且由于存在吸收和损害婴儿生长发育的潜在可能,因此,在给哺乳妇女服用Jetrea时应格外小心。
儿科用
不建议在儿科患者中使用Jetrea。在22例患者的24眼中进行了一项单中心,随机,安慰剂对照,双掩蔽临床研究,以研究玻璃体腔内单次注射0.175 mg环孢菌素作为小儿玻璃体切除术辅助治疗的安全性和有效性。两组之间在诱导总黄斑玻璃体后脱离(PVD),任何次要终点或不良事件方面没有统计学或临床差异。
老人用
在临床研究中,Jetrea组和载剂组分别有384岁和145岁≥65岁的患者,其中192岁和73岁≥75岁的患者。在这些研究中,随着年龄的增长,在功效或安全性方面均未见明显差异。
过量
关于Jetrea过量影响的临床数据有限。据报道,一例意外过量服用0.250 mg环孢菌素(推荐剂量的两倍)与炎症和视力下降有关。
Jetrea说明
Ocriplasmin是重组人的纤溶酶的截短形式,分子量为27.2 kDa,是通过重组DNA技术在巴斯德毕赤酵母表达系统中产生的。
Jetrea是一种无菌,澄清且无色的溶液,在一次性玻璃瓶中不含防腐剂,该玻璃瓶在0.3 mL溶液中含有0.375 mg环孢菌素,用于玻璃体内注射。
每个小瓶包含0.375 mg环孢菌素(活性成分),0.16 mg柠檬酸,0.56 mg甘露醇,1.35 mg氯化钠,氢氧化钠和盐酸(用于调节pH)和注射用水(定量)。溶液的pH为3.1。
Jetrea-临床药理学
作用机理
Ocriplasmin对玻璃体和玻璃体视网膜界面(VRI)的蛋白质组分(例如层粘连蛋白,纤连蛋白和胶原蛋白)具有蛋白水解活性,从而溶解了负责玻璃体粘连(VMA)的蛋白质基质。
药代动力学
在计划进行玻璃体切割的患者的临床研究中确定了玻璃纤维蛋白的玻璃体内药代动力学,其中玻璃体注射剂量为0.125 mg球蛋白(每毫升玻璃体液平均浓度为29 mcg球蛋白[大约4.3 mL /眼])玻璃体切除术之前的不同时间点。如表1所示,根据二次动力学过程,从注射到采样时间,平均Ocriplasmin活性水平随时间降低。注射后24小时,玻璃体内的水平低于注射后立即达到的理论浓度的3%。
由于给予的剂量很小(0.125 mg),玻璃体内注射后无法预期体循环中可检测到的环孢菌素水平。
表1:玻璃体内注射0.125 mg Ocriplasmin后玻璃体样品的平均Ocriplasmin活性水平
| a 2名受试者低于检测下限,其他2名受试者的0.88和0.57 mcg / mL b检测下限 | |||||
| 注射后时间 (主题) | 5-30分钟 (n = 8) | 31-60分钟 (n = 8) | 2-4小时 (n = 8) | 24小时±2小时 (n = 4) | 7天±1天 (n = 4) |
| 平均值±SD 卵磷脂的水平 (微克/毫升) | 12±7.6 | 8.1±5.2 | 2.6±1.6 | 0.5±0.3 a | <0.27 b |
Ocriplasmin进入内源性蛋白质分解代谢途径,通过它与蛋白酶抑制剂α2-antiplasmin或α2-巨球蛋白的相互作用而迅速失活。
非临床毒理学
致癌,诱变,生育力受损
没有使用ocriplasmin进行致癌性,致突变性或生殖和发育毒性研究。
动物毒理学和/或药理学
已在兔子,猴子和小型猪中评估了玻璃体内单次剂量后眼泪溶血素的眼毒性。 Ocriplasmin在兔和猴子中引起炎症反应和短暂的ERG变化,并随着时间的流逝逐渐消失。在3种物种中,玻璃体中眼泪溶酶的浓度等于或高于41 mcg / mL时发生晶状体半脱位,该浓度比玻璃体中预期的临床浓度29 mcg / mL高1.4倍。在兔子和猴子中观察到眼内出血。
在猴子中以75 mcg /眼(41 mcg / mL玻璃体)或125 mcg /眼(68 mcg / mL玻璃体)的剂量第二次玻璃体内口服Ocriplasmin(相隔28天)与所有经Ocriplasmin治疗的眼半脱位相关。晶状体半脱位的两只动物的眼压持续升高。眼睛的显微镜检查结果包括玻璃液化,玻璃样囊膜韧带的变性/破坏(睫状小带纤维丧失),晶状体变性,玻璃体单核细胞浸润以及视网膜内核细胞层的空泡化。这些剂量分别是玻璃体内29 mcg / mL的预期临床浓度的1.4倍和2.3倍。
临床研究
对有症状玻璃体粘连(VMA)的患者进行的两个多中心,随机,双掩蔽,媒介物控制的6个月研究证明了Jetrea的疗效和安全性。在这两项研究中,共有652名患者(Jetrea 464,载体188)被随机分配。研究1中的随机分配为2:1(Jetrea:vehicle),研究2中的随机分配为3:1。
用Jetrea或媒介单次治疗。在两项研究中,与第6个月的媒介物组相比,ocriplasmin组在第28天获得VMA缓解(即在主要终点获得成功)的患者比例显着更高(表2和图5 )。
表2:研究眼中具有VMA缓解能力的患者比例(研究1,研究2:完整分析集)
| 研究1 | 研究2 | |||||
| 车辆 N = 107 | Jetrea N = 219 | 区别 (95%CI) | 车辆 N = 81 | Jetrea N = 245 | 区别 (95%CI) | |
| n(%) | n(%) | n(%) | n(%) | |||
| 第七天 | 8(7.5) | 54(24.7) | 17.2(9.6,24.8) | 1(1.2) | 36(14.7) | 13.5(8.4,18.5) |
| 第十四天 | 12(11.2) | 57(26.0) | 14.8(6.5,23.2) | 1(1.2) | 44(18.0) | 16.7(11.4,22.1) |
| 第28天 | 14(13.1) | 61(27.9) | 14.8(6.0,23.5) | 5(6.2) | 62(25.3) | 19.1(11.6,26.7) |
| 第三个月 | 16(15.0) | 58(26.5) | 11.5(2.6,20.5) | 7(8.6) | 62(25.3) | 16.7(8.5,24.9) |
| 第6个月 | 15(14.0) | 60(27.4) | 13.4(4.5,22.2) | 10(12.3) | 65(26.5) | 14.2(5.1,23.2) |
图5:研究眼中具有VMA消退的患者比例(研究1和研究2)

通过B超检查评估有症状玻璃体粘连患者的总后玻璃体脱离(PVD)。研究1(16%vs. 6%; p = 0.014)和研究2(11%vs. 0%; p <0.01 )。
在这两项试验中,与血浆赋形剂相比,ocriplasmin组的视力至少增加了3行的患者数量在数值上更高,但是,ocriplasmin组的视力至少下降了3行的患者数量也更高在一项研究中(表3和图6 )。
表3:第6个月,与玻璃体切除术无关,BCVA相对于基线的分类变化(研究1和研究2)
| 研究1 | 研究2 | |||||
| Jetrea | 车辆 | 区别 | Jetrea | 车辆 | 区别 | |
| N = 219 | N = 107 | (95%CI) | N = 245 | N = 81 | (95%CI) | |
| BCVA≥3行改善 | ||||||
| 第6个月 | 28(12.8%) | 9(8.4%) | 4.4(-2.5,11.2) | 29(11.8%) | 3(3.8%) | 8.1(2.3,13.9) |
| > 3行在BCVA中恶化 | ||||||
| 第6个月 | 16(7.3%) | 2(1.9%) | 5.4(1.1,9.7) | 10(4.1%) | 4(5.0%) | -0.9(-6.3,4.5) |
图6:协议规定的就诊时BCVA≥3行的获得或丢失的患者百分比

供应/存储和处理方式
每个小瓶的Jetrea均在0.3 mL不含防腐剂的柠檬酸缓冲溶液(1.25 mg / mL)中包含0.375 mg环氧纤溶酶。 Jetrea装在2毫升带蓝色聚丙烯可掀盖的玻璃小瓶中。样品瓶塞不是用天然橡胶乳胶制成的。小瓶仅供一次性使用。
NDC 24856-002-01
存储
冷冻保存在-4°F(-20°C)或以下。将小瓶存放在原始包装中直至使用,以防止光线直射。
病人咨询信息
在服用Jetrea之后的几天里,患者有发生眼内炎症/感染的风险。如果眼睛发红,对光线敏感,疼痛或视力发生变化,建议患者立即去眼科医生那里求医[见警告和注意事项(5.2) ] 。
接受Jetrea玻璃体内注射后,患者可能会出现暂时性视力障碍[参见警告和注意事项(5.1) ]。建议患者不要驾驶或操作重型机械,直到这种视力障碍得到解决。如果视觉障碍持续存在或进一步减轻,建议患者寻求眼科医生的护理。
由制造:
ThromboGenics,Inc.
101 Wood Avenue South,Suite 610
伊瑟林(新泽西州)08830
美国牌照编号:1866
©2012,ThromboGenics,Inc.保留所有权利。
2017年2月修订
美国初次批准:2012年
ThromboGenics美国专利:7,445,775; 7,547,435; 7,914,783和其他正在申请的专利。
包装标签-主显示屏-Jetrea-小瓶1.25 mg

包装标签-主显示屏-Jetrea-纸箱1.25 mg

| Jetrea 针cri素注射液 | ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| 贴标机-ThromboGenics Inc.(133263215) |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| 英国Patheon有限公司 | 237710418 | 标签(24856-002),制造(24856-002),包装(24856-002) | |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| Patheon Italia SPA | 434078638 | 标签(24856-002),制造(24856-002),包装(24856-002) | |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| 英国富士胶片生物技术有限公司 | 778997119 | api制造(24856-002) | |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
美国日本医生

Bert Hepner DO

Gregory Aaen MD

Gregory Aaen MD

Kristopher Aalderink MD

Kristopher Aalderink MD

渡邊剛

吉井文均 东海大学名誉教授

三角和雄

福田恵一 教授

須磨久善
临床试验
- 用于缓解鼻塞的 Soniflow 系统的用户研究
- NMS-03305293+TMZ 在成人复发性胶质母细胞瘤患者中的 I/II 期研究
- TACE、乐伐替尼和卡瑞珠单抗治疗 BCLC B/C 期肝细胞癌的疗效和安全性:一项单臂、单中心、开放标签研究
- 评估 DZD9008 的安全性、耐受性和药代动力学 (PK) 以及低脂膳食对健康成人参与者 DZD9008 PK 的影响
- 袋鼠宝宝按摩对家庭母婴互动的影响 (KBM)
- 伊布替尼和奥比妥珠单抗 (GA-101) 对初治 CLL 患者的固定持续时间治疗 (FIGHT)
- Avapritinib和咪达唑仑的药物相互作用研究
- 环面单焦和多焦人工晶状体的比较
- 血管内超声用于评估急性主动脉夹层 (AAD) 中的灌注不良综合征
- CNSL中的阿卡布替尼







