获取国外Luxturna药品价格,使用等信息,最快 24 小时回馈
Luxturna
什么是Luxturna?
Luxturna(用于眼睛)用于治疗可能引起夜盲症,光敏性和进行性视力丧失的视网膜疾病。
Luxturna仅用于具有特定基因突变的人。在您接受Luxturna之前,您需要进行医学检查以确保您具有此基因突变。
您的医生还将确定您的视网膜中是否有足够的剩余细胞可以用这种药物安全地治疗。
Luxturna也可用于本用药指南中未列出的目的。
重要信息
肾上腺病毒会导致视网膜改变,从而导致视力丧失。与您的医生讨论这种药物的风险和益处。
在服药之前
未批准将Voretigene neparvovec用于12个月以下或65岁以上的任何人。
告诉医生您是孕妇还是母乳喂养。
Luxturna如何服用?
Luxturna一次性注射入每只眼睛。您将在医生的办公室或其他诊所接受注射。
从注射前3天开始,您可能会口服类固醇药物。只要您的医生开处方,就继续使用类固醇。
通常在分开的时间(至少相隔6天)分别给每只眼睛注射Voretigene neparvovec。
在给您注射维瑞替尼neparvovec注射剂之前,您的医生会使用一种药物使您的眼睛麻木。
每次注射后至少24小时内,您需要尽可能多地躺下休息。
将定期检查您的眼睛,以确保该药物有效且未引起严重的副作用。
您不应该突然停止使用类固醇药物。按照医生的指示逐渐减少剂量。
少量的Luxturna会在短时间内残留在您的眼中。每次注射后至少7天:将所有用过的绷带,眼敷料或用过的纸巾放入密封的袋子中,然后扔到垃圾桶中。
如果我错过剂量怎么办?
肾上腺伏尔替吉林(Voretigene neparvovec)单次使用,没有每日给药时间表。
如果您错过了一定剂量的类固醇药物治疗,请致电医生。激素剂量相对于孕激素neparvovec注射的时机对预防某些副作用非常重要。
如果我服药过量怎么办?
由于Luxturna是在医疗机构中由医疗保健专业人员提供的,因此服用过量的可能性不大。
接受Luxturna时应该避免什么?
用这种药物治疗后,眼内会形成气泡。当气泡消失时,您的医生会告诉您。在此之前,请避免乘飞机旅行或潜水。如果气泡仍然存在,这些活动可能会导致永久性视力丧失。
Luxturna副作用
如果您有过敏反应迹象,请寻求紧急医疗救助:呼吸困难;脸,嘴唇,舌头或喉咙肿胀。
肾上腺病毒(Voretigene neparvovec)会引起视网膜改变,可能导致视力丧失,包括:
新的或恶化的白内障(眼内晶状体混浊);
眼前透明层变薄;
视网膜下的沉积物;
分隔视网膜中央的层或显影孔;
视网膜变薄或功能丧失;
视网膜表面破裂或起皱;
视网膜脱离
视网膜出血;要么
视力的永久下降。
与您的医生讨论Luxturna的风险和益处。
如果您有以下情况,请立即致电您的医生:
新的或恶化的视力问题;
眼痛;
视线中闪烁着灯光或“漂浮物”,看到灯光周围有光晕;要么
眼睛感染的迹象-眼睛疼痛或肿胀,头痛,对光的敏感性增加,结s或引流,视力下降。
常见的副作用可能包括:
眼睛疼痛,肿胀或发红;
白内障(眼睛混浊);
眼睑肿胀;要么
眼内压力增加。
这不是副作用的完整列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响Luxturna?
眼睛使用的药物不太可能会受到您使用的其他药物的影响。但是许多药物可以互相影响。向您的每个医疗保健提供者告知您使用的所有药物,包括处方药和非处方药,维生素和草药产品。
版权所有1996-2018 Cerner Multum,Inc.版本:1.01。
注意:本文档包含有关维罗替尼neparvovec眼药的副作用信息。此页面上列出的某些剂型可能不适用于商标名称Luxturna。
对于消费者
适用于眼病伏尔特金(neorvovec)眼内悬液
我需要马上打电话给我的医生什么副作用?
警告/警告:尽管这种情况很少见,但有些人在服药时可能会有非常严重的副作用,有时甚至是致命的副作用。如果您有以下任何与严重不良副作用相关的症状或体征,请立即告诉医生或寻求医疗帮助:
- 过敏反应的迹象,如皮疹;麻疹;瘙痒;发红或发烧的皮肤发红,肿胀,起泡或脱皮;喘息胸部或喉咙发紧;呼吸,吞咽或说话困难;异常嘶哑或嘴,脸,嘴唇,舌头或喉咙肿胀。
- 眼睛内部可能会发生非常严重的感染或其他眼部问题。这些可能会导致视力下降。如果您的视力,眼睛疼痛或严重的眼睛不适感有所变化,请立即致电医生。如果发现任何新的浮子或闪光,请立即致电医生。
这种药物还有哪些其他副作用?
所有药物都可能引起副作用。但是,许多人没有副作用,或者只有很小的副作用。如果这些副作用或任何其他副作用困扰您或不消失,请致电您的医生或获得医疗帮助:
- 眼睛刺激。
这些并非所有可能发生的副作用。如果您对副作用有疑问,请致电您的医生。打电话给您的医生,征求有关副作用的医疗建议。
您可以致电1-800-332-1088向FDA报告副作用。您也可以在https://www.fda.gov/medwatch报告副作用。
对于医疗保健专业人员
适用于眼病伏尔特金(neorvovec)眼内悬液
一般
最常见的不良反应包括眼睛发红,白内障,眼压升高和视网膜裂孔。 [参考]
眼科
非常常见(10%或更多):任何眼部不良反应(66%),结膜充血(发红; 22%),白内障(20%),眼压升高(15%),视网膜泪液(10%)
常见(1%到10%):角膜基质变薄(黄斑),黄斑裂孔,视网膜下沉积物,眼睛发炎,眼睛刺激,眼痛,黄斑病,中央凹变薄和中央凹功能丧失,眼内炎,中央凹裂开(分离黄斑中心的视网膜层)视网膜出血
据报告66%(27/41)的受试者发生眼部不良反应(81只注射的眼睛中有46只; 57%)。不良反应可能是由于这种药物,视网膜下注射程序,同时使用皮质类固醇激素或这三者的组合引起的。
参考文献
1.“产品信息。Luxturna(眼球伏雷替尼)。”宾夕法尼亚州费城的Spark Therapeutics,Inc.。
2. Aziz MY,Hoffmann KJ,Ashton M“通过IVIV外推法,抗疟疾哌喹及其代谢产物在人肝微粒体内对CYP3A的抑制作用。”药学杂志(2018):
某些副作用可能没有报道。您可以将其报告给FDA。
制备
在II级垂直层流生物安全柜(BSC)中在无菌条件下使用无菌技术在给药后4小时内制备LUXTURNA。以下是稀释和给药注射器准备所需的物品清单:
- 一小瓶Luxturna
- 两小瓶稀释剂
- 一个3毫升无菌注射器
- 一根20G 1英寸无菌针头
- 三个1毫升无菌注射器
- 三个27G½英寸无菌针头
- 两个无菌注射器盖
- 1个10毫升无菌空玻璃瓶
- 一种无菌的实用窗帘
- 一个无菌塑料袋
- 用于注射器的两个无菌标签
- 一个无菌的普通标签
- 一种无菌皮肤标记
LUXTURNA的稀释
- 在室温下解冻一小瓶LUXTURNA和两小瓶稀释剂。
- 将融化的稀释剂瓶中的内容物轻轻倒置约5次,以使其混合。
- 检查稀释瓶。如果看到颗粒,混浊或变色,请不要使用小瓶。应使用新的稀释剂瓶。
- 获得3毫升无菌注射器,20克1英寸无菌针头和10毫升无菌空玻璃瓶。
- 使用带有20G 1英寸针头的3-mL注射器,将2.7 mL稀释剂转移到10 mL玻璃小瓶中。将针头和注射器放在适当的容器中。
- 轻轻翻转约5次,将融化后的LUXTURNA单剂量小瓶中的内容物混合。
- 检查LUXTURNA单剂量小瓶。如果看到颗粒,混浊或变色,请不要使用小瓶。应使用新的LUXTURNA单剂量小瓶。
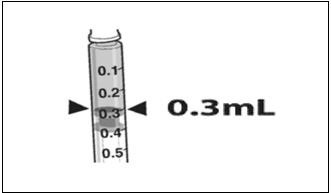
- 用27G½英寸无菌针头将0.3 mL LUXTURNA吸入1 mL无菌注射器中。 (图1)
图1.带有0.3 mL LUXTURNA的注射器
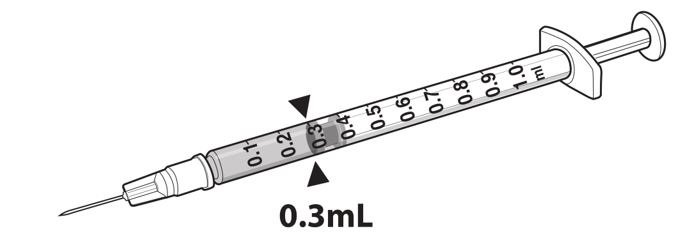
9.将0.3 mL LUXTURNA转移至含有2.7 mL步骤5稀释剂的玻璃瓶中。将10 mL玻璃瓶轻轻倒置约5次以混合内容物。
10.使用无菌的普通标签和无菌的皮肤标记,按照以下步骤标记装有稀释的LUXTURNA的10 mL玻璃小瓶:“稀释的LUXTURNA”。
11.从BSC上取下所有物品,除了标有“ Diluted LUXTURNA”的玻璃瓶和无菌皮肤标记物。
12.在进行下一步之前,先对BSC进行消毒,然后将玻璃瓶和无菌标记物放在BSC的左侧。
注射用LUXTURNA的制备
为了使注射器保持无菌,需要两名操作员将标有“ Dilted LUXTURNA”的10毫升玻璃小瓶的内含物转移到两个1毫升无菌注射器中。
13.将无菌的消毒盖布,无菌的塑料袋和两个无菌的标签放入BSC中。
14.将无菌盖布放在经过消毒的BSC表面右侧的主操作员附近,远离稀释的LUXTURNA。
15.二级操作员解开BSC中的两个1-mL注射器,两个27G½英寸针头和两个注射器盖,以确保一级操作员将物品转移到无菌盖布时仅接触无菌表面。
16.次要操作员更换为新的无菌手套,并站立或坐在主要操作员的左侧。二级操作员拿着装有稀释的LUXTURNA的10 mL玻璃瓶(图2a)。
图2a。 LUXTURNA注射器准备过程中操作员的第一位置
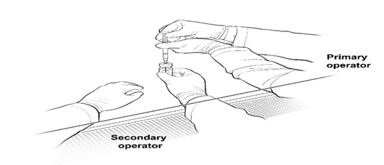

17.主要操作人员使用27G½英寸无菌针头将0.8 mL稀释的LUXTURNA抽入1 mL无菌注射器中,而次要操作人员则持有10 mL玻璃小瓶。插入针头后,二级操作员将10 mL玻璃小瓶倒置,使一级操作员无需触摸10 mL玻璃小瓶即可抽出0.8 mL(图2b)。
图2b。 LUXTURNA注射器制备过程中操作员的第二位置
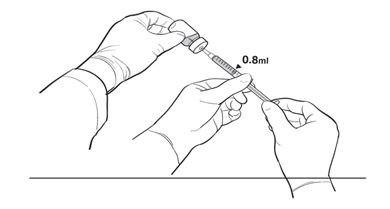

18.主操作员取下针头,并在无菌注射器上贴上无菌帽,将针头放置在适当的容器中,并在给药注射器上贴上无菌标签。
19.主要操作员重复步骤17和18,以准备总共两个管理注射器。使用无菌皮肤标记器将第一个注射器标记为“ Dillut LUXTURNA”,将第二个注射器标记为“ Backup-Backup Diluted LUXTURNA”。第二个注射器将作为外科医生进行视网膜下给药的备用工具。如果不使用,请在手术后丢弃备用注射器。
20.检查两个注射器。如果看到颗粒,混浊或变色,请勿使用注射器。
21.目视检查后将注射器放入无菌塑料袋中并密封。
22.将装有装有稀释的LUXTURNA的注射器的无菌塑料袋放入适当的辅助容器(例如,硬质塑料冷却器)中,以便在室温下输送到手术室。
行政
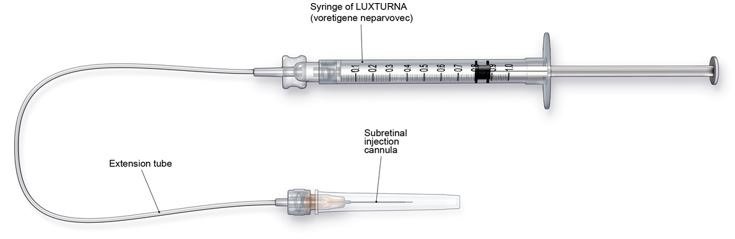
LUXTURNA应在具有受控眼科手术条件的外科手术室中由经验丰富的外科医生进行眼内手术。除装有稀释的LUXTURNA的注射器外,还需要以下物品才能进行给药:
- 视网膜下注射套管,内径为41号的聚酰胺微尖端。
- 延长管由聚氯乙烯制成,长度不超过6英寸(15.2厘米),内径不超过1.4毫米。
图3.注射设备组装

请按照以下步骤进行视网膜下注射:
- 在确认LUXTURNA的可用性后,扩大眼睛并为患者进行充分的麻醉。
- 手术前对结膜,角膜和眼睑使用局部广谱杀菌剂。
- 给药前检查LUXTURNA。如果看到颗粒,混浊或变色,请勿使用该产品。
- 将包含稀释后的LUXTURNA的注射器连接到延长管和视网膜下注射套管。为避免灌注过多,延长管的长度不得超过15.2厘米,内径不得超过1.4毫米。通过延长管和视网膜下注射套管缓慢注入产品,以消除气泡。
- 将柱塞头与标记为0.3 mL的线对齐,以确认注射器中可用的产品量。 (图4)
图4.注射用LUXTURNA的体积

6.完成玻璃体切除术后,确定预期的给药部位。视网膜下注射套管可通过平面pars引入。 (图5a)
7.在直接可视化下,将视网膜下注射套管的尖端与视网膜表面接触。推荐的注射部位应位于上血管中心,距中央凹中心至少2 mm(图5b),避免直接接触视网膜脉管系统或病理特征区域,例如密集的萎缩或视网膜内色素沉着移民。缓慢注入少量产品,直到观察到最初的视网膜下泡为止。然后缓慢注入剩余体积,直到总浓度为0.3 mL。
图5a。经平面pars引入视网膜下注射套管
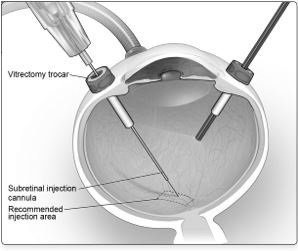

图5b。将视网膜下注射套管的尖端放置在推荐的注射部位内(外科医生的观点)
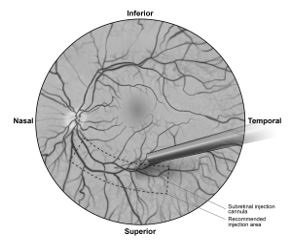

8.完成注射后,从眼睛上取下视网膜下注射套管。
9.注射后,丢弃所有未使用的产品。根据适用于产品处理和处置的当地生物安全准则处理备用注射器。
10.进行流体-空气交换,小心避免在为视网膜下注射而形成的视网膜切开术附近排出流体。
11.术后立即开始仰卧头定位。
12.出院后,建议患者尽可能仰卧休息24小时。
Luxturna的适应症和用法
Luxturna(voretigene neparvovec-rzyl)是一种基于腺相关病毒载体的基因疗法,适用于治疗已确诊与双等位基因RPE65突变相关的视网膜营养不良的患者。
患者必须具有治疗医师确定的存活视网膜细胞。
Luxturna用法用量
仅用于视网膜下注射。
剂量
- 每只眼睛的Luxturna推荐剂量为1.5 x 10 11个载体基因组(vg),通过视网膜下注射以0.3 mL的总体积给药。
- 在接近的间隔内,在分开的几天中对每只眼睛进行Luxturna的视网膜下给药,但间隔不少于6天。
- 建议全身性口服皮质类固醇等效于泼尼松,剂量为1毫克/千克/天(最大40毫克/天),共7天(从给第一只眼施用Luxturna前3天开始),然后在服药期间逐渐减少剂量接下来的10天。相同的皮质类固醇给药方案适用于第二只眼的Luxturna给药。如果在计划将Luxturna施用给第二只眼之前三天,Luxturna施用给第一只眼的皮质类固醇锥度还没有完成,那么第二只眼的皮质类固醇激素疗法将替代第一只眼的锥形。
制备
在II级垂直层流生物安全柜(BSC)中在无菌条件下使用无菌技术在给药后4小时内制备Luxturna。以下是稀释和给药注射器准备所需的物品清单:
- 一小瓶Luxturna
- 两小瓶稀释剂
- 一个3毫升无菌注射器
- 一根20G 1英寸无菌针头
- 三个1毫升无菌注射器
- 三个27G½英寸无菌针头
- 两个无菌注射器盖
- 1个10毫升无菌空玻璃瓶
- 一种无菌的实用窗帘
- 一个无菌塑料袋
- 用于注射器的两个无菌标签
- 一个无菌的普通标签
- 一种无菌皮肤标记
Luxturna的稀释
- 在室温下解冻一小瓶Luxturna和两小瓶稀释剂。
- 将融化的稀释剂瓶中的内容物轻轻倒置约5次,以使其混合。
- 检查稀释瓶。如果看到颗粒,混浊或变色,请不要使用小瓶。应使用新的稀释剂瓶。
- 获得3毫升无菌注射器,20克1英寸无菌针头和10毫升无菌空玻璃瓶。
- 使用带有20G 1英寸针头的3-mL注射器,将2.7 mL稀释剂转移到10 mL玻璃小瓶中。将针头和注射器放在适当的容器中。
- 轻轻倒置约5次,将解冻的Luxturna单剂量小瓶中的内容物混合。
- 检查Luxturna单剂量小瓶。如果看到颗粒,混浊或变色,请不要使用小瓶。应使用新的Luxturna单剂量小瓶。
- 用27G½英寸无菌针头将0.3 mL Luxturna吸入1 mL无菌注射器中。 (图1)
图1.带有0.3 mL Luxturna的注射器

9.将0.3 mL的Luxturna转移至含有2.7 mL步骤5稀释剂的玻璃小瓶中。将10 mL玻璃小瓶轻轻倒置约5次以混合内容物。
10.使用无菌的普通标签和无菌的皮肤标记,按照以下步骤标记装有稀释的Luxturna的10 mL玻璃小瓶:“ Dilted Luxturna”。
11.从BSC上取下所有物品,除了标有“ Diluted Luxturna”的玻璃小瓶和无菌皮肤标记物。
12.在进行下一步之前,先对BSC进行消毒,然后将玻璃瓶和无菌标记物放在BSC的左侧。
注射用Luxturna的制备
为了使注射器保持无菌状态,需要两名操作员将标有“ Diluted Luxturna”的10毫升玻璃小瓶的内容物转移到两个1毫升无菌注射器中。
13.将无菌的消毒盖布,无菌的塑料袋和两个无菌的标签放入BSC中。
14.将无菌盖布放在经过消毒的BSC表面右侧的主操作员附近,远离稀释的Luxturna。
15.二级操作员解开BSC中的两个1-mL注射器,两个27G½英寸针头和两个注射器盖,以确保一级操作员将物品转移到无菌盖布时仅接触无菌表面。
16.次要操作员更换为新的无菌手套,并站立或坐在主要操作员的左侧。二级操作人员持有10 mL装有稀释的Luxturna的玻璃小瓶(图2a)。
图2a。 Luxturna注射器制备过程中操作员的第一位置


17.主要操作人员使用27G½英寸无菌针头将0.8 mL稀释的Luxturna抽入无菌的1 mL注射器中,而次要操作人员则持有10 mL玻璃瓶。插入针头后,二级操作员将10 mL玻璃小瓶倒置,使一级操作员无需触摸10 mL玻璃小瓶即可抽出0.8 mL(图2b)。
图2b。 Luxturna注射器制备过程中操作员的第二位置


18.主操作员取下针头,并在无菌注射器上贴上无菌帽,将针头放置在适当的容器中,并在给药注射器上贴上无菌标签。
19.主要操作员重复步骤17和18,以准备总共两个管理注射器。使用无菌皮肤标记器将第一个注射器标记为“ Diluted Luxturna”,将第二个注射器标记为“ Backup-Diluted Luxturna”。第二个注射器将作为外科医生进行视网膜下给药的备用工具。如果不使用,请在手术后丢弃备用注射器。
20.检查两个注射器。如果看到颗粒,混浊或变色,请勿使用注射器。
21.目视检查后将注射器放入无菌塑料袋中并密封。
22.将带有装有稀释的Luxturna的注射器的无菌塑料袋放入适当的辅助容器(例如,硬塑料冷却器)中,以便在室温下递送至手术室。
行政
Luxturna应在具有无菌操作条件的外科手术室中由经验丰富的外科医生进行眼内手术。除了装有稀释的Luxturna的注射器外,还需要以下物品进行管理:
- 视网膜下注射套管,内径为41号的聚酰胺微尖端。
- 延长管由聚氯乙烯制成,长度不超过6英寸(15.2厘米),内径不超过1.4毫米。
图3.注射设备组装


请按照以下步骤进行视网膜下注射:
- 在确认Luxturna的可用性后,扩大眼睛并为患者进行充分的麻醉。
- 手术前对结膜,角膜和眼睑使用局部广谱杀菌剂。
- 用药前检查Luxturna。如果看到颗粒,混浊或变色,请勿使用该产品。
- 将包含稀释的Luxturna的注射器连接到延长管和视网膜下注射套管。为避免灌注过多,延长管的长度不得超过15.2厘米,内径不得超过1.4毫米。通过延长管和视网膜下注射套管缓慢注入产品,以消除气泡。
- 将柱塞头与标记为0.3 mL的线对齐,以确认注射器中可用的产品量。 (图4)
图4.注射用Luxturna的体积


6.完成玻璃体切除术后,确定预期的给药部位。视网膜下注射套管可通过平面pars引入。 (图5a)
7.在直接可视化下,将视网膜下注射套管的尖端与视网膜表面接触。推荐的注射部位应位于上血管中心,距中央凹中心至少2 mm(图5b),避免直接接触视网膜脉管系统或病理特征区域,例如密集的萎缩或视网膜内色素沉着移民。缓慢注入少量产品,直到观察到最初的视网膜下泡为止。然后缓慢注入剩余体积,直到总浓度为0.3 mL。
图5a。经平面pars引入视网膜下注射套管


图5b。将视网膜下注射套管的尖端放置在推荐的注射部位内(外科医生的观点)


8.完成注射后,从眼睛上取下视网膜下注射套管。
9.注射后,丢弃所有未使用的产品。根据适用于产品处理和处置的当地生物安全准则处理备用注射器。
10.进行流体-空气交换,小心避免在为视网膜下注射而形成的视网膜切开术附近排出流体。
11.术后立即开始仰卧头定位。
12.出院后,建议患者尽可能仰卧休息24小时。
剂型和优势
Luxturna是用于视网膜下注射的悬浮液,以0.5mL的可提取体积装在2mL的单剂量小瓶中;所提供的浓度(5 x 10 12 vg / mL)在给药前需要1:10稀释。稀释液以两个一次性使用的2 mL样品瓶提供。
禁忌症
没有。
警告和注意事项
眼内炎
眼内手术或注射后可能会发生眼内炎。给予Luxturna时,请使用适当的无菌注射技术。注射后,监控患者以及早治疗任何感染。建议患者立即报告感染或炎症的任何体征或症状。
视力永久下降
视网膜下注射Luxturna后可能会导致视力永久下降。监视患者的视觉障碍。
视网膜异常
在视网膜下注射Luxturna期间或之后,可能会发生视网膜异常,包括黄斑裂孔,中央凹变薄,中央凹功能丧失,中央凹裂开和视网膜出血。适当地监视和管理这些视网膜异常。不要在中央凹附近使用Luxturna。 [参见剂量和用法( 2.3 ) ]
视网膜异常可能发生在玻璃体切除术期间或之后,包括视网膜撕裂,视网膜前膜或视网膜脱离。在注射过程中和注射后监视患者,以便及早治疗这些视网膜异常。建议患者立即报告视网膜撕裂和/或脱离的任何体征或症状
眼内压升高
视网膜下注射Luxturna后可能发生眼内压升高。适当监测和管理眼压。
眼内气泡膨胀
指导患者避免乘飞机旅行,前往高海拔地区或进行水肺潜水,直到服用Luxturna后形成的气泡完全从眼中消失。注入气泡可能需要一周或更长时间才能消散。当气泡仍然存在时,高度的变化会导致不可逆的视力丧失。通过眼科检查验证气泡的散发。
白内障
视网膜下注射Luxturna,尤其是玻璃体切除术,与白内障发展和/或进展的发生率增加相关。
不良反应
最常见的不良反应(发生率≥5%)是结膜充血,白内障,眼内压增高,视网膜撕裂,dellen(角膜基质变薄),黄斑裂孔,视网膜下沉积物,眼睛发炎,眼刺激,眼痛和黄斑病(在黄斑表面起皱)。
临床试验经验
由于临床试验是在宽泛的条件下进行的,因此无法将药物临床试验中观察到的不良反应率直接与其他产品的临床试验中的发生率进行比较,并且可能无法反映实际中观察到的不良反应率。
本节中描述的安全性数据反映了两项临床试验中暴露于Luxturna的情况,该试验由41名确诊为与等位基因RPE65突变相关的视网膜营养不良的受试者(81眼)组成。在41名受试者中,有40名接受了每只眼睛连续视网膜下注射Luxturna的治疗。一名受试者仅用一只眼睛接受了Luxturna。 81只眼睛中有72只以1.5 x 10 11 vg的推荐剂量暴露于Luxturna。 9只眼睛暴露于较低剂量的Luxturna。研究1(n = 12)是一项开放性剂量探索安全性研究。研究2(n = 29)是一项关于疗效和安全性的开放标签,随机对照研究[ (请参阅临床研究( 14 ) ]。41名受试者的平均年龄为17岁,范围为4至44岁。 41名受试者中,有25名(61%)是18岁以下的儿科受试者,而23名(56%)是女性。
二十七名(27 / 41,66%)受试者发生了眼部不良反应,涉及注射的46只眼睛(46 / 81,57%)。表1中描述了研究1和研究2中所有受试者的不良反应。不良反应可能与Voretigene neparvovec-rzyl,视网膜下注射程序,同时使用皮质类固醇或这些程序和产品的组合有关。
| 不良反应 | 主题n = 41 | 处理过的眼睛n = 81 |
| 任何眼部不良反应 | 27(66%) | 46(57%) |
| 结膜充血 | 9(22%) | 9(11%) |
| 白内障 | 8(20%) | 15(19%) |
| 眼内压升高 | 6(15%) | 8(10%) |
| 视网膜撕裂 | 4(10%) | 4(5%) |
| Dellen(角膜基质变薄) | 3(7%) | 3(4%) |
| 黄斑孔 | 3(7%) | 3(4%) |
| 视网膜下沉积物* | 3(7%) | 3(4%) |
| 眼睛发炎 | 2(5%) | 4(5%) |
| 眼睛刺激 | 2(5%) | 2(2%) |
| 眼痛 | 2(5%) | 2(2%) |
| 黄斑病(在黄斑表面起皱) | 2(5%) | 3(4%) |
| 中央凹变薄和中央凹功能丧失 | 1(2%) | 2(2%) |
| 眼内炎 | 1(2%) | 1(1%) |
| 中央凹裂开(黄斑中心视网膜层分离) | 1(2%) | 1(1%) |
| 视网膜出血 | 1(2%) | 1(1%) |
*注射后1-6天,低于视网膜注射部位的无症状视网膜下沉淀物的短暂出现
免疫原性
在研究1和研究2中评估的所有剂量的Luxturna,免疫反应和眼外暴露都是轻度的。在研究1(n = 12)中,两只眼睛的视网膜下注射间隔为1.7年至4.6年。在研究2中,两只眼睛的视网膜下注射之间的间隔为7到14天。没有受试者对AAV2或RPE65具有临床上显着的细胞毒性T细胞反应。
受试者在每只眼睛视网膜下注射Luxturna之前和之后都接受了全身性皮质类固醇激素治疗。皮质类固醇可能降低了对载体衣壳(腺相关病毒血清型2 [AAV2]载体)或转基因产物(视网膜色素上皮65 kDa蛋白[RPE65])的潜在免疫反应。
在特定人群中的使用
怀孕
风险摘要
尚未在孕妇中进行Luxturna的充分且对照良好的研究。 Luxturna尚未进行动物生殖研究。在美国普通人群中,临床公认的怀孕中主要先天缺陷和流产的估计背景风险分别为2-4%和15-20%。
哺乳期
风险摘要
没有关于母乳中Luxturna的存在,对母乳喂养婴儿的影响或对牛奶产量的影响的信息。应当考虑母乳喂养的发育和健康益处,以及母亲对Luxturna的临床需求以及对Luxturna母乳喂养婴儿的任何潜在不利影响。
生殖潜力的男性和女性
没有进行非临床或临床研究来评估Luxturna对生育力的影响。
儿科用
不建议12个月以下的患者使用Luxturna治疗,因为视网膜细胞仍在进行细胞增殖,并且Luxturna在细胞增殖期间可能会被稀释或丢失。
Luxturna的安全性和有效性已在儿科患者中确立。研究1和研究2支持使用Luxturna [参见临床研究( 14 ) ],其中包括25个以下年龄段与双等位基因RPE65突变相关的视网膜营养不良的儿科患者:21名儿童(4岁至12岁以下) 4名青少年(12岁至17岁以下)。不同年龄组之间的安全性无显着差异。
老人用
Luxturna的安全性和有效性尚未在老年患者中确定。 Luxturna对此适应症的临床研究不包括65岁以上的患者。
Luxturna说明
Luxturna(voretigene neparvovec-rzyl)是用于视网膜下注射的基于腺相关病毒载体的基因治疗的悬浮液。 Luxturna是一种活的,非复制型腺相关病毒血清型2,已进行基因修饰以表达人RPE65基因。使用重组DNA技术,Luxturna来源于天然存在的腺相关病毒。
每个小剂量Luxturna小瓶每毫升包含5 x 10 12个载体基因组(vg),赋形剂180 mM氯化钠,10 mM磷酸钠和0.001%泊洛沙姆188(pH 7.3),可提取体积为0.5 mL 。 Luxturna需要在给药前以1:10的比例稀释。稀释后,Luxturna的每剂剂量为1.5 x 10 11 vg,可递送量为0.3 mL。
稀释剂以每小瓶1.7毫升可提取体积的价格提供在两个2毫升小瓶中,由含有180 mM氯化钠,10 mM磷酸钠和0.001%泊洛沙姆188(pH 7.3)的无菌水组成。
Luxturna也可能含有HEK293细胞的残留成分,包括DNA和蛋白质以及痕量的胎牛血清。
该产品不含防腐剂。
Luxturna-临床药理学
作用机理
Luxturna旨在将生物活性RPE65水平降低或缺失的人的正常编码基因编码人视网膜色素上皮65 kDa蛋白(RPE65)传递至视网膜细胞。 RPE65在视网膜色素上皮(RPE)细胞中产生,并将全反式视黄醇转化为11-顺式视黄醇,随后在视觉(类视色素)周期中形成了顺势疗法的11-顺式-视网膜。视觉循环在光转导中至关重要,光转导是指光的光子在视网膜中生物转化为电信号的过程。 RPE65基因的突变导致RPE65异构水解酶活性的降低或缺失,从而阻断了视力循环并导致视力下降。
药效学
Luxturna注入视网膜下空间导致某些视网膜色素上皮细胞被编码正常人RPE65蛋白的cDNA转导,从而提供了恢复视觉循环的潜力。
药代动力学
生物分布(体内)和媒介脱落(排泄/分泌)
使用定量聚合酶链反应(qPCR)测定法确定各种组织和分泌物中的Luxturna载体DNA水平。
非临床数据
在非人灵长类动物视网膜下给药后三个月评估了Luxturna的生物分布。在注射载体的眼睛的眼内液(前房液和玻璃体)中检测到最高水平的载体DNA序列。在注射载体的眼睛,视交叉,脾脏和肝脏的视神经中,以及在淋巴结中偶发地检测到低水平的载体DNA序列。在性腺中未检测到载体DNA序列。
临床资料
在一项测量研究2中受试者双眼,血清和全血的泪液中Luxturna DNA的研究中,研究了Luxturna载体的脱落和生物分布。总而言之,Luxturna载体在注射的眼泪中短暂而低水平地脱落在研究2中,有45%的受试者患有这种情况,偶尔(从注射后的眼睛中直到注射后的第3天)为(7%)。
在接受双边给药的29位受试者中,Luxturna载体DNA存在于13位受试者(45%)的眼泪样品中。注射后第1天在眼泪样品中检测到载体DNA的峰值水平,此后在大多数受试者中未检测到载体DNA(13个中的8个)。直到注射后第3天,三名受试者(10%)的泪液样本中含有载体DNA,而在注射后约两周,两名受试者(7%)的泪液样本中具有载体DNA。在另外两个受试者(7%)中,直到注射后第3天,在未注射(或先前注射)的眼泪样品中检测到载体DNA。在3/29(10%)受试者的血清中检测到载体DNA,其中包括两名在每次注射后第3天直至眼泪样品中含有载体DNA的受试者。
特定人群
尚未使用Luxturna进行药代动力学研究。
药物相互作用研究
Luxturna尚未进行相互作用研究。
非临床毒理学
致癌,诱变,生育力受损
尚未进行动物研究来评估Luxturna对致癌,诱变和生育力损害的影响。
动物毒理学和/或药理学
天然发生RPE-65突变的狗的双眼同时视网膜下施用Luxturna的剂量水平高达每只眼睛8.25 x 10 10 vg,每只眼睛的7.5 x 10 11 vg(比建议的人类剂量水平高5倍),非人灵长类动物(NHP)的眼睛,视力正常。在这两种动物模型中,在建议的剂量为每只眼睛1.5 x 10 11 vg的人类推荐剂量水平下,对侧连续进行视网膜下给药(对侧眼是在第一只眼睛之后注射)的。此外,具有RPE-65突变的狗表现出改善的视觉行为和瞳孔反应。眼组织病理学仅显示轻度变化,这主要与手术给药过程的愈合有关。在犬和NHP的视网膜下注射Luxturna后观察到的其他发现包括偶发的和分离的视网膜炎性细胞,没有明显的视网膜变性。单次给予Luxturna后,先前未接触过AAV2载体的狗会产生针对AAV2衣壳的抗体,而NHP则不会。
临床研究
在一项开放标签,两中心,随机试验中评估了Luxturna在双等位基因RPE65突变相关性视网膜营养不良的儿科和成年患者中的疗效(研究2)。在这31名受试者中,有21名受试者被随机接受视网膜下注射Luxturna。一名受试者在治疗前退出研究。将十名受试者随机分为对照组(非干预组)。对照组中的一名受试者撤回同意书,并从研究中终止。观察一年后,将随机分为对照组的9名受试者交叉接受视网膜下注射Luxturna。 31名随机受试者的平均年龄为15岁(4至44岁),其中包括64%的儿科受试者(n = 20,年龄从4至17岁)和36%的成年人(n = 11)。 31名随机受试者包括13名男性和18名女性。 68%(68%)的受试者为白人,亚裔为16%,美洲印第安人或阿拉斯加土著人为10%,黑人或非裔美国人为6%。在两个单独的手术程序中以6到18天的间隔顺序进行双眼视网膜下注射Luxturna。
Luxturna的功效是建立在从基线到1年级的多亮度移动性测试(MLMT)得分变化的基础上。MLMT旨在测量功能性视力的变化,通过受试者准确导航课程的能力进行评估并以合理的速度在不同级别的环境照明下使用。使用两只眼睛和两只眼睛分别在七个照度级别(从400勒克斯(相当于明亮的办公室)到1勒克斯(相当于不满月的夏夜))中的一个或多个级别评估MLMT。为每个光照水平分配了一个介于0到6之间的得分代码。更高的得分表明受试者能够以更低的光照水平通过MLMT。对于在400 lux的光照水平下无法通过MLMT的受试者,得分为-1。对每个主题的MLMT进行了录像,并由独立的评分者进行了评估。 MLMT分数由受试者能够通过MLMT的最低照度确定。 MLMT得分变化定义为基线得分与第1年得分之间的差异。从基线到第1年就诊的MLMT得分变化为正值表示受试者能够在较低光照水平下完成MLMT。
还评估了其他临床结局,包括全视野光敏阈值(FST)测试,视敏度和视野。
表2总结了Luxturna治疗组与对照组相比,从基线到1年级的MLMT得分中位数变化。当使用两只眼睛或第一次治疗的眼睛时,在Luxturna治疗组中观察到的MLMT得分中位数为2或更高,而在对照组中观察到的MLMT得分中位数变化为0。 MLMT得分变化为2或更大被认为对功能性视力具有临床意义。
| 疗效结果 | Luxturna n = 21 | 控制 n = 10 | 区别 (Luxturna 减号) | p值 |
| 双眼MLMT得分变化,中位数(最小,最大) | 2(0,4) | 0(-1,2) | 2 | 0.001 |
| 首次治疗的眼睛的MLMT得分变化,中位数(最小,最大) | 2(0,4) | 0(-1,1) | 2 | 0.003 |
表3显示了在第1年时,两只眼睛的MLMT得分变化幅度不同的受试者的数量和百分比。Luxturna治疗组的21名受试者(52%)中有11名的MLMT得分变化为2或更高,其中1名受试者的MLMT得分变化为2或更高。对照组中十名(10%)受试者的MLMT得分变化为2。
| 分数变化 | Luxturna n = 21 | 控制 n = 10 |
| -1 | 0 | 3(30%) |
| 0 | 2(10%) | 3(30%) |
| 1个 | 8(38%) | 3(30%) |
| 2 | 5(24%) | 1(10%) |
| 3 | 5(24%) | 0 |
| 4 | 1(4%) | 0 |
图6显示了在基线和一年级时用两只眼睛的单个受试者的MLMT性能。
图6.两只受试者在基线和一年中双眼的MLMT得分


图6的注释:*撤回或中止的受试者。空心圆圈是基线分数。实心圆是一年级分数。实心圆旁边的数字表示第一年的分数变化。带箭头的水平线表示分数变化的幅度及其方向。指向右边的箭头表示改进。顶部显示了治疗组中21名受试者的结果。底部显示了对照组中10位受试者的结果。每个组中的主题按年龄按时间顺序组织,最年轻的主题排在顶部,最老的主题排在底部。
白光FST测试分析显示,与对照组相比,Luxturna治疗组从基线到1年级有统计学显着改善。 Luxturna和对照组之间从基线到1年级的视敏度变化无显着差异。
图7显示了在Luxturna治疗组的两年内Luxturna的作用,以及接受接受Luxturna的视网膜下注射后的对照组的作用。在第30天,Luxturna治疗组的MLMT得分中位数变化为2,并且在整个两年期间的其余后续随访中,这种效应一直持续。对于对照组,在第一年的所有四次随访中,MLMT评分中位数变化均为0。然而,在交叉接受卢克索坦的视网膜下注射后,与卢克索坦治疗组的受试者相比,对照组的受试者对卢克索坦的反应相似。
图7.两年的MLMT时间课程:双眼


关于图7的注释:每个框代表MLMT得分变化分布的中间50%。垂直虚线表示框上方和下方的其他25%。每个框中的水平条表示中位数。每个框中的点代表平均值。实线连接了治疗组就诊时MLMT得分的平均变化,包括第一年的5次访视和第二年的1次访视(标记为x365)。虚线连接了对照组的平均MLMT得分变化,包括第一年不接受Luxturna的五次访问,以及第二年交叉后的四次访问(标记为x30,x90,x180和x365)。在一年级接受Luxturna。
供应/存储和处理方式
每箱Luxturna(NDC 71394 – 415-01)包含一个Luxtrona单剂量小瓶(NDC 71394 – 065-01,可提取体积0.5 mL)和两瓶稀释液(NDC 71394 – 716-01,可提取1.7 mL)每个小瓶中的体积)。 Luxturna每毫升包含5 x 10 12个载体基因组(vg),在给药前需要1:10稀释。
将Luxturna和稀释剂储存在≤-65°C下冷冻。
小瓶解冻后,在室温下保存。将稀释的Luxturna置于室温下[参见剂量和用法2.2 ]。
Luxturna是一种基于腺相关病毒载体的基因疗法。请遵循通用的生物危害预防措施进行处理。
病人咨询信息
向患者和/或其看护者建议以下风险。
- 眼内炎和其他眼部感染
严重的感染可能发生在眼内,并可能导致失明。在这种情况下,迫切需要立即进行管理。如果患者出现新的漂浮物,眼痛或视力变化,建议患者致电其医疗保健提供者。
- 视力永久下降
视网膜下注射Luxturna后可能会导致视力永久下降。如果患者视力有任何变化,建议他们与他们的医疗保健提供者联系。
- 视网膜异常
Luxturna的治疗可能会在视网膜上造成一些缺陷,例如小眼泪或注射部位或附近的孔洞。治疗可能会导致中央视网膜变薄或视网膜出血。建议患者定期与他们的医疗保健提供者进行跟进,并立即报告任何症状,例如视力下降,视力模糊,闪光灯或视力浮动等。
- 眼内压升高
Luxturna的治疗可能会导致眼内压短暂或持续增加。如果不加以治疗,眼内压的这种升高可能导致失明。建议患者与其医疗保健提供者进行跟进,以发现并治疗眼内压的任何升高。
- 眼内气泡膨胀
建议患者避免空中旅行,高海拔旅行或水肺潜水,直到服用Luxturna后形成的气泡完全从眼中消失。当气泡仍然存在时,高度变化可能会造成不可逆转的损坏。
- 白内障
劝告患者使用Luxturna治疗后,他们可能会发展出新的白内障,或者任何现存的白内障都可能恶化。
- Luxturna脱落
患者的眼泪可能会发生Luxturna的短暂和低水平脱落。向患者和/或其护理人员建议适当处理因敷料,眼泪和鼻腔分泌物产生的废物的处理方法,包括在处置前将废物存储在密封袋中。 Luxturna用药后最多7天应遵循这些操作预防措施。
由制造:
Spark Therapeutics,Inc.
市场街3737号
宾夕法尼亚州费城19104
美国牌照#2056
Luxturna是Spark Therapeutics,Inc.的商标。
分级为4 +©2017 Spark Therapeutics,Inc.
主显示屏面板-Luxturna纸箱标签
NDC 71394-415-01
仅Rx
肾上腺病毒基因
Luxturna™
5 x 10 12个载体基因组/ mL。没有美国效力标准。
一(1)个单剂量小瓶的Voretigene neparvovec-rzyl,每小瓶0.5 mL
两(2)瓶稀释液,用于孕激素neparvovec-rzyl,每瓶1.7毫升
储存于≤-65°C。使用前先稀释。丢弃未使用的部分。
用于视网膜下注射
有关完整的处方信息和说明,请参阅包装插页
剂量和给药。
由Spark Therapeutics Inc.制造
市场街3737号套房1300
宾夕法尼亚州费城19104
美国许可证号2056

主要显示面板-Voretigene Neparvovec标签的稀释剂
NDC 71394-716-01
孕激素新药neparvovec-rzyl的稀释剂
pH 7.3,含0.001%
泊洛沙姆188
仅限于接收
每瓶1.7毫升储存在≤-65°C
为火花疗法制造
诺瓦实验室
美国许可证号2056

主显示面板-Luxturna标签
NDC 71394-065-01
肾上腺病毒基因
视网膜下注射
5 x 10 12个载体基因组/ mL
一(1)个单剂量小瓶,每小瓶0.5 mL
仅用于Rx;使用前必须稀释
储存于≤-65°C;丢弃未使用的部分
由制造
Spark Therapeutics,Inc.
美国许可证号2056

主显示屏面板-Luxturna邮袋标签
NDC 71394-415-01
仅Rx
肾上腺病毒基因
Luxturna™
5 x 10 12个载体基因组/ mL。没有美国效力标准。
一(1)个单剂量小瓶的Voretigene neparvovec-rzyl,每小瓶0.5 mL
两(2)瓶稀释液,用于孕激素neparvovec-rzyl,每瓶1.7毫升
储存于≤-65°C。使用前先稀释。丢弃未使用的部分。
用于视网膜下注射
有关完整的处方信息和说明,请参阅包装插页
用于剂量和给药
NDC 71394-415-01
由Spark Therapeutics制造
市场街3737号套房1300
宾夕法尼亚州费城19104
美国许可证号2056

主显示屏面板-Luxturna邮袋标签
NDC 71394-415-01
仅Rx
肾上腺病毒基因
Luxturna™
5 x 10 12个载体基因组/ mL。没有美国效力标准。
一(1)个单剂量小瓶的Voretigene neparvovec-rzyl,每小瓶0.5 mL
两(2)瓶稀释液,用于孕激素neparvovec-rzyl,每瓶1.7毫升
储存于≤-65°C。使用前先稀释。丢弃未使用的部分。
用于视网膜下注射
有关完整的处方信息和说明,请参阅包装插页
用于剂量和给药
NDC 71394-415-01
由Spark Therapeutics制造
市场街3737号套房1300
宾夕法尼亚州费城19104
美国许可证号2056

| Luxturna 血管性病毒基因neparvovec-rzyl试剂盒 | ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| 贴标机-Spark Therapeutics,Inc.(079498241) |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| Spark Therapeutics,Inc. | 079498241 | API制造(71394-415、71394-065、71394-716),分析(71394-415、71394-065、71394-716) | |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| 生物信赖公司 | 147227730 | 分析(71394-065,71394-716) | |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| 药品开发有限公司(PPD) | 838082055 | 分析(71394-065,71394-716) | |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| 吸收系统 | 007797314 | 分析(71394-065,71394-716) | |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| Eurofins(兰开斯特实验室) | 069777290 | 分析(71394-065,71394-716) | |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| Intertek制药服务 | 805606758 | 分析(71394-065,71394-716) | |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| 新星实验室有限公司 | 230804692 | 制造(71394-065,71394-716),分析(71394-065,71394-716),标签(71394-065,71394-716) | |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| 康泰伦特制药解决方案 | 232616826 | 包装(71394-415),包装(71394-065,71394-716),标签(71394-415,71394-065,71394-716) | |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| Hologic Ltd Tepnel制药服务 | 218122626 | 分析(71394-065,71394-716) | |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| 协同健康(Steris的一部分) | 226067312 | 灭菌(71394-065,71394-716) | |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
美国日本医生

Bert Hepner DO

Gregory Aaen MD

Kristopher Aalderink MD

Kristopher Aalderink MD

Denise Aaron MD

村上和成 教授

中山秀章 教授

村田朗

溝上裕士 医院教授
