获取国外Vistaseal药品价格,使用等信息,最快 24 小时回馈
Vistaseal
Vistaseal
在本页面
- 适应症和用法
- 剂量和给药
- 剂型和优势
- 禁忌症
- 警告和注意事项
- 不良反应/副作用
- 在特定人群中使用
- 描述
- 临床药理学
- 非临床毒理学
- 临床研究
- 供应/存储和处理方式
- 病人咨询信息
Vistaseal的适应症和用法
当通过标准外科手术技术(例如缝合,结扎和烧灼)控制出血无效或不切实际时,在进行手术的成年人中,Vistaseal可以作为止血的辅助工具,用于轻度至中度出血。 Vistaseal对肝素化患者有效。
Vistaseal剂量和给药
仅用于局部使用。
剂量
个性化应用纤维蛋白封闭剂。在临床研究中,单个剂量的范围通常为0.3到18.0 mL。除临床研究中所包括的以外,其他外科手术可能需要更大的容积。
表1列出了每种Vistaseal包装尺寸的大致表面积。
| Vistaseal包装尺寸 | 表面积(cm 2 ) 滴加或喷涂 (1毫米厚的层) |
| 2毫升 | 16-22 |
| 4毫升 | 32-44 |
| 6毫升 | 48-66 |
| 10毫升 | 80-110 |
剂量取决于变量,包括但不限于外科手术的类型,区域的大小,预期的应用方法和应用次数。
施加足够量的Vistaseal,以薄层完全覆盖预期的应用区域。如有必要,请重复该应用程序。
准备和处理
仅根据说明和推荐的设备来准备和管理产品。
从冰箱中取出纸箱,打开并取出两个水泡。
将装有Vistaseal Dual Applicator的泡罩置于室温下,直到Vistaseal纤维蛋白密封剂(人类)准备使用为止。
室温解冻(首选方法)
使用Vistaseal预装注射器在室温下解冻起泡,请执行以下步骤:
- 在室温(20ºC-25ºC,[68-77ºF])的表面上将装有注射器支架的泡罩与预装好的注射器一起放置
对于2 mL和4 mL的包装,约需70分钟
对于6 mL和10 mL的包装,约需90分钟
解冻后,无需加热产品即可使用。
解冻后,溶液必须澄清至微乳白色,无色至浅黄色。
请勿使用浑浊或有沉淀的溶液。
修复后存储:
解冻后,包含Vistaseal注射器支架,预装注射器和Dual Apparator的套件在使用前可以在2到8ºC[36-46ºF]的冰箱中或在室温下24小时在冰箱中存放不超过48小时( 20-25°C [68-77ºF]),如果仍密封在原始包装中。一旦水泡打开,在手术期间立即使用Vistaseal并丢弃所有未使用的内容物。
解冻后,请勿重新冻结。
转移说明:
- 解冻后,在室温下或2-8°C [36-46ºF]下从冰箱表面去除水泡。
- 打开水泡,使配备了预装注射器的Vistaseal注射器架可供第二个人使用,以转移到无菌区域。水泡的外部不应与无菌区域接触。参见图1。

图1
无菌水浴(快速解冻)
在不超过37ºC[99ºF]的无菌恒温水浴中,在无菌区域内解冻Vistaseal预装注射器,方法如下:
注意:打开Vistaseal水泡后,请在手术期间立即使用本产品。使用无菌技术以避免因处理不当而造成污染的可能性,并准确执行以下步骤。解冻完成并且准备好安装双重涂抹器之前,请勿取下注射器鲁尔盖。
- 打开水泡,使配备了预装注射器的Vistaseal注射器架可供第二个人使用,以转移到无菌区域。水泡的外部不应与无菌区域接触。参见图1。
- 将装有预装注射器的注射器支架直接放入无菌水浴中,以确保将其完全浸入水中。参见图2。
- 在37ºC下,对于2 mL,4 mL,6 mL和10 mL的包装,所需时间约为5分钟,但在此温度下放置的时间不得超过10分钟。
水浴温度不得超过37ºC。 - 解冻后,使用无菌外科纱布将注射器支架用预装的注射器干燥。

图2
解冻后,溶液必须澄清至微乳白色,无色至浅黄色。
请勿使用浑浊或有沉淀的溶液。
手术期间立即使用Vistaseal,并丢弃所有未使用的内容物。
连接说明
- 打开水泡,使Vistaseal Dual Applicator和另外两个无气喷头可供第二个人使用,以转移到无菌区域。水泡的外部不应与无菌区域接触。
- 握住Vistaseal纤维蛋白密封剂(人类)注射器支架,并使注射器路厄帽朝上。参见图3。
- 拧开并丢弃纤维蛋白原和凝血酶注射器的注射器鲁尔盖。参见图3。

图3 - 握住注射器支架,使路厄指向上。要去除注射器中的气泡,请轻轻地敲打注射器支架的侧面一到两次,同时将其保持在直立的位置,并轻轻按下柱塞以排出空气。参见图4。

图4 - 附上双重涂药器。参见图5。
注意:在连接过程中或在预定使用之前,请勿压下柱塞,因为这两种生物成分会在无气喷头中预混合,从而形成纤维蛋白凝块,从而阻止分配。参见图6。
图5
图6 - 拧紧鲁尔锁,并确保牢固地安装了双重涂抹器。该设备现在可以使用了。
2.3管理
使用随附的注射器支架和柱塞涂抹Vistaseal纤维蛋白密封剂(人类)。
使用产品随附的双重涂抹器涂抹Vistaseal纤维蛋白密封剂(人类)。也可以使用由FDA批准的Vistaseal纤维蛋白密封剂(人类)专用的涂药器提示。使用随附的双重涂药器时,请按照上一节中的连接说明进行准备。使用其他涂药器吸头时,请遵循涂药器吸头随附的使用说明。
施用Vistaseal纤维蛋白封闭剂(人类)之前:
-为防止组织粘附在不希望的位置,请保护(覆盖)身体部位,使其超出预期的应用区域。 [参见剂量和用法(2.4) ]
-使用标准技术(例如,间歇性按压,拭子,使用抽吸装置)来干燥目标出血部位的表面积。
喷涂施工
- 握住并弯曲双重涂抹器到所需位置。尖端将保持其形状。
- 将无气喷涂头放置在距目标组织至少2 cm的位置。向柱塞施加均匀的压力,以喷涂纤维蛋白密封剂。相应地增加距离,以实现目标区域的所需覆盖范围。
- 如果出于任何原因停止了表情,请更换无气喷嘴。要更换无气喷嘴,请从患者身上取下设备,然后拧松旧的无气喷嘴。请参见图7。将用过的无气喷嘴远离备用的无气喷嘴。用干燥或潮湿的无菌手术纱布擦拭涂抹器的末端。然后,连接包装中提供的新的无气喷嘴,并在使用前确保已牢固连接。
注意:如果正确连接了无气喷涂头,则红色指示灯将不可见。参见图8。
注意:请勿继续推动柱塞,以试图清除无气喷雾嘴中的血纤维蛋白凝块;否则,涂抹器可能无法使用。
注意:请勿修剪双喷头,以免暴露内部电线。
图7
图8
滴涂
- 拧下无气喷涂头,以除去喷嘴和滴头的无气喷涂头部分。
参见图7。 - 抓住并弯曲滴头至所需位置。尖端将保持其形状。
- 在滴注过程中,在滴注过程中,滴头的末端应尽可能靠近组织表面,而不要接触组织。
- 将单滴药液涂在要处理的表面积上。为防止不受控制的凝结,请让液滴彼此分开并与滴头末端分开。
注:从适配器上卸下用过的滴头后,请勿重新连接;否则,滴头内部可能会形成凝块,并且涂抹器可能无法使用。
2.4应用注意事项
- 在施用Vistaseal之前,保护(覆盖)身体所需部位以外的部位,以防止组织粘附在不需要的部位。 [请参阅剂量和用法(2.3)
- 将Vistaseal涂薄。血块厚度过大可能会对产品的功效和伤口愈合过程产生负面影响。 [参见剂量和用法(2.1)]
- 仅在可能准确判断从喷嘴到组织表面的距离时才喷涂Vistaseal。 [参见剂量和用法(2.3)]
- 没有临床数据可支持该产品在神经外科手术中的使用或通过柔性内窥镜在治疗出血中的应用。
剂型和优势
Vistaseal作为套件提供,包括两个独立的包装:
- 一个包装,每个包装一个注射器,分别装在注射器支架上的80 mg / mL人纤维蛋白原(组分1)和500 IU / mL人凝血酶(组分2)无菌冷冻溶液。
- 一个包装,内含一个带有两个附加无气喷头的双喷头。
表2列出了Vistaseal的可用包装尺寸。
| 包装尺寸(总体积) | 人纤维蛋白原 | 人凝血酶 |
| 2毫升 | 1毫升 | 1毫升 |
| 4毫升 | 2毫升 | 2毫升 |
| 6毫升 | 3毫升 | 3毫升 |
| 10毫升 | 5毫升 | 5毫升 |
禁忌症
- 请勿直接注入循环系统。 [请参阅警告和注意事项(5.1)]
- 请勿用于治疗严重或轻度的动脉出血。在这些情况下,血流将冲走Vistaseal并防止止血。
- 已知对人血产品产生过敏性或严重全身性超敏反应的患者请勿使用Vistaseal。 [请参阅警告和注意事项(5.2)]
- 除非可以达到从涂抹器尖端到出血部位的最小推荐距离,否则请勿使用Vistaseal进行喷涂。 [参见剂量和用法(2.3)]
警告和注意事项
血栓形成
如果在血管内施用Vistaseal,可能会发生危及生命的血栓栓塞并发症。
5.2过敏
过敏型超敏反应是可能的。过敏反应的迹象包括荨麻疹,全身性荨麻疹,胸闷,喘息,低血压和过敏反应。如果出现这些症状,请立即停止使用Vistaseal。相应地处理反应。
5.3传染性传染源
由于Vistaseal是由人血浆制成的,因此可能具有传播传染原的风险,例如病毒,克雅氏病(vCJD)变种,理论上是Creatzfeldt-Jakob(CJD)病原。这也适用于未知或新兴病毒和其他病原体。医生或其他医疗保健提供者应将与该产品有关的所有可疑感染报告给Grifols Therapeutics LLC,电话是1-800-520-2807。医生应与患者讨论使用Vistaseal的风险和益处。 [请参阅患者咨询信息(17)]
不良反应
最常见的不良反应(据报道> 1%的临床试验受试者)为恶心和程序性疼痛。
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此不能将在一种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映在临床实践中观察到的不良反应率。
使用相同的一般设计进行了三项临床试验,每项试验都是随机的并且是主动控制的。每个试验中包括的手术类型不同。在所有试验中,血管外科手术占26%,实质组织手术占37%,软组织手术占37%。临床试验使用Fibrijet®滴或喷雾施用器以纤维蛋白胶(人)进行的。
在所有临床试验中,使用纤维蛋白封闭剂(人类)来治疗血管外科手术中的血管出血,肝手术过程中的实质性出血,腹膜后或骨盆手术,腹部整形术或不孕症期间的软组织出血,涉及500名接受纤维蛋白封闭剂治疗的受试者(人类)和377个控制对象。每种外科手术接受治疗的试验对象的数量为:血管外科手术168人,实质外科手术163人,软组织外科手术169人。
纤维蛋白封闭剂(人类)治疗组的平均年龄为57岁(标准差:15.6岁;范围:0.3至86岁)。中位年龄为60岁。有11名年龄小于18岁的受试者。有51%的男性受试者。暴露于纤维蛋白封闭剂(人类)的受试者中有87%是白人。
每个受试者和目标出血部位使用的纤维蛋白封闭剂(人类)的平均体积为7 mL(标准偏差3.5),范围为0.3至18 mL。中位数为6 mL。暴露于纤维蛋白封闭剂(人类)由一次术中给药组成。
临床安全性数据库包括所有受试者在所有临床研究中均接受了任意量的纤维蛋白封闭剂(人类)的受试者,没有任何排除。
在纤维蛋白封闭剂(人类)治疗组中,有13%的试验受试者经历了一种或多种不良反应,而8%的对照受试者经历了一种或多种不良反应。
表3-6中显示的不良反应被评估为与纤维蛋白封闭剂(人类)治疗具有可能的因果关系,并且发生在> 1%的受试者中。
| 首选条款 | N = 500 n(%) |
| 恶心 | 6(1) |
| 程序性疼痛 | 10(2) |
| 首选条款 | N = 168 n(%) |
| 恶心 | 2(1) |
| 发热(发烧) | 2(1) |
| 程序性疼痛 | 4(2) |
| 血管移植并发症 | 2(1) |
| 细小病毒B19测试呈阳性 | 2(1) |
| 尿retention留(无法完全排空膀胱) | 2(1) |
| 首选条款 | N = 163 n(%) |
| 术后胆漏 | 2(1) |
| 程序性疼痛 | 2(1) |
| 肺栓塞(肺部血块) | 2(1) |
| 深静脉血栓形成(在深静脉中形成的血凝块) | 2(1) |
| 首选条款 | N = 169 n(%) |
| 贫血(低红细胞) | 2(1) |
| 白细胞增多症(白细胞增多) | 2(1) |
| 肠梗阻(胃或肠的运动减少或缺乏) | 2(1) |
| 恶心 | 4(2) |
| 程序性疼痛 | 4(2) |
| 丙氨酸转氨酶增加 | 2(1) |
| 天冬氨酸转氨酶增加 | 2(1) |
| 低钙血症(低血钙) | 2(1) |
| 低钾血症(低血钾) | 2(1) |
| 低钠血症(低血清钠) | 2(1) |
| 凝血酶原时间延长(出血时间增加) | 2(1) |
| 头痛 | 2(1) |
| 失眠 | 2(1) |
| 瘙痒(瘙痒) | 4(2) |
| 高血压 | 2(1) |
在特定人群中的使用
怀孕
风险摘要
目前尚无孕妇使用Vistaseal的数据。 Vistaseal尚未进行动物繁殖研究。尚不清楚Vistaseal对孕妇给药是否会造成胎儿伤害或会影响生殖能力。在美国普通人群中,临床公认的怀孕中估计的主要先天缺陷和流产的背景风险分别为2-4%和15-20%。
哺乳期
风险摘要
没有关于人乳中存在Vistaseal,对母乳喂养婴儿的影响或对牛奶产量的影响的信息。应当考虑母乳喂养对发育和健康的益处,以及母亲对Vistaseal的临床需求以及Vistaseal或潜在母体状况对母乳喂养婴儿的任何潜在不利影响。
儿科用
在临床试验中,在接受纤维蛋白封闭剂(人类)治疗的500名受试者中,共有11名是儿科受试者。在这11名受试者中,有5名是2岁以下的婴儿,5名是2至11岁的儿童,还有1名是12至16岁的青少年。儿科患者的安全性和有效性尚未确定。
老人用
临床试验包括172位65岁或65岁以上的纤维蛋白封闭剂(人类)治疗的受试者。在这些受试者和较年轻的受试者之间未观察到安全性或有效性的差异。
Vistaseal说明
Vistaseal是一种两组分纤维蛋白密封剂,由人纤维蛋白原(组分1)和人凝血酶与氯化钙(组分2)无菌溶液组成,填充在注射器中,并在注射器支架中组装。
Vistaseal以冷冻溶液的形式提供。解冻后,人纤维蛋白原和凝血酶溶液呈澄清或微乳白色,无色或浅黄色。 Vistaseal不包含任何防腐剂。
纤维蛋白原
组分1是无菌溶液,pH 6.5-8.0,其中包含浓缩的人纤维蛋白原和赋形剂。纤维蛋白原是人血中的一种蛋白质,与凝血酶结合时会形成凝块。人纤维蛋白原溶液的组成如下:
活性成分:人纤维蛋白原(80 mg / mL)
其他成分:柠檬酸钠,氯化钠,精氨酸,L-异亮氨酸,L-谷氨酸一钠和注射用水。
凝血酶
组分2是无菌溶液,pH 6.0-8.0,其中包含纯化的人凝血酶和赋形剂。凝血酶是一种特定的蛋白酶,可激活最终结合产物的凝结并将纤维蛋白原转化为纤维蛋白。人凝血酶溶液的组成如下:
有效成分:人凝血酶(500 IU / mL)
其他成分:氯化钙,人白蛋白,氯化钠,甘氨酸和注射用水。
生产Vistaseal的纤维蛋白原和凝血酶成分的起始材料是从美国FDA许可的血浆收集中心获得的人源血浆。使用Cohn的血浆分级分离方法来获得级分I(是产生纤维蛋白原的起始原料),以及从级分I的上清液中分离的凝血酶原复合物(级分是凝血酶的起始原料)。纤维蛋白原的纯化过程包括溶剂/去污剂处理,三个甘氨酸沉淀步骤以及使用35 nm和20 nm滤膜的双重纳米过滤。凝血酶的纯化过程包括溶剂/去污剂处理,离子交换色谱和通过15 nm滤膜的双重纳米过滤。纳滤后,将纤维蛋白原和凝血酶溶液配制,无菌过滤,无菌填充在注射器中,包装,灭菌和冷冻。
病毒安全
用于制造Vistaseal的单个血浆捐赠物在美国FDA许可的血浆捐赠中心中收集,并按照美国法规要求进行病毒标记测试。此外,使用经过验证的核酸测试(NAT)方法,测试了血浆单元的微型池作为甲型肝炎病毒(HAV)和细小病毒B19(B19V)的过程中对照。除B19V以外,所有测试都必须是非反应性(阴性)测试,对于B19V,血浆生产池中的限值不超过10 4 IU / mL的效价。生产血浆池也已通过NAT对HBV,HCV和HIV进行了测试,并且所有测试都必须是非反应性的(阴性)。
纤维蛋白原和凝血酶的制造工艺包括旨在降低病毒传播风险的加工步骤。两种成分均具有两个具有病毒清除能力的不连续步骤,即溶剂/去污剂处理(1.0%(v / v)吐温80 / 0.30%(v / v)磷酸三正丁酯(TNBP)在6.0-6.5小时内)纤维蛋白原为27.0±1.5ºC,凝血酶为25±1ºC,已验证可灭活被包膜的病毒,纳滤步骤可去除非包膜和被包膜的病毒(用于纤维蛋白原的35 nm和20 nm过滤器以及两个15 nm过滤器)凝血酶过滤器)。另外,甘氨酸沉淀步骤在人纤维蛋白原的纯化过程中有助于产品的整体安全性。级分I沉淀和离子交换层析步骤有助于纯化人类凝血酶过程中产品的整体安全性。
这些病毒的灭活/清除程序的病毒清除能力已在小规模的体外研究中得到验证,使用相关的和模型的病毒具有一系列的理化特性。病毒清除率验证研究的结果总结在表7和8中:
| 制造步骤 | 病毒减少系数(log 10 )* | |||||
| 包膜病毒 | 非包膜病毒 | |||||
| HIV-1 | PRV | 西尼 | BVDV | 甲肝病毒 | PPV | |
| S / D处理 | ≥5.33 | ≥6.80 | ≥5.20 | ≥5.60 | 呐 | 呐 |
| 甘氨酸 降水 | nd | nd | nd | nd | 5.21 | 2.09 |
| 纳滤35 nm 和20海里 | ≥5.57 | ≥6.09 | ≥4.51 | ≥4.53 | 5.22 | 4.37 |
| 全球病毒 衰减系数 (日志10 ) | ≥10.90 | ≥12.89 | ≥9.71 | ≥10.13 | 10.43 | 6.46 |
| *:在计算全局病毒减少量时未考虑小于1 log 10的减少率; nd:没有完成; na:不适用; BVDV:牛病毒性腹泻病毒,HCV模型; WNV:西尼罗河病毒; PRV:伪狂犬病病毒,大型包膜DNA病毒的模型; PPV:猪细小病毒,B19V模型 | ||||||
| 制造步骤 | 病毒减少系数(log 10 )* | |||||
| 包膜病毒 | 非包膜病毒 | |||||
| HIV-1 | PRV | 西尼 | BVDV | 甲肝病毒 | PPV | |
| 分数I沉淀 | <1.0 | 2.13 | 2.78 | 1.34 | 1.18 | <1.0 |
| S / D处理 | ≥5.52 | ≥5.85 | ≥5.94 | ≥5.09 | 呐 | 呐 |
| SP-Sepharose XL色谱 | nd | nd | nd | nd | 4.61 | 3.97 |
| 双纳滤15 nm | ≥4.03 | ≥5.95 | ≥5.42 | ≥4.93 | 6.56 | 6.14 |
| 全球病毒减少系数(log 10 ) | ≥9.55 | ≥13.93 | ≥14.14 | ≥11.36 | 12.35 | 10.11 |
Vistaseal-临床药理学
作用机理
Vistaseal包含人类纤维蛋白原和人类凝血酶。当应用到伤口部位并混合时,这些生物成分会在生成人类血液凝固系统最后阶段的过程中生成交联的纤维蛋白凝块。纤维蛋白原被凝血酶转化为纤维蛋白单体和纤维蛋白肽。血纤蛋白单体聚集并形成血纤蛋白凝块,该血凝块阻止出血。 XIIIa因子通过凝血酶从XIII因子激活,它使纤维蛋白交联。钙离子是纤维蛋白原的转化和纤维蛋白交联所必需的。
药效学
Vistaseal没有相关的药效学数据。
药代动力学
Vistaseal通过纤维蛋白溶解和吞噬作用以与内源性纤维蛋白相同的方式代谢。没有针对Vistaseal进行药代动力学研究。
非临床毒理学
致癌性,诱变,生育力受损
没有进行动物研究来评估Vistaseal的致癌或致突变作用或其对生育力的影响。
临床研究
血管外科
进行了一项前瞻性,随机,对照临床研究,以评估纤维蛋白封闭剂(人类)辅助血管手术止血的安全性和有效性。受试者接受了使用聚四氟乙烯移植物材料进行近端端到端动脉吻合或上肢血管通路动脉吻合的血管外科手术。临床试验用使用Fibrijet®施放器生物蛋白胶(人)进行的。当比较每组4分钟止血的受试者比例时,血纤蛋白封闭剂(人类)优于对照组(手动加压)(表9)。在10分钟时也建立了优势。与对照组(≥10.0分钟)相比,纤维蛋白封闭剂(人类)治疗组(4.0分钟)的止血时间中位数显着缩短(p值<0.001)。
| *意向性治疗(ITT)人群:包括所有随机接受血纤蛋白封闭剂(人类)或对照的受试者。 1两个治疗组(纤维蛋白封闭剂(人类)相对于对照组)中达到功效终点的受试者比例。 CI =置信区间。 列出的功效结果是累积结果。 | ||||
| 功效终点 | 纤维蛋白封闭剂 (人类) N = 109 n(%) | 控制 N = 57 n(%) | -比例1 (95%CI) | P值 |
| 4分钟止血 | 83(76.1) | 13(22.8) | 3.3(2.0,5.4) | <0.001 |
| 10分钟止血 | 96(88.1) | 26(45.6) | 1.9(1.4,2.6) | <0.001 |
实质手术
进行了一项前瞻性,随机,对照的临床研究,以评估纤维蛋白封闭剂(人类)在实质手术中辅助止血的安全性和有效性。受试者进行了肝切除术。临床试验用使用Fibrijet®施放器生物蛋白胶(人)进行的。纤维蛋白封闭剂(人类)显示出在4分钟止血方面优于对照组(氧化再生纤维素)(表10)。与对照组(3.0分钟)相比,纤维蛋白封闭剂(人)治疗组(2.0分钟)的止血时间中位数显着缩短(p值<0.001)。
| *意向性治疗(ITT)人群:包括随机分配给纤维蛋白封闭剂(人类)或对照的所有受试者。 1在两个治疗组(纤维蛋白封闭剂(人类)相对于对照组)中达到功效终点的受试者比例。 CI =置信区间 列出的功效结果是累积结果。 | ||||
| 功效终点 | 纤维蛋白封闭剂 (人类) N = 111 n(%) | 控制 N = 113 n(%) | 比例1 (95%CI) | P值 |
| 4分钟止血 | 103(92.8) | 91(80.5) | 1.2(1.0,1.3) | 0.010 |
| 2分钟止血 | 62(55.9) | 47(41.6) | 1.3(1.0,1.8) | 0.045 |
软组织手术
进行了一项前瞻性,随机,对照临床研究,以评估纤维蛋白封闭剂(人类)在腹膜后和骨盆手术过程中以及在乳房畸形和腹部整形手术中辅助软组织止血止血的安全性和有效性。临床试验用使用Fibrijet®施放器生物蛋白胶(人)进行的。血纤蛋白封闭剂(人类)显示在4分钟止血方面不逊于对照组(氧化再生纤维素)(表11)。
| *意向性治疗(ITT)人群:包括随机分配给纤维蛋白封闭剂(人类)的所有受试者。 1在两个治疗组(纤维蛋白封闭剂(人类)相对于对照组)中达到功效终点的受试者比例。 CI =置信区间。 列出的功效结果是累积结果。 | ||||
| 功效终点 | 纤维蛋白封闭剂 (人类) N = 116 n(%) | 控制 N = 108 n(%) | 比例1 (95%CI) | P值 |
| 4分钟止血 | 96(82.8) | 84(77.8) | 1.1(0.9,1.2) | 0.401 |
供应/存储和处理方式
Vistaseal以单剂量试剂盒的形式提供,包括两个预装的注射器,其中装有人类纤维蛋白原(组分1)和含凝血钙的人类凝血酶(组分2)的无菌冷冻溶液,它们组装在单个注射器支架中。针筒柱塞通过柱塞连杆连接,以确保同时使用生物成分。与产品一起包装的是一个带两个附加的无气喷涂头的双重喷涂器,可以通过喷涂或滴注的方式进行喷涂。无气喷涂喷嘴不透射线。参见图9。

图9
表12列出了Vistaseal的可用包装尺寸。
| Vistaseal包装尺寸 | NDC号码 | |||
| 总容积 | 人的 纤维蛋白原 | 人的 凝血酶 | 纸箱 | 吸塑标签 |
| 2毫升 | 1毫升 | 1毫升 | 61953-0011-1 | 61953-0011-2 |
| 4毫升 | 2毫升 | 2毫升 | 61953-0012-1 | 61953-0012-2 |
| 6毫升 | 3毫升 | 3毫升 | 61953-0013-1 | 61953-0013-2 |
| 10毫升 | 5毫升 | 5毫升 | 61953-0014-1 | 61953-0014-2 |
存储
将冷冻的试剂盒(带Vistaseal Dual Applicator的内含纤维蛋白密封剂(人类))保存在冰箱中(-18°C [0°F]或更低温度)最多2年。在使用之前,不得中断冷藏条件。使用前解冻。解冻后,请勿重新冻结。
解冻后,如果保持密封,在使用前Vistaseal可以在2 ‑ 8ºC[36-46ºF]下存放48小时或在室温(20-25℃[68-77ºF])下存放24小时。原包装。打开包装后,请在手术期间立即使用Vistaseal并丢弃所有未使用的物品。
将消毒后的水泡放在外面的纸箱中,以避光。
请勿在外箱和容器标签上印刷的失效日期之后使用。如果包装损坏,则丢弃。
病人咨询信息
指示患者立即向医生报告血栓形成或栓塞的症状,其中可能包括:受累区域的手臂或腿部疼痛和/或肿胀并伴有温暖,手臂或腿部变色,无法解释的呼吸急促,胸痛或不适深呼吸,无法解释的快速脉搏,身体一侧的麻木或无力会恶化[ s血栓形成(5.1)] 。
告知患者Vistaseal由人血浆制成,并可能具有传播传染源(例如病毒,vCJD介质以及理论上为CJD介质)的风险。指导患者报告与他们有关的任何症状,可能是感染引起的。
由制造:
南非INSTITUTO GRIFOLS
西班牙巴塞罗那
美国牌照编号1181
发行人:
Ethicon,Inc.
西22号公路,邮政信箱151
新泽西州萨默维尔08876-0151
美国•1-877-ETHICON•+ 1-513-337-6928
©Ethicon,Inc.2018年
包装标签,主要显示面板
NDC 61953-0011-1
纤维蛋白密封剂(人类)
Vistaseal™
冷冻解决方案
2毫升
乙炔
人纤维蛋白原/人凝血酶-用于局部使用。不要注射。
内容
•1个单剂量试剂盒,包含两个预先填充的注射器,每个注射器装有无菌冷冻溶液,并装在注射器支架中。
•1个双喷头,带有2个其他无气喷头。
成分1:1 mL人血纤维蛋白原(80 mg / mL)。其他成分:柠檬酸钠,氯化钠,精氨酸,L-异亮氨酸,L-谷氨酸一钠和注射用水。
成分2:1 mL人凝血酶(500 IU / mL)。其他成分:氯化钙,人白蛋白,氯化钠,甘氨酸和注射用水。
不含防腐剂。
存放在冰箱(-18°C [0°F]或更低)中。冷藏链在使用前不得中断。
将无菌水泡保持在外部纸箱中,以避光。
解冻使用。解冻后请勿重新冻结。解冻后,如果使用以下工具,则该套件在使用前可在2-8°C [36-46°F]下保存48小时,或者在室温下(20-25°C [68-77°F])在室温下保存24小时以下。它仍然密封在原始包装中。打开包装后,请立即使用产品。
有关使用说明和注意事项,请参阅随附的包装插页。
使用后,请丢弃所有未使用的内容和管理设备。
图1
无菌水浴(快速解冻)
使用以下步骤,在不超过37ºC[99ºF]的无菌恒温水浴中,在无菌区域内解冻VISTASEAL预装注射器:
注意:打开VISTASEAL水泡后,请在手术期间立即使用产品。使用无菌技术以避免因处理不当而造成污染的可能性,并准确执行以下步骤。解冻完成并且准备好安装双重涂抹器之前,请勿取下注射器鲁尔盖。
- 打开水泡,并与提供给第二人转移到无菌区预充式注射器的VISTASEAL注射器支撑。水泡的外部不应与无菌区域接触。参见图1。
- 与预填充注射器的注射器保持器直接放置入无菌水浴确保其完全浸没在水中。参见图2。
- 在37℃,所需的时间为2毫升,4毫升,6毫升和10毫升的封装尺寸约5分钟,但决不能在该温度下放置10分钟以上。
水浴温度不得超过37ºC。 - 干后用预填充的注射器,所述注射器座在解冻后,使用无菌外科手术纱布。
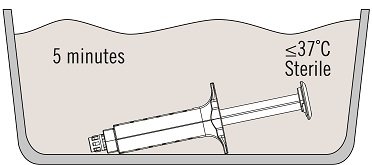
图2
解冻后,解决方案必须明确到轻微乳白色和无色至淡黄色。
请勿使用浑浊或有沉淀的溶液。
手术期间立即使用VISTASEAL,并丢弃所有未使用的物品。
连接说明
- 打开水泡,使VISTASEAL双涂覆和两个额外的无气喷涂技巧提供给第二人转移到无菌区。水泡的外部不应与无菌区域接触。
- 握住VISTASEAL纤维蛋白胶(人类)注射器座与注射器鲁尔帽向上指向。参见图3。
- 拧松并同时废弃纤维蛋白原和凝血酶的注射器注射器鲁尔帽。参见图3。
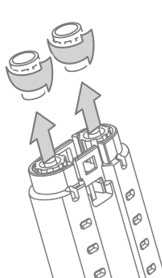
图3 - 握住向上指向的鲁尔注射器支撑器。要去除注射器中的气泡,请轻轻地敲打注射器支架的侧面一到两次,同时将其保持在直立的位置,并轻轻按下柱塞以排出空气。参见图4。
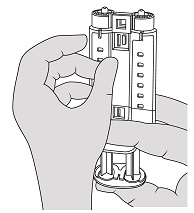
图4 - 装上双涂覆。参见图5。
注意:在连接过程中或在预定使用之前,请勿压下柱塞,因为这两种生物成分会在无气喷头中预混合,从而形成纤维蛋白凝块,从而阻止分配。参见图6。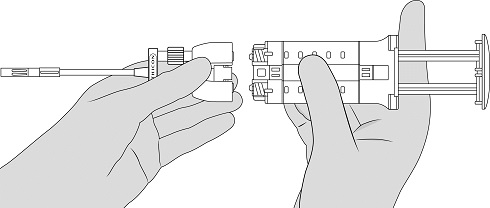
图5
图6 - 拧紧鲁尔锁,确保双涂覆牢固。该设备现在可以使用了。
2.3管理
应用使用所述注射器保持器和柱塞提供VISTASEAL纤维蛋白胶(人)。
申请使用双涂覆本产品提供的VISTASEAL生物蛋白胶(人)。也可以使用由FDA批准的用于VISTASEAL纤维蛋白密封剂(人用)的专用涂抹器技巧。使用随附的双重涂药器时,请按照上一节中的连接说明进行准备。使用其他涂药器吸头时,请遵循涂药器吸头随附的使用说明。
VISTASEAL生物蛋白胶(人类)给药前:
-为了防止在不希望的网站,保护(覆盖)的身体部位的预期应用领域以外组织粘连。 [参见剂量和用法(2.4) ]
-使用标准技术(例如,压缩时,拭子,使用抽吸装置的间歇应用程序)以干燥该目标出血部位的表面面积。
通过喷涂应用
- 把握和弯曲双涂覆到所需的位置。尖端将保持其形状。
- 定位无气喷涂提示至少2cm从目标组织的路程。向柱塞施加均匀的压力,以喷涂纤维蛋白密封剂。相应地增加距离,以实现目标区域的所需覆盖范围。
- 如果表达任何原因停止,改变无气喷涂提示。要更换无气喷嘴,请从患者身上取下设备,然后拧松旧的无气喷嘴。请参见图7。将用过的无气喷嘴远离备用的无气喷嘴。用干燥或潮湿的无菌手术纱布擦拭涂抹器的末端。然后,连接包装中提供的新的无气喷嘴,并在使用前确保已牢固连接。
注意:如果正确连接了无气喷涂头,则红色指示灯将不可见。参见图8。
注意:请勿继续推动柱塞,以试图清除无气喷雾嘴中的血纤维蛋白凝块;否则,涂抹器可能无法使用。
注意:请勿修剪双喷头,以免暴露内部电线。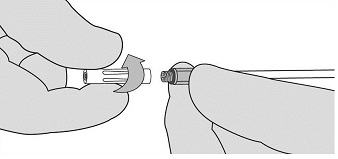
图7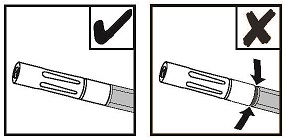
图8
通过淋漓的应用
- 取出无气通过拧下无气喷涂提示喷雾喷雾和滴尖端的尖端部分。
参见图7。 - 掌握和弯曲滴尖端到所需的位置。尖端将保持其形状。
- 在滴落,保持滴尖端尽可能靠近组织表面尽可能的端部,而不施加期间接触组织。
- 将单个滴的表面积来对待。为防止不受控制的凝结,请让液滴彼此分开并与滴头末端分开。
注:从适配器上卸下用过的滴头后,请勿重新连接;否则,滴头内部可能会形成凝块,并且涂抹器可能无法使用。
2.4应用注意事项
- VISTASEAL给药前,保护(覆盖)的身体的所希望的应用区域之外的部分,以防止在不希望位点组织粘连。 [请参阅剂量和用法(2.3)
- 应用VISTASEAL为薄层。血块厚度过大可能会对产品的功效和伤口愈合过程产生负面影响。 [参见剂量和用法(2.1)]
- 只有喷VISTASEAL如果它能够准确地从喷雾尖端到组织表面判断距离。 [参见剂量和用法(2.3)]
- 没有临床数据都可以通过柔性内窥镜支持神经外科或应用中使用的产品用于治疗出血。
Vistaseal的适应症和用法
当通过标准外科手术技术(例如缝合,结扎和烧灼)控制出血无效或不切实际时,在进行手术的成年人中,Vistaseal可以作为止血的辅助工具,用于轻度至中度出血。 Vistaseal对肝素化患者有效。
Vistaseal剂量和给药
仅用于局部使用。
剂量
个性化应用纤维蛋白封闭剂。在临床研究中,单个剂量的范围通常为0.3到18.0 mL。除临床研究中所包括的以外,其他外科手术可能需要更大的容积。
表1中提供了每种Vistaseal包装尺寸的大概表面积。
| Vistaseal包装尺寸 | 表面积(cm 2 ) 滴加或喷涂 (1毫米厚的层) |
| 2毫升 | 16-22 |
| 4毫升 | 32-44 |
| 6毫升 | 48-66 |
| 10毫升 | 80-110 |
剂量取决于变量,包括但不限于外科手术的类型,区域的大小,预期的应用方法和应用次数。
施加足够量的Vistaseal,以薄层完全覆盖预期的应用区域。如有必要,请重复该应用程序。
准备和处理
仅根据说明和推荐的设备来准备和管理产品。
从冰箱中取出纸箱,打开并取出两个水泡。
将装有Vistaseal Dual Applicator的泡罩置于室温下,直到Vistaseal纤维蛋白密封剂(人类)准备使用为止。
室温解冻(首选方法)
使用Vistaseal预装注射器在室温下解冻起泡,请执行以下步骤:
- 在室温(20ºC-25ºC,[68-77ºF])的表面上将装有注射器支架的泡罩与预装好的注射器一起放置
对于2 mL和4 mL的包装,约需70分钟
对于6 mL和10 mL的包装,约需90分钟
解冻后,无需加热产品即可使用。
解冻后,溶液必须澄清至微乳白色,无色至浅黄色。
请勿使用浑浊或有沉淀的溶液。
修复后存储:
解冻后,包含Vistaseal注射器支架,预装注射器和Dual Apparator的套件在使用前可以在2到8ºC[36-46ºF]的冰箱中或在室温下24小时在冰箱中存放不超过48小时( 20-25°C [68-77ºF]),如果仍密封在原始包装中。一旦水泡打开,在手术期间立即使用Vistaseal并丢弃所有未使用的内容物。
解冻后,请勿重新冻结。
转移说明:
- 解冻后,在室温下或2-8°C [36-46ºF]下从冰箱表面去除水泡。
- 打开水泡,使配备了预装注射器的Vistaseal注射器架可供第二个人使用,以转移到无菌区域。水泡的外部不应与无菌区域接触。参见图1。

图1
无菌水浴(快速解冻)
在不超过37ºC[99ºF]的无菌恒温水浴中,在无菌区域内解冻Vistaseal预装注射器,方法如下:
注意:打开Vistaseal水泡后,请在手术期间立即使用本产品。使用无菌技术以避免因处理不当而造成污染的可能性,并准确执行以下步骤。解冻完成并且准备好安装双重涂抹器之前,请勿取下注射器鲁尔盖。
- 打开水泡,使配备了预装注射器的Vistaseal注射器架可供第二个人使用,以转移到无菌区域。水泡的外部不应与无菌区域接触。参见图1。
- 将装有预装注射器的注射器支架直接放入无菌水浴中,以确保将其完全浸入水中。参见图2。
- 在37ºC下,对于2 mL,4 mL,6 mL和10 mL的包装,所需时间约为5分钟,但在此温度下放置的时间不得超过10分钟。
水浴温度不得超过37ºC。 - 解冻后,使用无菌外科纱布将注射器支架用预装的注射器干燥。

图2
解冻后,溶液必须澄清至微乳白色,无色至浅黄色。
请勿使用浑浊或有沉淀的溶液。
手术期间立即使用Vistaseal,并丢弃所有未使用的内容物。
连接说明
- 打开水泡,使Vistaseal Dual Applicator和另外两个无气喷头可供第二个人使用,以转移到无菌区域。水泡的外部不应与无菌区域接触。
- 握住Vistaseal纤维蛋白密封剂(人类)注射器支架,并使注射器路厄帽朝上。参见图3。
- 拧开并丢弃纤维蛋白原和凝血酶注射器的注射器鲁尔盖。参见图3。

图3 - 握住注射器支架,使路厄指向上。要去除注射器中的气泡,请轻轻地敲打注射器支架的侧面一到两次,同时将其保持在直立的位置,并轻轻按下柱塞以排出空气。参见图4。

图4 - 附上双重涂药器。参见图5。
注意:在连接过程中或在预定使用之前,请勿压下柱塞,因为这两种生物成分会在无气喷头中预混合,从而形成纤维蛋白凝块,从而阻止分配。参见图6。
图5
图6 - 拧紧鲁尔锁,并确保牢固地安装了双重涂抹器。该设备现在可以使用了。
2.3管理
使用随附的注射器支架和柱塞涂抹Vistaseal纤维蛋白密封剂(人类)。
使用产品随附的双重涂抹器涂抹Vistaseal纤维蛋白密封剂(人类)。也可以使用由FDA批准的Vistaseal纤维蛋白密封剂(人类)专用的涂药器提示。使用随附的双重涂药器时,请按照上一节中的连接说明进行准备。使用其他涂药器吸头时,请遵循涂药器吸头随附的使用说明。
施用Vistaseal纤维蛋白封闭剂(人类)之前:
-为防止组织粘附在不希望的位置,请保护(覆盖)身体部位,使其超出预期的应用区域。 [参见剂量和用法( 2.4 ) ]
-使用标准技术(例如,间歇性按压,拭子,使用抽吸装置)来干燥目标出血部位的表面积。
喷涂施工
- 握住并弯曲双重涂抹器到所需位置。尖端将保持其形状。
- 将无气喷涂头放置在距目标组织至少2 cm的位置。向柱塞施加均匀的压力,以喷涂纤维蛋白密封剂。相应地增加距离,以实现目标区域的所需覆盖范围。
- 如果出于任何原因停止了表情,请更换无气喷嘴。要更换无气喷嘴,请从患者身上取下设备,然后拧松旧的无气喷嘴。请参见图7。将用过的无气喷嘴远离备用的无气喷嘴。用干燥或潮湿的无菌手术纱布擦拭涂抹器的末端。然后,连接包装中提供的新的无气喷嘴,并在使用前确保已牢固连接。
注意:如果正确连接了无气喷涂头,则红色指示灯将不可见。参见图8。
注意:请勿继续推动柱塞,以试图清除无气喷雾嘴中的血纤维蛋白凝块;否则,涂抹器可能无法使用。
注意:请勿修剪双喷头,以免暴露内部电线。
图7
图8
滴涂
- 拧下无气喷涂头,以除去喷嘴和滴头的无气喷涂头部分。
参见图7。 - 抓住并弯曲滴头至所需位置。尖端将保持其形状。
- 在滴注过程中,在滴注过程中,滴头的末端应尽可能靠近组织表面,而不要接触组织。
- 将单滴药液涂在要处理的表面积上。为防止不受控制的凝结,请让液滴彼此分开并与滴头末端分开。
注:从适配器上卸下用过的滴头后,请勿重新连接;否则,滴头内部可能会形成凝块,并且涂抹器可能无法使用。
2.4应用注意事项
- 在施用Vistaseal之前,保护(覆盖)身体所需部位以外的部位,以防止组织粘附在不需要的部位。 [请参阅剂量和用法( 2.3 )
- 将Vistaseal涂薄。血块厚度过大可能会对产品的功效和伤口愈合过程产生负面影响。 [参见剂量和用法( 2.1 )]
- 仅在可能准确判断从喷嘴到组织表面的距离时才喷涂Vistaseal。 [参见剂量和用法( 2.3 )]
- 没有临床数据可支持该产品在神经外科手术中的使用或通过柔性内窥镜在治疗出血中的应用。
剂型和优势
Vistaseal作为套件提供,包括两个独立的包装:
- 一个包装,每个包装一个注射器,分别装在注射器支架上的80 mg / mL人纤维蛋白原(组分1)和500 IU / mL人凝血酶(组分2)无菌冷冻溶液。
- 一个包装,内含一个带有两个附加无气喷头的双喷头。
表2列出了Vistaseal的可用包装尺寸。
| 包装尺寸(总体积) | 人纤维蛋白原 | 人凝血酶 |
| 2毫升 | 1毫升 | 1毫升 |
| 4毫升 | 2毫升 | 2毫升 |
| 6毫升 | 3毫升 | 3毫升 |
| 10毫升 | 5毫升 | 5毫升 |
禁忌症
- 请勿直接注入循环系统。 [请参阅警告和注意事项( 5.1 )]
- 请勿用于治疗严重或轻度的动脉出血。在这些情况下,血流将冲走Vistaseal并防止止血。
- 已知对人血产品产生过敏性或严重全身性超敏反应的患者请勿使用Vistaseal。 [请参阅警告和注意事项( 5.2 )]
- 除非可以达到从涂抹器尖端到出血部位的最小推荐距离,否则请勿使用Vistaseal进行喷涂。 [参见剂量和用法( 2.3 )]
警告和注意事项
血栓形成
如果在血管内施用Vistaseal,可能会发生危及生命的血栓栓塞并发症。
5.2过敏
过敏型超敏反应是可能的。过敏反应的迹象包括荨麻疹,全身性荨麻疹,胸闷,喘息,低血压和过敏反应。如果出现这些症状,请立即停止使用Vistaseal。相应地处理反应。
5.3传染性传染源
由于Vistaseal是由人血浆制成的,因此可能具有传播传染原的风险,例如病毒,克雅氏病(vCJD)变种,理论上是Creatzfeldt-Jakob(CJD)病原。这也适用于未知或新兴病毒和其他病原体。医生或其他医疗保健提供者应将与该产品有关的所有可疑感染报告给Grifols Therapeutics LLC,电话是1-800-520-2807。医生应与患者讨论使用Vistaseal的风险和益处。 [请参阅患者咨询信息( 17 )]
不良反应
最常见的不良反应(据报道> 1%的临床试验受试者)为恶心和程序性疼痛。
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此不能将在一种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映在临床实践中观察到的不良反应率。
使用相同的一般设计进行了三项临床试验,每项试验都是随机的并且是主动控制的。每个试验中包括的手术类型不同。在所有试验中,血管外科手术占26%,实质组织手术占37%,软组织手术占37%。临床试验使用Fibrijet®滴或喷雾施用器以纤维蛋白胶(人)进行的。
在所有临床试验中,使用纤维蛋白封闭剂(人类)来治疗血管外科手术中的血管出血,肝手术过程中的实质性出血,腹膜后或骨盆手术,腹部整形术或不孕症期间的软组织出血,涉及500名接受纤维蛋白封闭剂治疗的受试者(人类)和377个控制对象。每种外科手术接受治疗的试验对象的数量为:血管外科手术168人,实质外科手术163人,软组织外科手术169人。
纤维蛋白封闭剂(人类)治疗组的平均年龄为57岁(标准差:15.6岁;范围:0.3至86岁)。中位年龄为60岁。有11名年龄小于18岁的受试者。有51%的男性受试者。暴露于纤维蛋白封闭剂(人类)的受试者中有87%是白人。
每个受试者和目标出血部位使用的纤维蛋白封闭剂(人类)的平均体积为7 mL(标准偏差3.5),范围为0.3至18 mL。中位数为6 mL。暴露于纤维蛋白封闭剂(人类)由一次术中给药组成。
临床安全性数据库包括所有受试者在所有临床研究中均接受了任意量的纤维蛋白封闭剂(人类)的受试者,没有任何排除。
在纤维蛋白封闭剂(人类)治疗组中,有13%的试验受试者经历了一种或多种不良反应,而8%的对照受试者经历了一种或多种不良反应。
表3-6中所示的不良反应被评估为与纤维蛋白封闭剂(人类)治疗具有可能的因果关系,并且发生在> 1%的受试者中。
| 首选条款 | N = 500 n(%) |
| 恶心 | 6(1) |
| 程序性疼痛 | 10(2) |
| 首选条款 | N = 168 n(%) |
| 恶心 | 2(1) |
| 发热(发烧) | 2(1) |
| 程序性疼痛 | 4(2) |
| 血管移植并发症 | 2(1) |
| 细小病毒B19测试呈阳性 | 2(1) |
| 尿retention留(无法完全排空膀胱) | 2(1) |
| 首选条款 | N = 163 n(%) |
| 术后胆漏 | 2(1) |
| 程序性疼痛 | 2(1) |
| 肺栓塞(肺部血块) | 2(1) |
| 深静脉血栓形成(在深静脉中形成的血凝块) | 2(1) |
| 首选条款 | N = 169 n(%) |
| 贫血(低红细胞) | 2(1) |
| 白细胞增多症(白细胞增多) | 2(1) |
| 肠梗阻(胃或肠的运动减少或缺乏) | 2(1) |
| 恶心 | 4(2) |
| 程序性疼痛 | 4(2) |
| 丙氨酸转氨酶增加 | 2(1) |
| 天冬氨酸转氨酶增加 | 2(1) |
| 低钙血症(低血钙) | 2(1) |
| 低钾血症(低血钾) | 2(1) |
| 低钠血症(低血清钠) | 2(1) |
| 凝血酶原时间延长(出血时间增加) | 2(1) |
| 头痛 | 2(1) |
| 失眠 | 2(1) |
| 瘙痒(瘙痒) | 4(2) |
| 高血压 | 2(1) |
在特定人群中的使用
怀孕
风险摘要
目前尚无孕妇使用Vistaseal的数据。 Vistaseal尚未进行动物繁殖研究。尚不清楚Vistaseal对孕妇给药是否会造成胎儿伤害或会影响生殖能力。在美国普通人群中,临床公认的怀孕中估计的主要先天缺陷和流产的背景风险分别为2-4%和15-20%。
哺乳期
风险摘要
没有关于人乳中存在Vistaseal,对母乳喂养婴儿的影响或对牛奶产量的影响的信息。应当考虑母乳喂养对发育和健康的益处,以及母亲对Vistaseal的临床需求以及Vistaseal或潜在母体状况对母乳喂养婴儿的任何潜在不利影响。
儿科用
在临床试验中,在接受纤维蛋白封闭剂(人类)治疗的500名受试者中,共有11名是儿科受试者。在这11名受试者中,有5名是2岁以下的婴儿,5名是2至11岁的儿童,还有1名是12至16岁的青少年。儿科患者的安全性和有效性尚未确定。
老人用
临床试验包括172位65岁或65岁以上的纤维蛋白封闭剂(人类)治疗的受试者。在这些受试者和较年轻的受试者之间未观察到安全性或有效性的差异。
Vistaseal说明
Vistaseal是一种两组分纤维蛋白密封剂,由人纤维蛋白原(组分1)和人凝血酶与氯化钙(组分2)无菌溶液组成,填充在注射器中,并在注射器支架中组装。
Vistaseal以冷冻溶液的形式提供。解冻后,人纤维蛋白原和凝血酶溶液呈澄清或微乳白色,无色或浅黄色。 Vistaseal不包含任何防腐剂。
纤维蛋白原
组分1是无菌溶液,pH 6.5-8.0,其中包含浓缩的人纤维蛋白原和赋形剂。纤维蛋白原是人血中的一种蛋白质,与凝血酶结合时会形成凝块。人纤维蛋白原溶液的组成如下:
活性成分:人纤维蛋白原(80 mg / mL)
其他成分:柠檬酸钠,氯化钠,精氨酸,L-异亮氨酸,L-谷氨酸一钠和注射用水。
凝血酶
组分2是无菌溶液,pH 6.0-8.0,其中包含纯化的人凝血酶和赋形剂。凝血酶是一种特定的蛋白酶,可激活最终结合产物的凝结并将纤维蛋白原转化为纤维蛋白。人凝血酶溶液的组成如下:
有效成分:人凝血酶(500 IU / mL)
其他成分:氯化钙,人白蛋白,氯化钠,甘氨酸和注射用水。
生产Vistaseal的纤维蛋白原和凝血酶成分的起始材料是从美国FDA许可的血浆收集中心获得的人源血浆。使用Cohn的血浆分级分离方法来获得级分I(是产生纤维蛋白原的起始原料),以及从级分I的上清液中分离的凝血酶原复合物(级分是凝血酶的起始原料)。纤维蛋白原的纯化过程包括溶剂/去污剂处理,三个甘氨酸沉淀步骤以及使用35 nm和20 nm滤膜的双重纳米过滤。凝血酶的纯化过程包括溶剂/去污剂处理,离子交换色谱和通过15 nm滤膜的双重纳米过滤。纳滤后,将纤维蛋白原和凝血酶溶液配制,无菌过滤,无菌填充在注射器中,包装,灭菌和冷冻。
病毒安全
用于制造Vistaseal的单个血浆捐赠物在美国FDA许可的血浆捐赠中心中收集,并按照美国法规要求进行病毒标记测试。此外,使用经过验证的核酸测试(NAT)方法,测试了血浆单元的微型池作为甲型肝炎病毒(HAV)和细小病毒B19(B19V)的过程中对照。除B19V以外,所有测试都必须是非反应性(阴性)测试,对于B19V,血浆生产池中的限值不超过10 4 IU / mL的效价。生产血浆池也已通过NAT对HBV,HCV和HIV进行了测试,并且所有测试都必须是非反应性的(阴性)。
纤维蛋白原和凝血酶的制造工艺包括旨在降低病毒传播风险的加工步骤。两种成分均具有两个具有病毒清除能力的不连续步骤,即溶剂/去污剂处理(1.0%(v / v)吐温80 / 0.30%(v / v)磷酸三正丁酯(TNBP)在6.0-6.5小时内)纤维蛋白原为27.0±1.5ºC,凝血酶为25±1ºC,已验证可灭活被包膜的病毒,纳滤步骤可去除非包膜和被包膜的病毒(用于纤维蛋白原的35 nm和20 nm过滤器以及两个15 nm过滤器)凝血酶过滤器)。另外,甘氨酸沉淀步骤在人纤维蛋白原的纯化过程中有助于产品的整体安全性。级分I沉淀和离子交换层析步骤有助于纯化人类凝血酶过程中产品的整体安全性。
这些病毒的灭活/清除程序的病毒清除能力已在小规模的体外研究中得到验证,使用相关的和模型的病毒具有一系列的理化特性。表7和表8总结了病毒清除率验证研究的结果:
| 制造步骤 | 病毒减少系数(log 10 )* | |||||
| 包膜病毒 | 非包膜病毒 | |||||
| HIV-1 | PRV | 西尼 | BVDV | 甲肝病毒 | PPV | |
| S / D处理 | ≥5.33 | ≥6.80 | ≥5.20 | ≥5.60 | 呐 | 呐 |
| 甘氨酸 降水 | nd | nd | nd | nd | 5.21 | 2.09 |
| 纳滤35 nm 和20海里 | ≥5.57 | ≥6.09 | ≥4.51 | ≥4.53 | 5.22 | 4.37 |
| 全球病毒 衰减系数 (日志10 ) | ≥10.90 | ≥12.89 | ≥9.71 | ≥10.13 | 10.43 | 6.46 |
| *:在计算全局病毒减少量时未考虑小于1 log 10的减少率; nd:没有完成; na:不适用; BVDV:牛病毒性腹泻病毒,HCV模型; WNV:西尼罗河病毒; PRV:伪狂犬病病毒,大型包膜DNA病毒的模型; PPV:猪细小病毒,B19V模型 | ||||||
| 制造步骤 | 病毒减少系数(log 10 )* | |||||
| 包膜病毒 | 非包膜病毒 | |||||
| HIV-1 | PRV | 西尼 | BVDV | 甲肝病毒 | PPV | |
| 分数I沉淀 | <1.0 | 2.13 | 2.78 | 1.34 | 1.18 | <1.0 |
| S / D处理 | ≥5.52 | ≥5.85 | ≥5.94 | ≥5.09 | 呐 | 呐 |
| SP-Sepharose XL色谱 | nd | nd | nd | nd | 4.61 | 3.97 |
| 双纳滤15 nm | ≥4.03 | ≥5.95 | ≥5.42 | ≥4.93 | 6.56 | 6.14 |
| 全球病毒减少系数(log 10 ) | ≥9.55 | ≥13.93 | ≥14.14 | ≥11.36 | 12.35 | 10.11 |
Vistaseal-临床药理学
作用机理
Vistaseal包含人类纤维蛋白原和人类凝血酶。当应用到伤口部位并混合时,这些生物成分会在生成人类血液凝固系统最后阶段的过程中生成交联的纤维蛋白凝块。纤维蛋白原被凝血酶转化为纤维蛋白单体和纤维蛋白肽。血纤蛋白单体聚集并形成血纤蛋白凝块,该血凝块阻止出血。 XIIIa因子通过凝血酶从XIII因子激活,它使纤维蛋白交联。钙离子是纤维蛋白原的转化和纤维蛋白交联所必需的。
药效学
Vistaseal没有相关的药效学数据。
药代动力学
Vistaseal通过纤维蛋白溶解和吞噬作用以与内源性纤维蛋白相同的方式代谢。没有针对Vistaseal进行药代动力学研究。
非临床毒理学
致癌性,诱变,生育力受损
没有进行动物研究来评估Vistaseal的致癌或致突变作用或其对生育力的影响。
临床研究
血管外科
进行了一项前瞻性,随机,对照临床研究,以评估纤维蛋白封闭剂(人类)辅助血管手术止血的安全性和有效性。受试者接受了使用聚四氟乙烯移植物材料进行近端端到端动脉吻合或上肢血管通路动脉吻合的血管外科手术。临床试验用使用Fibrijet®施放器生物蛋白胶(人)进行的。当比较每组在4分钟内止血的受试者的比例时,血纤蛋白封闭剂(人类)表现出优于对照组(手动加压)(表9 )。在10分钟时也建立了优势。与对照组(≥10.0分钟)相比,纤维蛋白封闭剂(人类)治疗组(4.0分钟)的止血时间中位数显着缩短(p值<0.001)。
| *意向性治疗(ITT)人群:包括随机分配给纤维蛋白封闭剂(人类)或对照的所有受试者。 1两个治疗组(纤维蛋白封闭剂(人类)相对于对照组)中达到功效终点的受试者比例。 CI =置信区间。 列出的功效结果是累积结果。 | ||||
| 功效终点 | 纤维蛋白封闭剂 (人类) N = 109 n(%) | 控制 N = 57 n(%) | -比例1 (95%CI) | P值 |
| 4分钟止血 | 83(76.1) | 13(22.8) | 3.3(2.0,5.4) | <0.001 |
| 10分钟止血 | 96(88.1) | 26(45.6) | 1.9(1.4,2.6) | <0.001 |
实质手术
进行了一项前瞻性,随机,对照的临床研究,以评估纤维蛋白封闭剂(人类)在实质手术中辅助止血的安全性和有效性。受试者进行了肝切除术。临床试验用使用Fibrijet®施放器生物蛋白胶(人)进行的。纤维蛋白封闭剂(人类)显示出在4分钟止血方面优于对照组(氧化再生纤维素)(表10 )。与对照组(3.0分钟)相比,纤维蛋白封闭剂(人)治疗组(2.0分钟)的止血时间中位数显着缩短(p值<0.001)。
| *意向性治疗(ITT)人群:包括随机分配给纤维蛋白封闭剂(人类)或对照的所有受试者。 1在两个治疗组(纤维蛋白封闭剂(人类)相对于对照组)中达到功效终点的受试者比例。 CI =置信区间 列出的功效结果是累积结果。 | ||||
| 功效终点 | 纤维蛋白封闭剂 (人类) N = 111 n(%) | 控制 N = 113 n(%) | 比例1 (95%CI) | P值 |
| 4分钟止血 | 103(92.8) | 91(80.5) | 1.2(1.0,1.3) | 0.010 |
| 2分钟止血 | 62(55.9) | 47(41.6) | 1.3(1.0,1.8) | 0.045 |
软组织手术
进行了一项前瞻性,随机,对照临床研究,以评估纤维蛋白封闭剂(人类)在腹膜后和骨盆手术过程中以及在乳房畸形和腹部整形手术中辅助软组织止血止血的安全性和有效性。临床试验用使用Fibrijet®施放器生物蛋白胶(人)进行的。血纤蛋白封闭剂(人类)显示在达到4分钟止血方面不逊于对照组(氧化再生纤维素)(表11 )。
| *意向性治疗(ITT)人群:包括随机分配给纤维蛋白封闭剂(人类)的所有受试者。 1在两个治疗组(纤维蛋白封闭剂(人类)相对于对照组)中达到功效终点的受试者比例。 CI =置信区间。 列出的功效结果是累积结果。 | ||||
| 功效终点 | 纤维蛋白封闭剂 (人类) N = 116 n(%) | 控制 N = 108 n(%) | 比例1 (95%CI) | P值 |
| 4分钟止血 | 96(82.8) | 84(77.8) | 1.1(0.9,1.2) | 0.401 |
供应/存储和处理方式
Vistaseal以单剂量试剂盒的形式提供,包括两个预装的注射器,其中装有人类纤维蛋白原(组分1)和含凝血钙的人类凝血酶(组分2)的无菌冷冻溶液,它们组装在单个注射器支架中。针筒柱塞通过柱塞连杆连接,以确保同时使用生物成分。与产品一起包装的是一个带两个附加的无气喷涂头的双重喷涂器,可以通过喷涂或滴注的方式进行喷涂。无气喷涂喷嘴不透射线。参见图9。

图9
表12列出了Vistaseal的可用包装尺寸。
| Vistaseal包装尺寸 | NDC号码 | |||
| 总容积 | 人的 纤维蛋白原 | 人的 凝血酶 | 纸箱 | 吸塑标签 |
| 2毫升 | 1毫升 | 1毫升 | 61953-0011-1 | 61953-0011-2 |
| 4毫升 | 2毫升 | 2毫升 | 61953-0012-1 | 61953-0012-2 |
| 6毫升 | 3毫升 | 3毫升 | 61953-0013-1 | 61953-0013-2 |
| 10毫升 | 5毫升 | 5毫升 | 61953-0014-1 | 61953-0014-2 |
存储
将冷冻的试剂盒(带Vistaseal Dual Applicator的内含纤维蛋白密封剂(人类))保存在冰箱中(-18°C [0°F]或更低温度)最多2年。在使用之前,不得中断冷藏条件。使用前解冻。解冻后,请勿重新冻结。
解冻后,如果保持密封,在使用前Vistaseal可以在2 ‑ 8ºC[36-46ºF]下存放48小时或在室温(20-25℃[68-77ºF])下存放24小时。原包装。打开包装后,请在手术期间立即使用Vistaseal并丢弃所有未使用的物品。
将消毒后的水泡放在外面的纸箱中,以避光。
请勿在外箱和容器标签上印刷的失效日期之后使用。如果包装损坏,则丢弃。
病人咨询信息
指示患者立即向医生报告血栓形成或栓塞的症状,其中可能包括:受累区域的手臂或腿部疼痛和/或肿胀并伴有温暖,手臂或腿部变色,无法解释的呼吸急促,胸痛或不适深呼吸,无法解释的快速脉搏,身体一侧的麻木或无力会恶化[ s血栓形成( 5.1 )]
药物状态
- 可用性 仅处方
- 怀孕类别 不能排除风险
- CSA时间表* 不是管制药物
美国日本医生

Heather Benjamin MD

Heather Benjamin MD

Heather Miske DO

Heather Miske DO

Bert Hepner DO

渡邊剛

渡邊剛

宮崎総一郎 中部大学特聘教授

百村伸一 教授















