4006 776 356
免费咨询 9:00-18:00
获取国外西地那非片25mgvi“ teva” / sildenafil片剂50mgvi“ teva”jazh药品价格,使用等信息,最快 24 小时回馈
出境医 / 海外药品 / 西地那非片25mgvi“ teva” / sildenafil片剂50mgvi“ teva”jazh
西地那非片25mgvi“ teva” / sildenafil片剂50mgvi“ teva”jazh
西地那非片25mgvi“ teva” / sildenafil片剂50mgvi“ teva”
创建或修订年
- ** Mushi:2023年2月修订(第6版)
- *马克:于2021年1月修订
日本标准产品分类编号
- 87259
医学分类名称
- 勃起功能障碍治疗剂
批准,等等
- 销售名称
- 西地那非片25mgvi“ teva”
销售名称代码
- 259000AF1032
批准 /许可号码
- 批准编号
- 22600AMX00919000
- 欧洲商品名称
- Sildenafil Tab.25mg vi“ teva”
药品价格
药品价格无关
销售开始
- 2014年10月
到期日期,等等。
- 积累
- 室温保存
- 截止日期
- 在外观上显示的到期日期内使用。
法规类别
- 处方药
- 预防措施 - 由医生的处方
作品
- 一台平板电脑:
- Cildena Falteric Acid ... 35.12 mg(25mg作为西地那非)
- <加法>
- 横car旋律钠,轻质无水钠,晶体纤维素,氧化钛,硬脂酸镁,triastin,乳糖水氢,羟基丙糖,羟基丙糖,Hyropomeros,黄色Trinangle,SinariDER Iron sinaride。
特点
- 淡红色和白色胶片涂料锁
- 识别码(PTP)
- 电视S25
- 外部形状(尺寸)
表(直径毫米)  7.1
7.1- 外部形状(尺寸)
背部(重量毫克)  143.5
143.5- 外部形状(尺寸)
侧(厚度毫米)  3.8
3.8
- 销售名称
- 西地那非片50mgvi“ teva”
销售名称代码
- 259000AF2055
批准 /许可号码
- 批准编号
- 22600AMX00920000
- 欧洲商品名称
- Sildenafil Tab.50mg VI“ Teva”
药品价格
药品价格无关
销售开始
- 2014年10月
到期日期,等等。
- 积累
- 室温保存
- 截止日期
- 在外观上显示的到期日期内使用。
法规类别
- 处方药
- 预防措施 - 由医生的处方
作品
- 一台平板电脑:
- Cildena Falteric Acid ... 70.23 mg(50mg作为西地那非)
- <加法>
- 横car旋律钠,轻质无水钠,晶体纤维素,氧化钛,硬脂酸镁,triastin,乳糖水氢,羟基丙糖,羟基丙糖,Hyropomeros,黄色Trinangle,SinariDER Iron sinaride。
特点
- 淡红色和白色胶片涂料锁
- 识别码(PTP)
- 电视S50
- 外部形状(尺寸)
表(直径毫米)  9.1
9.1- 外部形状(尺寸)
背部(重量毫克)  284
284- 外部形状(尺寸)
侧(厚度毫米)  4.6
4.6
一般名称
- Syildena Filecuenate片剂
警告- 1。
- 该药物是由于使用该药物或硝酸甘油(NO)(no)(no)(否)住宅剂(硝酸甘油,硝酸盐,亚硝酸盐,亚硝酸盐,硝酸盐等)来降低降压作用的原因。这是充分证实的,硝酸盐或氮(NO)不给予,因此在这种药物期间和之后不给予硝酸或一氧化氧化物(NO)提供剂。要小心。 (请参阅[禁忌症]的部分)
- 2。
- 由于已经报道了诸如严重心血管系统(包括死亡)等不良事件,例如心肌梗塞,因此请仔细确认在服用该药物之前是否确认心血管疾病等是否已确认。 (请参阅[禁忌]和“副作用”)
|
限制(请勿对下一个患者进行管理)- 1。
- 对该药物成分过敏的患者
- 2。
- 患有硝酸或氮生氧化物(NO)提供的患者(硝酸甘油,亚硝酸盐,亚硝酸盐,异溶胶等)(请参阅[警告]和“相互作用”部分)。
- 3。
- 性活动不合适的患者,例如患有心血管疾病
- 四个。
- 严重肝功能障碍的患者
- 五。
- 低血压(血压<90/50 mmHg)或高血压患者非治疗患者(静止血压> 170mmHg或静止膨胀期血压> 100mmHg)
- 6。
- 在过去6个月内有脑梗塞,脑出血和心肌梗塞病史的患者
- 7。
- 色素性视网膜炎患者[少数视网膜色素症患者患有磷酸二酯酶的遗传疾病]
- 8。
- *正在施用盐酸淀粉酮(口服剂)的患者(请参阅“相互作用”部分)
- 9。
- 患有可溶性甘氨酸(SGC)兴奋剂(Riosiguat)的患者(请参阅“相互作用”部分)
|
功效 /效果
- 勃起功能障碍(足够的勃起进行令人满意的性活动和无法维持的患者)
用法 /剂量
- 通常,成年人每天一次在性活动前约1小时口服一次性服用。
对于老年人(65岁或以上),肝损伤患者和严重肾脏疾病的患者(CCR <30ml/min),允许该药物的血浆浓度,因此25 mg为25 mg。剂量。
每日管理应为一次,并且管理间隔应为24小时或更长时间。
使用预防措施
谨慎的管理
(请小心地给下一个患者管理)
- 1。
- 患有结构性缺陷(屈曲,阴茎纤维化,佩罗尼病等)的患者[性活动困难而痛苦]
- 2。
- 可能是可持续勃起基础的疾病患者(镰状血细胞,多发性骨髓瘤,白血病等)
- 3。
- PDE5抑制剂或其他勃起功能障碍的患者[尚未确定合并用途的安全]
- 四个。
- 允许患有出血疾病或消化溃疡的患者在抑制硝基钙胞菌菌中增加血小板聚集(无提供)。尚未确定患有出血疾病或消化溃疡患者的安全性。这是给出的
- 五。
- 老年人(65岁或以上)[在老年人中,血浆浓度可以增加,因此要仔细给药,例如从低剂量开始给药(25 mg)](“对老年人的管理”。
- 6。
- 严重肾脏疾病(CCR <30ml/min)的患者[应服用给药,例如从低剂量开始给药(25 mg),因为它可以增加血浆。]
- 7。
- 肝脏损伤的患者[精心给药,例如从低剂量(25 mg)开始给药,因为它可以增加血浆浓度]。
- 8。
- 施用α烧毁剂的患者(请参阅“相互作用”部分)
- 9。
- 正在施用抑制Chitochrome P450 3A4的药物的患者(精心给药,例如从低剂量开始给药(25 mg),因为它可以增加该药物的血浆浓度]
- 十。
- 给药的紫杉醇的患者(请参阅“相互作用”部分)
- 11。
- 多边萎缩患者(害羞综合征等)。
重要的基本预防措施
- 1。
- 在给药的情况下,应被诊断出患有勃起功能障碍及其基本疾病,应在一定史上进行和进行,并限于基于客观诊断的临床治疗的患者。
- 2。
- 在治疗勃起功能障碍之前,请注意心血管系统的状态,并伴有性活动。由于该药物由于血管扩展而具有降压作用,因此可以增强硝酸或一氧化氮(NO)提供的硝酸作用。
- 3。
- 在过去六个月内,脑梗塞,脑出血和心肌梗塞病史的患者是禁忌的,但是在此之前,当对患有脑梗塞史,脑出血史的患者进行治疗时,不是。 (请参阅[禁忌症]的部分)
- 四个。
- 据报道,在国外市市可用后,勃起的勃起延长超过4个小时或可持续的勃起(超过6个小时或更长时间的痛苦勃起)。如果您不立即采取针对可持续勃起的措施,则可能会对阴茎组织或勃起功能造成永久损害,因此,如果勃起持续4个小时或更长时间,您将被指示立即接收医生。
- 五。
- 该药物不是壮阳药或性欲促进剂。
- 6。
- 在进行驾驶汽车或操作机械时要小心,因为在其他公司进行的临床试验中观察到头晕和视觉障碍。
- 7。
- 如果该药物用饮食施用,则与空腹给药相比,效果表达时间可能会延迟。
- 8。
- 如果这种药物之后,视力突然下降或突然失去视力丧失,则应停止使用,并向患者立即去看眼科医生。 (请参阅“其他预防措施”部分)
相互作用
互动的轮廓
- 该药物主要由Chitochrome P450(CYP)3A4代谢,但CYP2C9也很重要。
禁忌症(不要一起使用)- 1。
- 毒品名称,等等
- 硝酸甘油硝酸甘油硝基甘油硝酸盐硝酸硝酸硝酸硝酸硝酸盐Isosolvid等(请参阅[警告]部分)
- 临床症状 /度量方法
- 联合使用可以增强降压作用。
- 机械 /危险因素
- NO刺激CGMP的产生,而这种药物抑制了CGMP的分解,因此通过使用两种药物,可以增强NO通过CGMP的增加的降压作用。
- 2。
- 毒品名称,等等
- *盐酸氨基酮(锚固片)
- 临床症状 /度量方法
- *盐酸氨二酮对QTC的扩展可能会增加。
- 机械 /危险因素
- *未知机制。
据报道,由于药物方面和盐酸胺的各个方面的组合,可能会发生QTC扩展。 - 3。
- 毒品名称,等等
- SGC刺激器Riosiguato(ADEM PASS)
- 临床症状 /度量方法
- 联合使用可能会导致症状性低血压。
- 机械 /危险因素
- Riosiguto给药增加了CGMP浓度,而两种药物的使用可能会增加由于两种药物的结合而增加的CGMP的细胞浓度,这可能是倾斜的血压组合。
|
合并用途的注释
(请注意联合使用)
- 1。药物名称等。*Chitochrome P450 3A4抑制剂Ritonabil ** Nirmatrelville darnabil darnabil el navir Eliisromycin simetojin simetojin ketokonazole itlaconazole等
- 临床症状 /度量方法
- *与Litonaville,红霉素和Shimetidine结合使用,该药物的血浆浓度增加了,最高的血浆浓度(CMAX)增加了3.9次,2.6次,2.6次和1.5次,血浆浓度浓度较低的曲面较低面积。 。(AUC)分别增加了10.5次,2.8次和1.6次。 (请参阅有关“仔细管理”的部分)
- 机械 /危险因素
- 由于代谢酶抑制剂的清除率降低
- 2。药物名称等。ChitochromeP450 3A4诱导的药物Bossentan Rifampicin等。
- 临床症状 /度量方法
- 该药物的血浆浓度可能会降低。
- 机械 /危险因素
- 由于代谢酶诱导而增加清除率
- 3。药品名称等。
- 临床症状 /度量方法
- 据报道,降压作用与抗高血压剂(如阿莫迪地平)相结合增强了。
- 机械 /危险因素
- 由于该药物由于血管延伸而具有降压作用,因此可能会增加由于组合而引起的降压作用。
- 四个。毒品名称等。α-块剂
- 临床症状 /度量方法
- 据报道,由于主观症状,例如头晕,例如α-释放剂,例如多克萨斯辛,血压降低。
由于降压作用可能会增加,因此仔细给药很重要,例如从低剂量开始给药(25 mg)。 - 机械 /危险因素
- 由于该药物由于血管延伸而具有降压作用,因此可能会增加由于组合而引起的降压作用。
- 五。 calperitide,例如毒品名称
- 临床症状 /度量方法
- 通过合并使用可以增强降压作用。
- 机械 /危险因素
- 由于该药物由于血管延伸而具有降压作用,因此可能会增加由于组合而引起的降压作用。
副作用
概述表达状态,副作用
- 该药物不进行调查,以阐明副作用的频率,例如用法调查。
另一个副作用
- 如果确认以下副作用,则根据需要采取适当的措施,例如减肥和取消。
- 1.心血管
- 未知频率
- 血管膨胀(热,下),胸痛,心p,心动过速,高血压,心律不齐,右腿不完整,周围体内梗塞) ,低血压,昏厥。
- 2.精神神经系统
- 未知频率
- 头痛,头晕,饥饿,异常感,下肢抽搐,下肢抽搐,记忆力下降,亲密,混乱,思维异常,神经炎,神经炎,神经质,神经质,焦虑,失眠,彻底。
- 3.肝脏
- 未知频率
- AST(GOT)增加,ALT(GPT)增加,增加LDH,增加LDH,血液甘油三酸酯的增加,γ-GTP增加,血清磷脂升高,血液淀粉酶的增加,血液白蛋白减少,血液胆红素,总蛋白质,总蛋白质,总蛋白质。
- 4.消化
- 未知频率
- 顽皮,胃肠道疾病,嘴巴,消化不良,腹痛,Okubi,胃炎,胃炎,胃炎,腹泻,嘴唇干燥,舌头疾病,舌头疾病,白色舌头,腹部坚持,便秘,便秘,呕吐,吞咽障碍。
- 5.尿 /生殖器
- 未知频率
- 疼痛疼痛,射精障碍,早晨站立的延伸,半勃起,勃起的延伸,可持续勃起,尿路感染,前列腺疾病
- 6.呼吸道
- 未知频率
- 鼻炎,呼吸系统疾病,鼻腔闭合,咽炎,哮喘,鼻腔出血,气道感染,鼻窦炎
- 7.肌肉 /骨骼系统
- 未知频率
- 关节疼痛,肌肉疼痛,骨痛,背痛
- 8.皮肤
- 未知频率
- 皮疹,瘙痒,眼睑,脱发,雄性图案多发性,出汗,皮肤干燥,皮肤疾病,红斑
- 9.血
- 未知频率
- 血红蛋白,血细胞比容升高,血红蛋白还原,淋巴细胞减少,淋巴细胞,嗜酸性粒细胞半胞膜,红细胞增加,白细胞增加,白细胞。
- 10.传感器
- 未知频率
- 眼睛救赎,结膜炎,彩色视觉障碍,视觉障碍,眼痛,屈光不适,光泽,味道异常,味觉丧失,富动物异常,富富,富曲,雾气,雾气,视觉,视网膜出血,视网膜静脉障碍,突然的聋哑度,突然的耳聋
- 11.其他
- 未知频率
- 增加CK(CPK),疼痛,热量,增加流感综合征,流感综合征,淋巴结,血液钠,增加血液,体重增加,增加血液,阳性,阳性,ubobilin阳性,尿红细胞,尿红细胞,尿红细胞阳性,尿红细胞阳性,阳性,阳性,阳性,阳性,阳性,阳性,阳性,阳性尿蛋白阳性,疲劳,无助,反应,感染
- 请注意)尽管因果关系尚不清楚,但据报道,在其他公司的商业产品之后,在Sildena Filcuinate管理后已经发展了心肌梗塞。 (请参阅有关“外国职业事件”的部分)
- 外国商业不利事件
- 在其他公司的其他公司中,自发报告已经报告了以下不良事件(包括未知因果关系)。这些包括100毫克的给药病例。
- 心血管系统:心源性死亡,心肌梗死,心室心律失常,脑出血,瞬时脑缺血性攻击和严重的心血管疾病(例如高血压),例如高血压。并非全部,其中许多已经患有心血管危险因素。许多事件在性活动或性活动后得到认可,有些事件在执行西地那非甲酸盐而没有性活动后得到认可。据报道,性活动后几个小时到几天,性活动几小时到几天。不可能确定这些病例是否与Sildena filteric Acid,性活动,最初持有的心血管疾病,这些因素的组合或其他因素的组合直接相关。
- 其他事件:
精神病学,焦虑,焦虑尿 /生殖器:勃起伸展,可持续勃起,血尿:血肿,暂时损失 /视力,眼睛 - 捕捉眼睛,眼睛灼热的眼睛,眼球肿胀 /压力,眼睛。增加压力,无序或出血的视网膜剂,玻璃体静脉容器,玻璃体分离 /牵引力,大黄斑周围的水肿
老年人的管理
- 应该仔细管理老年人,例如从低剂量(25 mg)开始给药,因为该药物的清除率会降低。
管理孕妇,妇产科妇女等。
- 没有对女性的适应性。
给儿童的管理等
- 没有适应儿童。
过量
- 1。
- 症状:在国外,如果给予800毫克健康的受试者,则不良事件与低剂量允许的事件相同,但其频率和严重程度增加。 200毫克给药并没有显示出更高的效力,但是不良事件的表达率(头痛,洪水,头晕,消化,鼻炎,视觉异常)增加。 100mg不良事件率高于25 mg和50 mg的批准剂量。
- 2。
- 行动:没有特定的药物治疗来进行过度疗法,但有适当的症状治疗。该药物的血浆蛋白组合率很高,尿液排泄率较低,因此不能预期通过肾透析促进清除率。
适用的预防措施
- 在药物时:PTP包装中的药物应从PTP纸中取出并指示服用。 (据报道,PTP纸的难以到叶片在食管粘膜中有一个硬尖的角,并且严重的并发症(如纵隔炎)是由穿孔引起的)。
其他预防措施
- 1。
- 尽管与该药物的因果关系尚不清楚,但在外国含有Sildena过滤酸的PDE5抑制剂期间,很少会导致视力降低或视力丧失的无政治动脉粥样硬化。 。这些患者中有许多患有NAION的危险因素(年龄(50岁),糖尿病,高血压,冠状动脉疾病,高脂血症,吸烟等)。
在一个外国的外国,在国外的男性中,在PDE5抑制剂期间,在一项自我控制的研究中,大约一天(T1 /2 )进行了大约一天(Sildenafil)。据报道,野生风险约为两次。 - 2。
- 尽管与药物的因果关系尚不清楚,但在极少数情况下,在据报道,包括西替尼氯酸酯在内的PDE5抑制剂后,在国外报告了抽搐的表达。
- 3。
- 该药物没有影响性传播疾病的作用。
- 四个。
- 据报道,45mg/kg和200 mg/kg组的大鼠具有大鼠口服1个月毒性测试,但在六个月测试或癌症原始测试中尚未识别。还据报道,在比格狗的长期有毒测试(6个月,12个月)的最大含量为50 mg/kg的情况下,雄性动物患有多种动脉炎。但是,这些病变已被确定为人类的外推性较低。
- 五。
- 有报道说,动物实验与富含黑色素色素的视网膜具有高亲和力,因此,如果您长时间进行管理,请注意眼科测试。
药代动力学
- 生物等效测试1)
- ●Sildena Phil Tablet 25mgvi“ Teva”
- Sildenafil片剂25MGVI“ TEVI”基于“生物形式的形式形式的等效测试指南,其内容不同(2012年2月29日为0229)”,Syildenafil片剂50mgvi“ Tevi” Tevi“ Tevi”并被认为是生物学。
- ●Sildena Phil Tablet 50mgvi“ Teva”
- Syindenafil片剂50 mgvi“ TEVI”,标准制剂是1片(50 mg作为西地那非),通过跨界方法(50 mg为西地那非)健康的成年男孩被固定在AROGA中的不愉快的身体浓度(AUC)(AUC)(AUC)(AUC)(AUC)(AUC) ,CMAX)根据90%的置信区定律,在log(0.80)到log(1.25)的范围内,并确认了两种药物的生物当量。
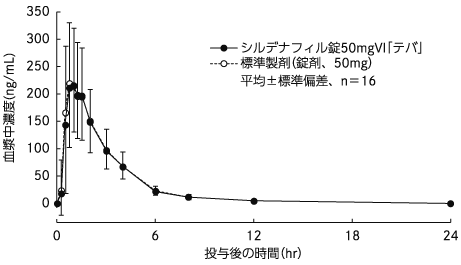
西地那非片50mgvi“ teba”禁食单切割东正教药物plameter(平均±标准偏差,n = 16)
| 剂量(mg) | AUC 0-24
(ng/hr/ml) | cmax
(ng/ml) | tmax
(HR) | T 1/2
(HR) |
| 西地那非片50mgvi“ teva” | 50 | 692±245 | 262±100 | 1.1±0.7 | 2.6±0.4 |
| 标准准备(平板电脑,50mg) | 50 | 708±225 | 270±93 | 1.1±0.6 | 2.6±0.4 |
血浆浓度和参数(例如AUC和CMAX)可能会根据测试条件(例如选择受试者的选择,收集体液的时间数量等)而有所不同。
有关活性成分的物理和化学知识
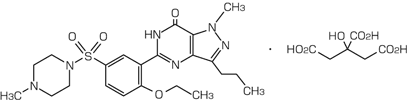
- 通用名称
- 西地那非柠檬酸盐
- 化学名称
- 1- [[3-(6,7-二氢-1-甲基-7-oxo-3-丙基-1 h -pyrazolo [4,3- d ]嘧啶-5-基)-4-乙氧基苯基] -4-4-4-4-4-4-4-乙氧基苯基] - 乙氧基苯基] - 4-甲基哌嗪单尿不足
- 分子
- C 22 H 30 N 6 O 4 S / C 6 H 8 O 7
- 分子量
- 666.70
- 性欲
- 它是白色结晶粉。它很难溶于水或甲醇,并且几乎不溶于乙醇(99.5)。
- 结构公式
处理的预防措施
- 稳定性测试结果的概述2)
- 由于加速度测试(40°C,相对湿度,75%,6个月),据推测,在正常的市场分布中,西地那非片25 mgvi“ tevi”和sildenafil片剂50 mgvi“ tevi”稳定了三年。
包装
- ●Sildena Phil Tablet 25mgvi“ Teva”
PTP包装:20片(10片X 2) - ●Sildena Phil Tablet 50mgvi“ Teva”
PTP包装:20片(10片X 2),100片(10片X 10)
主要文献和文档请求目的地
主要文献
- 1)
- Takeda Tebaphama Co.,Ltd。在房屋材料(生物等效测试)中
- 2)
- Takeda Tebaphama Co.,Ltd。在 - 房屋材料(稳定性测试)
文献请求 /产品信息查询
- 请索取下面“主文档”列中描述的文档和房屋材料。
Takeda Teba Farm Co.,Ltd. Takeda Teva di Center - 1-24-11 Taiko,Nakamura-Ku,Nagoya 453-0801
- 电话0120-923-093
接待时间9:00-17:30(不包括周末和假期,我们的假期)
制造商等的姓名或名称和地址等。
- 销售
- 武田制药有限公司
- 4-1-1,大阪的Chuo-ku
- 制造和分销商
- Takeda Tebapmer Co.,Ltd.
- 1-24-11 Taiko,Nakamura -Ku,名古屋
7.1
143.5
3.8
9.1
284
4.6