获取国外Xolair药品价格,使用等信息,最快 24 小时回馈
Xolair
什么是Xolair?
Xolair(omalizumab)是一种有助于减少体内过敏反应的抗体。
Xolair用于治疗由成年人和至少6岁的儿童过敏引起的中度至重度哮喘。当哮喘症状不受哮喘吸入类固醇药物控制时,可使用Xolair。它不是用于治疗哮喘发作的急救药物。
在尝试使用抗组胺药未成功后,Xolair还用于治疗至少12岁的成年人和儿童的慢性荨麻疹(特发性荨麻疹)。
重要信息
一些使用Xolair的人在注射后或数小时后发生了严重的,危及生命的过敏反应。即使定期使用Xolair一年或更长时间,也可能发生过敏反应。
如果您对Xolair有任何过敏反应迹象,请寻求紧急医疗救助:荨麻疹,皮疹;焦虑或恐惧;潮红(温暖,发红或刺痛的感觉);感觉自己可能会昏倒;胸闷,喘息,呼吸困难,呼吸困难;快速或微弱的心跳;脸,嘴唇,舌头或喉咙肿胀。
哮喘经常与多种药物合用。按照医生的指示使用所有药物。阅读每种药物随附的药物指南或患者说明。未经医生建议,请勿更改剂量或用药时间表。
如果您还使用口服类固醇药物,请不要突然停止使用类固醇,否则您可能会出现令人不快的戒断症状。如果您的任何哮喘药物在治疗或预防发作方面效果不佳,请与您的医生谈谈。一旦开始使用Xolair,您的症状可能不会立即改善。为了获得最佳效果,请始终按照指示接收Xolair。如果治疗几周后症状仍未改善,请与您的医生交谈。
定期使用Xolair可获得最大收益。在完全用完药物之前,请先补充处方。
在服药之前
如果您对omalizumab过敏,则不应使用Xolair。
为确保Xolair对您安全,请告知您的医生是否患有:
任何感染迹象(发烧,腺体肿胀,全身不适);
任何其他过敏(食物,花粉等);
由寄生虫引起的感染(例如贾第虫,疟疾,利什曼病,钩虫,pin虫,弓形虫病等);
过去或现在的癌症;
心脏病发作或中风的历史;
如果您正在接受过敏注射;要么
如果您曾经有过严重的过敏反应(过敏反应)。
使用Xolair可能会增加您罹患某些类型的乳腺癌,皮肤癌,前列腺癌或唾液腺癌的风险。与您的医生讨论您的个人风险。
当您使用Xolair时,如果您居住或旅行到此类感染常见的地方,则感染寄生虫(蠕虫)的风险也可能会增加。与您的医生讨论寻找什么以及如何治疗这种情况。
Xolair预计不会伤害未出生的婴儿。告诉医生您是否怀孕或打算在治疗期间怀孕。
如果您怀孕了,您的名字可能会在怀孕登记簿中列出。这是为了追踪妊娠结局并评估Xolair对婴儿的影响。
尚不知道omalizumab是否会进入母乳或是否会损害哺乳婴儿。告诉医生您是否正在母乳喂养婴儿。
不要给Xolair小于12岁的孩子。
我应该如何使用Xolair?
Xolair被注入皮肤下。医护人员会给您注射。 Xolair通常每2或4周服用一次。
在开始使用Xolair进行治疗之前,您的医生可能会进行过敏性皮肤测试或血液测试,以确保该药适合您。
服用Xolair后,您将在短时间内密切注视您,以确保您对药物没有过敏反应。
您的病情可以通过药物联合治疗。按照医生的指示使用所有药物。阅读每种药物随附的药物指南或患者说明。未经医生建议,请勿更改剂量或用药时间表。
如果您还使用类固醇药物,请不要突然停止使用它,否则可能会有令人不快的戒断症状。如果您的任何哮喘药物在治疗或预防发作方面效果不佳,请与您的医生谈谈。
使用Xolair时,您可能需要经常进行医学检查,例如变态反应检查和肺功能检查。您的粪便也可能需要检查是否含有寄生虫,尤其是在旅行时。
您的病情可能不会立即改善。为了获得最佳效果,请继续按照指示接受药物治疗。如果治疗几周后症状仍未改善,请与您的医生交谈。
如果我错过剂量怎么办?
如果您错过了注射预约,请致电医生。
如果我服药过量怎么办?
寻求紧急医疗护理或致电1-800-222-1222,拨打毒药帮助热线。
使用Xolair时应避免什么?
关于食物,饮料或活动的任何限制,请遵循医生的指示。
Xolair的副作用
一些使用Xolair的人在注射后或数小时后发生了严重的,危及生命的过敏反应。即使定期使用药物一年或更长时间,也可能发生过敏反应。
如果您对Xolair有任何过敏反应,请寻求紧急医疗帮助:
荨麻疹,皮疹;
焦虑或恐惧,觉得自己可能会昏倒;
潮红(温暖,发红或刺痛的感觉);
胸闷,喘息,呼吸困难,呼吸困难;
快速或微弱的心跳;要么
脸,嘴唇,舌头或喉咙肿胀。
如果您有以下情况,请立即致电您的医生:
支气管痉挛(喘息,胸闷,呼吸困难);
发烧,腺体肿胀,皮疹或瘙痒,关节痛或全身不适;
胸痛蔓延到您的下巴或肩膀,咳血;
突然的麻木或虚弱(尤其是在身体的一侧),视力或言语问题;
一只或两只腿疼痛,肿胀,发热或发红;
新的或恶化的咳嗽,发烧,呼吸困难;要么
皮疹,瘀伤,严重刺痛,麻木,疼痛,肌肉无力。
常见的Xolair副作用可能包括:
瘙痒,轻度皮疹;
关节疼痛,骨折;
手臂或腿部疼痛;
恶心;
头晕,疲倦;
耳痛;要么
感冒症状,如鼻塞,打喷嚏,窦痛,咳嗽,喉咙痛。
这不是副作用的完整列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响Xolair?
其他药物可能与奥马珠单抗相互作用,包括处方药和非处方药,维生素和草药产品。向您的每个医疗保健提供者告知您现在使用的所有药物以及您开始或停止使用的任何药物。
版权所有1996-2020 Cerner Multum,Inc.版本:4.03。
注意:本文档包含有关omalizumab的副作用信息。此页面上列出的某些剂型可能不适用于商标名称Xolair。
综上所述
更常见的副作用包括:小腿疼痛。有关不良影响的完整列表,请参见下文。
对于消费者
适用于奥马珠单抗:皮下注射液,皮下注射液
警告
皮下途径(粉剂)
据报道,服用奥马珠单抗会导致过敏反应,表现为支气管痉挛,低血压,晕厥,荨麻疹和/或咽喉或舌头血管性水肿。从首次给药到奥马珠单抗开始后一年以上的任何时间都可能发生过敏反应。服用奥马珠单抗后应密切监测患者,并准备处理任何过敏反应。
需要立即就医的副作用
omalizumab(Xolair中包含的活性成分)及其所需的作用可能会导致某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用奥马珠单抗时,如果出现以下任何副作用,请立即咨询医生或护士:
不常见
- 皮肤起泡,结s,发炎,瘙痒或变红
- 身体产生可与药物结合的物质,使其无效或引起副作用
罕见
- 咳嗽
- 吞咽困难
- 头晕
- 快速的心跳
- 荨麻疹,瘙痒或皮疹
- 恶性肿瘤
- 眼睑或眼睛,面部,嘴唇或舌头周围浮肿或肿胀
- 胸闷
- 异常疲倦或虚弱
发病率未知
- 黑色柏油凳
- 牙龈出血
- 尿液或大便中有血
- 胸痛
- 发冷
- 移动困难
- 发热
- 肌肉疼痛或僵硬
- 关节疼痛
- 排尿困难或困难
- 查明皮肤上的红色斑点
- 咽喉痛
- 嘴唇或嘴中的疮,溃疡或白斑
- 腺体肿胀
- 异常出血或瘀伤
不需要立即就医的副作用
可能会出现omalizumab的某些副作用,这些副作用通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 出血,起泡,灼热,寒冷,皮肤变色,压力感,荨麻疹,感染,炎症,瘙痒,肿块,麻木,疼痛,皮疹,发红,疤痕,酸痛,刺痛,肿胀,压痛,刺痛,溃疡或温暖在注射部位
- 身体疼痛或疼痛
- 感冒或流感样症状
- 拥塞
- 喉咙干燥或酸痛
- 头痛
- 嘶哑
- 腿痛
- 结块
- 眼睛和che骨周围疼痛或压痛
- 鼻塞或流鼻涕
- 声音变化
不常见
- 手臂痛
- 皮肤开裂,干燥或鳞屑
- 耳痛
发病率未知
- 脱发
对于医疗保健专业人员
适用于奥马珠单抗:皮下注射粉剂,皮下溶液
一般
较常见的副作用包括注射部位反应,头痛和鼻咽炎。 [参考]
本地
非常常见(10%或更多):任何注射部位反应,包括疼痛,肿胀,瘙痒,发红,瘀伤,出血,硬结或肿块(高达45%),严重的注射部位反应(高达12%)
罕见(0.1%至1%):手臂肿胀[Ref]
在临床试验中,分别有45%和43%的患者在服用这种药物和安慰剂后发生任何注射部位反应。严重反应分别发生在12%和9%。 [参考]
免疫学的
在临床研究中,分别有37%和39%的患者或接受这种药物或安慰剂的患者发生了病毒感染。与安慰剂相比,寄生虫感染的增加没有统计学意义。 [参考]
非常常见(10%或更多):病毒感染(高达37%)
罕见(0.1%至1%):念珠菌病,寄生虫感染
稀有(0.01%至0.1%):抗omalizumab抗体形成
上市后报告:血清病,过敏性肉芽肿性血管炎(Churg-Strauss综合征),淋巴结肿大[参考]
神经系统
在临床试验中,服用该药(n = 716)或安慰剂(n = 694)的患者中有37%发生头痛;头痛发生在6至12岁的患者中。 [参考]
很常见(10%或更多):头痛(高达27%)
普通(1%至10%):头晕
罕见(0.1%至1%):晕厥,血管迷走性晕厥,嗜睡,感觉异常
未报告频率:偏头痛,窦性头痛[参考]
肌肉骨骼
非常常见(10%或更多):背痛(高达13%)
常见(1%至10%):关节痛,肌痛,扭伤,拉伤,四肢疼痛,骨折
上市后报告:共同膨胀[参考]
呼吸道
常见(1%至10%):鼻咽炎,鼻窦炎,病毒性上呼吸道感染(URI),URI
罕见(0.1%至1%):咽炎,咳嗽,过敏性支气管痉挛
稀有(0.01%至0.1%):喉水肿
未报告频率:哮喘,口咽痛[参考]
在慢性特发性荨麻疹的临床试验中,患者分别以150 mg,300 mg和安慰剂分别报道了9.1%,6.6%和7%的鼻咽炎;患者也分别报告鼻窦炎(1.1%,4.9%,2.1%),咳嗽(1.1%,2.2%,1.2%)和上呼吸道感染(11.1%,3.4%,2.1%)。 [参考]
皮肤科
常见(1%至10%):皮炎,瘙痒
罕见(0.1%至1%):皮疹,潮红,光敏性
上市后报告:脱发,脱发[参考]
其他
在临床试验中,发烧非常常见于6至12岁的患者。 [参考]
常见(1%至10%):发烧,耳痛
罕见(0.1%至1%):疲劳,注射后现象[Ref]
胃肠道
在临床试验中,上腹痛在6至12岁的患者中非常普遍。在慢性特发性荨麻疹的临床试验中,患者分别以150 mg,300 mg和安慰剂报道恶心的时间分别为1.1%,2.7%和2.5%。 [参考]
常见(1%至10%):上腹部疼痛,恶心
罕见(0.1%至1%):腹泻,消化不良,肠胃炎
未报告频率:牙痛[参考]
泌尿生殖
常见(1%至10%):尿路感染[参考]
过敏症
罕见(0.1%至1%):荨麻疹
罕见(0.01%至0.1%):过敏反应,血管性水肿
上市后报告:类过敏反应[参考]
心血管的
罕见(0.1%至1%):体位性低血压
未报告的频率:周围性水肿,动脉血栓形成事件(包括短暂性缺血发作,心肌梗塞,不稳定型心绞痛和心血管死亡)
上市后报告:低血压,胸闷[参考]
血液学
罕见(0.1%至1%):无症状的血小板减少
上市后报告:特发性严重血小板减少症,嗜酸性疾病[参考]
在临床试验中,有0.6%的患者血小板计数降低至正常实验室范围以下。这些患者没有相关的出血发作或血红蛋白减少。 [参考]
新陈代谢
罕见(0.1%至1%):体重增加[参考]
精神科
未报告频率:焦虑[参考]
参考文献
1. Cerner Multum,Inc.“澳大利亚产品信息”。 00
2. Cerner Multum,Inc.“英国产品特性摘要”。 00
3.“产品信息。Xolair(奥马珠单抗)。” Genentech,南旧金山,CA。
某些副作用可能没有报道。您可以将其报告给FDA。
慢性特发性荨麻疹的剂量
每4周皮下注射150毫克或300毫克XOLAIR。
CIU患者的XOLAIR剂量与血清IgE(游离或总)水平或体重无关。
尚未评估CIU的适当治疗时间。定期重新评估继续治疗的必要性。
行政
XOLAIR可作为预充式注射器和如在小瓶中用于重建的冻干粉末。 XOLAIR预装注射器和冻干粉均应由医疗专业人员进行管理。通过皮下注射施用XOLAIR。注射可能需要5-10秒才能完成。每个部位最多只能注射一剂。 (表3,表4)。
| XOLAIR剂量* | 75毫克注射器 | 150毫克注射器 | 总注入量 |
|---|---|---|---|
| |||
| 75毫克 | 1个 | 0 | 0.5毫升 |
| 150毫克 | 0 | 1个 | 1毫升 |
| 225毫克 | 1个 | 1个 | 1.5毫升 |
| 300毫克 | 0 | 2 | 2毫升 |
| 375毫克 | 1个 | 2 | 2.5毫升 |
| XOLAIR剂量* | 样品瓶数量 | 注射次数 | 总注入量 |
|---|---|---|---|
| |||
| 75毫克 | 1个 | 1个 | 0.6毫升 |
| 150毫克 | 1个 | 1个 | 1.2毫升 |
| 225毫克 | 2 | 2 | 1.8毫升 |
| 300毫克 | 2 | 2 | 2.4毫升 |
| 375毫克 | 3 | 3 | 3.0毫升 |
XOLAIR预填充注射器的使用和注射准备
为了准备XOLAIR预填充的皮下注射针筒,请仔细阅读并遵守这些使用说明。
XOLAIR预充式注射器在2个剂量长处可用。这些说明适用于两种剂量强度。您应该检查XOLAIR预装注射器的纸箱上的标签,以确保剂量正确。
XOLAIR 75毫克预充式注射器具有蓝色针护罩
XOLAIR 150毫克预充式注射器具有紫色针护罩
存储说明
- 保留未使用的注射器在原来的纸箱和纸箱存放在36F(2〜8),冰箱,46F。在存放期间,请勿将注射器从其原始纸箱中取出。
- 保持XOLAIR注射器,避免阳光直射。
- 不要冻结。
- 如果注射器已被冻结,请勿使用。
- 始终保持注射器干燥。
关于预充注射器重要信息
- 的XOLAIR溶液用于注射在预充式注射器可移除针头帽含有天然橡胶乳胶的衍生物[参见描述(11)]。
- 直到你准备注射XOLAIR不要打开密封的外包装纸盒。
- 直到你准备注射XOLAIR不要拿针帽掉。
- 不要试图在任何时候采取注射器分开。
- 不要重复使用同一个注射器。
- 如果注射器已被删除或损坏,请勿使用。
- 如果包装破损或出现被篡改,请勿使用。
- 不要把注射器无人值守。
- 将此药品放在儿童不能接触的注射器抽出。
准备注射
| |
|  |
| |
|   |
|  |
|  |
|  |
| 实施注射 | |
|  |
| |
|  |
|  |
|  |
注射后
| |
|  |
XOLAIR冻干粉的使用和注射用制剂
所提供的XOLAIR冻干粉必须按照以下说明用无菌注射用水(SWFI)USP配制:
- 1)
- 重构之前,确定需要重构的小瓶数量(每个小瓶在1.2 mL中提供150 mg XOLAIR)(参见表4) 。
- 2)
- 将1.4 mL SWFI,USP抽入装有1英寸18号针的3 mL注射器中。
- 3)
- 将小瓶直立放置在平坦的表面上,并使用标准无菌技术,将针头插入,然后将SWFI,USP直接注射到产品上。
- 4)
- 保持小瓶直立,轻轻旋转小瓶约1分钟以均匀润湿粉末。不要摇晃。
- 5)
- 大约每5分钟轻轻旋转小瓶5至10秒,以溶解所有残留的固体。冻干的产品需要15到20分钟才能溶解。如果要花费超过20分钟才能完全溶解,请大约每5分钟轻轻旋转小瓶5至10秒,直到溶液中没有可见的凝胶状颗粒为止。如果样品瓶中的内容物在40分钟内没有完全溶解,请勿使用。
- 6)
- 重建后,XOLAIR溶液有些粘稠,会显得透明或微乳白色。样品瓶边缘周围有一些小气泡或泡沫是可以接受的。复溶溶液中不应有可见的凝胶状颗粒。如果存在异物,请勿使用。
- 7)
- 翻转样品瓶15秒钟,以使溶液向塞子排放。
- 8)
- 当在2ºC至8ºC(36ºF至46ºF)的小瓶中保存时,在重构后的8小时内使用XOLAIR溶液,或者在室温下存储时,在重构后的4小时内使用XOLAIR溶液。重新配制的XOLAIR小瓶应避免阳光直射。
- 9)
- 使用配备1英寸18规格针头的新3 mL注射器,将针头插入倒置的样品瓶中。将溶液吸入注射器时,将针尖放在小瓶塞子中溶液的最底部。重构的产品有些粘稠。从小瓶中抽出所有产品,然后再从注射器中排出空气或多余的溶液。在从小瓶中取出针头之前,将柱塞一直拉回到注射器筒的末端,以便从倒置的小瓶中取出所有溶液。
- 10)
- 用25号针头替换18号针头以进行皮下注射。
- 11)
- 排出空气,大气泡和任何过量的溶液,以获得1.2 mL的体积,相当于150 mg的XOLAIR。为了获得相当于75 mg XOLAIR剂量的0.6 mL体积,排出空气,大气泡并从注射器中丢弃0.6 mL。注射器中溶液的顶部可能残留有一层薄薄的小气泡
- 12)
- 辖XOLAIR通过皮下注射。注射可能需要5到10秒钟,因为溶液略带粘性。每个注射部位的剂量不要超过150 mg(一个小瓶的含量)。在两个或多个注射部位之间分配150 mg以上的剂量。
据报道,服用Xolair后出现过敏反应,表现为支气管痉挛,低血压,晕厥,荨麻疹和/或咽喉或舌头血管性水肿。过敏反应早在首次服用Xolair后就发生了,但在开始定期给药后的一年后也发生过。由于存在过敏反应的风险,因此在Xolair给药后的适当时间内密切观察患者。管理Xolair的医疗保健提供者应做好应对可能威胁生命的过敏反应的准备。告知患者过敏反应的体征和症状,并指示患者出现症状时应立即就医[请参阅警告和注意事项(5.1)和不良反应( 6.1,6.3) ] 。
Xolair的适应症和用法
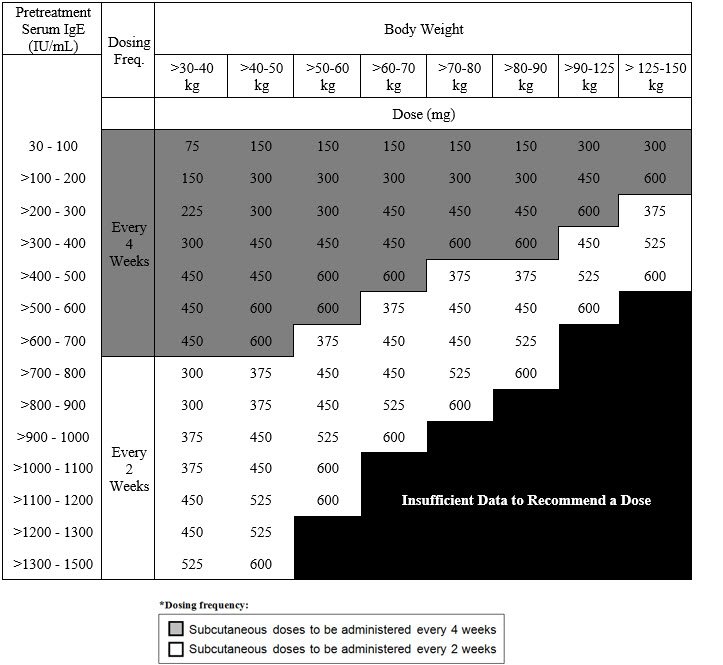
哮喘
Xolair适用于年龄在6岁及以上的中度至重度持续性哮喘患者,其皮肤试验阳性或对多年生气变应原具有体外反应性,且其症状无法通过吸入糖皮质激素控制。
Xolair已被证明可以降低这些患者哮喘加重的发生率。
使用限制:
- Xolair不适用于缓解急性支气管痉挛或哮喘状态。
- Xolair不适用于其他过敏性疾病的治疗。
慢性特发性荨麻疹(CIU)
Xolair适用于治疗12岁及12岁以上的慢性和特发性荨麻疹的成人和青少年,尽管使用H1抗组胺药仍可保持症状。
使用限制:
Xolair不适用于治疗其他形式的荨麻疹。
Xolair剂量和给药
哮喘剂量
每2或4周皮下注射一次Xolair 75 mg至375 mg。根据开始治疗前测得的血清总IgE水平(IU / mL)和体重(kg)确定剂量(mg)和给药频率。
调整剂量,以在治疗期间显着改变体重(见表1和2 )。
治疗期间IgE总水平升高,并且在停止治疗后长达一年的时间内仍保持升高。因此,Xolair治疗期间对IgE水平的重新测试不能用作剂量确定的指导。
- 持续不到一年的中断:根据在初始剂量确定时获得的血清IgE水平的剂量。
- 持续一年或一年以上的中断:根据患者年龄,使用表1或表2重新测试总血清IgE水平,以确定剂量。
根据患者的疾病严重程度和哮喘控制水平,定期重新评估是否需要继续治疗。
12岁及12岁以上的成人和青少年患者:根据表1开始给药。
 |
6至<12岁的儿科患者:根据表2开始给药。
表2.对于6至<12岁之间开始使用Xolair的小儿哮喘患者,每2或4周*进行皮下Xolair剂量*

慢性特发性荨麻疹的剂量
每4周皮下注射150毫克或300毫克Xolair。
CIU患者的Xolair剂量与血清IgE(游离或总)水平或体重无关。
尚未评估CIU的适当治疗时间。定期重新评估继续治疗的必要性。
行政
Xolair可作为预装注射器和小瓶中的冻干粉进行重构。 Xolair预装注射器和冻干粉均应由医疗保健专业人员进行管理。通过皮下注射施用Xolair。注射可能需要5-10秒才能完成。每个部位最多只能注射一剂。 (表3 ,表4 )。
| Xolair剂量* | 75毫克注射器 | 150毫克注射器 | 总注入量 |
|---|---|---|---|
| |||
| 75毫克 | 1个 | 0 | 0.5毫升 |
| 150毫克 | 0 | 1个 | 1毫升 |
| 225毫克 | 1个 | 1个 | 1.5毫升 |
| 300毫克 | 0 | 2 | 2毫升 |
| 375毫克 | 1个 | 2 | 2.5毫升 |
| Xolair剂量* | 样品瓶数量 | 注射次数 | 总注入量 |
|---|---|---|---|
| |||
| 75毫克 | 1个 | 1个 | 0.6毫升 |
| 150毫克 | 1个 | 1个 | 1.2毫升 |
| 225毫克 | 2 | 2 | 1.8毫升 |
| 300毫克 | 2 | 2 | 2.4毫升 |
| 375毫克 | 3 | 3 | 3.0毫升 |
Xolair预填充注射器的使用和注射准备
要准备用于皮下给药的Xolair预填充注射器,请仔细阅读并遵守这些使用说明。

Xolair预装注射器有2种剂量强度。这些说明适用于两种剂量强度。您应该检查Xolair预装注射器的纸箱上的标签,以确保剂量正确。
Xolair 75毫克预填充注射器,带蓝色针头护罩

Xolair 150毫克预填充注射器,带紫色针头护罩

储存说明
- 将未使用的注射器放在原始纸箱中,然后将纸箱存放在36˚F至46˚F(2˚C至8˚C)的冰箱中。在存放期间,请勿将注射器从其原始纸箱中取出。
- Xolair注射器应避免阳光直射。
- 不要冻结。
- 如果注射器已冷冻,请勿使用。
- 始终保持注射器干燥。
有关预装注射器的重要信息
- Xolair注射溶液的可移动针头盖在预装注射器中含有天然橡胶胶乳的衍生物[请参阅说明(11) ] 。
- 在准备注射Xolair之前,请勿打开密封的外部纸箱。
- 准备注射Xolair之前,请勿取下针帽。
- 请勿随时拆开注射器。
- 不要重复使用相同的注射器。
- 如果注射器跌落或损坏,请勿使用。
- 如果包装已损坏或被篡改,请勿使用。
- 不要让注射器无人看管。
- 请将注射器放在儿童接触不到的地方。
准备注射
| |
|  |
| |
|   |
|  |
|  |
|  |
| 管理注射 | |
|  |
| |
|  |
|  |
|  |
注射后
| |
|  |
Xolair冻干粉的使用和注射用制剂
所提供的Xolair冻干粉必须按照以下说明用无菌注射用水(SWFI)USP配制:
- 1)
- 复溶前,确定需要复溶的小瓶数(每个小瓶在1.2 mL中输送150 mg Xolair)(请参见表4 ) 。
- 2)
- 将1.4 mL SWFI,USP抽入装有1英寸18号针的3 mL注射器中。
- 3)
- 将小瓶直立放置在平坦的表面上,并使用标准无菌技术,将针头插入,然后将SWFI,USP直接注射到产品上。
- 4)
- 保持小瓶直立,轻轻旋转小瓶约1分钟以均匀润湿粉末。不要摇晃。
- 5)
- 大约每5分钟轻轻旋转小瓶5至10秒,以溶解所有残留的固体。冻干的产品需要15到20分钟才能溶解。如果要花费超过20分钟才能完全溶解,请大约每5分钟轻轻旋转小瓶5至10秒,直到溶液中没有可见的凝胶状颗粒为止。如果样品瓶中的内容物在40分钟内没有完全溶解,请勿使用。
- 6)
- 复溶后,Xolair溶液有些粘稠,会显得澄清或微乳白色。样品瓶边缘周围有一些小气泡或泡沫是可以接受的。复溶溶液中不应有可见的凝胶状颗粒。如果存在异物,请勿使用。
- 7)
- 翻转样品瓶15秒钟,以使溶液向塞子排放。
- 8)
- 如果将Xolair溶液在2ºC至8ºC(36ºF至46ºF)的温度下保存在小瓶中,则应在复溶后8小时内使用;如果在室温下存储,则应在复溶4小时内使用。再生的Xolair小瓶应避免阳光直射。
- 9)
- 使用配备1英寸18规格针头的新3 mL注射器,将针头插入倒置的样品瓶中。将溶液吸入注射器时,将针尖放在小瓶塞子中溶液的最底部。重构的产品有些粘稠。从小瓶中抽出所有产品,然后再从注射器中排出空气或多余的溶液。在从小瓶中取出针头之前,将柱塞一直拉回到注射器筒的末端,以便从倒置的小瓶中取出所有溶液。
- 10)
- 用25号针头替换18号针头以进行皮下注射。
- 11)
- 排出空气,大气泡和任何多余的溶液,以获得1.2毫升的体积,相当于150毫克Xolair的剂量。为了获得相当于75 mg Xolair剂量的0.6 mL体积,排出空气,大气泡并从注射器中丢弃0.6 mL。注射器中溶液的顶部可能残留有一层薄薄的小气泡
- 12)
- 通过皮下注射施用的Xolair。注射可能需要5到10秒钟,因为溶液略带粘性。每个注射部位的剂量不要超过150 mg(一个小瓶的含量)。在两个或多个注射部位之间分配150 mg以上的剂量。
剂型和优势
注射:
Xolair注射液为澄清至微乳白色,无色至浅棕黄色溶液,可用:
- 在带有蓝色针头护罩的单剂量预填充注射器中,剂量为75 mg / 0.5 mL
- 带有紫色针头护罩的单剂量预装注射器中的150 mg / mL
注射用:150毫克白色冻干粉末装在单剂量小瓶中,以进行重建。
禁忌症
禁止在以下情况下使用Xolair:
对Xolair或Xolair的任何成分的严重超敏反应[请参阅警告和注意事项(5.1) ] 。
警告和注意事项
过敏反应
据报道,在上市前临床试验和上市后自发报告中,服用Xolair后会发生过敏反应[见盒装警告和不良反应(6.3) ] 。这些报告病例的体征和症状包括支气管痉挛,低血压,晕厥,荨麻疹和/或咽喉或舌头血管性水肿。其中一些事件危及生命。在针对哮喘患者的上市前临床试验中,3507名患者中有3名(0.1%)出现了过敏反应。两名患者首次使用Xolair发生过敏反应,一名患者发生第四剂过敏反应。过敏反应的发作时间在两名患者给药后90分钟,在一名患者给药后2小时。
一项病例对照研究表明,与没有过敏史的患者相比,在Xolair使用者中,对食物,药物或其他原因有过敏史的患者与Xolair相关的过敏反应的风险增加[请参阅不良反应( 6.1) ] 。
在上市后的自发报告中,基于2003年6月至2006年12月约57,300名患者的暴露量,估计归因于Xolair使用的过敏反应发生率至少为患者的0.2%。 Xolair,但在开始定期进行定期治疗后也已经发生了一年。
仅在医疗保健提供者愿意为可能会威胁生命的过敏反应管理的医疗保健场所中管理Xolair。考虑到在上市前临床试验和上市后自发报告中见到的过敏反应发作时间,请在服用Xolair后的适当时间内密切观察患者[见不良反应(6) ] 。告知患者过敏反应的体征和症状,并指示他们在出现体征或症状时立即就医。
在出现严重超敏反应的患者中停用Xolair [请参阅禁忌症(4) ] 。
恶性肿瘤
在接受Xolair治疗的4127名患者中,有20名(0.5%)患恶性肿瘤,而在12岁以上患有哮喘和其他过敏性疾病的成人和青少年的临床研究中,有2236名(5)(0.2%)对照患者中有5名患有恶性肿瘤。在Xolair治疗的患者中观察到的恶性肿瘤为多种类型,其中乳腺癌,非黑色素瘤皮肤,前列腺,黑色素瘤和腮腺发生不止一次,其他五种类型均发生一次。观察到大多数患者不到一年。长期暴露于Xolair或对具有较高恶性风险的患者(例如,老年人,吸烟者)的影响尚不清楚。
在随后的500例Xolair治疗和2829例非Xolair治疗的青少年和成年患者中观察到严重的持续性哮喘,并且皮肤试验反应呈阳性或对多年生气变应原具有体外反应性,该患者的随访时间长达5年。在这项研究中,在接受Xolair治疗的患者(12.3)和未接受Xolair治疗的患者(13.0)中,原发恶性肿瘤的发生率(每1000患者年)相似[参见不良反应(6) ] 。但是,研究局限性无法明确排除Xolair的恶性风险。研究的局限性包括:观察性研究设计,允许先前接受Xolair暴露的患者(88%),在癌症病史或恶性病史为研究排除标准的患者(56%)中引入的偏倚,以及研究终止率(44%)。
急性哮喘症状
Xolair尚未显示出能急性缓解哮喘急性发作。不要使用Xolair治疗急性支气管痉挛或哮喘病。
皮质类固醇减少
在开始使用Xolair进行哮喘治疗时,请勿突然中断全身或吸入皮质类固醇激素治疗。在医师的直接监督下,逐渐减少皮质类固醇激素。在CIU患者中,尚未评估Xolair与皮质类固醇联合使用的情况。
嗜酸性条件
在极少数情况下,接受Xolair治疗的哮喘患者可能会出现严重的全身性嗜酸性粒细胞增多症,有时表现出与Churg-Strauss综合征相符的血管炎的临床特征,这种疾病通常需要全身性糖皮质激素治疗。这些事件通常但并非总是与口服糖皮质激素治疗的减少有关。医师应警惕患者的嗜酸性粒细胞增多,皮疹,肺部症状加重,心脏并发症和/或神经病变。 Xolair与这些潜在条件之间没有因果关系。
发烧,关节痛和皮疹
在批准后使用中,一些患者在首次或随后注射Xolair后1至5天开始出现一系列星座和症状,包括关节炎/关节痛,皮疹,发烧和淋巴结病。在某些患者中,补充剂量后这些症状和体征已经复发。尽管在这些病例中未见到循环免疫复合物或符合III型反应的皮肤活检,但这些体征和症状与血清病患者相似。如果患者出现这种症状和体征,医师应停止Xolair [见不良反应(6.3) ] 。
寄生虫(蠕虫)感染
在进行Xolair治疗时,监测有高风险的蠕虫感染患者。没有足够的数据来确定停止Xolair治疗后对蠕虫感染所需的监测时间。
在巴西进行的一项为期一年的临床试验中,对患有地蠕虫感染高风险的成人和青少年患者(round虫,钩虫,鞭虫,线虫)进行了诊断,根据Xolair的诊断,有53%(36/68)的Xolair治疗患者经历了感染标准大便检查,而安慰剂对照组为42%(29/69)。感染的优势比的点估计为1.96,置信区间为95%(0.88,4.36),表明在该研究中,被感染的患者接受Xolair的可能性是患者的0.88到4.36倍谁没有感染。各治疗组之间对粪便卵计数对适当的抗地蠕虫感染的治疗反应无差异。
实验室测试
服用Xolair后,由于Xolair:IgE复合物的形成,血清总IgE水平增加[参见临床药理学(12.2) ] 。 Xolair停用后,血清总IgE水平升高可能持续长达1年。不要使用停药后不到一年的血清总IgE水平来重新评估哮喘患者的给药方案,因为这些水平可能无法反映稳定的游离IgE水平[见剂量和给药方法(2.1) ] 。
不良反应
Xolair的使用与以下方面有关:
- 过敏反应[见盒装警告和警告和注意事项(5.1) ]
- 恶性肿瘤[请参阅警告和注意事项(5.2) ]
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此不能将在一种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映在临床实践中观察到的不良反应率。
来自12岁及以上哮喘的成年和青少年患者的临床研究不良反应
下述数据反映了安慰剂对照或其他对照哮喘研究中2067名12岁及以上的成人和青少年患者的Xolair暴露,包括1687名暴露六个月的患者和555名暴露一年或以上的患者。接受Xolair治疗的患者的平均年龄为42岁,其中134位年龄在65岁以上的患者;妇女占60%,白人占85%。患者每2周或4周接受150 mg至375 mg Xolair的治疗;对于分配给对照组的患者,则接受或不接受安慰剂的标准疗法。
最经常导致临床干预的不良事件(例如,停用Xolair或需要同时用药治疗不良事件)是注射部位反应(45%),病毒感染(23%),上呼吸道感染(20 %),鼻窦炎(16%),头痛(15%)和咽炎(11%)。在Xolair治疗的患者和对照组患者中观察到这些事件的发生率相似。
表5显示了接受Xolair的四个安慰剂对照哮喘试验的不良反应发生率≥1%,并且在接受Xolair治疗的12岁以上的成人和青少年患者中的发生率高于接受安慰剂的患者。不良事件使用国际医学术语(IMN)词典中的首选术语进行分类。注射部位反应与其他不良事件的报告分开记录。
| 不良反应 | Xolair n = 738 | 安慰剂 n = 717 |
|---|---|---|
| 身体整体 | ||
| 疼痛 | 7% | 5% |
| 疲劳 | 3% | 2% |
| 肌肉骨骼系统 | ||
| 关节痛 | 8% | 6% |
| 断裂 | 2% | 1% |
| 腿痛 | 4% | 2% |
| 手臂痛 | 2% | 1% |
| 神经系统 | ||
| 头晕 | 3% | 2% |
| 皮肤和附属物 | ||
| 瘙痒 | 2% | 1% |
| 皮炎 | 2% | 1% |
| 特殊感官 | ||
| 耳痛 | 2% | 1% |
基于年龄(65岁以下患者),性别或种族的不良反应发生率没有差异。
过敏性病例对照研究
一项回顾性病例对照研究调查了接受Xolair哮喘治疗的患者中发生Xolair过敏反应的危险因素。将对Xolair有过敏反应裁定史的病例与没有此类史的对照组进行比较。研究发现,Xolair过敏患者(30例中的57%)比对照组(88例中的23%)更常见于自我报告的食物,药物或其他原因引起的过敏史[OR 8.1,95%CI 2.7至24.3]。由于这是一项病例对照研究,因此该研究无法提供Xolair用户过敏反应的发生率。从其他来源,根据上市后的报告,在临床试验中有0.1%的患者出现了Xolair过敏反应,至少有0.2%的患者出现了过敏反应[见警告和注意事项(5.1) ,不良反应(6.3) ] 。
注射部位反应
在成人和青少年中,任何严重程度的注射部位反应在Xolair治疗的患者中发生率为45%,而在安慰剂治疗的患者中为43%。注射部位的反应类型包括:瘀伤,发红,发热,灼热,刺痛,瘙痒,蜂巢形成,疼痛,硬结,肿块和发炎。
与安慰剂组相比,在Xolair治疗的患者中更严重的注射部位反应发生的频率更高(12%对9%)。
大多数注射部位反应发生在注射后1小时内,持续时间少于8天,并且通常在随后的给药访视中频率降低。
6至<12岁哮喘儿童患者的临床研究不良反应
下述数据反映了安慰剂对照或其他对照哮喘研究中926名6至12岁以下患者的Xolair暴露,包括583名6个月的患者和292名1年或以上的患者。接受Xolair治疗的儿科患者的平均年龄为8.8岁;男性为69%,白人为64%。小儿患者每2或4周接受Xolair 75 mg至375 mg的治疗;对于分配给对照组的患者,接受或不接受安慰剂的标准治疗。在这些试验中,没有报道用Xolair治疗的患者发生恶性肿瘤。
在接受Xolair的小儿患者中,最常见的不良反应发生率≥3%,并且比接受安慰剂治疗的患者更常见:鼻咽炎,头痛,发热,上腹痛,咽炎链球菌,中耳炎,病毒性肠胃炎,节肢动物叮咬和鼻epi 。
最经常导致临床干预的不良事件(例如,停用Xolair或需要同时用药治疗不良事件)为支气管炎(0.2%),头痛(0.2%)和荨麻疹(0.2%)。在Xolair治疗的患者和对照组患者中观察到这些事件的发生率相似。
慢性特发性荨麻疹(CIU)患者的临床研究不良反应
Xolair治疗CIU的安全性在三项安慰剂对照的多剂量临床试验中进行了评估,这些试验分别为12周(CIU试验2)和持续24周(CIU试验1和3)。在CIU试验1和2中,患者在整个治疗期内,除了其基线水平的H1抗组胺药治疗外,每4周接受Xolair 75 mg,150 mg或300 mg或安慰剂治疗。在CIU试验中,除了基线水平的H1抗组胺药治疗外,每4周将3例患者随机分配至Xolair 300 mg或安慰剂。下述数据反映了三项临床试验中入选并接受至少一剂Xolair的733名患者接受Xolair暴露的情况,其中包括684名暴露于12周的患者和427名暴露于24周的患者。接受Xolair 300 mg的患者的平均年龄为43岁,女性为75%,白人为89%。接受Xolair 150 mg和75 mg的患者的人口统计学特征相似。
表6显示了接受Xolair(150或300 mg)的患者中≥2%发生的不良反应,并且比接受安慰剂的患者更频发。从试验2以及试验1和3的前12周收集不良反应。
| 不良反应* | CIU试验1、2和3汇总 | ||
|---|---|---|---|
| 150毫克 (n = 175) | 300毫克 (n = 412) | 安慰剂 (n = 242) | |
| |||
| 胃肠道疾病 | |||
| 恶心 | 2(1.1%) | 11(2.7%) | 6(2.5%) |
| 感染和侵扰 | |||
| 鼻咽炎 | 16(9.1%) | 27(6.6%) | 17(7.0%) |
| 鼻窦炎 | 2(1.1%) | 20(4.9%) | 5(2.1%) |
| 上呼吸道感染 | 2(1.1%) | 14(3.4%) | 5(2.1%) |
| 病毒性上呼吸道感染 | 4(2.3%) | 2(0.5%) | (0.0%) |
| 肌肉骨骼和结缔组织疾病 | |||
| 关节痛 | 5(2.9%) | 12(2.9%) | 1(0.4%) |
| 神经系统疾病 | |||
| 头痛 | 21(12.0%) | 25(6.1%) | 7(2.9%) |
| 呼吸,胸和纵隔疾病 | |||
| 咳嗽 | 2(1.1%) | 9(2.2%) | 3(1.2%) |
在试验1和3的24周治疗期间报告的其他反应[≥2%的患者接受Xolair(150 mg或300 mg)且比接受安慰剂的患者更频繁]包括:牙痛,真菌感染,尿路感染,肌痛,四肢疼痛,肌肉骨骼疼痛,外周水肿,发热,偏头痛,窦性头痛,焦虑,口咽痛,哮喘,荨麻疹和脱发。
注射部位反应
在研究期间,更多的Xolair治疗患者发生了任何严重程度的注射部位反应[300 mg时有11例患者(2.7%),150 mg时有1例患者(0.6%)],而安慰剂治疗的2例患者(0.8%)。注射部位反应的类型包括:肿胀,红斑,疼痛,瘀伤,瘙痒,出血和荨麻疹。这些事件均未导致研究中断或治疗中断。
哮喘患者临床研究中的心脑血管事件
一项≥5年的观察性队列研究在≥12岁,患有中度至重度持续性哮喘且对多年生气变应原的皮肤试验反应阳性的患者中进行,以评估Xolair的长期安全性,包括恶性肿瘤的风险[参见警告和注意事项(5.2) 。该研究共纳入5007名接受Xolair治疗的患者和2829名未接受Xolair治疗的患者。在两个队列中,当前吸烟者(5%)或以前吸烟者(29%)的患者百分比相似。患者平均年龄为45岁,平均随访时间为3.7年。与未经Xolair治疗的患者(23%)相比,被Xolair治疗的患者被诊断出患有严重哮喘(50%),并且44%的患者过早中断了研究。此外,在接受Xolair治疗的队列中,有88%的患者此前曾平均接受Xolair暴露8个月。
与未经Xolair治疗的患者(8.1)相比,在Xolair治疗的患者(13.4)中观察到总体心血管和脑血管严重不良事件(SAE)的发生率更高(每1000患者-年)。短暂性脑缺血发作(0.7比0.1),心肌梗塞(2.1比0.8),肺动脉高压(0.5比0),肺栓塞/静脉血栓形成(3.2比1.5)和不稳定型心绞痛(2.2比1.4)的发生率增加。 ,而在两个研究队列中观察到的缺血性卒中和心血管死亡的发生率相似。结果表明,用Xolair治疗的患者发生严重心血管和脑血管事件的风险可能增加。但是,观察性研究设计,先前接触Xolair的患者(88%),治疗组之间心血管风险因素的基线失衡,无法调整未测风险因素以及较高的研究中断率限制了量化风险的大小。
进行了25项为期8至52周的随机双盲,安慰剂对照临床试验的汇总分析,以进一步评估上述观察性队列研究中指出的心血管和脑血管SAE的失衡。汇总分析总共包括3342名接受Xolair治疗的患者和2895名接受安慰剂治疗的患者。患者平均年龄为38岁,平均随访时间为6.8个月。上面列出的心脑血管和脑血管SAE发生率未发现明显的失衡。但是,汇总分析的结果是基于事件数量少,患者年龄较小,随访时间比观察性队列研究短的。因此,结果不足以证实或拒绝观察性队列研究中指出的发现。
免疫原性
与所有治疗性蛋白质一样,具有免疫原性的潜力。抗体形成的检测高度依赖于测定的灵敏度和特异性。另外,在测定中观察到的抗体(包括中和抗体)阳性的发生率可能受到几个因素的影响,这些因素包括测定方法,样品处理,样品收集的时机,伴随用药和基础疾病。由于这些原因,将下述研究中的奥马珠单抗抗体的发生率与其他研究或其他产品中抗体的发生率进行比较可能会产生误导
在临床研究中,在接受Xolair治疗的患者中约有1/1723(<0.1%)的患者中检测到针对Xolair的抗体,该研究评估了12岁及以上患者的哮喘批准情况。在三项儿科研究中,在用Xolair治疗的581名6至<12岁的患者中,有1名患者检测到Xolair抗体,并评估了抗体。在CIU 3期临床试验中治疗的患者中没有可检测到的抗体,但是由于在进行抗治疗性抗体采样时Xolair的水平以及某些患者的样品缺失,因此只能在88%的人群中确定针对Xolair的抗体在这些临床研究中治疗的733例患者中。数据反映了在ELISA分析中测试结果被认为对Xolair抗体呈阳性的患者百分比,并且高度依赖于分析的敏感性和特异性。
上市后经验
在Xolair的12岁及以上成人和青少年患者的批准后使用过程中,已发现以下不良反应。由于这些反应是从不确定大小的人群中自愿报告的,因此并非总是能够可靠地估计其发生频率或建立与药物暴露的因果关系。
过敏反应:根据自发报告,从2003年6月至2006年12月,估计有约57,300例患者暴露,使用Xolair引起的过敏反应频率估计至少占患者的0.2%。过敏反应的诊断标准是皮肤或粘膜组织受累,气道受损和/或血压降低(有或没有相关症状),以及与Xolair给药的暂时关系,无其他可查明原因。这些报告病例的体征和症状包括支气管痉挛,低血压,晕厥,荨麻疹,咽喉或舌头血管性水肿,呼吸困难,咳嗽,胸闷和/或皮肤血管性水肿。据报道有89%的病例有肺部受累。据报道14%的患者出现低血压或晕厥。报告的病例中有15%住院。据报道有24%的病例与Xolair无关的过敏反应史。
在已报告的Xolair过敏反应病例中,第一剂发生39%,第二剂发生19%,第三剂发生10%,其余均在随后的剂量之后。 1例在39剂后发生(连续治疗19个月后,在3个月的间隔后重新开始治疗时出现过敏反应)。在这些情况下,发生过敏反应的时间最长为3分钟的30分钟,超过16%的超过30分钟和60分钟,超过2%的超过60分钟和90分钟,超过90分钟和120分钟6%,大于5%的2小时至6小时,大于14%的大于6小时和12小时,大于8%大于12小时和24小时,以及大于24小时至5%的4天。在9%的病例中,发病时间未知。
接受过敏性反应的23例患者接受了Xolair的再治疗,有18例复发了类似的过敏性症状。另外,有4例以前仅患荨麻疹的患者在接受Xolair攻击后发生过敏反应。
嗜酸性疾病:已报道嗜酸性疾病[见警告和注意事项(5.5) ] 。
发烧,关节痛和皮疹:批准使用Xolair后,据报有星座和症状群,包括关节炎/关节炎,皮疹(荨麻疹或其他形式),发烧和淋巴结病,类似于血清病[见警告和注意事项(5.6 ) ] 。
血液学:已报道严重血小板减少症。
皮肤:有脱发的报道。
药物相互作用
Xolair尚未进行正式的药物相互作用研究。
在哮喘患者中,尚未评估Xolair与过敏原免疫疗法同时使用的评估
已知总共有8种药物与Xolair(omalizumab)相互作用。
- 1中度药物相互作用
- 7种次要药物相互作用
检查互动
已知与Xolair(omalizumab)相互作用的药物
注意:仅显示通用名称。
- 猫爪
- 紫锥菊
- 奥马他汀
- 维生素E
- 醋酸锌
- 氯化锌
- 葡萄糖酸锌
- 硫酸锌
Xolair(omalizumab)疾病相互作用
Xolair(omalizumab)与1种疾病的相互作用包括:
- 恶性肿瘤
药物相互作用分类
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |











