获取国外Cuvitru(皮下)药品价格,使用等信息,最快 24 小时回馈
Cuvitru(皮下)
Cuvitru(皮下)
什么是Cuvitru?
Cuvitru是由人血浆制成的无菌溶液。它包含可保护您免受各种疾病感染的抗体。
Cuvitru(用于皮下注射)用于治疗原发性免疫缺陷疾病。
Cuvitru还用于治疗慢性炎症性脱髓鞘性多发性神经病(一种自身免疫性疾病,其中免疫系统攻击神经,导致肌肉无力和麻木)。
Cuvitru也可用于本用药指南中未列出的目的。
重要信息
Cuvitru会引起血液凝块。该风险在老年人或患有血凝块,心脏问题或血液循环问题的人中最高。在长期卧床休息期间,使用避孕药或激素替代疗法时,或者在放置中央静脉(IV)导管时,血块也更有可能发生。
如果您出现胸痛,呼吸困难,心跳加快,麻木或无力,或手臂或腿肿胀,发热或变色,请立即致电医生。
这种药物也会损害肾脏,特别是如果您患有肾脏疾病或同时使用某些药物。如果您有肾脏问题的迹象,例如肿胀,体重迅速增加,排尿很少或没有,请立即告诉医生。
在服药之前
在以下情况下,您不应使用这种药物:
您对Cuvitru或血液制品有过敏反应;要么
您患有抗IgA抗体的Cuvitru A(IgA)缺乏症。
如果您曾经对聚山梨酯80产生过敏反应,或者您患有称为高脯氨酸血症(血液中某些氨基酸含量高)的疾病,则可能无法使用Cuvitru。
这种药物会引起血凝块或肾脏问题,尤其是在老年人或某些情况下的人。告诉医生您是否曾经:
心脏问题,血液循环问题或“浓血”;
中风或血块;
肾脏疾病;
糖尿病;
一种称为败血症的感染;
如果您使用雌激素(避孕药或激素替代疗法);
如果您长期卧床休息;要么
如果您有中央静脉(IV)导管。
如果您暴露于麻疹或前往该病常见的地区,则可能需要调整剂量。
告诉医生您是孕妇还是母乳喂养。
没有医疗建议,请勿给孩子服用这种药。
Cuvitru由捐赠的人血浆制成,可能含有病毒或其他传染性物质。对捐赠的血浆进行了测试和处理,以减少污染的风险,但是仍然存在传播疾病的可能性很小。向您的医生询问任何可能的风险。
Cuvitru如何服用?
使用输液泵将Cuvitru注入皮肤下。药物通过放置在皮肤下的导管进入人体。医护人员可能会教您如何自行正确使用药物。
有时每天服用Cuvitru,有时每1至2周一次。定期使用Cuvitru可以始终保持体内稳定量的药物。如果您在家中使用这种药物,请记下注射日期和时间以及将其注射到身体上的位置的日记。
必须缓慢使用Cuvitru,您可能需要使用多达8个不同的导管同时将这种药物注入不同的身体部位。您的医疗保健提供者会告诉您在身体上何处注射这种药物。每次注射时,请使用其他位置。请勿连续两次注射到同一位置。
阅读并认真遵循您的药物随附的所有使用说明。如果您不了解所有说明,请咨询您的医生或药剂师。
仅在准备好注射时才准备注射。如果药物浑浊,变色或有颗粒,请勿使用。致电您的药剂师购买新药。
请勿摇动药瓶,否则可能会损坏药物。
不要将Cuvitru注入静脉。
您需要经常进行血液检查。这种药物可能会影响您可能需要的某些其他医学检查的结果。告诉任何治疗您的医生您正在使用Cuvitru。
在室温下将Cuvitru存放在原始纸箱中。避免受热和光照。
您也可以将这种药物保存在冰箱的原始纸箱中。不要冷冻Cuvitru,如果冷冻了,请将其丢弃。
您需要在一定数量的月份内使用药物。这将取决于您储存药物的方式(在室温下或在冰箱中)。仔细按照药物随附的存储说明进行操作。问您的药剂师是否有疑问。
标签上的有效期过后,请丢弃所有未使用的药物。
每个小瓶(瓶)仅可使用一次。一次使用后将其扔掉,即使里面仍然有药物。
只能一次性使用一次性注射物品(针头,导管,导管),然后将其放入防刺穿的“尖头”容器中。遵循州或当地有关如何处置此容器的法律。请将其放在儿童和宠物接触不到的地方。
如果我错过剂量怎么办?
如果您错过剂量,请致电医生。
如果我服药过量怎么办?
寻求紧急医疗护理或致电1-800-222-1222,拨打毒药帮助热线。
使用Cuvitru时应避免什么?
使用Cuvitru时不要接种“活”疫苗。疫苗可能效果不佳,并且可能无法完全保护您免受疾病侵害。活疫苗包括麻疹,腮腺炎,风疹(MMR),轮状病毒,伤寒,黄热病,水痘(水痘),带状疱疹(带状疱疹)和鼻流感(流感)疫苗。
Cuvitru副作用
如果您有过敏反应迹象,请停止使用Cuvitru并获得紧急医疗救助:喘息,胸闷,呼吸困难;头晕,觉得自己可能会昏倒;脸,嘴唇,舌头或喉咙肿胀。
如果您有以下情况,请立即致电您的医生:
血细胞疾病-皮肤苍白或发黄,尿色深,发烧,意识模糊或虚弱;
肾脏问题-小便或无小便,肿胀,体重迅速增加,呼吸急促;
肺部疾病-胸部疼痛,呼吸困难,嘴唇,手指或脚趾呈蓝色;
新发感染的迹象-发烧并伴有严重的头痛,颈部僵硬,眼痛以及对光的敏感性增加;要么
血块的迹象-气短,深呼吸的胸痛,心律加快,身体一侧的麻木或无力,手臂或腿部肿胀,发热或变色。
常见的副作用可能包括:
喘息,呼吸困难;
注射药物时出现的疼痛,发红,瘀伤,发痒,肿胀或硬块;
发烧,疲倦,头晕;
恶心,呕吐,腹泻,腹胀,胃痛;
瘙痒,皮疹或其他皮肤问题;
感冒或流感症状,例如鼻塞,打喷嚏,喉咙痛,咳嗽;
头痛,偏头痛要么
身体任何地方都疼痛。
这不是副作用的完整列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响Cuvitru?
Cuvitru可能会损害肾脏,特别是如果您还使用某些药物来感染,癌症,骨质疏松症,器官移植排斥反应,肠道疾病或疼痛或关节炎(包括阿司匹林,泰诺,阿德维尔和阿列夫)。
其他药物可能会影响Cuvitru,包括处方药和非处方药,维生素和草药产品。告诉您的医生您目前所有的药物以及您开始或停止使用的任何药物。
版权所有1996-2018 Cerner Multum,Inc.版本:6.01。
注意:本文包含有关皮下免疫球蛋白的副作用信息。此页面上列出的某些剂型可能不适用于Cuvitru品牌。
对于消费者
适用于免疫球蛋白皮下:皮下溶液
警告
皮下途径(溶液)
警告:血栓形成免疫球蛋白产品(包括免疫球蛋白-hipp)可能发生血栓形成。危险因素可能包括:高龄,长期固定,高凝状态,静脉或动脉血栓形成史,使用雌激素,留置中央血管导管,高粘度和心血管危险因素。在没有已知危险因素的情况下可能会发生血栓形成。对于有血栓形成危险的患者,应以最小剂量和可行的输注速度给予免疫球蛋白-hipp。给药前确保患者有足够的水分。监测血栓形成的体征和症状,并评估有高粘度风险的患者的血液粘度。
需要立即就医的副作用
皮下免疫球蛋白(Cuvitru中包含的活性成分)及其所需的作用可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
皮下服用免疫球蛋白时,请立即咨询医生是否有以下任何副作用:
比较普遍;普遍上
- 皮肤起泡,结s,发炎,瘙痒或变红
- 发冷
- 咳嗽
- 龟裂,干燥,鳞屑状的皮肤
- 呼吸困难
- 头晕
- 面部肿胀
- 发热
- 头痛
- 恶心
- 嘈杂的呼吸
- 皮疹
- 胸闷
- 呕吐
发病率未知
- 搅动
- 焦虑
- 皮肤起泡,脱皮或松弛
- 血腥,黑色或柏油样的粪便
- 嘴唇,指甲或皮肤发蓝
- 模糊的视野
- 灼烧,爬行,发痒,麻木,刺,“针刺”或刺痛感
- 胸部不适或疼痛
- 皮肤下的血液收集
- 混乱
- 咳嗽有时会产生粉红色泡沫状的痰
- 意识或反应能力下降
- 尿量减少
- 深,深紫色的瘀伤
- 萧条
- 腹泻
- 困难,快速,嘈杂的呼吸
- 吞咽困难
- 快速,剧烈或不规则的心跳或脉搏
- 头痛,剧烈和跳动
- 高烧
- 荨麻疹或伤口,发痒
- 敌意
- 出汗增加
- 不规则,快速或缓慢或呼吸浅
- 易怒
- 关节或肌肉疼痛
- 头晕或昏厥
- 意识丧失
- 肌肉抽搐
- 紧张
- 胸部,腹股沟或腿部特别是小腿疼痛
- 皮肤疼痛,发红或肿胀
- 排尿困难或困难
- 皮肤苍白
- 敲打耳朵
- 眼睑或眼睛,面部,嘴唇或舌头周围浮肿或肿胀
- 体重快速增加
- 皮肤病变为红色,中心常为紫色
- 眼睛发红
- 癫痫发作
- 严重嗜睡
- 心跳缓慢
- 言语不清
- 咽喉痛
- 口腔或嘴唇上的疮,溃疡或白斑
- 脖子或背部僵硬
- 突然失去协调
- 手臂或腿突然,严重的虚弱或麻木
- 腿,脚踝或手肿胀
- 腺体肿胀
- 患处有压痛,疼痛,肿胀,发热,皮肤变色和明显的浅表静脉
- 劳累呼吸困难
- 原因不明的出血或瘀伤
- 异常出血或瘀伤
- 不寻常的嗜睡,迟钝,疲倦,虚弱或呆滞感
- 上胃痛
- 视力改变
不需要立即就医的副作用
可能会发生皮下免疫球蛋白的一些副作用,这些副作用通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 皮肤擦伤
发病率未知
- 背疼
- 移动困难
- 温暖的感觉
- 出汗增加
- 脱发或稀疏
- 肌肉抽筋
- 手臂或腿部疼痛
- 脸部,脖子,手臂发红,偶尔上胸部发红
- 皮肤变色
- 胃胀
- 关节肿胀
对于医疗保健专业人员
适用于免疫球蛋白皮下:皮下溶液
一般
最常见的不良事件是局部反应,头痛,腹泻,疲劳,背痛,恶心,四肢疼痛和咳嗽。 [参考]
本地
非常常见(10%或更多):局部反应(49%),输注部位红斑,注射部位疼痛
常见(1%至10%):注射部位肿胀,注射部位瘀伤
罕见(0.1%至1%):注射部位浮肿
上市后报告:输液部位溃疡[参考]
神经系统
非常常见(10%或更多):头痛(29.2%)
常见(1%至10%):偏头痛,头晕,嗜睡
罕见(0.1%至1%):灼热感
上市后报告:震颤,感觉异常[参考]
胃肠道
非常常见(10%或更多):腹泻(18.8%),恶心(12.2%),呕吐,腹痛
常见(1%到10%):上腹部疼痛,腹部不适,下腹疼痛[参考]
皮肤科
很常见(10%或更多):红斑(10.8%)
常见(1%至10%):皮疹,瘙痒,荨麻疹[参考]
过敏症
常见(1%至10%):过敏
售后报告:过敏性过敏反应(例如,面部或舌头和咽部肿胀,发热,发冷,头晕,高血压或血压变化,不适) [参考]
心血管的
常见(1%至10%):低血压
稀有(小于0.1%):热冲洗
上市后报告:胸部不适(包括胸痛),心动过速[参考]
其他
很常见(10%或更多):疲劳(12.5%)
常见(1%至10%):肢体疼痛,疼痛,挫伤,血肿
罕见(0.1%至1%):抗GAD抗体阳性
罕见(小于0.1%):血肿[参考]
呼吸道
很常见(10%或更多):咳嗽(10.4%)
常见(1%至10%):口咽痛
罕见(小于0.1%):鼻咽炎
上市后报告:呼吸困难,喉痉挛[参考]
肌肉骨骼
很常见(10%或更多):四肢疼痛
常见(1%至10%):背痛,关节痛,发冷,肌痛[Ref]
血液学
罕见(0.1%至1%):Coombs直接测试阳性[参考]
参考文献
1.“产品信息。Hizentra(皮下免疫球蛋白)。” CSL Behring,宾夕法尼亚州普鲁士国王。
2.“产品信息。Vivaglobin(皮下免疫球蛋白)。” ZLB Bioplasma Inc,加利福尼亚州格伦代尔。
3. Cerner Multum,Inc.“澳大利亚产品信息”。 00
4. Cerner Multum,Inc.“英国产品特性摘要”。 00
5.“产品信息。Cuvitru(皮下免疫球蛋白)。”百特医疗公司,伊利诺伊州迪尔菲尔德。
某些副作用可能没有报道。您可以将其报告给FDA。
行政
| 输液参数 | 前2次输液 | 随后的输液 | ||
|---|---|---|---|---|
| 耐心 <40公斤 | 耐心 ≥40公斤 | 耐心 <40公斤 | 耐心 ≥40公斤 | |
| ||||
| 卷 (mL /部位) | ≤20 | ≤60 | ≤60 | |
| 速率(mL /小时/部位) | 10至20 | ≤60 | ||
输注部位的选择:建议将CUVITRU皮下输注的部位是腹部,大腿,上臂或外侧髋。 CUVITRU可以注入多个输注部位。最多同时使用4个站点。输液部位应至少相距四英寸,以避免骨突出。每次管理都轮换网站。
每个部位的体积:要计算要使用的部位数量,请将要注入的总体积除以要注入的最大体积/部位(最多60 mL /部位)。通过使用多针给药套件可以促进在多个部位同时进行皮下输注。
输注速率:对于CUVITRU的前两次输注,建议的输注速率为10-20 mL / hr /部位。对于随后的输注,可以将输注速率提高到容许的60 mL / hr /部位(例如60 mL / hr /部位×2部位= 120 mL / hr)。对于利用4个输液部位的患者,所有部位相加的最大输液速率为240毫升/小时。
管理说明:
在准备和使用CUVITRU进行输注时,请使用无菌技术。
- 1。
- 检查小瓶:检查透明度,颜色和有效期。 [参见剂量和用法(2.1) ]
- 2。
- 准备输液:
- 收集用品:CUVITRU小瓶,辅助用品,尖锐的容器和输液泵。
- 准备一个干净的工作区。
- 洗手。
- 3。
- 准备CUVITRU:
- 用无菌酒精擦拭每个塞子并使其干燥。
- 转移到注射器中,最好使用排气钉。
- 将CUVITRU吸入注射器后,立即开始输液。由于硅化注射器可能形成颗粒,建议在2小时内完成给药。
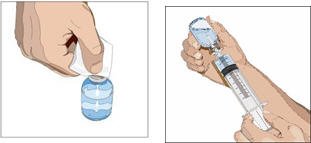
- 4。
- 准备输液泵和输液管:
- 按照制造商的说明灌注管道和泵。
- 将装满CUVITRU的注射器连接到针头上。
- 将针设置灌注到针座上。
- 5,
- 准备输液部位:
- 潜在的输注部位包括腹部,大腿,上臂或外侧髋。
- 避免:骨头区域,可见血管,疤痕和任何炎症(刺激)或感染区域。
- 输液部位的数量和位置取决于总剂量。
- 输液部位应至少相距4英寸。
- 在连续输注之间旋转身体部位。
- 从每个输液部位的中央开始,以圆周运动向外移动,用无菌酒精擦拭布清洁输液部位。让输液部位干燥。
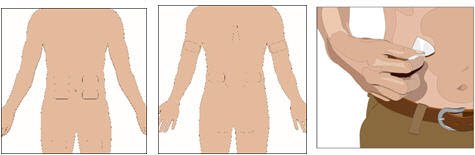
- 6。
- 插入并固定皮下针组:
- 用两根手指夹住至少一英寸的皮肤。以90度角将针头插入皮下组织,并用无菌胶带固定针头。
- 如果使用多个站点,请重复步骤。
- 用无菌保护敷料将针固定到位。
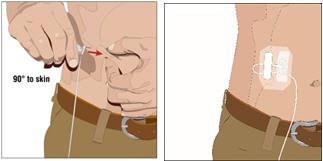
- 7。
- 根据开处方者的顺序开始灌注CUVITRU:
按照制造商的说明打开输液泵。 - 8。
- 从输液部位取下皮下注射针头:
输注完成后,取下针头套并盖上保护性敷料。根据当地要求丢弃任何部分用过的样品瓶和一次性耗材。 - 9。
- 记录输液:
从使用过的每个CUVITRU小瓶上取下剥离标签,并贴在患者的治疗记录或输液记录上。另外,记录每次输注后的时间,日期,剂量,输注部位位置和任何反应。
对于自我管理,请为患者提供在家中或其他适当场所进行输注的指导和培训。
- 免疫球蛋白产品(包括Cuvitru)可能发生血栓形成。危险因素可能包括高龄,长期固定,高凝状态,静脉或动脉血栓形成史,使用雌激素,留置血管导管,高粘度和心血管危险因素。
- 对于有血栓形成危险的患者,以可行的最小剂量和输注速度施用Cuvitru。给药前确保患者有足够的水分。监测血栓形成的体征和症状,并评估有高粘度风险的患者的血液粘度。
Cuvitru的适应症和用法
Cuvitru是一种免疫球蛋白皮下(人)(IGSC)的20%溶液,可作为2岁及以上的成年和小儿患者原发性体液免疫缺陷(PI)的替代疗法。这包括但不限于常见的可变免疫缺陷(CVID),X连锁无球蛋白血症,先天性无球蛋白血症,维斯科特-奥尔德里奇综合症和严重的合并免疫缺陷1,2 。
Cuvitru剂量和给药
仅用于皮下给药。不要静脉内或肌肉内给药。
准备和处理
- 给药前肉眼检查药品是否有颗粒物质和变色。 Cuvitru是澄清无色或浅黄色或浅棕色溶液,无颗粒物质。如果溶液浑浊,浑浊或含有颗粒,请勿使用。
- 请勿将Cuvitru与其他产品混合使用。
- 不要摇晃。
- 不要稀释。
- Cuvitru小瓶仅供一次性使用。输入的小瓶应立即使用。部分使用的小瓶应丢弃。 Cuvitru不含防腐剂。
- 在收件人的记录中记录产品的名称和批号。
剂量
- 每天至每两周(两周一次)可以定期施用Cuvitru。
- 根据患者的药代动力学和临床反应个体化剂量。
- 定期监测血清IgG谷值水平,以指导后续剂量调整和所需的给药间隔(请参阅“剂量调整” )。
对于从免疫球蛋白静脉(人)治疗(IGIV)转换的患者或从HYQVIA [免疫球蛋白10%(人)免疫球蛋白输注重组人透明质酸酶]转换的成年患者:
- 在患者最后一次注射IGIV或HYQVIA后一周,开始使用Cuvitru治疗。
- 通过将每月的IGIV或HYQVIA剂量转换为等效的每周剂量并使用剂量调整因子增加剂量来建立初始每周剂量。
- 要计算每周的初始剂量,请将先前的IGIV或HYQVIA剂量(以克为单位)除以静脉内剂量之间的周数;然后将此剂量乘以1.30的剂量调整系数。
每周初始剂量= 先前的IGIV或HYQVIA剂量(以克为单位) ×1.30 IGIV或HYQVIA剂量之间的周数 - 要将剂量(以克为单位)转换为毫升(mL),请将计算出的剂量(以克为单位)乘以5。
- 当以稳定状态定期给药时,一周,一周一次或两周一次的剂量可达到相似的暴露水平。
- 要确定其他常规给药间隔的剂量:
- ‒
- 频繁给药(每周2-7次):将计算出的每周剂量除以所需的每周次数。
- ‒
- 每两周一次给药:将计算出的每周剂量乘以2。
要指导剂量调整,请参阅剂量调整(表1)部分。
对于从免疫球蛋白皮下(人)治疗(IGSC)转换的患者:
- 建议Cuvitru的每周剂量(以克为单位)与先前IGSC治疗的每周剂量(以克为单位)相同。
- 当以稳定状态定期给药时,一周或一周一次或两周一次的剂量可达到相似的暴露水平。
- 要确定其他常规给药间隔的剂量:
- ‒
- 频繁给药(每周2-7次):将计算出的每周剂量除以所需的每周次数。
- ‒
- 每两周一次给药:将计算出的每周剂量乘以2。
- 要将剂量(以克为单位)转换为毫升(mL),请将计算出的剂量(以克为单位)乘以5。
要指导剂量调整,请参阅剂量调整(表1)部分。
剂量调整:
为了指导剂量调整,请在皮下治疗期间计算患者的目标血清IgG谷水平与IgG谷水平之间的差异。在表1中找到此差异,并根据患者的体重增加或减少每周/每两周一次剂量的相应量(以mL为单位)。如果测得的谷值与目标谷值之间的差小于100毫克/分升,则无需进行调整。但是,患者的临床反应应是剂量调整的主要考虑因素。
| 体重 | ||||||
|---|---|---|---|---|---|---|
| 与目标血清IgG谷值水平的差异 | 投药频率 | 30公斤 | 50公斤 | 70公斤 | 90公斤 | 110公斤 |
| ||||||
| 100毫克/分升 | 每周 | 3毫升 | 5毫升 | 7毫升 | 9毫升 | 11毫升 |
| 每两周一次 | 6毫升 | 10毫升 | 13毫升 | 17毫升 | 21毫升 | |
| 200毫克/分升 | 每周 | 6毫升 | 10毫升 | 13毫升 | 17毫升 | 21毫升 |
| 每两周一次 | 12毫升 | 19毫升 | 27毫升 | 35毫升 | 42毫升 | |
| 300毫克/分升 | 每周 | 9毫升 | 14毫升 | 20毫升 | 26毫升 | 32毫升 |
| 每两周一次 | 17毫升 | 29毫升 | 40毫升 | 52毫升 | 63毫升 | |
实施例1:每周治疗的体重为70kg的患者的测得的IgG谷水平为600毫克/ dL,目标谷水平为800毫克/ dL。所需的目标槽水平差为200毫克/分升(800毫克/分升减去600毫克/分升)。 Cuvitru的每周剂量应增加13 mL。
实施例2:每两周一次治疗的体重为50kg的患者的测量的IgG谷为900毫克/ dL,目标谷水平为700毫克/ dL。所需的目标槽水平差为200毫克/分升(900毫克/分升减去700毫克/分升)。 Cuvitru的双周剂量应减少19 mL。
行政
| 输液参数 | 前2次输液 | 随后的输液 | ||
|---|---|---|---|---|
| 耐心 <40公斤 | 耐心 ≥40公斤 | 耐心 <40公斤 | 耐心 ≥40公斤 | |
| ||||
| 卷 (mL /部位) | ≤20 | ≤60 | ≤60 | |
| 速率(mL /小时/部位) | 10至20 | ≤60 | ||
输液部位的选择:建议将Cuvitru皮下输注的部位是腹部,大腿,上臂或侧髋。 Cuvitru可以注入多个输注部位。最多同时使用4个站点。输液部位应至少相距四英寸,以避免骨突出。每次管理都轮换网站。
每个部位的体积:要计算要使用的部位数量,请将要注入的总体积除以要注入的最大体积/部位(最多60 mL /部位)。通过使用多针给药套件可以促进在多个部位同时进行皮下输注。
输注速度:对于Cuvitru的前两次输注,建议的输注速度为10-20 mL / hr /部位。对于随后的输注,可以将输注速率提高到容许的60 mL / hr /部位(例如60 mL / hr /部位×2部位= 120 mL / hr)。对于利用4个输液部位的患者,所有部位相加的最大输液速率为240毫升/小时。
管理说明:
在准备和使用Cuvitru进行输注时,请使用无菌技术。
- 1。
- 检查小瓶:检查透明度,颜色和有效期。 [参见剂量和用法(2.1) ]
- 2。
- 准备输液:
- 收集补给品:Cuvitru小瓶,辅助补给品,利器容器和输液泵。
- 准备一个干净的工作区。
- 洗手。
- 3。
- 准备Cuvitru:
- 用无菌酒精擦拭每个塞子并使其干燥。
- 转移到注射器中,最好使用排气钉。
- 将Cuvitru吸入注射器后,立即开始输液。由于硅化注射器可能形成颗粒,建议在2小时内完成给药。

- 4。
- 准备输液泵和输液管:
- 按照制造商的说明灌注管道和泵。
- 将装满Cuvitru的注射器连接到针头上。
- 将针设置灌注到针座上。
- 5,
- 准备输液部位:
- 潜在的输注部位包括腹部,大腿,上臂或外侧髋。
- 避免:骨头区域,可见血管,疤痕和任何炎症(刺激)或感染区域。
- 输液部位的数量和位置取决于总剂量。
- 输液部位应至少相距4英寸。
- 在连续输注之间旋转身体部位。
- 从每个输液部位的中央开始,以圆周运动向外移动,用无菌酒精擦拭布清洁输液部位。让输液部位干燥。

- 6。
- 插入并固定皮下针组:
- 用两根手指夹住至少一英寸的皮肤。以90度角将针头插入皮下组织,并用无菌胶带固定针头。
- 如果使用多个站点,请重复步骤。
- 用无菌保护敷料将针固定到位。

- 7。
- 根据开处方者的顺序开始注入Cuvitru:
按照制造商的说明打开输液泵。 - 8。
- 从输液部位取下皮下注射针头:
输注完成后,取下针头套并盖上保护性敷料。根据当地要求丢弃任何部分用过的样品瓶和一次性耗材。 - 9。
- 记录输液:
从每个使用过的Cuvitru小瓶上取下剥离标签,并贴在患者的治疗记录或输液记录上。另外,记录每次输注后的时间,日期,剂量,输注部位位置和任何反应。
对于自我管理,请为患者提供在家中或其他适当场所进行输注的指导和培训。
剂型和优势
Cuvitru是一种200 mg / mL(20%)的蛋白质溶液,用于皮下输注。
禁忌症
- Cuvitru禁忌于对人免疫球蛋白的皮下给药产生过敏性或严重的全身超敏反应的患者。
- Cuvitru在具有IgA抗体且对人类免疫球蛋白治疗过敏的病史的IgA缺陷患者中禁用。
警告和注意事项
过敏症
即使在先前接受人类免疫球蛋白治疗的患者中,也可能发生严重的超敏反应。如果发生超敏反应,请立即停止Cuvitru输注并采取适当的治疗措施。
Cuvitru含有痕量的IgA(平均浓度为80 mcg / mL)。服用Cuvitru的患者,具有已知抗IgA抗体的患者更有可能发生潜在的严重超敏反应,包括过敏反应。
肾功能不全/衰竭
使用免疫球蛋白治疗可能会发生急性肾功能不全/衰竭,急性肾小管坏死,近端肾小管肾病,渗透性肾病和死亡,尤其是那些含有蔗糖3,4的患者。 Cuvitru不包含蔗糖。在开始注入Cuvitru之前,请确保患者的体液没有耗尽。在因先前存在的肾功能不全或易患急性肾衰竭而有发展为肾功能不全的风险的患者中(例如糖尿病,年龄大于65岁,体质衰竭,败血症,副蛋白血症或接受已知肾毒性药物的患者),监护仪并考虑降低肾功能,更频繁用药。 [参见剂量和用法(2.1) ]
定期监测肾功能和尿量在倾向于发展为急性肾衰竭的风险较高的患者中尤其重要。在初次输入Cuvitru之前以及之后的适当间隔内,评估肾脏功能,包括测量血尿素氮(BUN)和血清肌酐。如果肾功能恶化,请考虑停用Cuvitru。 [参见剂量和用法(2.3) ]
血栓形成
用免疫球蛋白产品治疗后可能会发生血栓形成。 5,6危险因素可能包括高龄,长时间固定,高凝状态,静脉或动脉血栓形成史,使用雌激素,留置中央血管导管,高粘度和心血管危险因素。在没有已知危险因素的情况下可能会发生血栓形成。
考虑对存在高粘度风险的患者(包括患有冷球蛋白,空腹乳糜血症/高甘油三酸酯(甘油三酸酯)或单克隆血友病患者)进行血液粘度的基线评估。对于有血栓形成危险的患者,以可行的最小剂量和输注速度施用Cuvitru。给药前确保患者有足够的水分。监测血栓形成的体征和症状,并评估有高粘度风险的患者的血液粘度。 [请参阅带框警告,剂量和用法(2.1) ,患者咨询信息(17) ]
无菌性脑膜炎综合症(AMS)
已经报道了使用免疫球蛋白的AMS。综合征通常在免疫球蛋白治疗后数小时至两天内开始。女性患者可能会更频繁地发生AMS。
AMS的特征是以下症状和体征:剧烈头痛,颈部僵硬,嗜睡,发烧,畏光,眼部疼痛,恶心和呕吐。 [请参阅患者咨询信息(17) ]脑脊液(CSF)研究经常显示,每毫米3最多有数千个细胞存在胞吞作用,主要来自粒细胞系列,蛋白水平升高至数百毫克/分升,但培养结果阴性。对表现出此类体征和症状的患者进行彻底的神经系统检查,包括脑脊液检查,以排除脑膜炎的其他原因。中止治疗导致AMS在数天内无后遗症的缓解。
溶血
Cuvitru可能包含可能充当溶血素的血型抗体,并诱导免疫球蛋白在体内形成红细胞(RBC)涂层。这可能会导致直接抗球蛋白测试阳性[DAT(库姆氏测试)] 7,8 。由于RBC螯合增强,Cuvitru治疗后可能会出现延迟性溶血性贫血。急性溶血与血管内溶血一致,可发生7-11 。
以下危险因素可能与溶血的发展有关:高剂量(例如,≥2克/千克,单次给药或几天内分批给药)和非O型血型7、11 。个别患者潜在的炎症状态可能会增加溶血的风险7,但其作用尚不确定10,12 。
监视患者的溶血的临床体征和症状,尤其是具有上述危险因素的患者。考虑对高危患者进行适当的实验室检查,包括在输注前以及输注后约36至96小时内测量血红蛋白或血细胞比容。
输血相关的急性肺损伤(TRALI)
在用免疫球蛋白产品治疗后的患者中已报告了非心源性肺水肿(TRALI)。 TRALI的特征是严重的呼吸窘迫,肺水肿,低氧血症,左心室功能正常和发烧。症状通常在治疗后1至6个小时内发生。
监测患者的肺部不良反应。如果怀疑是TRALI,则对产品和患者血清中是否存在抗中性粒细胞和抗HLA抗体进行适当的测试。可以通过氧气治疗和足够的呼吸支持来控制TRALI。
传染性传染病
由于Cuvitru是由人类血液制成的,因此可能具有传播传染原的风险,例如病毒,变种的Creutzfeldt-Jakob病(vCJD)病原体,以及理论上讲的Creutzfeldt-Jakob病原体。这也适用于未知或新兴病毒和其他病原体。没有确诊的病毒传播或vCJD病例与Cuvitru相关。
医生或其他医疗保健提供者应将医生认为可能已由该产品传播的所有感染报告给Baxalta US Inc.,电话为1-800-423-2090。
监控:实验室测试
- 定期监测肾功能和尿量在倾向于发展为急性肾功能衰竭的风险较高的患者中尤其重要。在首次输注Cuvitru之前和之后的适当间隔,评估肾脏功能,包括测量BUN和血清肌酐。
- 考虑高粘度风险患者的血液粘度基线评估,包括那些患有球蛋白,空腹乳糜血症/高甘油三酸酯(甘油三酸酯)或单克隆血友病的患者,因为可能增加血栓形成风险3,5 。
- 如果在输注Cuvitru后出现溶血的迹象和/或症状,请进行适当的实验室测试以确认。
- 如果怀疑是TRALI,则对产品和患者血清中是否存在抗中性粒细胞抗体和抗HLA抗体进行适当的测试。
干扰实验室测试
- 输注IgG后,患者血液中各种被动转移的抗体的短暂升高可能会产生假阳性的血清学检测结果,并可能引起误解。抗红细胞抗原(例如A,B和D)的抗体的被动传递可能会导致直接或间接抗球蛋白(Coombs')测试阳性。
- 在检测β-D-葡聚糖以诊断真菌感染时,使用Cuvitru可能会导致检测结果出现假阳性。在产品注入后的几周内,这种情况可能会持续。
不良反应
在≥5%的受试者中观察到最常见的不良反应是:局部不良反应,全身性不良反应,包括头痛,恶心,疲劳,腹泻和呕吐。
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在一种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映在临床实践中观察到的不良反应率。
在两项前瞻性,开放标签,非对照,多中心研究中,对Cuvitru进行了皮下给药,以评估原发性免疫缺陷(PI)患者的疗效,安全性,耐受性和药代动力学。一项研究在北美进行,另一项研究在欧洲进行。
北美研究
在北美进行的一项临床研究中,接受Cuvitru治疗的74位受试者中有67位完成了研究,其中包括20/21位年龄在2至<16岁之间的受试者。在终止使用Cuvitru治疗的7名受试者中,有1名受试者由于疲劳(评估为无相关性)退出,1名受试者因不依从退出,而5名受试者因个人原因退出。
在临床研究期间,总共进行了4327次Cuvitru输液。用Cuvitru治疗期间未发生严重不良反应; 278次非严重不良反应发生,每次输注率为0.06。在4327次Cuvitru输注中,99.3%(276/278)的不良反应为轻度或中度且短暂的。在278个非严重不良反应(不包括感染)中,有83%(231/278)被定为轻度,16%(45/278)被定为中度,1%(2/278,有咯血和腹痛)很严重
表3显示了≥5%的受试者发生的不良反应(定义为在输注过程中或注射后72小时内发生的不良事件,或研究期内发生的任何因果相关事件)。没有受试者因局部不良反应而中断治疗。
| 不良反应 | 按主题 N(%) † (N = 74个科目) | 通过输液 N(比率) ‡ (N = 4327输液) |
|---|---|---|
| ||
| 局部不良反应 | 23(31.1%) | 96(0.022) |
| 系统性不良反应 | 41(55.4%) | 182(0.042) |
| 头痛 | 10(13.5%) | 50(0.012) |
| 恶心 | 9(12.2%) | 16(0.004) |
| 疲劳 | 6(8.1%) | 9(0.002) |
| 腹泻 | 5(6.8%) | 5(0.001) |
| 呕吐 | 4(5.4%) | 5(0.001) |
在研究的第1部分中,对静脉注射免疫球蛋白的全身性不良反应的发生率为0.302,而使用Cuvitru治疗期间的发生率为0.042。 Cuvitru系统性不良反应发生率比免疫球蛋白静脉注射发生率低约7倍。
局部不良反应:最常见的局部不良反应在表4中按频率列出。在96例局部不良反应中,100%的严重程度为轻度(92.5%)或中度(7.5%)。没有严重的局部不良反应的报道。在临床研究期间,在68.9%(51/74)的受试者和98.2%(4247/4327)的输注物中未观察到局部不良反应。临床研究期间局部不良反应(不包括感染)的总体发生率为0.022(轻度为0.021,中度为0.002)。局部不良反应的发生率与输注速度或每个部位的体积增加无关。
| 大事记 | 不良反应总数 | 按主题 氮(%) * (N = 74个科目) | 通过输液 N(比率) † (N = 4327输液) | |
|---|---|---|---|---|
| 轻度 | 中等 | |||
| ||||
| 疼痛 | 33 | 3 | 15(20.3%) | 36(0.008) |
| 红斑 | 22 | 1个 | 8(10.8%) | 23(0.005) |
| 瘙痒 | 7 | 1个 | 4(5.4%) | 8(0.002) |
欧洲研究
在欧洲的一项临床试验中,在48位受试者中评估了Cuvitru治疗期间的疗效和安全性。给予Cuvitru的中位治疗时间为358天(范围:127.0-399天),平均(±SD)为347.4±47.9天。 Cuvitru治疗:用Cuvitru治疗的45/48位受试者完成了研究,其中包括2 / <18岁的23/25位受试者。
在这项临床研究期间,总共进行了2349次Cuvitru输注。用Cuvitru治疗期间未发生严重的不良反应。总共报告了176例局部不良反应和205例全身性不良反应(不良反应定义为在输注过程中或输注72小时内发生的不良事件或研究期内发生的任何因果相关事件),但不包括感染。在205例全身性反应中,大多数(134)为轻度,70例为中度,一个事件为重度(头痛,评估为暂时相关,无因果关系)。 Cuvitru治疗期间的全身不良反应(不包括感染)发生率为0.087,每次输注相关的全身AE(不包括感染)发生率为0.032。在研究部分1中,以IGIV 10%治疗期间,相关全身性AE(不包括感染)的发生率为每次输注0.173个事件。 Cuvitru相关的全身不良事件发生率比免疫球蛋白静脉注射发生率低约5倍。
| 不良反应 | 按主题 N(%) † (N = 48个科目) | 通过输液 N(比率) ‡ (N = 2349次输注) |
|---|---|---|
| ||
| 局部不良反应 | 18(37.5%) | 176(0.075) |
| 系统性不良反应 | 33(68.8%) | 205(0.087) |
| 头痛 | 14(29.2%) | 59(0.025) |
| 腹泻 | 9(18.8%) | 58(0.025) |
| 咳嗽 | 5(10.4%) | 7(0.003) |
| 疲劳 | 6(12.5) | 8(0.003) |
| 关节痛 | 3(6.3%) | 5(0.002) |
| 口咽痛 | 3(6.3%) | 3(0.001) |
局部不良反应:在总共176种局部不良反应中(不良反应定义为在输注过程中或输注72小时内发生的不良事件或在研究期内发生的任何因果相关事件),没有严重的不良反应。总共175例不良反应(99.4%)为轻度,1例不良反应(0.6%)为中度。每次输注局部不良反应的总发生率为0.075。最常见的反应(按受试者)是输液部位疼痛,输液部位红斑和输液部位瘙痒。
| 大事记 | 不良反应总数 | 按主题 氮(%) * (N = 48个科目) | 通过输液 N(比率) † (N = 2349次输注) | |
|---|---|---|---|---|
| 轻度 | 中等 | |||
| ||||
| 疼痛 | 34 | 0 | 10(20.8%) | 34(0.014) |
| 红斑 | 54 | 0 | 10(20.8%) | 54(0.023) |
| 瘙痒 | 30 | 0 | 7(14.6%) | 30(0.013) |
| 肿胀 | 46 | 0 | 4(8.3%) | 46(0.020) |
上市后经验
由于不良反应的售后报告是自愿的,并且来自人群大小不确定,因此,始终无法可靠地估计这些反应的频率或建立与产品暴露的因果关系。
免疫球蛋白产品的上市后经验
在皮下注射免疫球蛋白产品上市后使用期间,已经确认并报告了以下不良反应:
| 免疫系统疾病 | 过敏反应 |
| 心脏疾病 | 心动过速 |
| 神经系统疾病 | 震颤和感觉异常 |
| 呼吸,胸和纵隔疾病 | 呼吸困难和喉痉挛 |
| 一般疾病和给药部位情况 | 注射部位反应(如硬结和发热)和胸部不适 |
药物相互作用
抗体的被动转移可能会暂时削弱对减毒活疫苗(例如腮腺炎,风疹和水痘)的免疫反应长达6个月,对麻疹(红疹)则持续一年或更长时间。告知免疫医生最近使用Cuvitru的治疗方法,以便采取适当的预防措施。 [请参阅患者咨询信息(17) ]
在特定人群中的使用
怀孕
风险摘要
没有人类数据可表明是否存在药物相关风险。 Cuvitru尚未进行动物繁殖研究。还不知道当Cuvitru给予孕妇时是否会造成胎儿伤害或会影响生殖能力。妊娠30周后,免疫球蛋白越来越多地从母体循环穿过胎盘。只有明确指出,才应将Cuvitru给予孕妇。在美国普通人群中,临床公认的怀孕中主要先天缺陷和流产的估计背景风险分别为2-4%和15-20%。
哺乳期
风险摘要
没有人类数据可表明是否存在药物相关风险。应当考虑母乳喂养对发育和健康的益处,以及母亲对Cuvitru的临床需求以及Cuvitru或潜在母体状况对母乳喂养婴儿的任何潜在不利影响。
儿科用
在一项多中心临床研究中,对21名PI(2至16岁)的儿科受试者进行了Cuvitru评估。安全性和有效性概况与成人受试者相似。达到所需的血清IgG水平不需要小儿专用剂量。
Cuvitru的安全性和有效性尚未在新生儿或2岁以下的婴儿中进行评估。
老人用
在9位65岁以上的受试者中对Cuvitru进行了评估。该组在安全性或疗效上均未见差异。
监测发生肾功能衰竭或血栓形成事件风险较高的患者。不要超过建议的剂量,并以可行的最小输注速度输注。 [请参阅带框的警告,警告和注意事项( 5.2、5.4)和剂量与用法(2.3) ]
Cuvitru说明
Cuvitru是高度纯化和浓缩的免疫球蛋白G(IgG)抗体的即用型无菌液体制剂。 IgG亚类的分布与正常血浆相似。 Fc和Fab功能在Cuvitru中保留。
Cuvitru的IgG纯度≥98%,pH值为4.6至5.1。重量克分子渗透压浓度为每公斤280-292摩尔渗透压浓度。 Cuvitru含有200毫克/毫升的蛋白质。免疫球蛋白A(IgA)的平均浓度为80 mcg / mL。 Cuvitru包含多种针对细菌和病毒制剂的IgG抗体。甘氨酸(0.25M)用作稳定剂和缓冲剂,并且不添加糖,钠或防腐剂。
Cuvitru由大量人血浆制成。使用改良的Cohn-Oncley冷乙醇分级分离工艺以及阳离子和阴离子交换色谱法从血浆库中纯化IgG制剂。
从供体选择过程开始对潜在传染原进行筛选,并在整个血浆收集和血浆制备过程中继续进行。仅在FDA批准的血液机构中收集用于生产Cuvitru的每个血浆捐赠,并通过FDA许可的血清学检测,以检测乙型肝炎表面抗原(HBsAg)和人类免疫缺陷病毒(HIV-1 / HIV-2)抗体)和丙型肝炎病毒(HCV)符合美国法规要求。作为一项额外的安全措施,通过FDA许可的核酸检测(NAT)测试了血浆的小池中HIV-1和HCV的存在,结果为阴性。
为了进一步提高安全边际的,经过验证的病毒失活/去除步骤已经被集成到制造和配制过程,即溶剂/去污剂(S / d)治疗13,35纳米纳滤,和低pH温育在升高的温度(30 °C至32°C)。 S / D过程包括在18°C至25°C下用磷酸三正丁酯,辛醇9和聚山梨酯80的有机混合物处理至少60分钟。 S / D处理可在几分钟内将被脂质包裹的病毒灭活至低于检测极限13 。乙醇分级分离过程提供了额外的病毒清除能力。
体外病毒加标研究已用于验证制造过程灭活和去除病毒的能力。为了确定制造过程中适用的最小病毒清除能力,这些病毒清除研究是在极端条件下进行的(例如,在最小S / D浓度,S / D处理的孵育时间和温度下)。
表7总结了根据良好实验室规范对Cuvitru进行的病毒清除研究。
| 病毒类型家族 | 包膜RNA | 包膜DNA | 非包膜RNA | 非包膜DNA | |||
|---|---|---|---|---|---|---|---|
| 逆转录病毒科 | 黄病毒科 | 疱疹病毒科 | 角膜科 | 细小病毒科 | |||
| 病毒 | HIV-1 | BVDV | 西尼 | PRV | 甲肝病毒 | 电磁兼容 | MMV |
| 缩写:HIV-1,人类免疫缺陷病毒1型; BVDV,牛病毒性腹泻病毒(丙型肝炎病毒和其他脂质包裹的RNA病毒模型); WNV,西尼罗河病毒; PRV,伪狂犬病病毒(脂质包裹的DNA病毒模型,包括乙型肝炎病毒); EMCV,脑心肌炎病毒(非脂质包膜RNA病毒模型,包括甲型肝炎病毒[HAV]); MMV,小鼠微小病毒(非脂质包膜DNA病毒模型,包括B19病毒[B19V]); nd(未完成),na(不适用)。 | |||||||
| |||||||
| 分馏 | > 5.1 | 1.3 | > 6.1 | > 4.9 | 3.9 | 4.2 | 4.9 |
| SD治疗 | > 4.5 | > 6.2 | 呐 | > 4.8 | nd | nd | nd |
| 35 nm纳滤 | > 4.5 | > 5.1 | > 6.2 | > 5.6 | 5.7 | 1.4 | 2.0 |
| 低pH值处理 | > 5.8 | > 5.5 | > 6.0 | > 6.5 | nd † | > 6.3 | 3.1 |
| 总体对数减少系数(ORF) | > 19.9 | > 18.1 | > 18.3 | > 21.8 | 9.6 † | > 11.9 | 10.1 |
Cuvitru-临床药理学
作用机理
Cuvitru提供针对多种细菌和病毒制剂的多种调理和中和IgG抗体。 Cuvitru还包含一系列能够与免疫系统细胞相互作用并改变其活性的抗体,以及能够与细胞(如红细胞)反应的抗体。这些抗体的作用和IgG在Cuvitru中的作用机理尚未完全阐明。
药效学
人正常的免疫球蛋白主要包含免疫球蛋白G(IgG)和广泛的抗感染因子抗体。人正常免疫球蛋白包含正常人群中存在的IgG抗体。它具有与天然人血浆中免疫球蛋白G亚类密切相关的分布。
适量的Cuvitru可使异常低的免疫球蛋白G水平恢复到正常范围。
药代动力学
在北美的一项临床研究中,对60名患有原发性免疫缺陷(PI)的受试者评估了皮下注射Cuvitru的药代动力学(PK)参数。 [参见临床研究(14) ]用对照产品[GAMMAGARD LIQUID,免疫球蛋白(人类),10%]静脉内治疗受试者13周,然后换成每周皮下注射Cuvitru。最初,以皮下注射剂量(静脉注射剂量的145%)对受试者进行长达12至16周的治疗。对15岁12岁以上的受试者进行了皮下注射和静脉注射的曲线下面积(AUC)比较。随后,如下所述,用该剂量治疗所有受试者12周,然后使用低谷IgG水平将所有受试者的剂量个体化。在该皮下剂量治疗约4个月后,对所有受试者进行PK评估。
在该剂量调节下,皮下Cuvitru与静脉内施用免疫球蛋白10%的AUC的几何平均比率为109%。皮下注射Cuvitru后79小时的几何平均值出现了最高IgG水平。
在研究的第4部分中,对60岁2岁及以上的受试者评估了Cuvitru的药代动力学参数。皮下施用Cuvitru的药代动力学参数示于表8中。与IGIV 10%给药相比(3周间隔2602 mg / dL和4周间隔2521 mg / dL),使用Cuvitru皮下治疗期间的IgG峰值中值较低(1809 mg / dL),与每周剂量较低相符与每3或4周静脉注射的剂量相比。相比之下,Cuvitru的几何平均谷值水平较高(1474 mg / dL),而静脉内给药的几何平均谷值水平(3周间隔为1158 mg / dL,4周间隔为1019 mg / dL),两者均较高每月剂量和更频繁的剂量。与IGIV间隔3至4周给药相比,每周皮下给药可产生相对稳定的稳态血清IgG水平。 Cuvitru的药代动力学参数在不同年龄组之间无显着差异。表9显示了不同年龄组Cuvitru的药代动力学参数。
| 参数 | 中位数(95%Cl) N = 60 |
|---|---|
| AUC [g *天/ L] | 115(110至121) |
| 表观清除率[mL / kg /天] | 1.86(1.80至2.17) |
| 最高C [mg / dL] | 1809(1745至2068) |
| C分钟[mg / dL] | 1477(1323至1535) |
| T max [小时] | 105(71至119) |
| 参数 | 年龄组 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 2至<5 (n = 1) 中位数 (95%CI) | 5至<12 (n = 10) 中位数 (95%CI) | 12至<16 (n = 5) 中位数 (95%CI) | 16至<65 (n = 37) 中位数 (95%CI) | ≥65 (n = 7) 中位数 (95%CI) | ||||||
| AUC [g *天/ L] | 106 (不适用) | 110 (87 已知总共有19种药物与Cuvitru(皮下免疫球蛋白)相互作用。
检查互动已知与Cuvitru相互作用的药物(皮下免疫球蛋白)注意:仅显示通用名称。
Cuvitru(皮下免疫球蛋白)疾病相互作用与Cuvitru(皮下免疫球蛋白)有两种疾病相互作用,包括:
药物相互作用分类
药物状态
美国日本医生 Heather Benjamin MD经验:11-20年  Heather Benjamin MD经验:11-20年  Suzanne Reitz MD经验:11-20年  Heather Miske DO经验:11-20年  Heather Miske DO经验:11-20年  渡邊剛经验:21年以上  村上和成 教授经验:21年以上  中山秀章 教授经验:21年以上  村田朗经验:21年以上  溝上裕士 医院教授经验:21年以上 | ||||||||





