获取国外Implanon药品价格,使用等信息,最快 24 小时回馈
Implanon
Implanon品牌在美国已经停产。如果该产品的通用版本已获得FDA批准,则可能有通用的等效版本。
什么是Implanon?
Implanon植入物包含Etonogestrel,这是一种防止排卵的激素(卵从卵巢释放)。依托孕酮还会引起宫颈粘液和子宫内膜的变化,使精子更难到达子宫,使受精卵更难附着在子宫上。
Implanon植入物用作避孕药以防止怀孕。药物包含在一根小的塑料棒中,该棒被植入上臂的皮肤中。该药物缓慢释放到体内。避孕棒可保持在原位,并持续避孕长达3年。
Implanon也可用于本用药指南中未列出的目的。
重要信息
如果您有以下任何一种情况,则不应使用Implanon:异常的阴道流血,肝脏疾病或肝癌,或者曾经患过乳腺癌或子宫癌,心脏病,中风或血凝块。
如果您怀孕或最近生过孩子,请不要使用。
使用Implanon植入物会增加血栓,中风或心脏病发作的风险,尤其是在您患有某些其他疾病或超重的情况下。
吸烟会大大增加您发生血栓,中风或心脏病发作的风险。如果您吸烟且年龄超过35岁,则不应使用Implanon。
接受Implanon植入物之前,请告诉医生您是否患有糖尿病,高血压,高胆固醇,胆囊疾病,肾脏疾病,卵巢囊肿,头痛,抑郁症史,体重超重或对麻木过敏药物。
Implanon植入物通过针头插入上臂的皮肤。药物从植入物缓慢释放到体内。植入物可以保留在原处,以提供长达3年的连续避孕。
使用Implanon植入物时,您很可能会有不规律且不可预测的时期。告诉您的医生,如果您的月经周期过长或持续时间太长,或者您错过了一个月经期(您可能已经怀孕)。如果需要手术或医学检查,或者卧床休息,则可能需要在短时间内取出Implanon植入物。任何对待您的医生或外科医生都应该知道您拥有Implanon植入物。
Implanon植入物必须在插入后的第三年年底之前移除,并且那时可以用新的植入物进行更换。如果您选择不更换植入物,那么您的怀孕能力将很快恢复。如果您想避免意外怀孕,请立即开始使用其他形式的节育方法。
在服药之前
使用Implanon可能会增加血液凝块,中风或心脏病发作的风险。如果您患有高血压,糖尿病,高胆固醇或超重,则您面临的风险更大。在使用这种药物的第一年,中风或血栓的风险最高。
吸烟会大大增加您发生血栓,中风或心脏病发作的风险。风险越大,年龄越大,吸烟就越多。如果您吸烟且年龄超过35岁,则不应使用这种药物。
如果您怀孕,请勿使用Implanon。如果您最近生过婴儿,则在接受Implanon植入物之前,至少要等待3周(如果是母乳喂养则要等待4周)。
接受植入物之前,您可能需要进行阴性妊娠试验。
如果您对Etonogestrel过敏或患有以下情况,则不应使用Implanon:
有心脏病,中风或血液凝块的病史;
与激素有关的癌症史,例如乳腺癌或子宫癌;
未经医生检查的异常阴道出血;要么
肝病或肝癌。
为确保Implanon对您安全,请告知您的医生是否患有:
糖尿病;
高胆固醇或甘油三酸酯,或者如果您超重;
高血压;
头痛
胆囊疾病
抑郁史;要么
如果您对麻醉药物过敏。
Implanon植入物不宜用于18岁以下的女孩。
如果您正在母乳喂养4周以下的婴儿,请勿使用植入物。
Implanon如何使用?
Implanon通过针头(在局部麻醉下)插入肘部内侧和上方的上臂皮肤。插入植入物后,手臂将被2条绷带覆盖。 24小时后取下顶部绷带,但将较小的绷带保留3至5天。保持该区域清洁干燥。
何时接受Implanon植入物的时间取决于您之前是否使用过节育措施以及使用哪种类型。
您应该能够感觉到皮肤下的植入物。如果植入物在任何时候都感觉不到,请告诉医生。
Implanon可以保留最多3年。如果正确放置了植入物,则无需使用备用避孕药。遵循医生的指示。
使用Implanon植入物时,您可能会经历不规则且不可预测的时期。告诉您的医生,如果您的月经周期过长或持续时间太长,或者您错过了一个月经期(您可能已经怀孕)。
如果需要手术或医学检查,或者卧床休息,则可能需要在短时间内取出Implanon植入物。任何对待您的医生或外科医生都应该知道您拥有Implanon植入物。
定期进行身体检查和乳房X线照片,并在使用Implanon时每月对乳房进行自我检查,看是否有肿块。
Implanon植入物必须在插入后的第三年年底之前移除,并且那时可以用新的植入物进行更换。移除植入物后,您的怀孕能力将迅速恢复。如果没有用新的植入物代替,如果您想防止怀孕,请立即开始使用另一种节育方法。
如果植入物在您的手臂上时可能弯曲或破裂,请立即致电医生。
Implanon剂量信息
通常的成人避孕剂量:
一枚68 mg植入物皮下插入。植入物不应放置超过三年。
Implanon植入物的插入时间必须根据患者的近期病史进行,如下所示:
如果在过去的一个月中以前没有使用过激素避孕药,即使该妇女仍在流血,也必须在第1至5天之间插入植入物(将月经的第一天算作“第1天”)。
如果从激素组合避孕药转换而来,则可以在最后一次使用活性药物(雌激素加孕激素)口服避孕药后7天内的任何时间,在NuvaRing的无环戒毒期7天(依托孕烯/乙炔雌二醇阴道环)的任何时间插入Implanon植入物),或在经皮避孕系统的7天无补丁期内的任何时间。
如果从仅使用孕激素的方法转换,则必须按以下方式插入植入物:如果从仅使用孕激素的药丸转换,则在一个月的任何一天(不要在最后一个药丸和插入之间跳过任何一天);如果从仅使用孕激素的植入物转换,则在去除避孕植入物的同一天插入植入物;如果从含孕激素的宫内节育器转换,则在摘除避孕植入物的同一天插入植入物;如果从避孕药具转用,则应在下一次注射的那一天插入植入物。
早孕流产或流产后:完全早孕流产后,可立即植入Implanon植入物。如果在早孕流产后的五天内未将其插入,请按照过去一个月未使用激素避孕药的说明进行操作。
分娩后或中期流产后:如果不是单纯母乳喂养,则可以在产后21至28天之间插入孕育植入物,或者在中期流产后21至28天之间植入Implanon植入物。如果经过了四个星期以上,则应排除妊娠,并且患者在插入后的前7天应使用非荷尔蒙的节育方法。如果患者仅用母乳喂养,则在产后第四周后插入植入物。
如果我错过剂量怎么办?
由于Implanon是由医疗保健专业人员植入的,因此您不会处于频繁的给药时间表。请确保在第三年年底前去看医生以取出植入物。
如果我服药过量怎么办?
如果植入物正确插入,则过量服用依托孕烯的可能性很小。
使用Implanon时应避免什么?
使用Implanon时请勿吸烟,特别是如果您年龄超过35岁。吸烟会增加因Implanon引起的血液凝块,中风或心脏病发作的风险。
Implanon不会保护您免受包括艾滋病毒和艾滋病在内的性传播疾病的侵害。使用安全套是保护自己免受这些疾病侵害的唯一方法。
Implanon副作用
如果您对Implanon有过敏反应,请寻求紧急医疗救助。呼吸困难;脸,嘴唇,舌头或喉咙肿胀。
如果您有以下情况,请立即致电您的医生:
植入植入物的位置是否温暖,发红,肿胀或渗出;
骨盆区域剧烈疼痛或绞痛(可能仅在一侧);
突然的麻木或虚弱(尤其是在身体的一侧),突然的剧烈头痛,说话含糊,视力或平衡问题;
突然咳嗽,喘息,呼吸急促,咳血;
一只或两只腿疼痛,肿胀,发热或发红;
胸痛或沉重感觉,疼痛蔓延至下巴或肩膀,恶心,出汗,全身不适;
您的手,脚踝或脚肿胀;
黄疸(皮肤或眼睛发黄);
乳房肿块要么
抑郁症状(睡眠问题,虚弱,疲倦的感觉,情绪变化)。
常见的Implanon副作用可能包括:
月经周期的变化;
轻度月经出血或斑点;
肚子痛;
乳房压痛;
粉刺;
体重增加;
阴道瘙痒或分泌物;要么
隐形眼镜的问题。
这不是完整的副作用列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响Implanon?
告诉您的医生您使用的所有药物,以及在Implanon放置期间您开始或停止使用的药物,尤其是:
波生坦
灰黄霉素
利福平
圣约翰草;
托吡酯
治疗艾滋病毒或艾滋病的药物;
巴比妥酸盐-丁巴比妥,司可巴比妥,苯巴比妥(Solfoton);要么
癫痫发作药物-卡马西平,非巴马特,奥卡西平,苯妥英钠。
此列表不完整。其他药物可能会与依托孕烯发生相互作用,包括处方药和非处方药,维生素和草药产品。本药物指南中并未列出所有可能的相互作用。
版权所有1996-2020 Cerner Multum,Inc.版本:3.06。
注意:本文档包含有关etonogestrel的副作用信息。此页面上列出的某些剂型可能不适用于品牌名称Implanon。
对于消费者
适用于依托孕酮:皮下植入物
我需要马上打电话给我的医生什么副作用?
警告/警告:尽管这种情况很少见,但有些人在服药时可能会有非常严重的副作用,有时甚至是致命的副作用。如果您有以下任何与严重不良副作用相关的症状或体征,请立即告诉医生或寻求医疗帮助:
- 过敏反应的迹象,如皮疹;麻疹;瘙痒;发红或发烧的皮肤发红,肿胀,起泡或脱皮;喘息胸部或喉咙发紧;呼吸,吞咽或说话困难;异常嘶哑或嘴,脸,嘴唇,舌头或喉咙肿胀。
- 出现肝脏问题的迹象,例如尿黑,感到疲倦,不饿,胃部或胃部不适,大便色浅,呕吐或皮肤或眼睛发黄。
- 高血压的迹象,例如非常头痛或头晕,昏倒或视力改变。
- 胆囊问题的迹象,例如右上腹部区域,右肩区域或肩blade骨之间的疼痛;皮肤或眼睛发黄;发烧发冷;腹胀或胃部不适或呕吐。
- 皮肤感染的迹象,如渗血,发热,肿胀,发红或疼痛。
- 身体一侧虚弱,说话或思考困难,平衡失调,面部一侧下垂或视力模糊。
- 抑郁或其他情绪变化。
- 视力改变或丧失,眼睛鼓胀或隐形眼镜的感觉改变。
- 乳房肿块,乳房疼痛或酸痛或乳头溢液。
- 流感样迹象。
- 阴道出血不正常。
- 这种药物可能会使您肿胀或使体内积水。告诉医生您是否有肿胀,体重增加或呼吸困难。
这种药物还有哪些其他副作用?
所有药物都可能引起副作用。但是,许多人没有副作用,或者只有很小的副作用。如果这些副作用或任何其他副作用困扰您或不消失,请致电您的医生或获得医疗帮助:
- 体重增加。
- 头晕或头痛。
- 青春痘(粉刺)。
- 阴道刺激。
- 月经(月经)改变。这些包括在周期之间或非常轻的周期之间发现斑点。
- 放置杆的地方有刺激感。
- 肚子痛。
- 喉咙发炎。
- 背疼。
- 胃部不适。
- 感到紧张和兴奋。
这些并非所有可能发生的副作用。如果您对副作用有疑问,请致电您的医生。打电话给您的医生,征求有关副作用的医疗建议。
您可以致电1-800-332-1088向FDA报告副作用。您也可以在https://www.fda.gov/medwatch报告副作用。
对于医疗保健专业人员
适用于依托孕酮:皮下植入物
泌尿生殖
非常常见(10%或更多):月经不调(37%),阴道炎(14.5%),乳房疼痛(12.8%)
常见(1%至10%):白带,痛经
罕见(0.1%至1%):尿路感染,排尿困难,生殖器排出,外阴不适,溢乳,乳房增大,瘙痒性生殖器
上市后报告:异位妊娠,乳腺溢液,卵巢囊肿[参考]
神经系统
非常常见(10%或更多):头痛(24.9%)
普通(1%至10%):头晕
罕见(0.1%至1%):偏头痛,嗜睡
上市后报告:抽搐[参考]
新陈代谢
很常见(10%或更多):体重增加(13.7%)
常见(1%至10%):食欲增加,体重减轻[参考]
皮肤科
非常常见(10%或更多):痤疮(14.8%)
常见(1%至10%):脱发
罕见(0.1%至1%):过度肥大,瘙痒,皮疹
上市后报告:血管性水肿,血管性水肿加重和/或遗传性血管性水肿加重,黄褐斑,皮脂溢,荨麻疹[参考]
胃肠道
非常常见(10%或更多):腹痛(10.9%)
常见(1%至10%):恶心,肠胃胀气
罕见(0.1%至1%):便秘,腹泻,呕吐[Ref]
呼吸道
非常常见(10%或更多):咽炎(10.5%)
上市后报告:鼻炎[参考]
本地
植入部位的并发症包括:瘀伤,轻微的局部刺激,疼痛,瘙痒,植入部位的纤维化,感觉异常或类似感觉异常的事件,疤痕,血肿,发红,肿胀和脓肿。
植入物的迁移很少发生到胸壁以及包括肺动脉的脉管系统内。一些迁移到肺动脉的患者报告有胸痛和/或呼吸困难,其他患者则无症状。 [参考]
常见(1%至10%):插入部位疼痛,植入部位并发症,注射部位反应
未报告频率:植入物排出或迁移[参考]
精神科
常见(1%至10%):情绪不稳定,抑郁,神经质,性欲下降
罕见(0.1%至1%):焦虑,失眠[Ref]
肌肉骨骼
常见(1%至10%):背痛
罕见(0.1%至1%):关节痛,肌肉骨骼疼痛,肌痛[Ref]
过敏症
常见(1%至10%):过敏
上市后报告:过敏反应[参考]
其他
常见(1%至10%):流感样症状,疼痛,潮热,疲劳
罕见(0.1%至1%):水肿,发热[参考]
心血管的
上市后报告:与临床相关的血压升高[参考]
参考文献
1.“产品信息。Nexplanon(依托孕烯)。”新泽西州西奥兰治的Organon Pharmaceuticals。
2.“产品信息。Implanon(依托孕烯)。”新泽西州西奥兰治的Organon Pharmaceuticals。
3. Cerner Multum,Inc.“澳大利亚产品信息”。 00
4. Cerner Multum,Inc.“英国产品特性摘要”。 00
某些副作用可能没有报道。您可以将其报告给FDA。
步骤2.识别插入部位,该部位位于肱骨内侧上con上方约8-10厘米(3-4英寸)的非优势上臂内侧,避免二头肌和肱二头肌之间的沟(沟)。肱三头肌和位于皮下组织深处的神经血管束中的大血管和神经(图3)。植入物应直接插入皮下[见警告和注意事项(5.1)]。
- 步骤3.用无菌标记物做两个标记:首先,标记将要插入依托孕烯植入物的位置,其次,在第一个标记附近几厘米处标记一个位置(图3)。此第二标记稍后将在插入过程中用作方向指南。
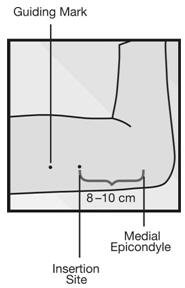
图3
- 步骤4.使用消毒液清洁插入部位。
- 步骤5.麻醉插入区域(例如,使用麻醉剂喷雾或沿计划的插入通道在皮肤正下方注入2 mL 1%利多卡因)。
- 第6步。从泡罩上取下装有植入物的无菌预装一次性IMPLANON涂抹器。保持IMPLANON针和杆无菌。如果对无菌性有疑问,请勿使用涂药器。如果发生污染,请使用新包装的IMPLANON和新的无菌涂抹器。
- 步骤7.将防护罩保持在针头上,并寻找IMPLANON杆,该针杆被视为针尖内的白色圆柱体。
- 步骤8.如果看不到IMPLANON杆,则将针头护罩的顶部紧贴固定表面,将植入物带入针头。
- 步骤9.目视确认后,通过将IMPLANON杆放回到针尖中,将其放回针中。然后在保持喷枪直立的同时取下针头护罩。
- 步骤10。请注意IMPLANON可能会掉出针头。因此,在卸下针头护罩之后,将涂抹器保持直立位置,直到插入为止
- 步骤11.用您的另一只手,用拇指和食指在插入部位周围拉伸皮肤(图4)。
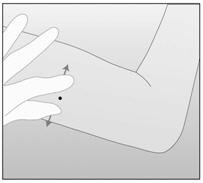
图4
- 步骤12.在一个很小的角度(不大于20°),仅插入与倾斜面朝上放入插入位点(图5)的针的尖端。
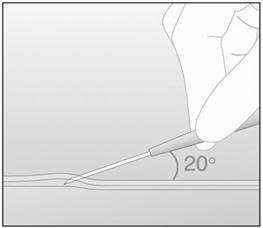
图5
- 步骤13.将施药器降低至水平位置。用针尖将皮肤提起,但将针保留在皮下结缔组织中(图6)。
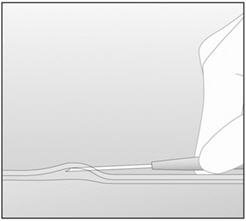
图6
- 步骤14.在“拉紧”(提起)皮肤的同时,将针头插入全长。插入过程中,使针头与皮肤表面平行(图7)。
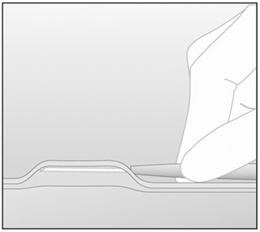
图7
步骤15.如果将IMPLANON放在很深的地方,则去除过程可能很困难或不可能。如果针未完全插入,植入物可能会从插入部位突出并掉出。
- 步骤16.通过按压填塞器支架,破坏涂药器的密封(图8)。
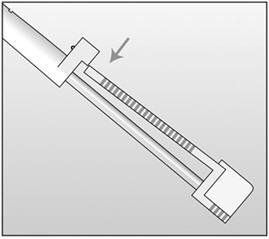
图8
- 步骤17.将填塞器相对于针头沿任一方向旋转90°(图9)。
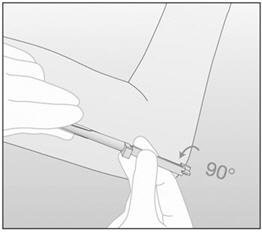
图9
- 步骤18.将填塞器固定在手臂上的同时,完全缩回套管(图10)。注意:此过程与注射相反。请勿推动闭孔器。通过将填塞器固定在手臂上的适当位置并完全缩回套管,植入物将留在其正确的皮下位置。不要同时从患者的手臂缩回闭孔器和套管。
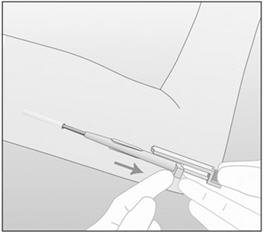 |
| 图10 |
| 在此图中,右手将填塞器固定在位,而左手缩回套管。 |
- 步骤19.通过检查针尖是否存在植入物来确认已插入植入物。插入植入物后,在针头内部将看到密闭器的带槽尖端(图11)。
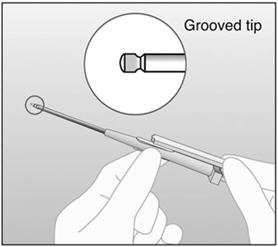
图11
步骤20.触诊插入后,务必立即验证植入物在女性手臂中的存在。通过触摸植入物的两端,您应该能够确认4厘米长棒的存在(图12)。请参阅下面的“如果不可触知杆”部分。
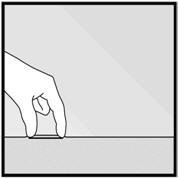
图12
步骤21.在插入部位上放一个小的绷带。要求妇女触诊植入物。
步骤22.用无菌纱布包扎压力绷带,以最大程度地减少瘀伤。女人可以在24小时内去除压力绷带,并在3至5天内去除插入部位的小绷带。
步骤23.填写用户卡,并将其交给女士保存。另外,填写患者图表标签并将其粘贴到女性的病历上。
步骤24.涂抹器仅供一次性使用,应根据疾病控制与预防中心处理危险废物的指南进行处置。
如果不明显,则:
如果您无法感觉到植入物或怀疑植入物的存在,则可能未插入植入物,或者可能已将其深深插入:
- 检查针尖是否有植入物。插入植入物后,在针头内部将看到密闭器的带槽尖端。
- 使用其他方法来确认植入物的存在。合适的定位方法是:具有高频线性阵列换能器(10 MHz或更高)的超声(US)或磁共振成像(MRI)。请注意,IMPLANON棒不是不透射线的,并且无法通过X射线或CT扫描看到。如果超声和MRI失败,请致电1-877-IMPLANON(1-877-467-5266),以获取有关测量依托孕烯血药浓度的步骤的信息。
在验证植入物是否存在之前,应建议女性使用非荷尔蒙避孕方法,例如避孕套。
一旦找到了不可触及的植入物,建议将其移除[请参阅警告和注意事项(5.1)] 。
移除IMPLANON
制备
在开始移除程序之前,医护人员应仔细阅读移除说明,并向用户卡和/或患者图表标签咨询植入物的位置。植入物在手臂中的确切位置应通过触诊加以验证。 [参见剂量和用法(2.3)和不可触及植入物的定位和去除。]
取出可触及的植入物的程序
在移除植入物之前,医疗服务提供者应确认:
- 该妇女对使用的防腐剂或麻醉剂没有过敏。
在无菌条件下取出植入物。
需要以下设备来移除植入物:
- 女人躺在床上的检查床
- 无菌手术单,无菌手套,消毒液,无菌标记物(可选)
- 局部麻醉剂,针头和注射器
- 无菌手术刀,镊子(直形和弯曲形蚊子)
- 皮肤封闭,无菌纱布,绷带和压力绷带
拆卸程序
- 步骤1.清洁将要切开切口的部位并使用防腐剂。通过触诊定位植入物,并用无菌标记物标记远端(最靠近肘部的一端)(图13)。
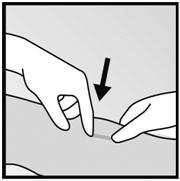
图13
- 步骤2.例如,在将要进行切口的标记部位,用0.5至1 mL 1%的利多卡因麻醉手臂(图14)。确保在植入物下方注入局部麻醉剂,以使其靠近皮肤表面。
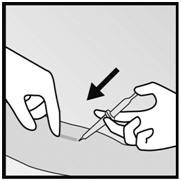
图14
- 步骤3.向下推植入物的近端(图15)以使其稳定;可能会出现凸起,表明植入物的远端。从植入物的远端开始,朝肘部纵向切开2 mm。
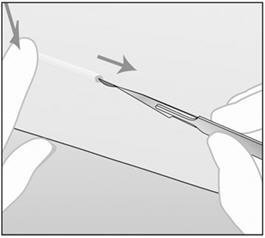
图15
- 步骤4.将植入物轻轻推向切口,直到可见尖端。用镊子(最好是弯曲的蚊子钳)抓住植入物,然后轻轻取出植入物(图16)。
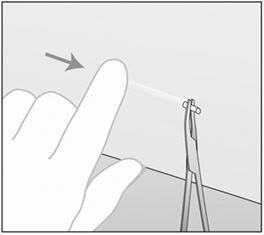
图16
- 步骤5.如果植入物被封装,则在组织鞘中切开一个切口,然后用镊子将植入物取出(图17和18)。
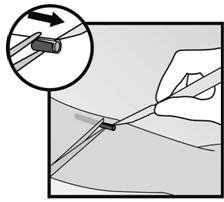 | 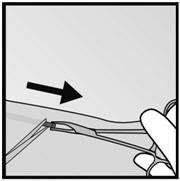 |
| 图17 | 图18 |
- 步骤6.如果在切口中看不到植入物的尖端,则将镊子轻轻插入切口中(图19)。将钳子翻转到另一只手中(图20)。
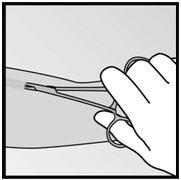 | 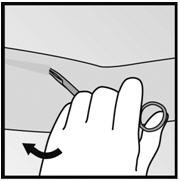 |
| 图19 | 图20 |
- 步骤7.用第二对镊子仔细解剖植入物周围的组织并抓住植入物(图21)。然后可以去除植入物。
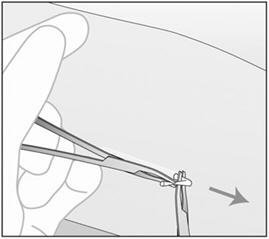
图21
步骤8.通过测量长度,确认已除去4厘米长的整个植入物。有报道说在病人的手臂上植入物破裂。在某些情况下,已经报道了难以去除损坏的植入物的情况。如果去除了部分植入物(小于4厘米),则应按照2.3节中的说明去除剩余的部分。 [参见剂量和给药方法(2.3)。]如果女性想继续使用IMPLANON,则可以在使用相同的切口取下旧植入物后立即插入新的植入物[请参见剂量和给药方法(2.4)] 。
- 步骤9.移除植入物后,用立体声带闭合切口并用绷带包扎。
- 步骤10.用无菌纱布包扎压力绷带,以最大程度地减少瘀伤。女人可以在24小时内去除压力绷带,在3至5天内去除小绷带。
不可触及的植入物的定位和去除
有植入物迁移的报道。通常,这涉及相对于原始位置的微小移动[请参阅警告和注意事项(5.1)] ,但可能会导致植入物在放置位置无法触摸。已深深插入或已迁移的植入物可能无法触摸,因此,可能需要进行如下所述的成像程序以进行定位。
不可触及的植入物应始终放在尝试移除之前。合适的定位方法包括使用高频线性阵列换能器(10 MHz或更高)进行超声检查或磁共振成像。一旦将植入物定位在手臂中,应按照剂量和给药方法(2.3),可触及的植入物去除程序中的说明去除植入物,并应考虑在去除过程中使用超声引导。
如果经过全面定位尝试后仍未在手臂中找到植入物,请咨询熟悉将高级成像技术应用于胸部的放射科医生,因为据报道已发生迁移至肺血管的事件。如果植入物位于胸部,则可能需要进行外科手术或血管内手术。应咨询熟悉胸部解剖的医护人员。
如果这些成像方法在任何时候都无法定位植入物,则可以使用依托孕酮血药浓度测定来验证植入物的存在。有关确定依托孕酮血药浓度的详细信息,请致电1-877-IMPLANON(1-877-467-5266)以获取更多说明。
如果植入物在手臂内迁移,则可能需要进行较大切口的较小外科手术或在手术室中进行外科手术。为了防止对手臂中较深的神经或血管结构造成伤害,应谨慎取出深插入的植入物,并应由熟悉手臂解剖结构的医疗保健提供者进行。
强烈建议不要进行不知道植入物确切位置的探索性手术。
更换IMPLANON
立即更换可在移除先前的植入物后进行,与2.2节“ IMPLANON的插入”中所述的插入步骤相似。
可以将新的植入物插入同一臂中,并通过与先前植入物相同的切口插入。如果使用相同的切口插入新的植入物,则将插入部位麻醉(例如2 mL利多卡因(1%)),将其沿“插入管”插入皮肤下。
请遵循插入说明中的后续步骤[请参阅剂量和用法(2.2)] 。
Implanon品牌在美国已经停产。如果该产品的通用版本已获得FDA批准,则可能有通用的等效产品。
Implanon的适应症和用法
Implanon®适用于女性预防妊娠。
Implanon剂量和管理
Implanon的功效不取决于每日,每周或每月给药。
在插入和/或卸下Implanon之前,所有医疗保健提供者均应接受指导和培训。
将单个Implanon植入物皮下插入上臂。为降低神经或血管损伤的风险,应将植入物插入非主要上臂内侧,距肱骨上epi上端约8-10厘米(3-4英寸)。植入物应直接插入皮下皮下,避免二头肌和三头肌之间的沟(沟)以及皮下组织深处神经血管束中的大血管和神经。植入物比皮下植入更深(深度插入)可能无法触及,并且难以或不可能进行定位和/或移除[请参见剂量和用法(2.3)和警告和注意事项(5.1) ] 。必须在包装上注明的有效期之前插入Implanon。 Implanon是一种长效(长达3年),可逆的荷尔蒙避孕方法。如果需要持续的避孕保护,则必须在第三年年底之前取出植入物,并且在取出时可以用新的植入物替换植入物。
用Implanon避孕
重要提示:在插入植入物之前,请排除妊娠。
插入时间取决于女性最近的避孕史,如下所示:
- 过去一个月内未曾使用过激素避孕药
- 即使妇女仍在流血,也应在月经周期的第1天(月经的第一天)和第5天之间插入止血带。
- 如果建议插入,则无需备用避孕。如果偏离建议的插入时间,则应建议女性使用屏障方法,直到插入后7天。如果已经发生性交,则应排除怀孕。
- 即使妇女仍在流血,也应在月经周期的第1天(月经的第一天)和第5天之间插入止血带。
- 将避孕方法改为Implanon
- 组合激素避孕药:
最好在先前联合口服避孕药的最后一剂有效片剂之后的第二天或在去除阴道环或经皮贴剂的那天插入Implanon。最迟应在先前联合激素避孕药的通常无片剂,无环,无贴剂或安慰剂片剂间隔的第二天插入Implanon。
如果建议插入,则无需备用避孕。如果偏离建议的插入时间,则应建议女性使用屏障方法,直到插入后7天。如果已经发生性交,则应排除怀孕。 - 仅孕激素避孕药:
仅孕激素方法有几种类型。 Implanon应该如下插入:- 可注射的避孕药:在下一次注射的当天插入Implanon。
- Minipill:妇女可以在每月的任何一天改用Implanon。 Implanon应该在服用最后一粒药片后的24小时内插入。
- 避孕植入物或子宫内系统(IUS):在取出先前的避孕植入物或IUS的同一天插入Implanon。
- 可注射的避孕药:在下一次注射的当天插入Implanon。
- 组合激素避孕药:
- 流产或流产后
- 早孕:流产应在早孕流产或流产后5天内插入。
- 孕中期:在孕中期流产或流产后21至28天之间插入Implanon。
- 早孕:流产应在早孕流产或流产后5天内插入。
- 产后
- 不母乳喂养:应在产后21至28天之间插入Implanon。如果建议插入,则无需备用避孕。如果偏离建议的插入时间,则应建议女性使用屏障方法,直到插入后7天。如果已经发生性交,则应排除怀孕。
- 母乳喂养:直到产后第四周之后才可以插入Implanon。建议女性在插入后7天内使用屏障方法。如果已经发生性交,则应排除怀孕。
- 不母乳喂养:应在产后21至28天之间插入Implanon。如果建议插入,则无需备用避孕。如果偏离建议的插入时间,则应建议女性使用屏障方法,直到插入后7天。如果已经发生性交,则应排除怀孕。
插入Implanon
成功使用和随后移除Implanon的基础是根据说明正确,仔细地将单个杆状植入物皮下插入。放置后,医疗服务提供者和女性均应能够感觉到皮肤下的植入物。
所有执行Implanon插入和/或移除的医疗服务提供者都应在插入或移除植入物之前接受说明和培训。有关插入和移除Implanon的信息将根据请求免费发送[1-877-Implanon(1-877-467-5266)]。
制备
在插入Implanon之前,请仔细阅读插入说明以及完整的处方信息。
在插入Implanon之前,医疗保健提供者应确认:
- 该妇女未怀孕,也没有使用伊普兰酮的其他禁忌症[见禁忌症(4) ] 。
- 该妇女有病史和体格检查,包括妇科检查。
- 女人了解Implanon的好处和风险。
- 该妇女已收到包装中包含的患者标签副本。
- 这位女士已审核并填写了同意书,该表格与该女士的病历表一起保存。
- 该妇女对插入期间使用的防腐剂和麻醉剂没有过敏。
在无菌条件下插入Implanon。
植入物需要以下设备:
- 女人躺在床上的检查床
- 无菌手术单,无菌手套,消毒液,无菌标记物(可选)
- 局部麻醉剂,针头和注射器
- 无菌纱布,绷带,压力绷带
涂抹器及其零件如下所示(图1a和1b )。
| 图1a (不按比例) |
 |
| 图1b |
 |
| 密闭槽的尖端(放大) |
Implanon插入的步骤与注射相反。当插管缩回时,阻塞器将Implanon保持在适当的位置。当带针的套管从手臂缩回时,填塞器必须保持固定在适当的位置。不要推闭孔器。
插入程序
- 步骤1.让女人躺在检查床上,她的非优势臂在肘部弯曲并向外旋转,以使手腕与耳朵平行或手靠近头部(图2 )。

图2
步骤2.识别插入部位,该部位位于肱骨内侧上con上方约8-10厘米(3-4英寸)的非主要上臂内侧,避免二头肌和肱二头肌之间的沟(沟)。肱三头肌和位于皮下组织深处的神经血管束中的大血管和神经(图3 )。植入物应直接插入皮下[见警告和注意事项(5.1) ]。
- 步骤3.用无菌标记物做两个标记:首先,标记将要插入依托孕烯植入物的部位,其次,在靠近第一个标记几厘米处标记一个部位(图3 )。此第二标记稍后将在插入过程中用作方向指南。

图3
- 步骤4.使用消毒液清洁插入部位。
- 步骤5.麻醉插入区域(例如,使用麻醉剂喷雾或沿计划的插入通道在皮肤正下方注入2 mL 1%利多卡因)。
- 步骤6.从水泡中取出无菌的预载一次性Implanon涂抹器,将其植入植入物。保持Implanon针和杆无菌。如果对无菌性有疑问,请勿使用涂药器。如果发生污染,请使用新包装的Implanon和新的无菌涂抹器。
- 步骤7.将防护罩保持在针头上,并寻找Implanon杆,该针杆被视为针尖内的白色圆柱。
- 第8步。如果看不到Implanon杆,则将针头护罩的顶部紧贴固定表面,将植入物带入针头。
- 步骤9.目视确认后,通过将Implanon杆放回到针尖中,将其降低回针中。然后在保持喷枪直立的同时取下针头护罩。
- 步骤10.请注意,Implanon可能会掉出针头。因此,在卸下针头护罩之后,将涂抹器保持直立位置,直到插入为止
- 步骤11.用您的另一只手,用拇指和食指在插入部位周围拉伸皮肤(图4 )。

图4
- 步骤12.在一个很小的角度(不大于20°),仅插入与斜面的侧成插入部位(在针的尖端图5 )。

图5
- 步骤13.将施药器降低至水平位置。用针尖将皮肤提起,但将针保留在皮下结缔组织中(图6 )。

图6
- 步骤14.在“拉紧”(提起)皮肤的同时,将针头插入全长。插入过程中,使针头与皮肤表面平行(图7 )。

图7
步骤15.如果将Implanon放在很深的地方,则清除过程可能很困难或不可能。如果针未完全插入,植入物可能会从插入部位突出并掉出。
- 步骤16.通过按下填塞器支撑件(图8 ),破坏涂药器的密封。

图8
- 步骤17.将填塞器相对于针头沿任一方向旋转90°(图9 )。

图9
- 步骤18.将填塞器固定在手臂上的同时,完全缩回套管(图10 )。注意:此过程与注射相反。请勿推动闭孔器。通过将填塞器固定在手臂上的适当位置并完全缩回套管,植入物将留在其正确的皮下位置。不要同时从患者的手臂缩回闭孔器和套管。
 |
| 图10 |
| 在此图中,右手将填塞器固定在位,而左手缩回套管。 |
- 步骤19.通过检查针尖是否存在植入物来确认已插入植入物。插入植入物后,将在针头内部看到填孔器的带槽尖端(图11 )。

图11
步骤20.触诊插入后,务必立即验证植入物在女性手臂中的存在。通过触诊植入物的两端,您应该能够确认4厘米长棒的存在(图12 )。请参阅下面的“如果不可触知杆”部分。

图12
步骤21.在插入部位上放一个小的绷带。要求妇女触诊植入物。
步骤22.用无菌纱布包扎压力绷带,以最大程度地减少瘀伤。女人可以在24小时内去除压力绷带,并在3至5天内去除插入部位的小绷带。
步骤23.填写用户卡,并将其交给女士保存。另外,填写患者图表标签并将其粘贴到女性的病历上。
步骤24.涂抹器仅供一次性使用,应根据疾病控制与预防中心处理危险废物的指南进行处置。
如果不明显,则:
如果您无法感觉到植入物或怀疑植入物的存在,则可能未插入植入物,或者可能已将其深深插入:
- 检查针尖是否有植入物。插入植入物后,在针头内部将看到密闭器的带槽尖端。
- 使用其他方法来确认植入物的存在。合适的定位方法是:具有高频线性阵列换能器(10 MHz或更高)的超声(US)或磁共振成像(MRI)。请注意,Implanon棒不是不透射线的,并且无法通过X射线或CT扫描看到。如果超声检查和MRI失败,请致电1-877-Implanon(1-877-467-5266),了解有关测量依托孕酮血药浓度的步骤的信息。
在验证植入物是否存在之前,应建议女性使用非荷尔蒙避孕方法,例如避孕套。
一旦找到了不可触及的植入物,建议将其移除[请参阅警告和注意事项(5.1) ] 。
去除Implanon
制备
在开始移除程序之前,医护人员应仔细阅读移除说明,并向用户卡和/或患者图表标签咨询植入物的位置。植入物在手臂中的确切位置应通过触诊加以验证。 [请参见剂量和用法(2.3)以及不可触及植入物的定位和去除。]
取出可触及的植入物的程序
在移除植入物之前,医疗服务提供者应确认:
- 该妇女对使用的防腐剂或麻醉剂没有过敏。
在无菌条件下取出植入物。
需要以下设备来移除植入物:
- 女人躺在床上的检查床
- 无菌手术单,无菌手套,消毒液,无菌标记物(可选)
- 局部麻醉剂,针头和注射器
- 无菌手术刀,镊子(直形和弯曲形蚊子)
- 皮肤封闭,无菌纱布,绷带和压力绷带
拆卸程序
- 步骤1.清洁将要切开切口的部位并使用防腐剂。通过触诊定位植入物,并用无菌标记物标记远端(最靠近肘部的一端)(图13 )。

图13
- 步骤2.例如,在将要进行切口的标记部位,用0.5至1 mL 1%的利多卡因麻醉手臂(图14 )。确保在植入物下方注入局部麻醉剂,以使其靠近皮肤表面。

图14
- 步骤3.向下推植入物的近端(图15 )以使其稳定;可能会出现凸起,表明植入物的远端。从植入物的远端开始,朝肘部纵向切开2 mm。

图15
- 步骤4.将植入物轻轻推向切口,直到可见尖端。用镊子(最好是弯曲的蚊子钳)抓住植入物,然后轻轻取出植入物(图16 )。

图16
- 步骤5.如果植入物被封装,则在组织鞘中切开一个切口,然后用镊子将植入物取出(图17和18 )。
 |  |
| 图17 | 图18 |
- 步骤6.如果在切口中看不到植入物的尖端,则将镊子轻轻插入切口中(图19 )。将钳子翻转到另一只手中(图20 )。
 |  |
| 图19 | 图20 |
- 步骤7.用第二对镊子仔细解剖植入物周围的组织并抓住植入物(图21 )。然后可以去除植入物。

图21
步骤8.通过测量长度,确认已除去4厘米长的整个植入物。有报道说在病人的手臂上植入物破裂。在某些情况下,已经报道了难以去除损坏的植入物的情况。如果去除了部分植入物(小于4厘米),则应按照2.3节中的说明去除剩余的部分。 [请参阅剂量和用法(2.3) 。]如果女性想继续使用Implanon,则可以在使用相同的切口将旧植入物移除后立即插入新的植入物[请参阅剂量和用法(2.4) ] 。
- 步骤9.移除植入物后,用立体声带闭合切口并用绷带包扎。
- 步骤10.用无菌纱布包扎压力绷带,以最大程度地减少瘀伤。女人可以在24小时内去除压力绷带,在3至5天内去除小绷带。
不可触及的植入物的定位和去除
有植入物迁移的报道。通常,这涉及相对于原始位置的微小移动[请参阅警告和注意事项(5.1) ] ,但可能会导致植入物在放置位置无法触摸。已深深插入或已迁移的植入物可能无法触摸,因此,可能需要进行如下所述的成像程序以进行定位。
不可触及的植入物应始终放在尝试移除之前。合适的定位方法包括使用高频线性阵列换能器(10 MHz或更高)进行超声检查或磁共振成像。一旦将植入物定位在手臂中,应按照剂量和给药方法(2.3),可触及的植入物去除程序中的说明去除植入物,并应考虑在去除过程中使用超声引导。
如果经过全面定位尝试后仍未在手臂中找到植入物,请咨询熟悉将高级成像技术应用于胸部的放射科医生,因为据报道已发生迁移至肺血管的事件。如果植入物位于胸部,则可能需要进行外科手术或血管内手术。应咨询熟悉胸部解剖的医护人员。
如果这些成像方法在任何时候都无法定位植入物,则可以使用依托孕酮血药浓度测定来验证植入物的存在。有关确定依托孕酮血药浓度的详细信息,请致电1-877-Implanon(1-877-467-5266)以获取更多说明。
如果植入物在手臂内迁移,则可能需要进行较大切口的较小外科手术或在手术室中进行外科手术。为了防止对手臂中较深的神经或血管结构造成伤害,应谨慎取出深插入的植入物,并应由熟悉手臂解剖结构的医疗保健提供者进行。
强烈建议不要进行不知道植入物确切位置的探索性手术。
更换Implanon
立即移除可在移除之前的植入物后进行,与2.2节“ Implanon的插入”中所述的插入步骤相似。
可以将新的植入物插入同一臂中,并通过与先前植入物相同的切口插入。如果使用相同的切口插入新的植入物,则将插入部位麻醉(例如2 mL利多卡因(1%)),将其沿“插入管”插入皮肤下。
请遵循插入说明中的后续步骤[请参阅剂量和用法(2.2) ] 。
剂型和优势
单个白色,柔软,柔软的乙烯醋酸乙烯酯(EVA)植入物,长4厘米,直径2毫米,含68 mg依托孕烯。
禁忌症
Implanon不应用于有以下症状的女性
- 已知或怀疑怀孕
- 血栓形成或血栓栓塞性疾病的当前或过去病史
- 肝肿瘤,良性或恶性或活动性肝病
- 未确诊的生殖器异常出血
- 现在或过去已知或怀疑的乳腺癌,乳腺癌的个人病史或其他对孕激素敏感的癌症
- 对Implanon的任何成分的过敏反应[请参阅不良反应(6) ]
警告和注意事项
以下信息基于使用Implanon,其他仅孕激素的避孕药的经验,或联合(雌激素加孕激素)口服避孕药的经验。
插入和取出的并发症
应将Implanon插入皮下,以便在插入后可触及,插入后应立即通过触诊确认。除非插入后立即触碰,否则未正确插入Implanon可能会引起注意。未检测到无法插入植入物可能会导致意外怀孕。可能会发生与插入和拔出过程相关的并发症,例如疼痛,感觉异常,出血,血肿,疤痕或感染。有时在上市后使用中,植入物插入失败是因为植入物在插入过程中掉出针头或留在了针头中。
如果将Implanon插入较深(肌肉内或筋膜中),可能会发生神经或血管损伤。为了降低神经或血管损伤的风险,应在肱骨内侧上con上方约8-10厘米(3-4英寸)的非优势上臂内侧插入Implanon。 Implanon应该直接插入皮下,避免二头肌和三头肌之间的沟(沟)以及皮下组织深处神经血管束中的大血管和神经。 Implanon的深层插入与感觉异常(由于神经损伤),植入物的迁移(由于肌肉内或筋膜插入)和血管内插入有关。如果在插入部位感染,请开始适当的治疗。如果感染持续存在,应将植入物移除。不完全插入或感染可能导致驱逐。
如果植入物未正确插入,插入得太深,不可触及,包裹在纤维组织中或已迁移,则移出植入物可能很困难或不可能。
有报道说植入物在手臂内从插入部位迁移,这可能与深度插入有关。上市后也有报道称植入物位于手臂和肺动脉血管内,这可能与深度插入或血管内插入有关。如果植入物已迁移至肺动脉,则可能需要进行血管内手术才能去除。
如果任何时候都无法触及植入物,应将其定位并建议将其移除。
强烈建议不要进行不知道植入物确切位置的探索性手术。为了防止对手臂中较深的神经或血管结构造成伤害,应谨慎取出深插入的植入物,并应由熟悉手臂解剖结构的医疗保健提供者进行。如果植入物位于胸部,应咨询熟悉胸部解剖结构的医疗保健提供者。未能移除植入物可能会导致依托孕烯的持续作用,例如生育能力受损,异位妊娠,持续存在或发生药物相关不良事件。
月经出血方式的变化
开始服用Implanon后,女性的月经出血模式可能会有所改变。这些可能包括出血频率(不存在,更少,更频繁或持续),强度(减少或增加)或持续时间的变化。在临床试验中,出血模式从闭经(五分之一的女性)到频繁和/或长时间出血(五分之一的女性)不等。在使用Implanon的前三个月内出现的出血模式可广泛预测许多女性未来的出血模式。应向妇女提供有关可能经历的出血模式变化的咨询,以使她们知道预期的结果。应根据需要评估异常出血,以排除病理状况或妊娠。
在Implanon的临床研究中,出血模式变化的报告是停止治疗的最常见原因(11.1%)。不规律出血(10.8%)是妇女停止治疗的最常见原因,而闭经(0.3%)的发生率较低。在这些研究中,女性平均每90天有17.7天的出血或斑点(基于780例患者记录的每90天的3315个间隔)。表1列出了在使用Implanon植入物的情况下,在90天的间隔内出现0、1-7、8-21或> 21天的斑点或出血的患者百分比。
| 发现或出血的总天数 | 患者百分比 | ||
|---|---|---|---|
| 治疗日91-180 (N = 745) | 治疗天数 271-360 (N = 657) | 治疗天数 631-720 (N = 547) | |
| 0天 | 19% | 24% | 17% |
| 1-7天 | 15% | 13% | 12% |
| 8-21天 | 30% | 30% | 37% |
| > 21天 | 35% | 33% | 35% |
表2总结了使用Implanon长达2年观察到的出血模式,以及90天间隔出现这些出血模式的比例。
| 出血模式 | 定义 | % † |
|---|---|---|
| ||
| 不常 | 90天内少于三个出血和/或斑点发作(不包括闭经) | 33.6 |
| 闭经 | 90天内无出血和/或斑点 | 22.2 |
| 延长时间 | 在90天内持续超过14天的任何出血和/或斑点发作 | 17.7 |
| 频繁的 | 90天内超过5次出血和/或斑点发作 | 6.7 |
如果未诊断,持续或反复出现异常阴道出血,应采取适当措施以排除恶性肿瘤。
异位妊娠
与所有仅使用孕激素的避孕产品一样,请警惕使用Implanon的孕妇有异位妊娠的可能,这些妇女会怀孕或抱怨下腹部疼痛。尽管异位妊娠在使用Implanon的妇女中很少见,但与未避孕的妇女相比,使用Implanon的妇女发生的妊娠更容易发生异位。
血栓和其他血管事件
激素类避孕药(孕激素加雌激素)的联合使用会增加血管事件的风险,包括动脉事件(中风和心肌梗塞)或深静脉血栓形成事件(静脉血栓栓塞,深静脉血栓形成,视网膜静脉血栓形成和肺栓塞)。 Implanon是仅孕激素的避孕药。尚不清楚这种增加的风险是否仅适用于依托孕烯。但是,建议仔细评估具有已知会增加静脉和动脉血栓栓塞风险的危险因素的妇女。
上市后的报告显示,使用Implanon的妇女发生严重的动脉血栓形成和静脉血栓栓塞事件,包括肺栓塞(一些致命),深静脉血栓形成,心肌梗塞和中风。万一发生血栓形成,应去除黑线。
由于妊娠和分娩后有血栓栓塞的风险,Implanon不应在产后21天之前使用。有血栓栓塞性疾病史的女性应注意复发的可能性。
如果出现无法解释的视力丧失,眼球突出,复视,乳头水肿或视网膜血管病变,请立即评估视网膜静脉血栓形成。
如果由于手术或疾病而长期无法固定,请考虑移除Implanon植入物。
卵巢囊肿
如果发生卵泡发育,则有时会延迟卵泡的闭锁,并且卵泡可能会继续增长,超出正常周期所能达到的大小。通常,这些增大的卵泡自发消失。在极少数情况下,可能需要进行手术。
乳腺癌和生殖器官癌
当前或曾经患有乳腺癌的妇女不应使用激素避孕药,因为乳腺癌可能是激素敏感性的[见禁忌症(4) ] 。一些研究表明,联合使用激素避孕药可能会增加乳腺癌的发病率。但是,其他研究尚未证实此类发现。
一些研究表明,联合使用激素避孕药与宫颈癌或上皮内瘤变的风险增加有关。然而,关于这种发现在多大程度上是由于性行为和其他因素的差异引起争议。
有乳腺癌家族病史或出现乳腺结节的妇女应仔细监测。
肝病
肝功能障碍可能需要停止使用激素避孕药,直到肝功能指标恢复正常。如果出现黄疸,请移除Implanon。
肝腺瘤与联合激素避孕药的使用有关。组合激素避孕药使用者的可归因风险估计为每100,000例3.3例。尚不清楚仅孕激素的方法(例如Implanon)是否存在类似的风险。
患有肝功能不全的女性在Implanon中的孕激素可能代谢不良。禁忌在患有活动性肝病或肝癌的妇女中使用Implanon [请参阅禁忌症(4) ] 。
体重增加
在临床研究中,美国Implanon使用者的平均体重增加在1年后为2.8磅,在2年后为3.7磅。多少重量增加与植入物有关尚不清楚。在研究中,有2.3%的使用者报告称体重增加是移除植入物的原因。
血压升高
有高血压相关疾病或肾脏疾病病史的妇女应避免使用激素避孕。对于高血压控制良好的女性,可以考虑使用Implanon。使用Implanon的高血压妇女应受到密切监测。如果在使用Implanon的过程中出现持续性高血压,或者如果血压的明显升高对降压治疗没有足够的反应,则应移除Implanon。
胆囊疾病
研究表明,激素类避孕药联合使用者发生胆囊疾病的相对危险性略有增加。尚不清楚仅孕激素的方法(例如Implanon)是否存在类似的风险。
碳水化合物和脂质代谢作用
Implanon的使用可能会引起轻度的胰岛素抵抗,并且血糖浓度的微小变化尚无临床意义。使用Implanon仔细监测糖尿病前期和糖尿病妇女。
如果选择使用Implanon,则应密切关注接受过高脂血症治疗的妇女。一些孕激素可能会升高LDL水平,并使高脂血症的控制更加困难。
沮丧的心情
有情绪低落史的女性应仔细观察。对于严重抑郁的患者,应考虑去除Implanon。
返回排卵
在使用Implanon进行的临床试验中,去除植入物后一周,血液中的依托孕酮水平降低至低于测定的灵敏度。另外,观察到怀孕发生在移走后的7至14天之内。因此,如果需要持续的避孕保护,女性应在移除植入物后立即重新开始避孕。
体液潴留
激素避孕药可能导致一定程度的体液滞留。在体液retention留可能加重病情的患者中,应谨慎行事,并且仅应进行仔细的监测。目前尚不清楚Implanon是否会引起液体滞留。
隐形眼镜
发生视觉变化或晶状体耐受性变化的隐形眼镜配戴者应由眼科医生评估。
原位破裂或弯曲的植入物
有报道说在病人的手臂上植入物破裂或弯曲。根据体外数据,当植入物破裂或弯曲时,依托孕烯的释放速率可能会略有增加。
当移除植入物时,重要的是将其整体移除[见剂量和用法(2.3) ] 。
监控方式
使用Implanon的妇女应每年与医疗保健提供者进行一次血压检查和其他指定的医疗保健服务。
药物实验室测试的相互作用
Implanon插入后的最初6个月内,性激素结合球蛋白的浓度可能会降低,然后逐渐恢复。甲状腺素浓度最初可能会略有降低,然后逐渐恢复至基线。
不良反应
标签中其他地方还讨论了使用激素避孕所报告的以下不良反应:
- 月经出血方式的变化[请参阅警告和注意事项(5.2) ]
- 异位妊娠[见警告和注意事项(5.3) ]
- 血栓性和其他血管事件[请参阅警告和注意事项(5.4) ]
- 肝病[请参阅警告和注意事项(5.7) ]
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物的临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
在包括942名经过安全性评估的女性的临床试验中,月经出血类型的变化(月经不规则)是导致停用Implanon的最常见不良反应(占女性的11.1%)。
表3显示了导致终止率≥1%的不良反应。
| 不良反应 | 所有研究 N = 942 |
|---|---|
| |
| 出血不规则* | 11.1% |
| 情绪不稳定† | 2.3% |
| 体重增加 | 2.3% |
| 头痛 | 1.6% |
| 粉刺 | 1.3% |
| 抑郁症‡ | 1.0% |
表4列出了Implanon临床试验中至少5%的受试者报告的其他不良反应。
| 不良反应 | 所有研究 N = 942 |
|---|---|
| 头痛 | 24.9% |
| 阴道炎 | 14.5% |
| 体重增加 | 13.7% |
| 粉刺 | 13.5% |
| 乳房胀痛 | 12.8% |
| 腹痛 | 10.9% |
| 咽炎 | 10.5% |
| 白带 | 9.6% |
| 流感样症状 | 7.6% |
| 头晕 | 7.2% |
| 痛经 | 7.2% |
| 背疼 | 6.8% |
| 情绪不稳定 | 6.5% |
| 恶心 | 6.4% |
| 疼痛 | 5.6% |
| 紧张 | 5.6% |
| 萧条 | 5.5% |
| 过敏症 | 5.4% |
| 插入部位疼痛 | 5.2% |
在临床试验的任何评估中,有3.6%的受试者报告了植入部位并发症。在插入期间和/或插入之后,疼痛是最常见的植入部位并发症,发生在2.9%的受试者中。此外,分别有0.1%,0.3%和0.3%的患者报告血肿,发红和肿胀[见警告和注意事项(5.1) ]。
上市后经验
在批准使用Implanon的过程中,还发现了以下其他不良反应。由于这些反应是从不确定大小的人群中自愿报告的,因此无法可靠地估计其发生频率或建立与药物暴露的因果关系。
胃肠道疾病:便秘,腹泻,肠胃气胀,呕吐。
一般疾病和给药部位状况:浮肿,疲劳,植入部位反应,发热。
免疫系统疾病:过敏反应
感染和侵染:鼻炎,尿路感染。
调查:临床上血压升高,体重下降。
代谢和营养失调:食欲增加。
肌肉骨骼和结缔组织疾病:关节痛,肌肉骨骼疼痛,肌痛。
神经系统疾病:抽搐,偏头痛,嗜睡。
怀孕,产褥期和围产期状况:异位妊娠。
精神疾病:焦虑,失眠,性欲下降。
肾脏和泌尿系统疾病:排尿困难。
生殖系统和乳房疾病:乳房分泌物,乳房增大,卵巢囊肿,生殖器瘙痒,外阴阴道不适。
皮肤和皮下组织疾病:血管性水肿,血管性水肿加重和/或遗传性血管性水肿加重,脱发,黄褐斑,过度发汗,瘙痒,皮疹,皮脂溢,荨麻疹。
血管疾病:潮热。
报道的与植入物插入或取出有关的并发症包括:瘀伤,轻微的局部刺激,疼痛或瘙痒,植入物部位的纤维化,感觉异常或感觉异常的事件,疤痕和脓肿。据报道,植入物被排出或迁移到胸壁。在某些情况下,已在包括肺动脉的脉管系统内发现了植入物。在肺动脉内发现的一些植入物病例报告了胸痛和/或呼吸困难。其他被报告为无症状的[见警告和注意事项(5.1) ] 。取出植入物时可能需要手术干预。
药物相互作用
请咨询同时使用的药物标签,以获得有关与激素避孕药相互作用或酶改变潜能的更多信息。
其他药物对激素避孕药的影响
降低激素避孕药(HCs)血浆浓度并可能降低HCs功效的物质:
诱导某些酶的药物或草药产品,包括细胞色素P450 3A4(CYP3A4),可能会降低HCs的血浆浓度并可能降低HCs的有效性或增加突破性出血。
可能会降低HC效力的某些药物或草药产品包括依非韦伦,苯妥英,巴比妥酸盐,卡马西平,波生坦,非尔巴特,灰黄霉素,奥卡西平,利福平,托吡酯,利福布汀,鲁非酰胺,阿瑞匹坦和含有圣约翰草的产品。 HCs与其他药物之间的相互作用可能导致突破性出血和/或避孕失败。建议女性在将酶诱导剂与HC一起使用时,使用替代性的非激素避孕方法或备用方法,并在停用酶诱导剂后继续备份非激素避孕28天,以确保避孕的可靠性。
升高HCs血浆浓度的物质:
某些HCs和强或中度CYP3A4抑制剂(例如伊曲康唑,伏立康唑,氟康唑,葡萄柚汁或酮康唑)的共同给药可能增加孕激素(包括依托孕酮)的血清浓度。
人类免疫缺陷病毒(HIV)/丙型肝炎病毒(HCV)蛋白酶抑制剂和非核苷逆转录酶抑制剂:
在与HIV蛋白酶抑制剂共同给药的情况下(例如,nelfinavir,ritonavir,darunavir / ritonavir,(fos)amprenavir / ritonavir,lopinavir / ritonavir,和替普那韦/利托那韦]或增加[例如,茚地那韦和阿扎那韦/利托那韦] / HCV蛋白酶抑制剂(减少[例如,boceprevir和telaprevir])或与非核苷逆转录酶抑制剂(减少[例如,奈韦拉平,依非韦伦]]或增加[例如,依曲韦林]。在某些情况下,这些变化可能与临床相关。
咨询抗病毒药和抗逆转录病毒药的处方信息,以识别潜在的相互作用。
激素避孕药对其他药物的影响
激素避孕药可能会影响其他药物的代谢。因此,血浆浓度可能增加(例如环孢素)或减少(例如拉莫三嗪)。请查阅所有同时使用的药物的标签,以获取有关与激素避孕药相互作用或酶改变潜能的更多信息。
在特定人群中的使用
怀孕
风险摘要
在怀孕期间禁用Implanon,因为已经怀孕的妇女无需进行怀孕预防[见禁忌症(4) ] 。流行病学研究和荟萃分析未显示孕妇在怀孕前或怀孕初期接触低剂量CHC后生殖器或非生殖器出生缺陷(包括心脏异常和四肢复位缺陷)的风险增加。 No adverse development outcomes were observed in pregnant rats and rabbits with the administration of etonogestrel during organogenesis at doses of 315 or 781 times the anticipated human dose (60 µg/day) (see Data ).
Implanon should be removed if maintaining a pregnancy.
数据
动物资料
Teratology studies have been performed in rats and rabbits using oral administration up to 315 and 781 times the human Implanon dose (based upon body surface) and revealed no evidence of fetal harm due to etonogestrel exposure.
哺乳期
风险摘要
Small amounts of contraceptive steroids and/or metabolites, including etonogestrel are present in human milk. No significant adverse effects have been observed in the production or quality of breast milk, or on the physical and psychomotor development of breastfed infants (see Data ).
Hormonal contraceptives, including etonogestrel, can reduce milk production in breastfeeding mothers.一旦确定母乳喂养,这种情况就不太可能发生;但是,某些女性可能会随时发生这种情况。 When possible, advise the nursing mother about both hormonal and non-hormonal contraceptive options, as steroids may not be the initial choice for these patients. The developmental and health benefits of breastfeeding should be considered along with the mother's clinical need for Implanon and any potential adverse effects on the breastfed child from Implanon or from the underlying maternal condition.
数据
The amount of etonogestrel contained within breast milk was measured in 38 lactating women who began using Implanon during the fourth to eighth week postpartum. The study evaluated Implanon versus another contraceptive, was not randomized and data were considered observational and exploratory; therefore, comparisons could not be made. Based on the findings of this study, during the first months after insertion of Implanon, when maternal blood levels of etonogestrel are highest, about 100 ng of etonogestrel may be ingested by the child per day based on an average daily milk ingestion of 658 mL. Based on daily milk ingestion of 150 mL/kg, the mean daily infant etonogestrel dose one month after insertion of Implanon is about 2.2% of the weight-adjusted maternal daily dose, or about 0.2% of the estimated absolute maternal daily dose. Adverse reactions were not observed in breastfed infants exposed to etonogestrel through breast milk. No adverse effects on the production or quality of breast milk were d
已知共有198种药物与Implanon(依托孕酮)相互作用。
- 30种主要药物相互作用
- 161种中等程度的药物相互作用
- 7种次要药物相互作用
检查互动
最常检查的互动
查看Implanon(依托孕酮)与以下药物的相互作用报告。
- 氯硝西am
- 氟西汀
- 加巴喷丁
- 布洛芬
- 拉莫三嗪
- Lexapro(依他普仑)
- 褪黑激素
- 奥美拉唑
- top托拉唑
- 扑热息痛(对乙酰氨基酚)
- Peri-DS(黄麻醇/多库酯)
- 芬特明
- 计划B(左炔诺孕酮)
- 普萘洛尔
- 百忧解(氟西汀)
- 舍曲林
- Symbicort(布地奈德/福莫特罗)
- Topamax(托吡酯)
- 曲马多
- 曲唑酮
- 钡(地西p)
- 维生素D3(胆钙化固醇)
Implanon(Etonogestrel)酒精/食物相互作用
Implanon(etonogestrel)与酒精/食物有2种相互作用
Implanon(Etonogestrel)疾病相互作用
与Implanon(etonogestrel)有9种疾病相互作用,包括:
- 生殖器异常出血
- 肝肿瘤
- 乳房恶性肿瘤
- 肝病
- 血栓栓塞
- 萧条
- 体液潴留
- 视网膜血栓形成
- 胆囊疾病
药物相互作用分类
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |










