获取国外米雷娜(52 MG)药品价格,使用等信息,最快 24 小时回馈
米雷娜(52 MG)
Mirena的用途:
- 它用于防止怀孕。
- 它用于治疗每月(月经)期间的大出血。
在服用Mirena之前,我需要告诉我的医生什么?
- 如果您对Mirena(52 MG)(左炔诺孕酮(IUD))过敏; Mirena(52 MG)(左炔诺孕酮(IUD))的任何部分;或任何其他药物,食物或物质。告诉您的医生有关过敏以及您有什么症状。
- 如果您怀孕或可能怀孕。如果您怀孕,请勿使用Mirena(52 MG)(左炔诺孕酮(IUD))。
- 如果您有宫内节育器(宫内节育器)。
- 如果您有以下任何健康问题:活动性肝病,衣原体或淋病,分娩后子宫内膜炎,生殖道感染,最近3个月内感染的流产,肝肿瘤,骨盆感染,子宫或宫颈肿瘤或生长,子宫问题子宫肌瘤或未经治疗的宫颈炎或阴道炎。
- 如果您有无法解释的阴道出血。
- 如果您曾经遇到以下任何健康问题:乳腺癌,荷尔蒙使其生长的癌症或盆腔炎。
- 如果您的免疫系统较弱,则使用或滥用了静脉注射药物,或者患有可能导致免疫系统较弱的疾病,例如HIV。
- 如果您或您的伴侣与一个以上的人发生性关系。
这不是与Mirena(52 MG)(左炔诺孕酮(IUD))相互作用的所有药物或健康问题的清单。
告诉您的医生和药剂师您所有的药物(处方药或非处方药,天然产品,维生素)和健康问题。您必须检查以确保安全服用米瑞娜(52毫克)(左炔诺孕酮(IUD))并避免所有药物和健康问题。未经医生许可,请勿开始,停止或更改任何药物的剂量。
服用Mirena时我需要了解或做什么?
- 告诉所有医疗保健提供者您服用Mirena(52 MG)(左炔诺孕酮(IUD))。这包括您的医生,护士,药剂师和牙医。
- 卵巢囊肿可能很少发生。大多数情况下,这些问题会在2到3个月内恢复正常。有时,卵巢囊肿会引起疼痛和手术需求。与医生交谈。
- 如果您在服用Mirena(52毫克)(左炔诺孕酮(IUD))时怀孕,可能会增加子宫外妊娠的机会(异位妊娠)。与您的医生交谈。
- 这种药物不能阻止通过性行为传播的艾滋病毒或肝炎等疾病。不使用乳胶或聚氨酯安全套就不要做任何事情。如有疑问,请咨询您的医生。
- 如果您要进行MRI检查,请咨询您的医生。
- 感染Mirena(52 MG)(左炔诺孕酮(IUD))后几天内,可能会危及生命。如果您在Mirena(52 MG)(levonorgestrel(IUD))所在的地方发烧或出现疼痛,请立即致电医生。放置。
- 如果Mirena(52 MG)(左炔诺孕酮(IUD))穿过子宫,则会出现非常糟糕的健康问题,并且需要进行手术。在大多数情况下,这种情况是在放入这种药物后发生的,但在使用过程中的任何时间都可能发生。如果在哺乳期间放入Mirena(52 MG)(左炔诺孕酮(IUD)),则机会增加。如果发生这种情况,这种药物也可能无法预防怀孕。如有疑问,请咨询您的医生。
- 这种药物可能会增加发生称为盆腔炎(PID)的健康问题的机会。如果您或您的伴侣与其他伴侣发生性关系,则机会更高。 PID可能导致其他健康问题,例如无法怀孕,手术或很少死亡。与您的医生交谈。
- 放置Mirena(52 MG)(左炔诺孕酮(IUD))后3到6个月可能会发生阴道流血,斑点或抽筋。如果这些迹象没有消失或非常严重,请立即致电医生。
- 如果您感觉不到绳子或您认为Mirena(52 MG)(左炔诺孕酮(IUD))已经出来,请致电您的医生。如果Mirena(52毫克)(左炔诺孕酮(IUD))出来,您可能会怀孕。使用另一种避孕措施,例如避孕套,直到您去看医生。
- 使用Mirena(52 MG)(左炔诺孕酮(IUD))1年后,某些女性的月经可能会停止。取出Mirena(52 MG)(左炔诺孕酮(IUD))后,月经会恢复正常。如果您没有Mirena(52 MG)(左炔诺孕酮(IUD))放置6周的时间,请致电您的医生。
- 在放入Mirena(52 MG)(左炔诺孕酮(IUD))之前,您可能需要进行妊娠试验。如有疑问,请咨询医生。
- 如果您认为在Mirena(52 MG)(左炔诺孕酮(IUD))就位时可能怀孕,请立即致电医生。取出Mirena(52 MG)(左炔诺孕酮(IUD))或在怀孕期间留在原处,可能会导致非常糟糕的健康问题,甚至有时甚至是致命的健康问题。这包括丧失生育能力,感染和失去胎儿。与您的医生谈谈Mirena(52 MG)(左炔诺孕酮(IUD))到位时怀孕的风险。
- 告诉医生您是否正在母乳喂养。您将需要谈论对宝宝的任何风险。
如何最好地服用这种药物(Mirena)?
按照医生的指示使用Mirena(52 MG)(左炔诺孕酮(IUD))。阅读提供给您的所有信息。请严格按照所有说明进行操作。
- 这种药将由医生给您。
- 有人告诉您,跟进医生。
- 按照医生的指示,检查Mirena(52 MG)(左炔诺孕酮(IUD))是否就位或阅读包装说明书。
- 根据放置Mirena(52 MG)(左炔诺孕酮(IUD))的时间,您可能需要使用非激素型避孕药,例如避孕套,以防一段时间怀孕。遵循医生告诉您的有关何时放入Mirena(52 MG)(左炔诺孕酮(IUD))并使用非激素型避孕药的建议。
- 如果Mirena(52 MG)(左炔诺孕酮(IUD))被取出而您不想怀孕,请咨询医生。在移除避孕套的一周前,您需要使用另一种避孕措施,例如避孕套。
- 该药不可用作紧急避孕药。与医生交谈。
如果我错过了剂量怎么办?
- 致电您的医生以了解如何处理。
我需要马上打电话给我的医生什么副作用?
警告/警告:尽管这种情况很少见,但有些人在服药时可能会有非常严重的副作用,有时甚至是致命的副作用。如果您有以下任何与严重不良副作用相关的症状或体征,请立即告诉医生或寻求医疗帮助:
- 过敏反应的迹象,如皮疹;麻疹;瘙痒;发红或发烧的皮肤发红,肿胀,起泡或脱皮;喘息胸部或喉咙发紧;呼吸,吞咽或说话困难;异常嘶哑或嘴,脸,嘴唇,舌头或喉咙肿胀。
- 高血压的迹象,例如非常头痛或头晕,昏倒或视力改变。
- 身体一侧虚弱,说话或思考困难,平衡失调,面部一侧下垂或视力模糊。
- 胸痛或压力。
- 肚子痛。
- 骨盆疼痛。
- 阴道流血不正常。
- 阴道瘙痒或分泌物。
- 发烧或发冷。
- 乳房肿块或乳房酸痛。
- 痛苦的性爱。
- 皮肤或眼睛发黄。
- 抑郁或其他情绪变化。
- 生殖器疮。
- 放入Mirena(52 MG)(左炔诺孕酮(IUD))时可能会发生一些疼痛,出血,头晕或其他反应。如果Mirena(52 MG)(左炔诺孕酮)在30分钟后仍未消失,请立即与您的医生交谈(IUD)),或者您有其他反应,例如癫痫发作,心跳缓慢或昏倒。
Mirena还有哪些其他副作用?
所有药物都可能引起副作用。但是,许多人没有副作用,或者只有很小的副作用。如果这些副作用或任何其他副作用困扰您或不消失,请致电您的医生或获得医疗帮助:
- 青春痘(粉刺)。
- 头痛。
- 胃部不适或呕吐。
这些并非所有可能发生的副作用。如果您对副作用有疑问,请致电您的医生。打电话给您的医生,征求有关副作用的医疗建议。
您可以致电1-800-332-1088向FDA报告副作用。您也可以在https://www.fda.gov/medwatch报告副作用。
如果怀疑OVERDOSE:
如果您认为服药过量,请致电毒物控制中心或立即就医。准备好告诉或显示采取了什么,采取了多少,何时发生。
如何存放和/或丢弃Mirena?
- 如果您需要在家存放Mirena(52 MG)(左炔诺孕酮(IUD)),请与您的医生,护士或药剂师商谈如何存放。
消费者信息使用
- 如果症状或健康问题没有好转或恶化,请致电医生。
- 不要与他人共享您的药物,也不要服用他人的药物。
- 将所有药物放在安全的地方。将所有毒品放在儿童和宠物够不到的地方。
- 扔掉未使用或过期的药物。除非被告知,否则不要冲厕所或倒水。如果您对扔出药物的最佳方法有疑问,请咨询您的药剂师。您所在地区可能有毒品回收计划。
- 有些药物可能还有另一份患者信息单张。请咨询您的药剂师。如果您对Mirena(52 MG)(左炔诺孕酮(IUD))有任何疑问,请与您的医生,护士,药剂师或其他医疗保健人员联系。
- 如果您认为服药过量,请致电毒物控制中心或立即就医。准备好告诉或显示采取了什么,采取了多少,何时发生。
注意:本文档包含有关左炔诺孕酮的副作用信息。此页面上列出的某些剂型可能不适用于Mirena品牌。
对于消费者
适用于左炔诺孕酮:口服片剂
其他剂型:
- 宫内插入物缓释
需要立即就医的副作用
左炔诺孕酮(美瑞娜中所含的活性成分)及其所需的作用可能会引起一些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用左炔诺孕酮时,如果有下列任何副作用,请立即与医生联系:
比较普遍;普遍上
- 月经量大或轻
发病率未知
- 遗漏或月经不调
- 抽筋
- 月经不调
- 疼痛
- 骨盆疼痛
- 停止月经出血
不需要立即就医的副作用
左炔诺孕酮可能会发生一些副作用,通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 腹部或胃痛
- 头晕
- 头痛
- 恶心
- 乳房的压痛
- 异常疲倦或虚弱
- 呕吐
不常见
- 腹泻
对于医疗保健专业人员
适用于左炔诺孕酮:宫内节育器,口服片剂,皮下植入物
一般
最常见的不良反应是月经出血方式改变,恶心,腹部/骨盆疼痛,头痛/偏头痛,头晕,疲劳,闭经,卵巢囊肿,生殖器排出,痤疮/皮脂溢,乳房压痛和外阴阴道炎。 [参考]
泌尿生殖
非常常见(10%或更多):月经不规律出血(67%),月经不频繁(高达57%),卵巢囊肿(31.2%),月经改变(高达31.9%),子宫出血减少(23.4%) ,月经延长出血(22%),外阴阴道炎(20.2%),闭经(18.4%),生殖器分泌物(高达14.9%),月经量多(13.8%),阴道感染(13.6%),外阴阴道感染(13.3% ),月经出血少(12.5%),定期子宫出血增加(11.9%),乳房压痛(10.7%)
常见(1%至10%):痛经,乳房疼痛/不适,上生殖道感染,生殖道出血,盆腔炎,子宫内膜炎,性交困难,盆腔不适/疼痛,月经延迟超过7天,白带,出血与月经无关
罕见(0.1%至1%):子宫痉挛,宫颈炎/帕帕尼可拉涂片正常II级,阴道分泌物改变
罕见(小于0.1%):子宫穿孔
未报告频率:乳房增大,阴道念珠菌病,宫颈糜烂变化,宫颈分泌物变化,异位妊娠
上市后报道:少乳,月经不调[参考]
胃肠道
非常常见(10%或更多):恶心(高达23.1%),腹/骨盆痛(高达22.6%)
常见(1%至10%):腹泻,呕吐
罕见(0.1%至1%):腹胀
未报告频率:腹胀,腹部绞痛[参考]
其他
非常常见(10%或更多):疲劳(16.9%)
常见(1%至10%):部分或完全切除IUS,体重增加
罕见(0.1%至1%):水肿,体重变化
非常罕见(少于0.01%):面部浮肿
未报告频率:体重减轻,败血症,A组链球菌败血症
上市后报告:IUS破损,程序性出血[参考]
神经系统
非常常见(10%或更高):头痛(高达16.8%),头晕(11.2%)
常见(1%至10%):偏头痛
上市后报告:中风,晕厥,IUS插入相关的血管迷走神经反应或癫痫发作[参考]
精神科
常见(1%至10%):情绪低落/沮丧,情绪变化,情绪波动,性欲下降,神经质
未报告频率:性欲变化[参考]
皮肤科
非常常见(10%或更多):痤疮/皮脂溢(15%)
常见(1%至10%):脱发,多毛症
罕见(0.1%至1%):瘙痒,湿疹,色素沉着改变/色素沉着
稀有(少于0.1%):皮疹,荨麻疹
未报告频率:黄褐斑,黄褐斑
上市后报告:血管性水肿[参考]
心血管的
上市后报告:血压升高,动脉/静脉血栓形成事件,肺栓塞,深静脉血栓形成,中风[Ref]
肌肉骨骼
常见(1%至10%):背痛[Ref]
肿瘤的
未报告频率:良性/恶性肝肿瘤
上市后报告:乳腺癌[参考]
眼科
未报告频率:隐形眼镜不耐受[参考]
新陈代谢
未报告频率:糖尿病[参考]
过敏症
未报告频率:过敏反应
上市后报告:过敏反应[参考]
参考文献
1.“产品信息。Liletta(levonorgestrel)。”新泽西州Parsippany的Actavis Pharma,Inc.。
2.“产品信息。Mirena(左炔诺孕酮)。”加利福尼亚州里士满市Berlex实验室。
3. Cerner Multum,Inc.“英国产品特性摘要”。 00
4.“产品信息。Kyleena(左炔诺孕酮)。”拜耳制药公司,康涅狄格州西黑文。
5.“产品信息。计划B(左炔诺孕酮)。”妇女资本公司,华盛顿州贝尔维尤。
6.“产品信息。Skyla(左炔诺孕酮)。”拜耳制药公司,康涅狄格州西黑文。
7. Cerner Multum,Inc.“澳大利亚产品信息”。 00
某些副作用可能没有报道。您可以将其报告给FDA。
插入说明
- •
- 应当获得完整的医学和社会史,以确定可能影响选择左炔诺孕酮的宫内节育系统(LNG IUS)进行避孕的条件。如果有指示,请对任何形式的生殖器或其他性传播感染进行身体检查和适当的检查。 [请参见禁忌症(4)和警告和注意事项(5.10)。]
- •
- 严格按照所述的插入说明进行操作,以确保正确放置并避免Mirena从插入器中过早释放。发行后,Mirena无法重新加载。
- •
- Mirena应该由训练有素的医疗服务提供者插入。在尝试插入Mirena之前,医疗服务提供者应完全熟悉插入说明。
- •
- 插入可能与一些疼痛和/或出血或血管迷走神经反应(例如晕厥,心动过缓)有关,或与癫痫患者(尤其是对这些症状易感的患者)癫痫发作有关。考虑在插入之前使用止痛药。
插入时间
在目前未使用激素或子宫内避孕的女性中开始Mirena | 可以在服务提供者可以确定女性未怀孕的任何时间插入Mirena。在开始使用本产品之前,考虑排卵和受孕的可能性[见禁忌症(4)] 。 如果在月经周期的前7天或在早孕流产后立即插入Mirena,则无需备用避孕。 如果在月经周期的前7天未插入Mirena,则应采用屏障避孕方法,或者患者应避免阴道交往7天以防止怀孕。 |
从口服,经皮或阴道激素避孕药改用Mirena | Mirena可以随时插入,包括在先前方法的无激素间隔内。 如果在积极使用前一种方法的过程中被插入,则在Mirena插入后继续该方法7天,或者直到当前治疗周期结束。 如果该妇女正在使用连续激素避孕药,则在Mirena插入后7天停止使用该方法。 |
从可注射的孕激素避孕药改用Mirena | Mirena可以随时插入;如果最后一次注射后3个月(13周)以上插入Mirena,则还应使用备用避孕方法(例如避孕套或杀精子剂)7天。 |
从避孕植入物或其他IUS转到Mirena | 在去除植入物或IUS的同一天插入Mirena。 在月经周期的任何时候都可以插入Mirena。 |
流产或流产后插入Mirena | |
孕早期 | 早孕流产或流产后可能会立即插入Mirena。 |
孕中期 | 在中期流产或流产后至少6周或子宫完全脱离子宫之前,请勿插入Mirena。如果延迟插销,请等待插销完成,然后再插入[请参阅警告和注意事项(5.6,5.7)] 。 如果该妇女还没有怀孕,请考虑在插入Mirena之前发生排卵和受孕的可能性。 [请参见禁忌症(4),警告和注意事项(5.2)和FDA批准的患者标签。] Mirena可以在提供者可以确定女性未怀孕的任何时间插入。 如果在月经周期的前7天未插入Mirena,则应采用备用避孕方法,或者患者应避免阴道交往7天以防止怀孕。 |
分娩后插入Mirena | 分娩后至少6周或子宫完全脱离子宫之前,请勿插入Mirena。如果延迟插销,请等待插销完成,然后再插入[请参阅警告和注意事项(5.6,5.7)] 。 如果该妇女还没有怀孕,请考虑在插入Mirena之前发生排卵和受孕的可能性。 [请参见禁忌症(4),警告和注意事项(5.2)]。可以在服务提供者可以确定女性未怀孕的任何时间插入Mirena。 如果在月经周期的前7天未插入Mirena,则应采用备用避孕方法,或者患者应避免阴道交往7天以防止怀孕。 哺乳期妇女的穿孔风险增加。 [请参阅警告和注意事项( 5.6 )。] |
插入工具
制备
- •
- 手套
- •
- 窥镜
- •
- 子宫不育音
- •
- 无菌触角
- •
- 消毒液,涂抹器
程序
- •
- 无菌手套
- •
- Mirena,插入器密封包装
- •
- 颈旁阻滞的器械和麻醉(如果有)
- •
- 考虑提供未打开的备份Mirena
- •
- 无菌锋利的弯曲剪刀
准备插入
- •
- 排除怀孕,并确认没有使用Mirena的其他禁忌症。
- •
- 轻轻插入窥镜使子宫颈可视化。
- •
- 用合适的消毒液彻底清洁子宫颈和阴道。
- •
- 准备听起来子宫腔。用触角镊子抓住子宫颈的上唇,并轻轻地施加牵引力,以使子宫颈管与子宫腔保持稳定并对齐。如果需要,请执行子宫颈阻滞。如果子宫逆行,可能更适合抓住子宫颈的下唇。在整个插入过程中,触角应保持在原位,并在子宫颈上保持轻柔的牵引力。
- •
- 轻轻插入子宫声音以检查子宫颈的通畅性,以厘米为单位测量子宫腔的深度,确认腔的方向,并检测是否存在子宫异常。如果遇到困难或宫颈狭窄,请使用扩张而不是用力来克服阻力。如果需要进行宫颈扩张术,可以考虑使用宫颈旁切除术。
- •
- 子宫的声音应达到6至10厘米的深度。通过发声将Mirena插入子宫腔不到6 cm可能会增加驱逐,出血,疼痛,穿孔和可能怀孕的发生率。
插入程序
仅在完成上述步骤并确定患者适合Mirena后才能进行插入。确保在整个过程中使用无菌技术。
步骤1 –打开包装
- •
- 打开包装(图1)。包装内容物是无菌的。
图1打开Mirena包装
- •
- 使用无菌手套提起无菌插入器的手柄,然后从无菌包装中取出。
步骤2 –将Mirena装入插入管
- •
- 沿箭头方向将滑块尽可能向前推,从而将插入管移到Mirena T形件上,以将Mirena装入插入管中(图2)。臂的尖端将汇合形成一个圆形末端,该末端略微超出插入管。
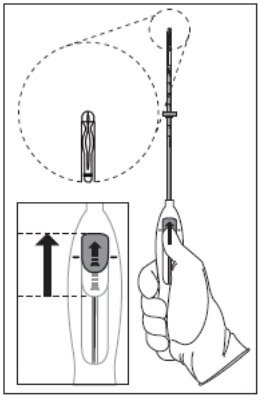
图2将滑块一直移动到向前位置以加载Mirena
- •
- 用拇指或食指在滑块上保持向前的压力。此时请勿向下滑动滑块,因为这可能会过早释放Mirena的螺纹。将滑块移动到标记的下方时,无法重新加载Mirena。
步骤3 –设置法兰
- •
- 将滑块保持在此向前位置,将法兰的上边缘设置为与在探空过程中测得的子宫深度(厘米)相对应(图3)。
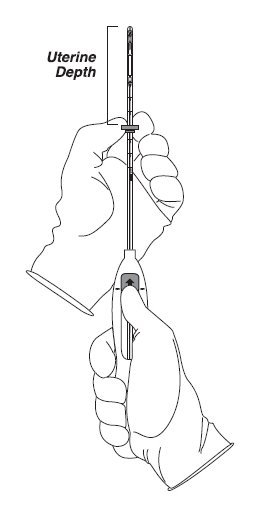
图3设置法兰
步骤4 –现在可以插入Mirena了
- •
- 继续将滑块保持在此向前位置。将插入器穿过子宫颈,直到凸缘距离子宫颈约1.5–2 cm,然后暂停(图4)。
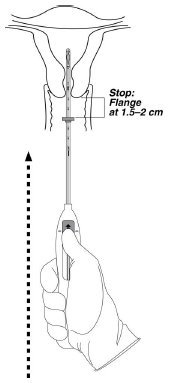
图4推进插入管直到法兰距离子宫颈1.5至2 cm
请勿强行插入器。如有必要,扩张宫颈管。
步骤5 –张开双臂
在稳固插入器的同时,将滑块向下移动到标记,以释放Mirena的臂(图5)。等待10秒钟,使水平臂完全打开。
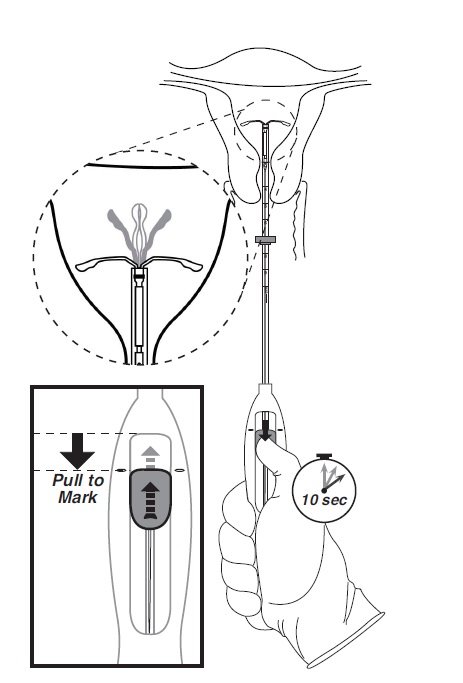
图5将滑块移回标记处,以释放并打开臂
步骤6 –晋升至基本职位
- •
- 轻轻地将插入器向子宫底推进,直到凸缘接触到子宫颈。如果遇到资金阻力,请勿继续前进。 Mirena现在处于基本位置(图6)。 Mirena的基本位置对于防止驱逐至关重要。
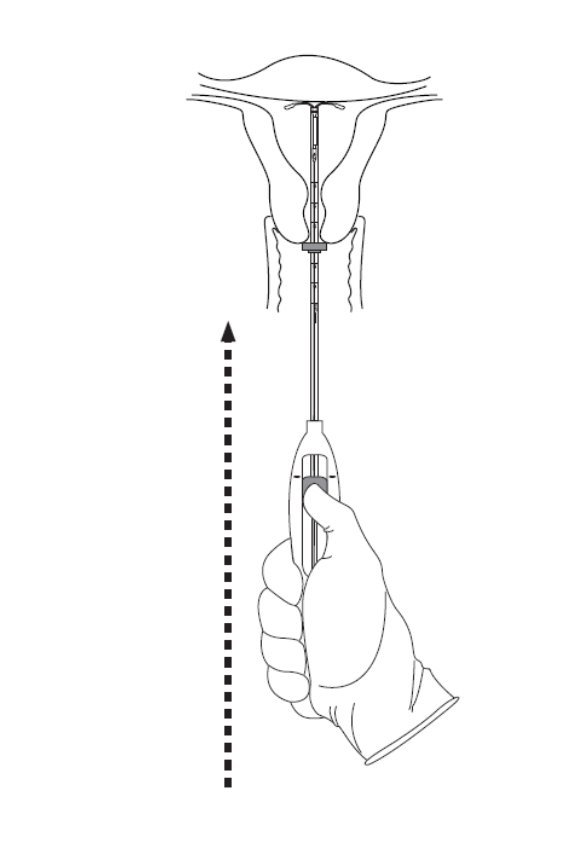
图6将Mirena移至基本位置
步骤7 –释放Mirena并取出插入器
- •
- 将整个插入器牢牢地固定到位,通过将滑块一直向下移动来释放Mirena(图7)。
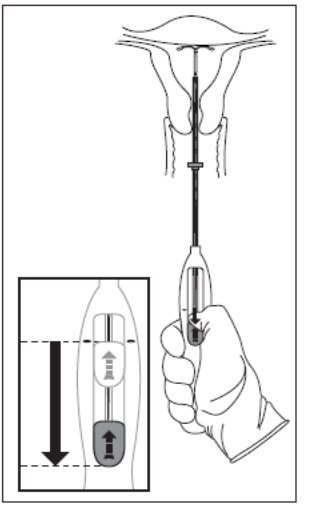
图7完全向下滑动滑块,从插入管中释放Mirena
- •
- 继续缓慢向下将插入器从子宫中完全拉出,同时将其完全向下压。
- •
- 使用锋利的弯曲剪刀,垂直切线,在子宫颈外侧留出大约3 cm的可见角度(以一定角度切割线可能会留下锋利的末端(图8))。切割时请勿施加张力或拉扯螺纹,以免移位Mirena。
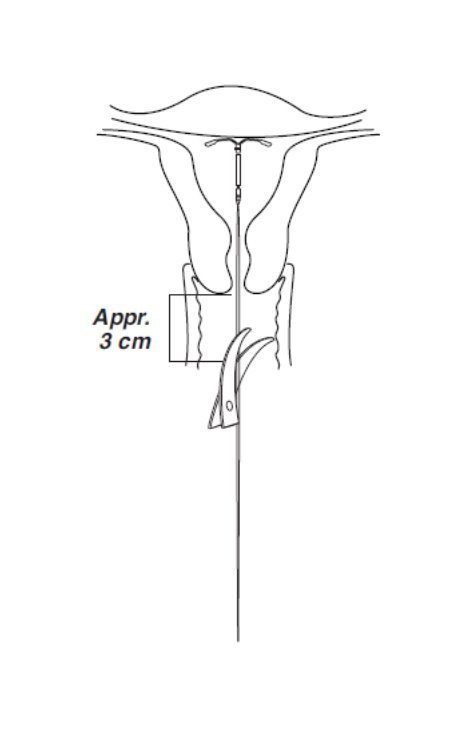
图8剪线
Mirena的插入现已完成。处方镇痛药(如果有指示)。在患者记录中记录Mirena批号。
插入期间或之后要考虑的重要信息
- •
- 如果您怀疑Mirena的位置不正确,请检查位置(例如,使用阴道超声检查)。如果Mirena并未完全位于子宫内,请将其取出。删除的Mirena不能重新插入。
如果存在临床问题,插入过程中或插入后异常疼痛或出血,应立即采取适当步骤(例如体格检查和超声检查)以排除穿孔。
病人跟进
插入后4至6周重新检查并评估患者,此后每年一次,如果有临床指征则更频繁。
拆除米雷娜
去除的时机
- •
- 对于避孕,请在第六年年底之前取出Mirena,如果需要继续使用,则在更换时用新的Mirena更换。如果需要继续治疗严重的月经出血,请在第五年年底之前更换Mirena。
- •
- 如果您不希望怀孕,请在月经期间移除Mirena,前提是该名妇女仍处于月经期。如果在该周期的其他时间进行除菌,请考虑在除菌一周前开始一种新的避孕方法。如果在该周期的其他时间发生摘除,并且该妇女在摘除前一周进行过性交,则她有怀孕的危险。 [参见剂量和用法(2.5) 。]
拆卸工具
制备
- •
- 手套
- •
- 窥镜
程序
- •
- 无菌钳
拆卸程序
- •
- 用镊子在螺纹上轻轻牵引,以去除Mirena。 (图9)。
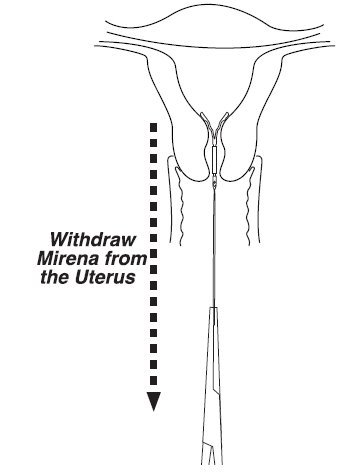
图9卸下Mirena
- •
- 如果看不见螺纹,请通过超声波确定Mirena的位置[请参阅警告和注意事项(5.10)]。
- •
- 如果在超声检查中发现Mirena位于子宫腔中,则可以使用诸如鳄鱼钳之类的窄镊子将其移除。这可能需要扩张宫颈管。卸下Mirena后,请检查系统以确保其完好无损。
切除可能与一些疼痛和/或出血或血管迷走神经反应(例如,晕厥或癫痫患者的癫痫发作)有关。
取出后继续避孕
- •
- 如果不希望怀孕并且妇女希望继续使用Mirena,则在整个周期中的任何时间取出后都可以立即插入新系统。
- •
- 如果有规律周期的患者想要开始使用其他避孕方法,则应减少时间并启动新方法以确保持续避孕。在月经周期的前7天内删除Mirena,然后立即开始新方法;如果在该周期的其他时间要去除Mirena,则至少在删除Mirena之前7天开始使用新方法。
如果周期不规律或闭经的患者想要开始另一种节育方法,请至少在撤除前7天开始使用新方法。
Mirena的适应症和用法
避孕
Mirena可以预防怀孕长达6年;第六年结束后更换。
重度月经出血
Mirena适用于选择使用宫内避孕作为避孕方法的女性,经期最多可治疗5年。如果需要继续治疗严重的月经出血,请在第五年末更换。
Mirena用法用量
随着时间的推移
Mirena含有52毫克左炔诺孕酮(LNG)。最初,LNG的释放速度约为20 mcg /天。该速率在5年后逐渐降低到大约10 mcg /天,在6年后逐渐降低到9 mcg /天。
对于避孕,请在第六年年底之前取出Mirena,如果需要继续使用,则在更换时用新的Mirena更换。
对于月经大量出血的治疗,如果需要继续使用,请在第五年年底之前更换Mirena,因为在此适应症中使用超过5年的数据有限。
Mirena以无菌包装形式提供在插入器中,该插入器可实现单手装载(请参见图1)。除非需要插入,否则不要打开包装[请参见说明( 11.2 )]。如果无菌包装的密封件破裂或损坏,请勿使用。在整个插入过程中使用严格的无菌技术[请参阅警告和注意事项( 5.3 )] 。

插入说明
- •
- 应当获得完整的医学和社会史,以确定可能影响选择左炔诺孕酮的宫内节育系统(LNG IUS)进行避孕的条件。如果有指示,请对任何形式的生殖器或其他性传播感染进行身体检查和适当的检查。 [请参阅禁忌症( 4 )和警告和注意事项( 5.10 )。]
- •
- 严格按照所述的插入说明进行操作,以确保正确放置并避免Mirena从插入器中过早释放。发行后,Mirena无法重新加载。
- •
- Mirena应该由训练有素的医疗服务提供者插入。在尝试插入Mirena之前,医疗服务提供者应完全熟悉插入说明。
- •
- 插入可能与一些疼痛和/或出血或血管迷走神经反应(例如晕厥,心动过缓)有关,或与癫痫患者(尤其是对这些症状易感的患者)癫痫发作有关。考虑在插入之前使用止痛药。
在目前未使用激素或子宫内避孕的女性中开始Mirena | 可以在服务提供者可以确定女性未怀孕的任何时间插入Mirena。在开始使用本产品之前,考虑排卵和受孕的可能性[见禁忌症( 4 )] 。 如果在月经周期的前7天或在早孕流产后立即插入Mirena,则无需备用避孕。 如果在月经周期的前7天未插入Mirena,则应采用屏障避孕方法,或者患者应避免阴道交往7天以防止怀孕。 |
从口服,经皮或阴道激素避孕药改用Mirena | Mirena可以随时插入,包括在先前方法的无激素间隔内。 如果在积极使用前一种方法的过程中被插入,则在Mirena插入后继续该方法7天,或者直到当前治疗周期结束。 如果该妇女正在使用连续激素避孕药,则在Mirena插入后7天停止使用该方法。 |
从可注射的孕激素避孕药改用Mirena | Mirena可以随时插入;如果最后一次注射后3个月(13周)以上插入Mirena,则还应使用备用避孕方法(例如避孕套或杀精子剂)7天。 |
从避孕植入物或其他IUS转到Mirena | 在去除植入物或IUS的同一天插入Mirena。 在月经周期的任何时候都可以插入Mirena。 |
流产或流产后插入Mirena | |
孕早期 | 早孕流产或流产后可能会立即插入Mirena。 |
孕中期 | 在中期流产或流产后至少6周或子宫完全脱离子宫之前,请勿插入Mirena。如果复旧被延迟,等待,直到对合是完全插入之前[见警告和注意事项( 5.6 , 5.7 )]。 如果该妇女还没有怀孕,请考虑在插入Mirena之前发生排卵和受孕的可能性。 [请参阅禁忌症( 4 ),警告和注意事项( 5.2 )和FDA批准的患者标签。] Mirena可以在提供者可以确定女性未怀孕的任何时间插入。 如果在月经周期的前7天未插入Mirena,则应采用备用避孕方法,或者患者应避免阴道交往7天以防止怀孕。 |
分娩后插入Mirena | 分娩后至少6周或子宫完全脱离子宫之前,请勿插入Mirena。如果复旧被延迟,等待,直到对合是完全插入之前[见警告和注意事项( 5.6 , 5.7 )]。 如果该妇女还没有怀孕,请考虑在插入Mirena之前发生排卵和受孕的可能性。 [请参见禁忌症( 4 ),警告和注意事项( 5.2 )]。可以在服务提供者可以确定女性未怀孕的任何时间插入Mirena。 如果在月经周期的前7天未插入Mirena,则应采用备用避孕方法,或者患者应避免阴道交往7天以防止怀孕。 哺乳期妇女的穿孔风险增加。 [请参阅警告和注意事项( 5.6 )。] |
制备
- •
- 手套
- •
- 窥镜
- •
- 子宫不育音
- •
- 无菌触角
- •
- 消毒液,涂抹器
程序
- •
- 无菌手套
- •
- Mirena,插入器密封包装
- •
- 颈旁阻滞的器械和麻醉(如果有)
- •
- 考虑提供未打开的备份Mirena
- •
- 无菌锋利的弯曲剪刀
- •
- 排除怀孕,并确认没有使用Mirena的其他禁忌症。
- •
- 轻轻插入窥镜使子宫颈可视化。
- •
- 用合适的消毒液彻底清洁子宫颈和阴道。
- •
- 准备听起来子宫腔。用触角镊子抓住子宫颈的上唇,并轻轻地施加牵引力,以使子宫颈管与子宫腔保持稳定并对齐。如果需要,请执行子宫颈阻滞。如果子宫逆行,可能更适合抓住子宫颈的下唇。在整个插入过程中,触角应保持在原位,并在子宫颈上保持轻柔的牵引力。
- •
- 轻轻插入子宫声音以检查子宫颈的通畅性,以厘米为单位测量子宫腔的深度,确认腔的方向,并检测是否存在子宫异常。如果遇到困难或宫颈狭窄,请使用扩张而不是用力来克服阻力。如果需要进行宫颈扩张术,可以考虑使用宫颈旁切除术。
- •
- 子宫的声音应达到6至10厘米的深度。通过发声将Mirena插入子宫腔不到6 cm可能会增加驱逐,出血,疼痛,穿孔和可能怀孕的发生率。
仅在完成上述步骤并确定患者适合Mirena后才能进行插入。确保在整个过程中使用无菌技术。
步骤1 –打开包装
- •
- 打开包装(图1)。包装内容物是无菌的。

图1打开Mirena包装
- •
- 使用无菌手套提起无菌插入器的手柄,然后从无菌包装中取出。
步骤2 –将Mirena装入插入管
- •
- 沿箭头方向将滑块尽可能向前推,从而将插入管移到Mirena T形件上,以将Mirena装入插入管中(图2)。臂的尖端将汇合形成一个圆形末端,该末端略微超出插入管。

图2将滑块一直移动到向前位置以加载Mirena
- •
- 用拇指或食指在滑块上保持向前的压力。此时请勿向下滑动滑块,因为这可能会过早释放Mirena的螺纹。将滑块移动到标记的下方时,无法重新加载Mirena。
步骤3 –设置法兰
- •
- 将滑块保持在此向前位置,将法兰的上边缘设置为与在探空过程中测得的子宫深度(厘米)相对应(图3)。

图3设置法兰
步骤4 –现在可以插入Mirena了
- •
- 继续将滑块保持在此向前位置。将插入器穿过子宫颈,直到凸缘距离子宫颈约1.5–2 cm,然后暂停(图4)。

图4推进插入管直到法兰距离子宫颈1.5至2 cm
请勿强行插入器。如有必要,扩张宫颈管。
步骤5 –张开双臂
在稳固插入器的同时,将滑块向下移动到标记,以释放Mirena的臂(图5)。等待10秒钟,使水平臂完全打开。

图5将滑块移回标记处,以释放并打开臂
步骤6 –晋升至基本职位
- •
- 轻轻地将插入器向子宫底推进,直到凸缘接触到子宫颈。如果遇到资金阻力,请勿继续前进。 Mirena现在处于基本位置(图6)。 Mirena的基本位置对于防止驱逐至关重要。

图6将Mirena移至基本位置
步骤7 –释放Mirena并取出插入器
- •
- 将整个插入器牢牢地固定到位,通过将滑块一直向下移动来释放Mirena(图7)。

图7完全向下滑动滑块,从插入管中释放Mirena
- •
- 继续缓慢向下将插入器从子宫中完全拉出,同时将其完全向下压。
- •
- 使用锋利的弯曲剪刀,垂直切线,在子宫颈外侧留出大约3 cm的可见角度(以一定角度切割线可能会留下锋利的末端(图8))。切割时请勿施加张力或拉扯螺纹,以免移位Mirena。

图8剪线
Mirena的插入现已完成。处方镇痛药(如果有指示)。在患者记录中记录Mirena批号。
插入期间或之后要考虑的重要信息- •
- 如果您怀疑Mirena的位置不正确,请检查位置(例如,使用阴道超声检查)。如果Mirena并未完全位于子宫内,请将其取出。删除的Mirena不能重新插入。
如果存在临床问题,插入过程中或插入后异常疼痛或出血,应立即采取适当步骤(例如体格检查和超声检查)以排除穿孔。
病人跟进
插入后4至6周重新检查并评估患者,此后每年一次,如果有临床指征则更频繁。
拆除米雷娜
搬迁时间- •
- 对于避孕,请在第六年年底之前取出Mirena,如果需要继续使用,则在更换时用新的Mirena更换。如果需要继续治疗严重的月经出血,请在第五年年底之前更换Mirena。
- •
- 如果您不希望怀孕,请在月经期间移除Mirena,前提是该名妇女仍处于月经期。如果在该周期的其他时间进行除菌,请考虑在除菌一周前开始一种新的避孕方法。如果在该周期的其他时间发生摘除,并且该妇女在摘除前一周进行过性交,则她有怀孕的危险。 [参见剂量和用法( 2.5 ) 。]
制备
- •
- 手套
- •
- 窥镜
程序
- •
- 无菌钳
- •
- 用镊子在螺纹上轻轻牵引,以去除Mirena。 (图9)。

图9卸下Mirena
- •
- 如果看不见螺纹,请通过超声波确定Mirena的位置[请参阅警告和注意事项( 5.10 )]。
- •
- 如果在超声检查中发现Mirena位于子宫腔中,则可以使用诸如鳄鱼钳之类的窄镊子将其移除。这可能需要扩张宫颈管。卸下Mirena后,请检查系统以确保其完好无损。
切除可能与一些疼痛和/或出血或血管迷走神经反应(例如,晕厥或癫痫患者的癫痫发作)有关。
取出后继续避孕
- •
- 如果不希望怀孕并且妇女希望继续使用Mirena,则在整个周期中的任何时间取出后都可以立即插入新系统。
- •
- 如果有规律周期的患者想要开始使用其他避孕方法,则应减少时间并启动新方法以确保持续避孕。在月经周期的前7天内删除Mirena,然后立即开始新方法;如果在该周期的其他时间要去除Mirena,则至少在删除Mirena之前7天开始使用新方法。
如果周期不规律或闭经的患者想要开始另一种节育方法,请至少在撤除前7天开始使用新方法。
剂型和优势
Mirena是一种释放LNG的IUS,由一个T形聚乙烯框架和一个类固醇储层组成,其中总共包含52 mg LNG。
禁忌症
如果存在以下一种或多种情况,则禁止使用Mirena:
- •
- 怀孕或怀疑怀孕;不能用于性交后避孕[请参阅警告和注意事项( 5.2 )]
- •
- 先天性或获得性子宫异常,包括子宫肌瘤,如果它们扭曲了子宫腔
- •
- 除非有随后的宫内妊娠,否则急性盆腔炎或盆腔炎病史[请参阅警告和注意事项( 5.4 )]
- •
- 过去3个月的产后子宫内膜炎或感染流产
- •
- 已知或怀疑的子宫或宫颈恶性肿瘤
- •
- 现在或过去已知或怀疑的乳腺癌或其他对孕激素敏感的癌症
- •
- 子宫出血原因不明
- •
- 未经治疗的急性宫颈炎或阴道炎,包括细菌性阴道病或其他下生殖道感染,直至感染得到控制
- •
- 急性肝病或肝肿瘤(良性或恶性)
- •
- 与骨盆感染易感性增加有关的疾病[见警告和注意事项( 5.4 )]
- •
- 尚未插入的先前插入的宫内节育器(IUD)
- •
- 对本产品任何成分的超敏反应[请参阅不良反应( 6.2 )]
警告和注意事项
异位妊娠
如果妇女在适当的地方怀孕了Mirena,则评估他们是否有异位妊娠,因为Mirena会增加异位妊娠的可能性。 Mirena就位时发生的怀孕中,有多达一半可能是异位的。在下腹部疼痛的情况下,也要考虑异位妊娠的可能性,尤其是与遗漏月经或闭经妇女开始流血有关。
Mirena临床试验中的异位妊娠发生率约为每年0.1%,该试验排除了有异位妊娠史的女性。有异位妊娠史并使用Mirena的女性发生异位妊娠的风险未知。有异位妊娠,输卵管手术或盆腔感染史的女性发生异位妊娠的风险较高。异位妊娠可能导致生育能力下降。
宫内妊娠
如果使用Mirena时发生怀孕,请移除Mirena,因为将其留在原处可能会增加自然流产和早产的风险。取出Mirena或探查子宫也可能导致自然流产。如果Mirena宫内妊娠,请考虑以下事项:
化脓性流产在原位放置宫内节育器的患者中,可能会发生败血性流产,包括败血症,败血性休克和死亡。
继续怀孕如果一名妇女怀有Mirena的身孕,并且无法将Mirena切除,或者该妇女选择不切除Mirena,请告诫她,如果未切除Mirena,则会增加流产,败血症,早产和早产的风险。密切关注她的怀孕,并建议她立即报告任何表明妊娠并发症的症状。
长期影响和先天性异常如果Mirena继续怀孕,对子代的长期影响是未知的。活产先天性异常很少发生。尚未观察到特定异常的明显趋势。由于胎儿局部暴露于LNG中,因此无法完全排除暴露于Mirena后致畸的可能性。一些观察数据支持,在暴露于孕激素的剂量大于目前口服避孕药剂量后,女性胎儿的外生殖器男性化的风险小幅增加。这些数据是否适用于Mirena尚不清楚。
败血症
Mirena插入后已报道严重感染或败血症,包括A组链球菌败血症(GAS)。在某些情况下,严重疼痛在插入后数小时内发生,然后在数天内发生败血症。由于如果延迟治疗,GAS更有可能导致死亡,因此,重要的是要意识到这些罕见但严重的感染。 Mirena插入过程中的无菌技术对于减少严重感染(例如GAS)至关重要。
盆腔感染
盆腔炎(PID)除非有随后的宫内妊娠,否则在已知或疑似PID的情况下,Mirena是禁忌的,除非有宫内妊娠[见禁忌症( 4 )]。宫内节育器与PID风险增加有关,这很可能是由于有机体在插入过程中被引入子宫所致。在临床试验中,有3.5%的Mirena使用者报告了合并的上生殖器总感染。更具体地说,据报道,女性子宫内膜炎占2.1%,PID占0.6%,所有其他上生殖器感染≤0.5%。这些感染在第一年内更频繁地发生。在使用其他宫内节育器的临床试验1和使用类似Mirena的宫内节育器的临床试验中,最高发生率发生在插入后的第一个月内。
立即检查有下腹部或骨盆疼痛,异味排出,不明原因的出血,发烧,生殖器病变或疮的主诉的使用者。如果子宫内膜炎或PID反复发作,或者急性盆腔感染严重或对治疗无反应,请去除Mirena。
妇女罹患PID的风险增加
PID通常与性传播感染相关,而Mirena不能防止性传播感染。拥有多个性伴侣的女性以及其性伴侣具有多个性伴侣的女性患PID的风险更大。患有PID的女性复发或再感染的风险增加。尤其要确定该妇女感染的风险是否增加(例如,白血病,获得性免疫缺陷综合症[AIDS],静脉吸毒)。
无症状PID
PID可能无症状,但仍会导致输卵管损害及其后遗症。
PID的治疗
诊断为PID或疑似PID后,应获取细菌标本并迅速开始抗生素治疗。通常在开始抗生素治疗后去除Mirena。可从佐治亚州亚特兰大市疾病控制中心(CDC)获得PID治疗指南。 1个
放线菌病
放线菌病与宫内节育器有关。有症状的女性应去除Mirena,并应接受抗生素治疗。无症状宫内节育器使用者在巴氏涂片上放线菌样生物的重要性尚不清楚,因此仅凭这一发现并不总是需要去除和治疗Mirena。如果可能,用培养物确认巴氏涂片诊断。
不规则出血和闭经
Mirena可以改变出血模式并导致斑点,不规则出血,大量出血,月经少和闭经。在使用Mirena的前三到六个月中,出血和斑点天数可能会增加,并且出血方式可能会不规则。此后,出血和斑点天数通常减少,但出血可能保持不规则。如果在长期治疗期间出现出血不规则现象,则应采取适当的诊断措施以排除子宫内膜病变。
一年后,约有20%的Mirena用户出现闭经。如果在前一次月经开始后六周内未发生月经,则应考虑怀孕的可能性。一旦排除了妊娠,除非有其他迹象,例如,其他妊娠迹象或骨盆疼痛,否则闭经妇女通常无需重复进行妊娠试验[见临床研究( 14.1 )]。
在大多数月经出血严重的女性中,在治疗的最初几个月内出血和斑点天数也可能增加,但通常随着持续使用而减少;每个周期的失血量逐渐减少[参见临床研究( 14.2 )]。
穿孔
穿孔(全部或部分穿孔,包括Mirena在子宫壁或子宫颈中的渗透/嵌入)在插入过程中可能最常发生,尽管直到一段时间后才可以检测到穿孔。穿孔可能会降低避孕药效并导致怀孕。在临床试验中,排除母乳喂养妇女的穿孔发生率<0.1%。
如果发生穿孔,请找到并卸下Mirena。可能需要手术。如果发生穿孔,延迟检测或去除Mirena可能会导致子宫腔外迁移,粘连,腹膜炎,肠穿孔,肠梗阻,脓肿和邻近内脏糜烂。
如果在子宫逆行固定或未完全退回时插入Mirena,则穿孔的风险可能会增加。延迟Mirena插入至少六周或直到分娩或中期流产后完全复旧为止。
在欧洲进行了为期1年的观察期的大型售后安全性研究,结果表明,插入IUD / IUS时的哺乳与穿孔风险增加有关。据报道,对于Mirena使用者,哺乳期妇女的子宫穿孔发生率为每1000次插入6.3次,而非哺乳期妇女则为每1000次插入1.0次。
开除
可能会部分或全部驱逐Mirena,导致失去避孕保护。驱逐可能与出血或疼痛症状相关,或者可能是无症状的并且没有引起注意。 Mirena通常会随着时间的流逝减少月经出血;因此,月经出血的增加可能表示驱逐。如果怀疑由于超声波而被驱逐,请考虑进行进一步的诊断成像,例如X射线[请参阅警告和注意事项( 5.10 )] 。当子宫未完全卷入时,驱逐的风险可能会增加。在临床试验中,报告在5年的研究期内驱逐率为4.5%。
分娩或中期流产后,将Mirena的插入延迟至少六周或直到子宫复旧完全。移除部分被驱逐的Mirena。如果被驱逐出境,则在提供者可以合理确定女性未怀孕的任何时候都可以插入新的Mirena。
卵巢囊肿
由于Mirena的避孕作用主要是由于其在子宫内的局部作用,因此使用Mirena的育龄妇女通常会发生卵泡破裂的排卵周期。有时卵泡闭锁被延迟,卵泡可能继续生长。据报道,使用Mirena的女性中约有8%患有卵巢囊肿。这些囊肿大多数无症状,尽管有些可能伴有骨盆疼痛或性交困难。
在大多数情况下,在观察两到三个月后,卵巢囊肿会自发消失。评价持续性卵巢囊肿。通常不需要手术干预。
乳腺癌
当前患有或曾经患有乳腺癌或怀疑患有乳腺癌的妇女不应使用激素避孕药,因为某些乳腺癌对激素敏感[见禁忌症( 4 )]。
在Mirena的上市后经验中,自发地报告了乳腺癌。使用释放LNG的IUS对乳腺癌风险的观察性研究并未提供确凿的证据表明风险增加。
使用和移除的临床注意事项
如果仔细评估以下条件是否存在,请谨慎使用Mirena;如果在使用过程中出现以下任何情况,请考虑卸下系统:
- •
- 凝血障碍或使用抗凝剂
- •
- 偏头痛,局灶性偏头痛伴不对称视力减退或其他症状表明短暂性脑缺血
- •
- 异常严重的头痛
- •
- 血压明显升高
- •
- 严重的动脉疾病,例如中风或心肌梗塞
此外,如果在使用过程中出现以下任何情况,请考虑移除Mirena [请参阅禁忌症( 4 )] :
- •
- 子宫或宫颈恶性肿瘤
- •
- 黄疸
如果看不见螺纹或螺纹明显缩短,则它们可能折断或缩回到宫颈管或子宫中。考虑,该系统可能已被移位(例如,驱逐或穿孔子宫)的可能性[见警告和注意事项( 5.6 , 5.7 )]。排除怀孕并例如通过超声检查,X射线或使用合适的仪器轻轻探查宫颈管来验证Mirena的位置。如果Mirena流离失所,请将其移除。如果确定没有怀孕,可以在那时或下一次月经期间插入新的Mirena。如果Mirena就位且无穿孔迹象,则无需干预。
不良反应
标签中其他地方讨论了以下严重或其他重要的不良反应:
- •
- 异位妊娠[请参阅警告和注意事项( 5.1 )]
- •
- 宫内妊娠[请参阅警告和注意事项( 5.2 )]
- •
- A组链球菌败血症(GAS) [请参阅警告和注意事项( 5.3 )]
- •
- 盆腔炎[请参阅警告和注意事项( 5.4 )]
- •
- 出血方式的更改[请参阅警告和注意事项( 5.5 )]
- •
- 穿孔[请参阅警告和注意事项( 5.6 )]
- •
- 开除[请参阅警告和注意事项( 5.7 )]
- •
- 卵巢囊肿[请参阅警告和注意事项( 5.8 )]
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此不能将在某种药物的临床研究中观察到的不良反应率直接与另一种药物的临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
表2中提供的数据反映了在充分和良好对照的研究以及在避孕和月经大量出血的支持性和非对照研究中使用Mirena的经验(n = 5,091)。数据涵盖使用12年之久的女性至最高使用5年,主要是在避孕研究中(11 761妇女年)。报告的药物不良反应的频率代表粗略的发生率。
最常见的不良反应(≥10%使用者)是月经出血类型的改变(包括计划外子宫出血(31.9%),子宫出血减少(23.4%),计划子宫出血增加(11.9%)和女性生殖道出血( 3.5%)],腹部/骨盆疼痛(22.6%),闭经(18.4%),头痛/偏头痛(16.3%),生殖器分泌物(14.9%)和外阴阴道炎(10.5%)。表2显示了≥5%的用户报告的不良反应。
系统器官分类 | 不良反应 | %(N = 5,091) |
生殖系统和乳房疾病 | 月经出血方式的改变,包括: 计划外子宫出血 减少子宫出血 计划性子宫出血增加 女性生殖道出血 | 31.9 23.4 11.9 3.5 |
闭经 | 18.4 | |
生殖器分泌物 | 14.9 | |
外阴阴道炎 | 10.5 | |
乳房疼痛 | 8.5 | |
卵巢良性囊肿及相关并发症 | 7.5 | |
痛经 | 6.4 | |
胃肠道疾病 | 腹部/骨盆疼痛 | 22.6 |
神经系统疾病 | 头痛/偏头痛 | 16.3 |
肌肉骨骼和结缔组织疾病 | 背疼 | 7.9 |
皮肤和皮下 | 粉刺 | 6.8 |
精神病 | 抑郁/抑郁情绪 | 6.4 |
在<5%的受试者中发生的其他不良反应包括脱发,(部分和完全)装置性驱逐,多毛症,恶心和PID /子宫内膜炎。
一项针对362名使用Mirena超过5年的女性的独立研究显示,在第6年出现了一致的不良反应。到使用6年结束时,分别有24%和31%的使用者经历了闭经和不频繁出血; 15%的人会发生不规则出血,而2%的使用者会出现长时间的出血。
上市后经验
在Mirena的批准后使用过程中,发现了以下不良反应。由于这些反应是从不确定大小的人群中自愿报告的,因此并非总是能够可靠地估计其发生频率或建立与药物暴露的因果关系。
- •
- 动脉血栓和静脉血栓栓塞事件,包括肺栓塞,深静脉血栓形成和中风
- •
- 设备损坏
- •
- 超敏反应(包括皮疹,荨麻疹和血管性水肿)
- •
- 血压升高
药物相互作用
Mirena尚未进行药物相互作用研究。
在使用Mirena的过程中,诱导或抑制LNG代谢酶(包括CYP3A4)的药物或草药产品可能分别降低或增加LNG的血清浓度。但是,Mirena的避孕作用是通过将LNG直接释放到子宫腔中来介导的,不太可能受到酶诱导或抑制作用下药物相互作用的影响。
在特定人群中的使用
怀孕
风险摘要使用曼月乐在怀孕或怀疑怀孕是禁忌,因为在一个女人谁是已经怀孕和曼月乐可能会导致不良妊娠结局[见禁忌证(不需要预防怀孕4 ),警告和注意事项( 5.1 , 5.2 ) ]。如果妇女在适当的地方接受Mirena怀孕,则异位妊娠的可能性会增加,流产,败血症,早产和早产的风险也会增加。如果在使用Mirena的妇女中怀孕,则尽可能移除Mirena。如果曼月乐不能被删除,按照妊娠密切[见警告和注意事项( 5.1 , 5.2 )]。
研究报告称,孕妇长期服用避孕剂量的口服孕激素不会对胎儿和婴儿发育产生不利影响。但是,据报道,在暴露于孕激素的剂量大于目前口服避孕药剂量后,女性胎儿的外生殖器发生男性化的情况。
哺乳期
风险摘要已发表的研究报告了母乳中存在液化天然气。在使用Mirena的哺乳母亲的母乳中检测到少量孕激素(约占母体总剂量的0.1%),导致LNG暴露于母乳喂养的婴儿。没有关于母体仅使用孕激素避孕药的母乳喂养婴儿的不良反应的报道。 Mirena曾报告过个别牛奶产量下降的案例。应当考虑母乳喂养的发育和健康益处,以及母亲对Mirena的临床需求以及Mirena或潜在母体状况对母乳喂养孩子的任何潜在不利影响。
8.3生殖潜力的男性和女性中止Mirena后重返生育
在两项研究中,对总共229名终止研究后希望怀孕的妇女进行了调查,并提供了随访信息。 Mirena切除后12个月内受孕的可能性约为80%。
儿科用
Mirena的安全性和功效已在育龄妇女中确立。预计18岁以下的青春期女性与18岁以上的使用者的功效相同。未指示初潮前使用本产品。
老人用
Mirena尚未在65岁以上的女性中进行研究,因此未获批准在此人群中使用。
肝功能不全
没有研究评估肝病对Mirena释放的LNG处置的影响[见禁忌症( 4 )]。
肾功能不全
没有研究评估肾病对Mirena释放的LNG处置的影响。
Mirena说明
Mirena(释放左炔诺孕酮的子宫内系统)含有52 mg LNG(一种孕激素),旨在提供大约20 mcg /天的LNG初始释放速率。
左炔诺孕酮USP,(-)-13-乙基-17-羟基-18,19-dinor-17α-pregn-4-en-20-yn-3-one是Mirena中的活性成分,分子量为312.4, C 21 H 28 O 2的分子式和以下结构式:

米雷娜
Mirena由一个T形聚乙烯框架(T形主体)组成,在垂直杆周围有一个类固醇贮存器(激素弹性体核)。储库由白色或几乎白色的圆柱体组成,由左炔诺孕酮和有机硅(聚二甲基硅氧烷)的混合物制成,共含52 mg左炔诺孕酮。储存器被半透明的有机硅(聚二甲基硅氧烷)膜覆盖。 T型主体在水平和垂直方向上均为32毫米。 T体的聚乙烯与硫酸钡混合,使其不透射线。将单丝棕色聚乙烯去除线连接到T体垂直杆末端的环上。清除线的聚乙烯包含氧化铁作为着色剂(请参见图10)。
Mirena的组件(包括其包装)不是使用天然橡胶乳胶制造的。

图10 Mirena
插入器
Mirena无菌包装在插入器中。用于将Mirena插入子宫腔的插入器(图11)由对称的两侧主体和滑块组成,该主体与法兰,锁,预弯曲的插入管和柱塞集成在一起。插入管的外径为4.4毫米。 Mirena的垂直杆装在插入器尖端的插入管中。臂在水平位置已预先对齐。拆卸螺纹包含在插入管和手柄内。放置Mirena后,将丢弃插入器。

图11插入器示意图
Mirena-临床药理学
作用机理
尚未最终证实持续释放LNG增强Mirena避孕效果的局部机制。 Mirena和类似的LNG IUS原型的研究提出了几种防止怀孕的机制:宫颈粘液变厚,阻止精子进入子宫,抑制精子获能或存活,以及子宫内膜改变。
药效学
Mirena在子宫腔内主要具有局部孕激素作用。 LNG 2的局部高水平导致形态学改变,包括基质假蜕膜化,腺体萎缩,白细胞浸润以及腺体和基质有丝分裂减少。
一些使用Mirena的女性排卵受到抑制。在一项为期1年的研究中,约有45%的月经周期是排卵,而在另一项研究中,在4年后,有75%的周期是排卵。
药代动力学
吸收性使用Mirena宫腔内输送系统将低剂量的LNG注入子宫腔。在测试的前3个月(第0天到第90天)中,初始释放速率约为20 mcg /天。 1年后降低到大约18 mcg /天,5年后降低到10 mcg /天,6年后降低到9 mcg /天。
在Mirena插入后的最初几周内,LNG的血清稳定浓度为150-200 pg / mL,没有峰值和谷值。长期使用12、24、60和72个月后的LNG浓度分别为180±66 pg / mL,192±140 pg / mL,159±59 pg / mL和121±49 pg / mL。
分配据报道,LNG的表观分布体积约为1.8 L / kg。它约占蛋白质结合的97.5%至99%,主要结合性激素结合球蛋白(SHBG),在较小程度上结合血清白蛋白。
代谢吸收后,LNG在17β-OH位置缀合,形成硫酸盐缀合物,并在较小程度上在血清中形成葡糖醛酸苷缀合物。血清中也存在大量的缀合和未缀合的3α,5β-四氢左炔诺孕酮,以及更少量的3α,5α-四氢左炔诺孕酮和16β-羟基左炔诺孕酮。 LNG及其第一阶段代谢产物主要以葡糖醛酸苷共轭物的形式排出。个体之间的代谢清除率可能相差几倍,这可能部分解释了使用含LNG避孕产品的个体中LNG浓度的个体差异很大。体外研究表明,LNG的氧化代谢被CYP酶,尤其是CYP3A4催化。
排泄大约45%的LNG及其代谢物通过尿液排泄,而大约32%的粪便则以葡萄糖醛酸化物结合物排泄。每日口服剂量后,LNG的消除半衰期约为17小时。
特定人群儿科:Mirena已在育龄妇女中确立了安全性和有效性。未指示初潮前使用本产品。
老人科:Mirena尚未在65岁以上的女性中进行研究,目前尚未批准在该人群中使用。
种族:尚无研究评估种族对Mirena药代动力学的影响。
肝功能不全:未进行评估肝病对Mirena处置的影响的研究。
肾功能不全:未进行正式研究以评估肾病对Mirena处置的影响。
药物相互作用Mirena没有进行任何药物相互作用研究[请参阅药物相互作用( 7 )] 。
非临床毒理学
致癌,诱变,生育力受损
[请参阅警告和注意事项( 5.9 )]
临床研究
避孕的临床试验
Mirena的安全性和有效性在芬兰和瑞典的两项临床试验中进行了研究。在这些试验中,有1169名18至35岁的女性在Mirena中使用了长达5年的时间,总共暴露了45,000个女性月。其中5.6%(66)是未生育妇女。受试者先前曾怀孕,无异位妊娠史,在过去12个月内没有盆腔炎史,主要为白人,并且超过70%的受试者先前曾使用过宫内节育器(宫内节育器)。报告的12个月怀孕率小于或等于每100名女性0.2(0.2%),累计5年怀孕率约为每100名女性0.7(0.7%)。
Mirena延长试验(NCT02985541)研究了Mirena延长使用5年以上的避孕功效,该试验是在美国进行的一项多中心,开放标签,未经控制的研究。该试验招募了18至35岁的女性,她们在入选时使用Mirena的时间不少于4.5年且不超过5年。功效人群包括使用Mirena的362名妇女。其中47.2%是未产的。女性主要是白人(75.4%);妇女中有14.1%是黑人/非洲裔美国人,有2.5%是亚洲人;西班牙裔占11.3%。体重范围为38.5–163.5 kg(平均体重:75.6 kg),平均BMI为27.9 kg / m 2 (范围:15.4–57.7 kg / m 2 )。主要功效终点是在6年末以36岁以下女性的Pearl指数(PI)计算的妊娠率。 PI是根据28天等效暴露周期计算的;可评估的周期不包括使用后备避孕的周期,除非在那个周期中发生了怀孕。共有362名妇女贡献了3,722个周期。根据Mirena移除或驱逐后6年内以及7天之内发生的1次怀孕,使用6年的PI为0.35,95%置信上限为1.95。
重度月经出血的临床试验
在将Mirena(n = 79)与已批准的醋酸甲羟孕酮(MPA)(n = 81)进行比较的一项随机,开放标签,主动对照,平行分组的随机试验中,研究了Mirena在治疗严重月经出血中的功效。 ),超过6个周期。受试者包括健康状况良好,没有禁忌药物且经碱性血红素法确诊的经血大量月经出血(≥80 mL月经失血[MBL])的育龄妇女。排除患有器质性或全身性疾病的妇女,这些疾病可能会导致严重的子宫出血(小肌瘤除外,总体积不大于5 mL)。 Mirena的治疗显示MBL的减少量在统计学上有显着提高(请参见图12),成功治疗的受试者数量在统计学上有显着提高(请参见图13)。成功的治疗定义为:(1)研究结束的MBL <80 mL,以及(2)从基线到研究结束的MBL降低≥50%的受试者的比例。

图12按时间和治疗划分的月经中位数失血(MBL)

图13成功治疗的受试者比例
参考资料
1 http://www.cdc.gov/std/tg2015/pid.htm。 2016年8月22日访问。
供应/存储和处理方式
泥潭
已知共有210种药物与Mirena(左炔诺孕酮)相互作用。
- 31种主要药物相互作用
- 167种中等程度的药物相互作用
- 12小药物相互作用
检查互动
最常检查的互动
查看有关Mirena(左炔诺孕酮)和以下药物的相互作用报告。
- 沙丁胺醇
- 氯硝西am
- mb(度洛西汀)
- 加巴喷丁
- 羟嗪
- 布洛芬
- 布洛芬
- Lamictal(拉莫三嗪)
- 左甲状腺素
- 褪黑激素
- 褪黑激素
- 奥美拉唑
- Peri-DS(黄麻醇/多库酯)
- 强的松
- 黄体酮
- 普萘洛尔
- 百忧解(氟西汀)
- Topamax(托吡酯)
- 曲马多
- 曲唑酮
- 维生素B12(氰钴胺)
- 维生素D3(胆钙化固醇)
- Yasmin(屈螺酮/乙炔雌二醇)
- Zoloft(舍曲林)
- Zyrtec(西替利嗪)
Mirena(左炔诺孕酮)酒精/食物相互作用
Mirena(levonorgestrel)与酒精/食物有5种相互作用
Mirena(左炔诺孕酮)疾病相互作用
与Mirena(左炔诺孕酮)有13种疾病相互作用,包括:
- 生殖器异常出血
- 肝肿瘤
- 颅内HTN
- 血栓栓塞
- 乳房恶性肿瘤
- 肝病
- 萧条
- 体液潴留
- 葡萄糖不耐症
- 视网膜血栓形成
- 甲状腺功能检查
- 高脂血症
- 体重增加
药物相互作用分类
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义最小。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
- 审批历史 FDA的药物史
美国日本医生

Heather Benjamin MD

Heather Benjamin MD

Heather Miske DO

Heather Miske DO

Bert Hepner DO

渡邊剛

村上和成 教授

中山秀章 教授

村田朗

溝上裕士 医院教授
临床试验
- 评估接受同种异体SCT(COSI)AML和MD的成年人结果影响的治疗试验
- 犬类气味诊断(KDOG1)的乳腺癌诊断(KDOG1)
- 结直肠癌患者和健康对照组中的挥发性有机化合物(VOC)谱。
- 癌症,营养和味觉(CANUT-1)
- 一项关于使用短信提醒使用Palbociclib的研究
- NAB-甲氟甲酰胺和alpelisib用于用PIK3CA或PTEN改变的蒽环类药物治疗难治性三重阴性乳腺癌
- 对患有晚期恶性肿瘤受试者的牛thotinib的研究
- 现代疗法治疗的癌症患者的血液,唾液和尿液的拉曼光谱的临床研究
- 与化学疗法和预防冰水浸入指甲色素沉着相关的指甲变化(Nipper)
- 曲妥珠单抗生物仿制药(Samfenet®)加上HER2阳性实体瘤(BIOS-HER)患者的医师选择(TPC)的治疗