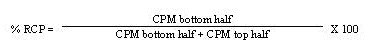获取国外泽伐林药品价格,使用等信息,最快 24 小时回馈
泽伐林
泽伐林
在本页面
- 盒装警告
- 适应症和用法
- 剂量和给药
- 剂型和优势
- 禁忌症
- 警告和注意事项
- 不良反应/副作用
- 药物相互作用
- 在特定人群中使用
- 过量
- 描述
- 临床药理学
- 非临床毒理学
- 临床研究
- 供应/存储和处理方式
- 病人咨询信息
严重的输注反应:输注利妥昔单抗后24小时内死亡,这是Zevalin治疗方案的重要组成部分。这些死亡与缺氧,肺部浸润,急性呼吸窘迫综合征,心肌梗塞,心室纤颤或心源性休克有关。多数(80%)死亡是在第一次利妥昔单抗输注时发生的[见警告和注意事项(5.1)和不良反应(6.1) ]。发生严重输注反应的患者应停止利妥昔单抗和Y-90 Zevalin输注。
长时间和严重的Cytopenias:大多数患者使用Y-90 Zevalin会导致严重的和长期的血细胞减少。请勿对淋巴瘤≥25%骨髓受累和/或骨髓储备受损的患者使用Y-90 Zevalin [见警告和注意事项(5.2)和不良反应(6.1) ]。
严重的皮肤和粘膜皮肤反应:Zevalin治疗方案可能会发生严重的皮肤和粘膜皮肤反应,有些致命。在发生严重皮肤或粘膜皮肤反应的患者中停用利妥昔单抗和Y-90 Zevalin输注[见警告和注意事项(5.3)和不良反应(6.2) ]。
剂量:Y-90 Zevalin的剂量不应超过32.0 mCi(1184 MBq) [参见剂量和用法(2.2) ]。
Zevalin的适应症和用法
复发或难治性,低度或滤泡性NHL
Zevalin被指定用于治疗患有复发或难治性,低度或滤泡性B细胞非霍奇金淋巴瘤(NHL)的成年患者。
先前未治疗的滤泡性NHL
Zevalin适用于治疗对一线化疗有部分或完全反应的成年患者中先前未治疗的滤泡性NHL。
泽伐林剂量和给药
建议加药时间表
- •
- 如下所述施用Zevalin治疗方案。
- •
- 在最后一线化疗后至少6周但不超过12周,血小板计数恢复至150,000 / mm 3或更高后,开始Zevalin治疗方案。
- •
- 仅在可立即使用复苏措施的设施中使用利妥昔单抗/ Zevalin。
给药时间表概述

Zevalin治疗方案的剂量和给药
第一天:
- •
- 利妥昔单抗输注前,口服对乙酰氨基酚650 mg和苯海拉明50 mg。
- •
- 初始剂量为50 mg / hr时,静脉使用rituximab 250 mg / m 2 。在没有输液反应的情况下,以每30分钟50 mg / hr的增量递增输注速率,最高可达到400 mg / hr。请勿将利妥昔单抗与其他药物混合或稀释。
- •
- 立即停止利妥昔单抗的输注以引起严重的输注反应,并终止Zevalin治疗方案[请参阅带框警告和警告与注意事项(5.1) ]。
- •
- 暂时减慢或中断利妥昔单抗的输注,以减轻不太严重的输注反应。如果症状改善,继续以先前速度的一半输注。
第7、8或9天:
- •
- 利妥昔单抗输注前,口服对乙酰氨基酚650 mg和苯海拉明50 mg。
- •
- 静脉注射利妥昔单抗250 mg / m 2 ,初始速率为100 mg / hr。以允许的速度,以30分钟的间隔以100 mg / hr的增量增加速率,最大可达到400 mg / hr。如果在治疗的第1天,在输注利妥昔单抗期间发生输注反应,请以50 mg / hr的初始速率给予利妥昔单抗,并以每30分钟50 mg / hr的增量递增输注速率,直至最高400 mg / hr。
- •
- 利妥昔单抗输注完成后4小时内,通过自由流动的静脉输注线管理Y-90 Zevalin注射液。在注射器和输液口之间使用0.22微米的低蛋白结合在线过滤器。输液后,用至少10 mL生理盐水冲洗管线。
- Ø
- 如果血小板计数至少为150,000 / mm 3 ,则在10分钟内以Y-90 0.4 mCi / kg(14.8 MBq / kg)实际体重的剂量静脉内输注Y-90 Zevalin。
- Ø
- 如果血小板计数为100,000至149,000 / mm 3 ,在复发或难治性患者中,应在10分钟内以每公斤Y-90 0.3 mCi(每公斤实际体重11.1 MBq)的剂量静脉内输注Y-90 Zevalin。
- Ø
- 无论患者体重如何,Y-90 Zevalin的剂量都不要超过32 mCi(1184 MBq)。
- •
- 在输注Y-90 Zevalin期间,密切监视患者是否有渗出的迹象。如果出现渗出的任何迹象或症状,请立即停止输液并在另一肢重新开始[见警告和注意事项(5.5) ]。
放射性标记的Y-90 Zevalin剂量的制备说明
制备Yttrium-90(Y-90)Zevalin需要使用标签清晰的试剂盒。请按照详细说明制备放射性标记的泽伐林[请参阅剂量和用法(2.4) ]。
套件中未提供的必需材料:
- 1。
- Yttrium-90氯化物无菌溶液
- 2。
- 三个无菌1 mL塑料注射器
- 3。
- 一个无菌的3 mL塑料注射器
- 4。
- 两个带有18-20 G针头的无菌10 mL塑料注射器
- 5,
- ITLC硅胶条
- 6。
- 色谱溶剂为0.9%氯化钠水溶液
- 7
- 色谱显影室
- 8。
- 合适的放射性计数仪
- 9。
- 过滤器,0.22微米,低蛋白结合
- 10。
- 适用于Y-90的反应瓶和注射器的丙烯酸涂层屏蔽
方法:
- 1。
- 让冷藏的Y-90 Zevalin试剂盒(Zevalin小瓶,50 mM乙酸钠小瓶和制剂缓冲液小瓶)中的内容物达到室温。
- 2。
- 将空的反应瓶放在适当的丙烯酸保护层中。
- 3。
- 确定所需的每个组件的数量:
- 一种。
- 根据Y-90氯化物原液的活性浓度,计算相当于40 mCi的Y-90氯化物体积。
- b。
- 所需的50 mM乙酸钠溶液的体积是上述步骤3.a中确定的Y-90氯化物溶液体积的1.2倍。
- C。
- 计算使反应小瓶内容物达到最终体积10 mL所需的配制缓冲液的体积。
- 4。
- 将计算量的50 mM乙酸钠转移到空的反应瓶中。通过轻轻翻转或滚动,在反应瓶的整个内表面上涂上一层涂层。
- 5,
- 使用丙烯酸屏蔽注射器将40 mCi的Y-90氯化物转移至反应瓶中。通过轻轻反转或滚动将两种溶液混合。
- 6。
- 将1.3 mL的Zevalin(依替莫单抗tiuxetan)转移至反应瓶中。请勿摇动或搅动样品瓶中的内容物。
- 7
- 使标记反应在室温下进行5分钟。较短或较长的反应时间可能会对最终标记的产品产生不利影响。
- 8。
- 孵育5分钟后,立即从步骤3.c转移计算体积的制剂缓冲液。到反应瓶中。在反应瓶侧面轻轻添加配方缓冲液。如有必要,抽取等量的空气以使压力正常化。
- 9。
- 使用适合测量Y-90的放射性校准系统测量最终产品的总活性。
- 10。
- 使用提供的标签,记录准备的日期和时间,总活性和总量以及有效期和时间,然后将这些标签粘贴到带屏蔽的反应瓶容器中。
- 11。
- 患者剂量:计算Y-90 Zevalin剂量所需的体积[参见剂量和用法(2.2) ]。从反应瓶中取出所需的体积。在适合于测量Y-90的剂量校准器中测定注射器。测量剂量必须在Y-90 Zevalin处方剂量的10%以内,并且不得超过32 mCi(1184 MBq) 。使用提供的标签,记录患者标识符,总活动量和总量以及有效期和时间,然后将这些标签粘贴到注射器和带屏蔽的单位剂量容器上。
- 12
- 确定放射化学纯度[ sEE剂量和给药方法(2.4) ]。
- 13
- 将Yttrium-90 Zevalin储存在2-8°C(36-46°F(华氏度))直到使用并在放射性标记的8小时内施用。即将给药前,使用适合于Y-90测量的放射性校准系统分析注射器和内容物。
测定放射化学纯度的程序
使用以下步骤对Y-90 Zevalin进行放射性标记:
- 1。
- 在ITLC硅胶条的起点处放一滴Y-90 Zevalin。
- 2。
- 将ITLC硅胶条放入色谱室中,原点在底部,溶剂在顶部。使溶剂(0.9%NaCl)从试纸底部迁移至少5 cm。从反应室中取出胶条并切成两半。用合适的计数设备将ITLC硅胶条的每一半计数1分钟(CPM)。
- 3。
- 计算RCP百分比,如下所示:

- 4。
- 如果放射化学纯度小于95%,请重复ITLC程序。如果重复测试确认放射化学纯度小于95%,请不要使用Y-90 Zevalin剂量。
辐射剂量法
在使用Zevalin进行临床试验期间,使用连续的全身图像和MIRDOSE 3软件程序估算了Y-90 Zevalin的辐射吸收剂量。表1总结了一个Zevalin治疗方案对器官和骨髓的估计辐射吸收剂量。对大肠下部,大肠上部和小肠的吸收剂量估计值已从标准MIRDOSE 3输出进行了修改,以考虑到假设活动是在肠壁内而不是在肠内容物中。
| ||
| 器官 | Y-90 Zevalin cGy / mCi(mGy / MBq) | |
| 中位数 | 范围 | |
| 脾* | 34.78(9.4) | 6.66-74.00(1.8-20.0) |
| 肝* | 17.76(4.8) | 10.73-29.97(2.9-8.1) |
| 下大肠壁* | 17.39(4.7) | 11.47-30.34(3.1-8.2) |
| 上大肠壁* | 13.32(3.6) | 7.40-24.79(2.0-6.7) |
| 心墙* | 10.73(2.9) | 5.55-11.84(1.5-3.2) |
| 肺* | 7.4(2) | 4.44-12.58(1.2 -3.4) |
| 睾丸* | 5.55(1.5) | 3.70-15.91(1.0-4.3) |
| 小肠* | 5.18(1.4) | 2.96-7.77(0.8-2.1) |
| 红骨髓† | 4.81(1.3) | 2.22-6.66(0.6-1.8) |
| 尿囊壁‡ | 3.33(0.9) | 2.59-4.81(0.7-1.3) |
| 骨骼表面† | 3.33(0.9) | 1.85-4.44(0.5-1.2) |
| 全身‡ | 1.85(0.5) | 1.48-2.59(0.4-0.7) |
| 卵巢‡ | 1.48(0.4) | 1.11-1.85(0.3-0.5) |
| 子宫‡ | 1.48(0.4) | 1.11-1.85(0.3-0.5) |
| 肾上腺 | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 脑‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 乳房‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 胆囊壁‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 肌肉‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 胰腺‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 皮肤‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 胃‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 胸腺‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 甲状腺‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 肾脏* | 0.37(0.1) | 0.00-1.11(0.0-0.3) |
剂型和优势
注射剂:在单剂量小瓶中,每2 mL含3.2 mg ibritumomab tiuxetan,为澄清,无色溶液,可能包含半透明颗粒。
禁忌症
没有。
警告和注意事项
严重的输液反应
利妥昔单抗单独或作为Zevalin治疗方案的组成部分可引起严重的(包括致命的)输注反应。这些反应通常在首次利妥昔单抗输注期间发生,发作时间为30至120分钟。严重输注反应的体征和症状可能包括荨麻疹,低血压,血管性水肿,缺氧,支气管痉挛,肺部浸润,急性呼吸窘迫综合征,心肌梗塞,心室纤颤和心源性休克。暂时减慢或中断利妥昔单抗的输注,以减轻不太严重的输注反应。立即停用利妥昔单抗和Y-90 Zevalin进行严重的输注反应。仅在可立即使用复苏措施的设施中使用利妥昔单抗/泽伐林[见盒装警告,剂量和给药方法(2.2) ]。另请参阅利妥昔单抗的处方信息。
长时间和严重的Cytopenias
Zevalin治疗方案最常见的严重不良反应是发生延迟和持续时间长的Cytopenias,有些并发出血和严重感染。按推荐剂量使用时,轻度基线血小板减少症(≥100,000但≤149,000 / mm 3 )的患者严重血小板减少和中性粒细胞减少的发生率高于正常血小板计数的患者。严重的血细胞减少症可在给药后持续超过12周。每周接受Zevalin治疗方案后监测全血细胞计数(CBC)和血小板计数,直至水平恢复或临床指示[见盒装警告和不良反应(6.1) ]。
不要对淋巴瘤≥25%骨髓受累和/或骨髓储备受损的患者使用Zevalin治疗方案。使用Zevalin治疗方案后最多3个月监测患者的血细胞减少症及其并发症(例如,发热性中性粒细胞减少,出血)。避免使用在Zevalin治疗方案后会干扰血小板功能或凝血的药物。
严重的皮肤和粘膜皮肤反应
在上市后的经验中报道了多形性红斑,史蒂文斯-约翰逊综合征,中毒性表皮坏死溶解,大疱性皮炎和剥脱性皮炎,其中一些是致命的。这些反应发生的时间是可变的,在施用泽伐林治疗方案后的几天到4个月不等。在发生严重的皮肤或粘膜皮肤反应的患者中停用Zevalin治疗方案[见盒装警告和不良反应(6.2) ]。
发生骨髓增生异常综合症,白血病和其他恶性肿瘤的风险
由治疗性暴露于Y-90放射性标记的泽伐林引起的辐射剂量可导致继发性恶性肿瘤。
在临床研究中,有5.2%(11/211)的复发或难治性NHL患者报告了骨髓增生异常综合症(MDS)和/或急性骨髓性白血病(AML),而扩大后的研究中则报道了1.5%(8/535)的患者访问试验,中位随访时间分别为6.5年和4.4年。在所报道的19个病例中,使用Zevalin治疗方案治疗后,诊断MDS或AML的中位时间为1.9年;然而,累积发生率继续增加[见不良反应(6.1) ]。
一线化疗后接受Y-90 Zevalin的204例患者中,Zevalin组中的26例(12.7%)患者发生了第二原发恶性肿瘤,而对照组中14例(6.8%)。接受泽伐林治疗后有7例患者(3.4%,7/204)被诊断出MDS / AML,而对照组的1例患者(0.5%,1/205)被诊断为MDS / AML,中位随访时间为7.3年。 Zevalin组由第二原发恶性肿瘤导致的死亡包括8(3.9%)患者,而对照组则为3(1.5%)。 Zevalin组死于MDS / AML的患者包括5名(2.5%),而对照组则没有。
监测患者的血液学毒性,包括MDS或AML的发展。
外渗
密切监视患者以了解泽伐林输注过程中是否有渗出的迹象。如果出现渗出的迹象或症状,请立即终止输注,并在另一肢中重新开始[见剂量和用法(2.2) ] 。
免疫风险
Zevalin治疗方案后用活病毒疫苗免疫的安全性尚未研究。不要对刚接受Zevalin的患者接种活病毒疫苗。 Zevalin治疗方案对任何疫苗产生免疫反应的能力尚未研究。
放射性核素注意事项
在使用Y-90放射性标记Zevalin的过程中和之后,应尽量减少对患者和医务人员的辐射暴露,这符合机构良好的辐射安全规范和患者管理程序。
胚胎-胎儿毒性
根据其放射性,Y-90 Zevalin对孕妇服用可能会造成胎儿伤害。建议孕妇注意胎儿的潜在危险。建议有生殖能力的女性和有生殖能力的女性伴侣在治疗期间以及最后一剂药物后至少十二个月内使用有效避孕药[见在特定人群中使用(8.1,8.3)和临床药理学(12.1)] 。
不良反应
标签的其他部分详细讨论了以下严重不良反应:
- •
- 严重的输注反应[请参阅带框警告和警告和注意事项(5.1) ] 。
- •
- 严重和严重的Cytopenias [见盒装警告和警告及注意事项(5.2) ]。
- •
- 严重的皮肤和粘膜皮肤反应[见盒装警告和警告及注意事项(5.3) ]。
- •
- 白血病和骨髓增生异常综合症[参见警告和注意事项(5.4) ]。
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物的临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
报告的安全性数据反映了一项随机试验(FIT)中的349例复发或难治,低度,滤泡性或转化性NHL的349名患者接受Zevalin的暴露(5项试验(4支单臂和1项随机))和206例先前未接受治疗的滤泡性NHL的患者(FIT研究人员)接受了Zevalin治疗方案的任何部分。安全性数据反映了270名复发或难治性NHL血小板计数≥150,000 / mm 3的患者接受Zevalin的暴露,这些患者接受了0.4 mCi / kg(14.8 MBq / kg)的Y-90 Zevalin(表4中的第1组),65名患者血小板计数≥100,000但≤149,000 / mm 3的复发性或难治性NHL患者接受0.3 mCi / kg(11.1 MBq / kg)的Y-90 Zevalin(表4组2),以及204例先前未经治疗的NHL患者血小板计数≥150,000/ mm 3 ,接受0.4 mCi / kg(14.8 MBq / kg)的Y-90 Zevalin;所有患者均接受单一疗程的Zevalin。
Zevalin最常见的不良反应是血细胞减少,疲劳,鼻咽炎,恶心,腹痛,乏力,咳嗽,腹泻和发热。
Zevalin最严重的不良反应是长期和严重的血细胞减少症(血小板减少症,贫血,淋巴细胞减少症,中性粒细胞减少症)和继发性恶性肿瘤。
由于Zevalin治疗方案包括利妥昔单抗的使用,请参阅利妥昔单抗的处方信息。
表2显示了一线化疗(FIT研究)后接受齐伐林治疗方案的任何部分(n = 206)或没有进一步治疗(n = 203)的患者中选择的不良反应发生率。
| ||||
| Zevalin(n = 206) | 观察(n = 203) | |||
| 所有年级† | 等级3-4 | 所有年级† | 等级3-4 | |
| % | % | % | % | |
| 胃肠道疾病 | ||||
| 腹痛 | 17 | 2 | 13 | <1 |
| 腹泻 | 11 | 0 | 3 | 0 |
| 恶心 | 18岁 | 0 | 2 | 0 |
| 身体整体 | ||||
| 虚弱 | 15 | 1个 | 8 | <1 |
| 疲劳 | 33 | 1个 | 9 | 0 |
| 流感样疾病 | 8 | 0 | 3 | 0 |
| 发热 | 10 | 3 | 4 | 0 |
| 肌肉骨骼 | ||||
| 肌痛 | 9 | 0 | 3 | 0 |
| 代谢 | ||||
| 厌食症 | 8 | 0 | 2 | 0 |
| 呼吸,胸腔与媒体 | ||||
| 咳嗽 | 11 | <1 | 5 | 0 |
| 咽喉痛 | 7 | 0 | 2 | 0 |
| 鼻出血 | 5 | 2 | <1 | 0 |
| 神经系统 | ||||
| 头晕 | 7 | 0 | 2 | 0 |
| 血管的 | ||||
| 高血压 | 7 | 3 | 2 | <1 |
| 皮肤和皮下 | ||||
| 盗汗 | 8 | 0 | 2 | 0 |
| tech科 | 8 | 2 | 0 | 0 |
| 瘙痒 | 7 | 0 | 1个 | 0 |
| 皮疹 | 7 | 0 | <1 | 0 |
| 感染和感染 | ||||
| 支气管炎 | 8 | 0 | 3 | 0 |
| 鼻咽炎 | 19 | 0 | 10 | 0 |
| 鼻炎 | 8 | 0 | 2 | 0 |
| 鼻窦炎 | 7 | <1 | <1 | 0 |
| 尿路感染 | 7 | <1 | 3 | 0 |
| 血液和淋巴系统 | ||||
| 血小板减少症 | 62 | 51 | 1个 | 0 |
| 中性粒细胞减少 | 45 | 41 | 3 | 2 |
| 贫血 | 22 | 5 | 4 | 0 |
| 白细胞减少症 | 43 | 36 | 4 | 1个 |
| 淋巴细胞减少 | 26 | 18岁 | 9 | 5 |
表3显示了349例接受Zevalin治疗的复发或难治性,低度,滤泡性或转化性B细胞NHL患者的血液学毒性。 86%Zevalin治疗的患者发生2-4级血液学毒性。
| ||
| 所有年级 % | 3-4年级 % | |
| 血小板减少症 | 95 | 63 |
| 中性粒细胞减少 | 77 | 60 |
| 贫血 | 61 | 17 |
| 瘀斑 | 7 | <1 |
长时间和严重的Cytopenias
在临床研究中,不允许患者在服用Zevalin治疗方案前2周开始接受造血生长因子治疗。
表4显示了接受Y-90 Zevalin治疗的先前接受治疗的NHL患者(N = 335)和未经接受治疗的患者(FIT研究)的严重血液学毒性的发生率和持续时间。
| |||
| 基线血小板计数 | 第一组 (n = 270) ≥150,000 / mm 3 | 2组 (n = 65) ≥100,000但≤149,000 / mm 3 | FIT研究 (n = 204) ≥150,000 / mm 3 |
| Y-90 Zevalin剂量 | 0.4立方厘米/千克 (14.8 MBq /千克) | 0.3立方厘米/千克 (11.1 MBq /千克) | 0.4立方厘米/千克 (14.8 MBq /千克) |
| 非国大 | |||
| 中位数最低点(每mm 3 ) | 800 | 600 | 721 |
| 每患者发病率 ANC <1000 /毫米3 | 57% | 74% | 65% |
| 每患者发病率 ANC <500 / mm 3 | 30% | 35% | 26% |
| 中位数持续时间(天)* ANC <1000 / mm 3 | 22 | 29 | 29 |
| 恢复时间中位数† | 12 | 13 | 15 |
| 血小板 | |||
| 中位数最低点(每mm 3 ) | 41,000 | 24,000 | 42,000 |
| 每患者发病率 血小板<50,000 / mm 3 | 61% | 78% | 61% |
| 每患者发病率 血小板<10,000 / mm 3 | 10% | 14% | 4% |
| 中位天数(天)‡血小板<50,000 / mm 3 | 24 | 35 | 26 |
| 恢复时间中位数† | 13 | 14 | 14 |
与接受不含氟达拉滨方案的患者相比,在一线氟达拉滨或含氟达拉滨的化疗方案后接受泽伐林治疗的十一例(5%)患者中,Cytopenias更为严重,并且更长。在这11例患者中,中位血小板最低点为13,000 / mm 3 ,其中血小板持续时间低于50,000 / mm 3的56天,中位血小板从最低点恢复为1级毒性或基线的中位时间为35天。 ANC的中位值为355 / mm 3 ,ANC的中位持续时间低于1,000 / mm 3 ,为37天,ANC从最低点恢复为1级毒性或基线的中位时间为20天。
在复发/难治性NHL患者和完成一线化疗的患者中,血细胞减少的中位时间相似,Y后中位ANC最低点在61-62天,血小板最低点在49-53天,血红蛋白最低点在Y后68-69天-90-Zevalin管理。
有关使用造血生长因子和血小板输注的信息基于211例复发/难治性NHL患者和206例在一线化疗后的患者。复发或难治性疾病患者给予非格司亭13%,促红细胞生成素8%;一线化疗后接受Zevalin的患者中,有14%接受了粒细胞集落刺激因子,而5%接受了红血球生成剂。在所有Zevalin治疗的患者中约有22%接受了血小板输注。一线化疗后,有20%的复发性或难治性NHL患者和2%的接受泽伐林治疗的患者接受了红细胞输血。
传染病
在复发或难治的NHL患者中,在开始使用Zevalin治疗方案后的前3个月内,有349位患者中有29%发生了感染,而3%的患者出现了严重感染(尿路感染,发热性中性粒细胞减少,败血症,肺炎,蜂窝织炎,结肠炎,腹泻,骨髓炎和上呼吸道感染)。据报道,威胁生命的感染占2%(败血症,脓胸,肺炎,发热性中性粒细胞减少,发烧和胆道支架相关性胆管炎)。 Zevalin治疗后3个月至4年,有6%的患者感染。严重的占2%(尿路感染,细菌性或病毒性肺炎,高热性中性粒细胞减少,肝门周围浸润,心包炎和静脉内与药物相关的病毒性肝炎)和1%的威胁生命的感染(细菌性肺炎,呼吸系统疾病和败血症)。
一线化疗后(表2)给药时,在8%的Zevalin治疗患者和2%的对照患者中发生3-4级感染,包括中性粒细胞减少性败血症(1%),支气管炎,导管败血症,憩室炎,带状疱疹,流感,下呼吸道感染,鼻窦炎和上呼吸道感染。
白血病和骨髓增生异常综合症
在746例复发/难治性NHL患者中,有19例(2.6%)发生了MDS / AML,中位随访时间为4.4年。临床研究中包括的211例患者中MDS / AML的总发生率为5.2%(11/211),中位随访时间为6.5年,中位发展为MDS / AML的时间为2.9年。在该患者人群中,Kaplan-Meier估计的MDS /继发性白血病累积发病率在2年时为2.2%,在5年时为5.9%。在扩展访问计划的535例患者中,MDS / AML的发生率为1.5%(8/535),中位随访时间为4.4年,中位发展为MDS / AML时间为1.5年。描述了多种细胞遗传学异常,最常见的是5号和/或7号染色体。MDS/ AML的风险与既往治疗的次数无关(0-1对2-10)。
在接受一线治疗后接受Y-90-Zevalin的204位患者中,有7位(3%)患者在服用Zevalin后约2至7年之间出现MDS / AML [见警告和注意事项(5.4) ]。
上市后经验
在血液恶性肿瘤中批准使用Zevalin治疗方案后,已确认出现以下不良反应。由于这些反应是从不确定大小的人群中自愿报告的,因此并非总是能够可靠地估计其发生频率或建立与药物暴露的因果关系。在标签中包括这些反应的决定通常基于以下因素中的一个或多个:(1)反应的严重性,(2)报告的频率或(3)与Zevalin治疗方案的因果关系强度。
- •
- 皮肤和粘膜皮肤反应:多形性红斑,史蒂文斯-约翰逊综合征,中毒性表皮坏死溶解,大疱性皮炎和剥脱性皮炎[见盒装警告和警告和注意事项(5.3) ]。
- •
- 渗出后输注部位出现红斑和溃疡[参见警告和注意事项( 5.5) ]。
- •
- Zevalin给药后一个月内,淋巴瘤受累区域附近组织的放射损伤。
免疫原性
与所有治疗性蛋白质一样,具有免疫原性的潜力。抗体形成的检测高度依赖于测定的灵敏度和特异性。另外,在测定中观察到的抗体(包括中和抗体)阳性的发生率可能受到几个因素的影响,这些因素包括测定方法,样品处理,样品收集的时机,伴随用药和基础疾病。由于这些原因,将下述研究中的Zevalin治疗方案的抗体发生率与其他研究或其他产品中的抗体发生率进行比较可能会产生误导。
提供了在10年时间内进行的8项临床研究中的446例患者的HAMA和HACA反应数据。总体而言,11/446(2.5%)的证据表明有HAMA形成(N = 8)或HACA形成(N = 4)。这些患者中有6例在接受Zevalin治疗后出现了HAMA / HACA,而5例在基线时为HAMA / HACA阳性。在HAMA / HACA阳性的6名患者中,两者均为阳性。此外,在11例患者中的6例中,HAMA / HACA在2周至3个月内恢复为阴性。在研究结束时,没有患者的HAMA / HACA水平升高。
仅用Zevalin治疗后有6/446例患者(1.3%)形成了抗体形成的证据,其中许多随着时间的流逝恢复为阴性或下降。该数据表明,HAMA / HACA很少发生,通常是短暂的,并且不会随时间增加。
药物相互作用
接受干扰血小板功能或凝血的药物的患者应更频繁地实验室监测血小板减少症。 Zevalin尚未进行正式的药物相互作用研究。
在特定人群中的使用
怀孕
风险摘要
基于其放射性,Y-90 Zevalin对孕妇给药可能会造成胎儿伤害[见临床药理学(12.1)] 。免疫球蛋白可穿过胎盘。目前尚无有关孕妇使用泽伐林的数据可告知与药物有关的重大先天缺陷和流产风险。建议有生育能力的妇女至少在十二个月内使用适当的避孕措施。告知接受Zevalin时怀孕的妇女潜在的胎儿风险。
对于指定人群,估计的主要先天缺陷和流产的背景风险尚不清楚。所有怀孕都有出生缺陷,流产或其他不良后果的背景风险。但是,在美国一般人群中,主要的先天缺陷的背景风险是临床公认的怀孕的2-4%,流产的是15-20%。
哺乳期
风险摘要
没有关于人乳中泽伐林或其代谢产物的存在,泽伐林对母乳喂养孩子的影响或其对产奶量的影响的数据。由于人IgG会从人乳中排出,因此预计泽伐林将存在于人乳中。由于使用Zevalin进行母乳喂养的孩子可能会出现严重的不良反应,因此建议哺乳期妇女在使用Zevalin治疗方案期间以及末次给药后的6个月内避免母乳喂养。
生殖潜力的男性和女性
给予孕妇时,泽伐林可能会造成胎儿伤害[见在特定人群中使用(8.1)] 。
验孕
在使用泽伐林治疗之前,对有生殖潜力的女性进行妊娠试验。
避孕
注意:本文档包含有关ibritumomab的副作用信息。此页面上列出的某些剂型可能不适用于品牌名称Zevalin。
对于消费者
适用于ibritumomab:静脉注射液
警告
静脉途径(解决方案)
输注利妥昔单抗24小时内发生了严重的输注反应,包括死亡,这是ibritumomab tiuxetan治疗方案的重要组成部分。大多数致命的输注反应(80%)发生在第一次利妥昔单抗输注时。在大多数患者中,给药也导致严重的和长期的血细胞减少。 ibritumomab tiuxetan治疗方案不应施用于淋巴瘤累及和/或骨髓储备受损25%或以上的患者。治疗可能会导致严重的皮肤和粘膜皮肤反应,其中一些具有致命的后果。 Y-90 ibritumomab tiuxetan的剂量不应超过32毫居里(1184 megabecquerels)的绝对最大允许剂量。
需要立即就医的副作用
除其需要的作用外,ibritumomab(泽伐林中所含的活性成分)可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用ibritumomab时,请立即与您的医生或护士联系,看是否有以下任何副作用:
比较普遍;普遍上
- 黑色柏油凳
- 牙龈出血
- 尿液或大便中有血
- 咳嗽或声音嘶哑
- 咳血
- 呼吸或吞咽困难
- 头晕
- 发烧或发冷
- 头痛
- 月经量增加或阴道流血
- 面部,眼睑,嘴唇,舌头,喉咙,手,腿,脚或性器官上出现类似蜂巢的大肿胀
- 下背部或侧面疼痛
- 嘈杂的呼吸
- 流鼻血
- 排尿困难或困难
- 皮肤苍白
- 麻痹
- 查明皮肤上的红色斑点
- 伤口长期出血
- 红色或深棕色尿液
- 红色的凳子
- 气促
- 咽喉痛
- 嘴唇或嘴中的疮,溃疡或白斑
- 腺体肿胀
- 胸闷
- 劳累呼吸困难
- 异常出血或瘀伤
- 异常疲倦或虚弱
- 喘息
不常见
- 将鼻子捏在一起并保持5至10分钟后不会停止的流血鼻子
- 嘴唇或皮肤发蓝
- 胸痛或不适
- 混乱
- 腹泻
- 晕倒
- 快速的心跳
- 麻疹
- 瘙痒
- 头昏眼花
- 眼睑或眼睛,面部,嘴唇或舌头周围浮肿或肿胀
- 快速,浅呼吸
- 皮疹
- 皮肤上的红色或紫色小斑点
- 异常阴道出血
- 吐血或看起来像咖啡渣的物质
罕见
- 搅动
- 焦虑
- 背疼
- 出血,起泡,灼热,寒冷,皮肤变色,压力感,荨麻疹,感染,炎症,瘙痒,肿块,麻木,疼痛,皮疹,发红,疤痕,酸痛,刺痛,肿胀,触痛,刺痛或温暖注射部位
- 模糊的视野
- 昏迷
- 睡意
- 快速,剧烈或不规则的心跳或脉搏
- 幻觉
- 无法说话
- 易怒
- 情绪或精神变化
- 恶心
- 皮肤发红
- 癫痫发作
- 严重头痛
- 言语不清
- 落枕
- 暂时失明
- 呕吐
- 身体一侧手臂或腿无力,突然而严重
- 贴边
发病率未知
- 皮肤起泡,脱皮或松弛
- 皮肤裂缝
- 关节或肌肉疼痛
- 身体热量散失
- 皮肤病变为红色,中心常为紫色
- 眼睛发红
- 皮肤红肿
- 鳞状皮
- 皮肤水泡
不需要立即就医的副作用
可能会出现ibritumomab的某些副作用,这些副作用通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 腹部或胃痛
- 瘀血
- 便秘
- 呼吸困难或劳累
- 移动困难
- 从躺着或坐着的姿势起来时头昏眼花或头昏眼花
- 恐惧
- 温暖的感觉
- 胃部饱满或腹胀或压力
- 关节痛
- 力量不足或丧失
- 皮肤大而扁平的蓝色或紫色斑点
- 食欲不振
- 肌肉酸痛或抽筋
- 肌肉疼痛或僵硬
- 紧张
- 疼痛
- 皮疹
- 脸部,脖子,手臂发红,偶尔上胸部发红
- 流鼻涕
- 失眠
- 打喷嚏
- 鼻塞
- 突然或多汗
- 腹部或胃部肿胀
- 手,脚踝,脚或小腿肿胀
- 关节肿胀
- 喉咙刺激
- 睡觉有麻烦
- 无法入睡
- 减肥
不常见
- 胃酸或酸
- ching
- 胃灼热
- 消化不良
- 胃部不适,不适或疼痛
- 关节肿胀或发红
接受这种疗法几个月后,它可能仍会产生一些需要注意的副作用。在此期间,如果您发现以下任何情况,请立即与医生联系:
- 牙龈出血
- 骨痛
- 头痛,突然和严重
- 无法说话
- 月经量增加或阴道流血
- 红色或黑色,柏油样凳子
- 红色或深棕色尿液
- 暂时失明
对于医疗保健专业人员
适用于ibritumomab:静脉内试剂盒
心血管的
常见(1%至10%):高血压[参考]
皮肤科
常见(1%至10%):盗汗,瘀斑,瘙痒,皮疹
上市后报告:多形红斑,史蒂文斯-约翰逊综合征,中毒性表皮坏死溶解,大疱性皮炎,剥脱性皮炎[参考]
胃肠道
非常常见(10%或更多):恶心,腹痛,腹泻[Ref]
泌尿生殖
常见(1%至10%):尿路感染[参考]
血液学
非常常见(10%或更多):血小板减少症,中性粒细胞减少症,贫血,白细胞减少症,淋巴细胞减少
常见(1%至10%):瘀斑
未报告频率:肾上腺皮质激素[参考]
本地
上市后报告:输注部位红斑,渗出后溃疡[参考]
新陈代谢
常见(1%至10%):厌食[参考]
肌肉骨骼
常见(1%至10%):肌痛[参考]
神经系统
常见(1%至10%):头晕[参考]
肿瘤的
未报告频率:继发性恶性肿瘤[参考]
其他
非常常见(10%或更多):疲劳,乏力,发热,严重和危及生命的感染
常见(1%至10%):流感样疾病
罕见(0.1%至1%):抗体形成
上市后报告:辐射损伤[参考]
呼吸道
非常常见(10%或更多):鼻咽炎(19%),咳嗽(11%)
常见(1%至10%):咽喉痛,鼻st,支气管炎,鼻炎,鼻窦炎[参考]
参考文献
1.“产品信息。In-111Zevalin(ibritumomab)”。 IDEC制药公司,加利福尼亚州圣地亚哥。
某些副作用可能没有报道。您可以将其报告给FDA。
Zevalin治疗方案的剂量和给药
第一天:
- •
- 利妥昔单抗输注前,口服对乙酰氨基酚650 mg和苯海拉明50 mg。
- •
- 初始剂量为50 mg / hr时,静脉使用rituximab 250 mg / m 2 。在没有输液反应的情况下,以每30分钟50 mg / hr的增量递增输注速率,最高可达到400 mg / hr。请勿将利妥昔单抗与其他药物混合或稀释。
- •
- 立即停止利妥昔单抗的输注以引起严重的输注反应,并终止Zevalin治疗方案[请参阅带框警告和警告与注意事项(5.1) ]。
- •
- 暂时减慢或中断利妥昔单抗的输注,以减轻不太严重的输注反应。如果症状改善,继续以先前速度的一半输注。
第7、8或9天:
- •
- 利妥昔单抗输注前,口服对乙酰氨基酚650 mg和苯海拉明50 mg。
- •
- 静脉注射利妥昔单抗250 mg / m 2 ,初始速率为100 mg / hr。以允许的速度,以30分钟的间隔以100 mg / hr的增量增加速率,最大可达到400 mg / hr。如果在治疗的第1天,在输注利妥昔单抗期间发生输注反应,请以50 mg / hr的初始速率给予利妥昔单抗,并以每30分钟50 mg / hr的增量递增输注速率,直至最高400 mg / hr。
- •
- 利妥昔单抗输注完成后4小时内,通过自由流动的静脉输注线管理Y-90 Zevalin注射液。在注射器和输液口之间使用0.22微米的低蛋白结合在线过滤器。输液后,用至少10 mL生理盐水冲洗管线。
- Ø
- 如果血小板计数至少为150,000 / mm 3 ,则在10分钟内以Y-90 0.4 mCi / kg(14.8 MBq / kg)实际体重的剂量静脉内输注Y-90 Zevalin。
- Ø
- 如果血小板计数为100,000至149,000 / mm 3 ,在复发或难治性患者中,应在10分钟内以每公斤Y-90 0.3 mCi(每公斤实际体重11.1 MBq)的剂量静脉内输注Y-90 Zevalin。
- Ø
- 无论患者体重如何,Y-90 Zevalin的剂量都不要超过32 mCi(1184 MBq)。
- •
- 在输注Y-90 Zevalin期间,密切监视患者是否有渗出的迹象。如果出现渗出的任何迹象或症状,请立即停止输液并在另一肢重新开始[见警告和注意事项(5.5) ]。
放射性标记的Y-90 Zevalin剂量的制备说明
制备Yttrium-90(Y-90)Zevalin需要使用标签清晰的试剂盒。请按照详细说明制备放射性标记的泽伐林[请参阅剂量和用法(2.4) ]。
套件中未提供的必需材料:
- 1。
- Yttrium-90氯化物无菌溶液
- 2。
- 三个无菌1 mL塑料注射器
- 3。
- 一个无菌的3 mL塑料注射器
- 4。
- 两个带有18-20 G针头的无菌10 mL塑料注射器
- 5,
- ITLC硅胶条
- 6。
- 色谱溶剂为0.9%氯化钠水溶液
- 7
- 色谱显影室
- 8。
- 合适的放射性计数仪
- 9。
- 过滤器,0.22微米,低蛋白结合
- 10。
- 适用于Y-90的反应瓶和注射器的丙烯酸涂层屏蔽
方法:
- 1。
- 让冷藏的Y-90 Zevalin试剂盒(Zevalin小瓶,50 mM乙酸钠小瓶和制剂缓冲液小瓶)中的内容物达到室温。
- 2。
- 将空的反应瓶放在适当的丙烯酸保护层中。
- 3。
- 确定所需的每个组件的数量:
- 一种。
- 根据Y-90氯化物原液的活性浓度,计算相当于40 mCi的Y-90氯化物体积。
- b。
- 所需的50 mM乙酸钠溶液的体积是上述步骤3.a中确定的Y-90氯化物溶液体积的1.2倍。
- C。
- 计算使反应小瓶内容物达到最终体积10 mL所需的配制缓冲液的体积。
- 4。
- 将计算量的50 mM乙酸钠转移到空的反应瓶中。通过轻轻翻转或滚动,在反应瓶的整个内表面上涂上一层涂层。
- 5,
- 使用丙烯酸屏蔽注射器将40 mCi的Y-90氯化物转移至反应瓶中。通过轻轻反转或滚动将两种溶液混合。
- 6。
- 将1.3 mL的Zevalin(依替莫单抗tiuxetan)转移至反应瓶中。请勿摇动或搅动样品瓶中的内容物。
- 7
- 使标记反应在室温下进行5分钟。较短或较长的反应时间可能会对最终标记的产品产生不利影响。
- 8。
- 孵育5分钟后,立即从步骤3.c转移计算体积的制剂缓冲液。到反应瓶中。在反应瓶侧面轻轻添加配方缓冲液。如有必要,抽取等量的空气以使压力正常化。
- 9。
- 使用适合测量Y-90的放射性校准系统测量最终产品的总活性。
- 10。
- 使用提供的标签,记录准备的日期和时间,总活性和总量以及有效期和时间,然后将这些标签粘贴到带屏蔽的反应瓶容器中。
- 11。
- 患者剂量:计算Y-90 Zevalin剂量所需的体积[参见剂量和用法(2.2) ]。从反应瓶中取出所需的体积。在适合于测量Y-90的剂量校准器中测定注射器。测量剂量必须在Y-90 Zevalin处方剂量的10%以内,并且不得超过32 mCi(1184 MBq) 。使用提供的标签,记录患者标识符,总活动量和总量以及有效期和时间,然后将这些标签粘贴到注射器和带屏蔽的单位剂量容器上。
- 12
- 确定放射化学纯度[ sEE剂量和给药方法(2.4) ]。
- 13
- 将Yttrium-90 Zevalin储存在2-8°C(36-46°F(华氏度))直到使用并在放射性标记的8小时内施用。即将给药前,使用适合于Y-90测量的放射性校准系统分析注射器和内容物。
测定放射化学纯度的程序
使用以下步骤对Y-90 Zevalin进行放射性标记:
- 1。
- 在ITLC硅胶条的起点处放一滴Y-90 Zevalin。
- 2。
- 将ITLC硅胶条放入色谱室中,原点在底部,溶剂在顶部。使溶剂(0.9%NaCl)从试纸底部迁移至少5 cm。从反应室中取出胶条并切成两半。用合适的计数设备将ITLC硅胶条的每一半计数1分钟(CPM)。
- 3。
- 计算RCP百分比,如下所示:
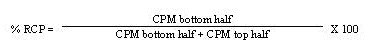
- 4。
- 如果放射化学纯度小于95%,请重复ITLC程序。如果重复测试确认放射化学纯度小于95%,请不要使用Y-90 Zevalin剂量。
辐射剂量法
在使用Zevalin进行临床试验期间,使用连续的全身图像和MIRDOSE 3软件程序估算了Y-90 Zevalin的辐射吸收剂量。表1总结了一个Zevalin治疗方案对器官和骨髓的估计辐射吸收剂量。对大肠下部,大肠上部和小肠的吸收剂量估计值已从标准MIRDOSE 3输出进行了修改,以考虑到假设活动是在肠壁内而不是在肠内容物中。
| ||
| 器官 | Y-90 Zevalin cGy / mCi(mGy / MBq) | |
| 中位数 | 范围 | |
| 脾* | 34.78(9.4) | 6.66-74.00(1.8-20.0) |
| 肝* | 17.76(4.8) | 10.73-29.97(2.9-8.1) |
| 下大肠壁* | 17.39(4.7) | 11.47-30.34(3.1-8.2) |
| 上大肠壁* | 13.32(3.6) | 7.40-24.79(2.0-6.7) |
| 心墙* | 10.73(2.9) | 5.55-11.84(1.5-3.2) |
| 肺* | 7.4(2) | 4.44-12.58(1.2 -3.4) |
| 睾丸* | 5.55(1.5) | 3.70-15.91(1.0-4.3) |
| 小肠* | 5.18(1.4) | 2.96-7.77(0.8-2.1) |
| 红骨髓† | 4.81(1.3) | 2.22-6.66(0.6-1.8) |
| 尿囊壁‡ | 3.33(0.9) | 2.59-4.81(0.7-1.3) |
| 骨骼表面† | 3.33(0.9) | 1.85-4.44(0.5-1.2) |
| 全身‡ | 1.85(0.5) | 1.48-2.59(0.4-0.7) |
| 卵巢‡ | 1.48(0.4) | 1.11-1.85(0.3-0.5) |
| 子宫‡ | 1.48(0.4) | 1.11-1.85(0.3-0.5) |
| 肾上腺 | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 脑‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 乳房‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 胆囊壁‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 肌肉‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 胰腺‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 皮肤‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 胃‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 胸腺‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 甲状腺‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 肾脏* | 0.37(0.1) | 0.00-1.11(0.0-0.3) |
严重的输注反应:输注利妥昔单抗后24小时内死亡,这是Zevalin治疗方案的重要组成部分。这些死亡与缺氧,肺部浸润,急性呼吸窘迫综合征,心肌梗塞,心室纤颤或心源性休克有关。多数(80%)死亡是在第一次利妥昔单抗输注时发生的[见警告和注意事项( 5.1 )和不良反应( 6.1 ) ]。发生严重输注反应的患者应停止利妥昔单抗和Y-90 Zevalin输注。
长时间和严重的Cytopenias:大多数患者使用Y-90 Zevalin会导致严重的和长期的血细胞减少。请勿将Y-90 Zevalin用于≥25%淋巴瘤累及和/或骨髓储备受损的患者[见警告和注意事项( 5.2 )和不良反应( 6.1 ) ]。
严重的皮肤和粘膜皮肤反应:Zevalin治疗方案可能会发生严重的皮肤和粘膜皮肤反应,有些致命。在发生严重皮肤或粘膜皮肤反应的患者中停用利妥昔单抗和Y-90 Zevalin输注[见警告和注意事项( 5.3 )和不良反应( 6.2 ) ]。
剂量:Y-90 Zevalin的剂量不应超过32.0 mCi(1184 MBq) [参见剂量和用法( 2.2 ) ]。
Zevalin的适应症和用法
复发或难治性,低度或滤泡性NHL
Zevalin被指定用于治疗患有复发或难治性,低度或滤泡性B细胞非霍奇金淋巴瘤(NHL)的成年患者。
先前未治疗的滤泡性NHL
Zevalin适用于治疗对一线化疗有部分或完全反应的成年患者中先前未治疗的滤泡性NHL。
泽伐林剂量和给药
建议加药时间表
- •
- 如下所述施用Zevalin治疗方案。
- •
- 在最后一线化疗后至少6周但不超过12周,血小板计数恢复至150,000 / mm 3或更高后,开始Zevalin治疗方案。
- •
- 仅在可立即使用复苏措施的设施中使用利妥昔单抗/ Zevalin。
给药时间表概述

Zevalin治疗方案的剂量和给药
第一天:
- •
- 利妥昔单抗输注前,口服对乙酰氨基酚650 mg和苯海拉明50 mg。
- •
- 初始剂量为50 mg / hr时,静脉使用rituximab 250 mg / m 2 。在没有输液反应的情况下,以每30分钟50 mg / hr的增量递增输注速率,最高可达到400 mg / hr。请勿将利妥昔单抗与其他药物混合或稀释。
- •
- 立即停止利妥昔单抗的输注,以免发生严重的输注反应,并中止Zevalin治疗方案[请参阅带框警告和警告和注意事项( 5.1 ) ]。
- •
- 暂时减慢或中断利妥昔单抗的输注,以减轻不太严重的输注反应。如果症状改善,继续以先前速度的一半输注。
第7、8或9天:
- •
- 利妥昔单抗输注前,口服对乙酰氨基酚650 mg和苯海拉明50 mg。
- •
- 静脉注射利妥昔单抗250 mg / m 2 ,初始速率为100 mg / hr。以允许的速度,以30分钟的间隔以100 mg / hr的增量增加速率,最大可达到400 mg / hr。如果在治疗的第1天,在输注利妥昔单抗期间发生输注反应,请以50 mg / hr的初始速率给予利妥昔单抗,并以每30分钟50 mg / hr的增量递增输注速率,直至最高400 mg / hr。
- •
- 利妥昔单抗输注完成后4小时内,通过自由流动的静脉输注线管理Y-90 Zevalin注射液。在注射器和输液口之间使用0.22微米的低蛋白结合在线过滤器。输液后,用至少10 mL生理盐水冲洗管线。
- Ø
- 如果血小板计数至少为150,000 / mm 3 ,则在10分钟内以Y-90 0.4 mCi / kg(14.8 MBq / kg)实际体重的剂量静脉内输注Y-90 Zevalin。
- Ø
- 如果血小板计数为100,000至149,000 / mm 3 ,在复发或难治性患者中,应在10分钟内以每公斤Y-90 0.3 mCi(每公斤实际体重11.1 MBq)的剂量静脉内输注Y-90 Zevalin。
- Ø
- 无论患者体重如何,Y-90 Zevalin的剂量都不要超过32 mCi(1184 MBq)。
- •
- 在输注Y-90 Zevalin期间,密切监视患者是否有渗出的迹象。如果出现渗出的任何迹象或症状,请立即停止输液并在另一肢重新开始[见警告和注意事项( 5.5 ) ]。
放射性标记的Y-90 Zevalin剂量的制备说明
制备Yttrium-90(Y-90)Zevalin需要使用标签清晰的试剂盒。请按照详细说明制备放射性标记的泽伐林[请参阅剂量和用法( 2.4 ) ]。
套件中未提供的必需材料:
- 1。
- Yttrium-90氯化物无菌溶液
- 2。
- 三个无菌1 mL塑料注射器
- 3。
- 一个无菌的3 mL塑料注射器
- 4。
- 两个带有18-20 G针头的无菌10 mL塑料注射器
- 5,
- ITLC硅胶条
- 6。
- 色谱溶剂为0.9%氯化钠水溶液
- 7。
- 色谱显影室
- 8。
- 合适的放射性计数仪
- 9。
- 过滤器,0.22微米,低蛋白结合
- 10。
- 适用于Y-90的反应瓶和注射器的丙烯酸涂层屏蔽
方法:
- 1。
- 让冷藏的Y-90 Zevalin试剂盒(Zevalin小瓶,50 mM乙酸钠小瓶和制剂缓冲液小瓶)中的内容物达到室温。
- 2。
- 将空的反应瓶放在适当的丙烯酸保护层中。
- 3。
- 确定所需的每个组件的数量:
- 一种。
- 根据Y-90氯化物原液的活性浓度,计算相当于40 mCi的Y-90氯化物体积。
- b。
- 所需的50 mM乙酸钠溶液的体积是上述步骤3.a中确定的Y-90氯化物溶液体积的1.2倍。
- C。
- 计算使反应小瓶内容物达到最终体积10 mL所需的配制缓冲液的体积。
- 4。
- 将计算量的50 mM乙酸钠转移到空的反应瓶中。通过轻轻翻转或滚动,在反应瓶的整个内表面上涂上一层涂层。
- 5,
- 使用丙烯酸屏蔽注射器将40 mCi的Y-90氯化物转移至反应瓶中。通过轻轻反转或滚动将两种溶液混合。
- 6。
- 将1.3 mL的Zevalin(依替莫单抗tiuxetan)转移至反应瓶中。请勿摇动或搅动样品瓶中的内容物。
- 7。
- 使标记反应在室温下进行5分钟。较短或较长的反应时间可能会对最终标记的产品产生不利影响。
- 8。
- 孵育5分钟后,立即从步骤3.c转移计算体积的制剂缓冲液。到反应瓶中。在反应瓶侧面轻轻添加配方缓冲液。如有必要,抽取等量的空气以使压力正常化。
- 9。
- 使用适合测量Y-90的放射性校准系统测量最终产品的总活性。
- 10。
- 使用提供的标签,记录准备的日期和时间,总活性和总量以及有效期和时间,然后将这些标签粘贴到带屏蔽的反应瓶容器中。
- 11。
- 患者剂量:计算Y-90 Zevalin剂量所需的体积[参见剂量和用法( 2.2 ) ]。从反应瓶中取出所需的体积。在适合于测量Y-90的剂量校准器中测定注射器。测量剂量必须在Y-90 Zevalin处方剂量的10%以内,并且不得超过32 mCi(1184 MBq) 。使用提供的标签,记录患者标识符,总活动量和总量以及有效期和时间,然后将这些标签粘贴到注射器和带屏蔽的单位剂量容器上。
- 12
- 确定放射化学纯度[ sEE剂量和给药方法( 2.4 ) ]。
- 13
- 将Yttrium-90 Zevalin储存在2-8°C(36-46°F(华氏度))直到使用并在放射性标记的8小时内施用。即将给药前,使用适合于Y-90测量的放射性校准系统分析注射器和内容物。
测定放射化学纯度的程序
使用以下步骤对Y-90 Zevalin进行放射性标记:
- 1。
- 在ITLC硅胶条的起点处放一滴Y-90 Zevalin。
- 2。
- 将ITLC硅胶条放入色谱室中,原点在底部,溶剂在顶部。使溶剂(0.9%NaCl)从试纸底部迁移至少5 cm。从反应室中取出胶条并切成两半。用合适的计数设备将ITLC硅胶条的每一半计数1分钟(CPM)。
- 3。
- 计算RCP百分比,如下所示:

- 4。
- 如果放射化学纯度小于95%,请重复ITLC程序。如果重复测试确认放射化学纯度小于95%,请不要使用Y-90 Zevalin剂量。
辐射剂量法
在使用Zevalin进行临床试验期间,使用连续的全身图像和MIRDOSE 3软件程序估算了Y-90 Zevalin的辐射吸收剂量。表1总结了一个Zevalin治疗方案对器官和骨髓的估计辐射吸收剂量。大肠下部,大肠上部和小肠的吸收剂量估计值已从标准MIRDOSE 3输出进行了修改,以考虑以下假设:活性在肠壁内而不是肠内。
| ||
| 器官 | Y-90 Zevalin cGy / mCi(mGy / MBq) | |
| 中位数 | 范围 | |
| 脾* | 34.78(9.4) | 6.66-74.00(1.8-20.0) |
| 肝* | 17.76(4.8) | 10.73-29.97(2.9-8.1) |
| 下大肠壁* | 17.39(4.7) | 11.47-30.34(3.1-8.2) |
| 上大肠壁* | 13.32(3.6) | 7.40-24.79(2.0-6.7) |
| 心墙* | 10.73(2.9) | 5.55-11.84(1.5-3.2) |
| 肺* | 7.4(2) | 4.44-12.58(1.2 -3.4) |
| 睾丸* | 5.55(1.5) | 3.70-15.91(1.0-4.3) |
| 小肠* | 5.18(1.4) | 2.96-7.77(0.8-2.1) |
| 红骨髓† | 4.81(1.3) | 2.22-6.66(0.6-1.8) |
| 尿囊壁‡ | 3.33(0.9) | 2.59-4.81(0.7-1.3) |
| 骨骼表面† | 3.33(0.9) | 1.85-4.44(0.5-1.2) |
| 全身‡ | 1.85(0.5) | 1.48-2.59(0.4-0.7) |
| 卵巢‡ | 1.48(0.4) | 1.11-1.85(0.3-0.5) |
| 子宫‡ | 1.48(0.4) | 1.11-1.85(0.3-0.5) |
| 肾上腺‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 脑‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 乳房‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 胆囊壁‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 肌肉‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 胰腺‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 皮肤‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 胃‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 胸腺‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 甲状腺‡ | 1.11(0.3) | 0.74-1.85(0.2-0.5) |
| 肾脏* | 0.37(0.1) | 0.00-1.11(0.0-0.3) |
剂型和优势
注射剂:在单剂量小瓶中,每2 mL含3.2 mg ibritumomab tiuxetan,为澄清,无色溶液,可能包含半透明颗粒。
禁忌症
没有。
警告和注意事项
严重的输液反应
利妥昔单抗单独或作为Zevalin治疗方案的组成部分可引起严重的(包括致命的)输注反应。这些反应通常在首次利妥昔单抗输注期间发生,发作时间为30至120分钟。严重输注反应的体征和症状可能包括荨麻疹,低血压,血管性水肿,缺氧,支气管痉挛,肺部浸润,急性呼吸窘迫综合征,心肌梗塞,心室纤颤和心源性休克。暂时减慢或中断利妥昔单抗的输注,以减轻不太严重的输注反应。立即停用利妥昔单抗和Y-90 Zevalin进行严重的输注反应。仅在可立即使用复苏措施的设施中使用利妥昔单抗/ Zevalin [见盒装警告和剂量与给药方法( 2.2 ) ]。另请参阅利妥昔单抗的处方信息。
长时间和严重的Cytopenias
Zevalin治疗方案最常见的严重不良反应是发生延迟和持续时间长的Cytopenias,有些并发出血和严重感染。按推荐剂量使用时,轻度基线血小板减少症(≥100,000但≤149,000 / mm 3 )的患者严重血小板减少和中性粒细胞减少的发生率高于正常血小板计数的患者。严重的血细胞减少症可在给药后持续超过12周。每周接受Zevalin治疗方案后监测全血细胞计数(CBC)和血小板计数,直至水平恢复或临床指示[见盒装警告和不良反应( 6.1 ) ]。
不要对淋巴瘤≥25%骨髓受累和/或骨髓储备受损的患者使用Zevalin治疗方案。使用Zevalin治疗方案后最多3个月监测患者的血细胞减少症及其并发症(例如,发热性中性粒细胞减少,出血)。避免使用在Zevalin治疗方案后会干扰血小板功能或凝血的药物。
严重的皮肤和粘膜皮肤反应
在上市后的经验中报道了多形性红斑,史蒂文斯-约翰逊综合征,中毒性表皮坏死溶解,大疱性皮炎和剥脱性皮炎,其中一些是致命的。这些反应发生的时间是可变的,在施用泽伐林治疗方案后的几天到4个月不等。在发生严重的皮肤或粘膜皮肤反应的患者中停用Zevalin治疗方案[见盒装警告和不良反应( 6.2 ) ]。
发生骨髓增生异常综合症,白血病和其他恶性肿瘤的风险
由治疗性暴露于Y-90放射性标记的泽伐林引起的辐射剂量可导致继发性恶性肿瘤。
在临床研究中,有5.2%(11/211)的复发或难治性NHL患者报告了骨髓增生异常综合症(MDS)和/或急性骨髓性白血病(AML),而扩大后的研究中则报道了1.5%(8/535)的患者访问试验,中位随访时间分别为6.5年和4.4年。在所报道的19个病例中,使用Zevalin治疗方案治疗后,诊断MDS或AML的中位时间为1.9年;但是,累积发生率继续增加[见不良反应( 6.1 ) ]。
一线化疗后接受Y-90 Zevalin的204例患者中,Zevalin组中的26例(12.7%)患者发生了第二原发恶性肿瘤,而对照组中14例(6.8%)。接受泽伐林治疗后有7例患者(3.4%,7/204)被诊断出MDS / AML,而对照组的1例患者(0.5%,1/205)被诊断为MDS / AML,中位随访时间为7.3年。 Zevalin组由第二原发恶性肿瘤导致的死亡包括8(3.9%)患者,而对照组则为3(1.5%)。 Zevalin组死于MDS / AML的患者包括5名(2.5%),而对照组则没有。
监测患者的血液学毒性,包括MDS或AML的发展。
外渗
密切监视患者以了解泽伐林输注过程中是否有渗出的迹象。如果出现渗出的迹象或症状,请立即终止输注,并在另一条肢体处重新开始[参见剂量和用法( 2.2 ) ] 。
免疫风险
Zevalin治疗方案后用活病毒疫苗免疫的安全性尚未研究。不要对刚接受Zevalin的患者接种活病毒疫苗。 Zevalin治疗方案对任何疫苗产生免疫反应的能力尚未研究。
放射性核素注意事项
在使用Y-90放射性标记Zevalin的过程中和之后,应尽量减少对患者和医务人员的辐射暴露,这符合机构良好的辐射安全规范和患者管理程序。
胚胎-胎儿毒性
根据其放射性,Y-90 Zevalin对孕妇服用可能会造成胎儿伤害。建议孕妇注意胎儿的潜在危险。繁殖潜力的提醒和雌性生殖潜在的女性伴侣男性治疗期间和最小的最后一次给药后十二个月使用有效避孕[见特殊人群中使用( 8.1 , 8.3 )和临床药理学( 12.1 )]。
不良反应
标签的其他部分详细讨论了以下严重不良反应:
- •
- 严重的输注反应[请参阅带框警告和警告和注意事项( 5.1 ) ] 。
- •
- 严重和严重的Cytopenias [见盒装警告和警告及注意事项( 5.2 ) ]。
- •
- 严重的皮肤和粘膜皮肤反应[参见盒装警告和警告及注意事项( 5.3 ) ]。
- •
- 白血病和骨髓增生异常综合症[参见警告和注意事项( 5.4 ) ]。
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物的临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
报告的安全性数据反映了一项随机试验(FIT)中的349例复发或难治,低度,滤泡性或转化性NHL的349名患者接受Zevalin的暴露(5项试验(4支单臂和1项随机))和206例先前未接受治疗的滤泡性NHL的患者(FIT研究人员)接受了Zevalin治疗方案的任何部分。安全数据反映了270例复发或难治的NHL血小板计数≥150,000 / mm 3的患者接受Zevalin的暴露,他们接受了0.4 mCi / kg(14.8 MBq / kg)的Y-90 Zevalin(表4中的第1组),65例患者复发或难治性NHL且血小板计数≥100,000但≤149,000 / mm 3 ,接受0.3 mCi / kg(11.1 MBq / kg)的Y-90 Zevalin(表4组2),以及204例先前未接受过NHL治疗的患者血小板计数≥150,000/ mm 3 ,接受0.4 mCi / kg(14.8 MBq / kg)的Y-90 Zevalin;所有患者均接受单一疗程的Zevalin。
Zevalin最常见的不良反应是血细胞减少,疲劳,鼻咽炎,恶心,腹痛,乏力,咳嗽,腹泻和发热。
Zevalin最严重的不良反应是长期和严重的血细胞减少症(血小板减少症,贫血,淋巴细胞减少症,中性粒细胞减少症)和继发性恶性肿瘤。
由于Zevalin治疗方案包括利妥昔单抗的使用,请参阅利妥昔单抗的处方信息。
表2显示了一线化疗(FIT研究)后接受齐伐林治疗方案的任何部分(n = 206)或没有进一步治疗(n = 203)的患者中选择的不良反应发生率。
| ||||
| Zevalin(n = 206) | 观察(n = 203) | |||
| 所有年级† | 等级† 3-4 | 所有年级† | 等级† 3-4 | |
| % | % | % | % | |
| 胃肠道疾病 | ||||
| 腹痛 | 17 | 2 | 13 | <1 |
| 腹泻 | 11 | 0 | 3 | 0 |
| 恶心 | 18岁 | 0 | 2 | 0 |
| 身体整体 | ||||
| 虚弱 | 15 | 1个 | 8 | <1 |
| 疲劳 | 33 | 1个 | 9 | 0 |
| 流感样疾病 | 8 | 0 | 3 | 0 |
| 发热 | 10 | 3 | 4 | 0 |
| 肌肉骨骼 | ||||
| 肌痛 | 9 | 0 | 3 | 0 |
| 代谢 | ||||
| 厌食症 | 8 | 0 | 2 | 0 |
| 呼吸,胸腔与媒体 | ||||
| 咳嗽 | 11 | <1 | 5 | 0 |
| 咽喉痛 | 7 | 0 | 2 | 0 |
| 鼻出血 | 5 | 2 | <1 | 0 |
| 神经系统 | ||||
| 头晕 | 7 | 0 | 2 | 0 |
| 血管的 | ||||
| 高血压 | 7 | 3 | 2 | <1 |
| 皮肤和皮下 | ||||
| 盗汗 | 8 | 0 | 2 | 0 |
| tech科 | 8 | 2 | 0 | 0 |
| 瘙痒 | 7 | 0 | 1个 | 0 |
| 皮疹 | 7 | 0 | <1 | 0 |
| 感染和感染 | ||||
| 支气管炎 | 8 | 0 | 3 | 0 |
| 鼻咽炎 | 19 | 0 | 10 | 0 |
| 鼻炎 | 8 | 0 | 2 | 0 |
| 鼻窦炎 | 7 | <1 | <1 | 0 |
| 尿路感染 | 7 | <1 | 3 | 0 |
| 血液和淋巴系统 | ||||
| 血小板减少症 | 62 | 51 | 1个 | 0 |
| 中性粒细胞减少 | 45 | 41 | 3 | 2 |
| 贫血 | 22 | 5 | 4 | 0 |
| 白细胞减少症 | 43 | 36 | 4 | 1个 |
| 淋巴细胞减少 | 26 | 18岁 | 9 | 5 |
表3显示了349例接受Zevalin治疗的复发或难治性,低度,滤泡性或转化性B细胞NHL患者的血液学毒性。 86%Zevalin治疗的患者发生2-4级血液学毒性。
| ||
| 所有年级 % | 3-4年级 % | |
| 血小板减少症 | 95 | 63 |
| 中性粒细胞减少 | 77 | 60 |
| 贫血 | 61 | 17 |
| 瘀斑 | 7 | <1 |
长时间和严重的Cytopenias
在临床研究中,不允许患者在服用Zevalin治疗方案前2周开始接受造血生长因子治疗。
表4显示了接受Y-90 Zevalin治疗的先前接受过NHL治疗的患者(N = 335)和未经接受治疗过的患者(FIT研究)的严重血液毒性的发生率和持续时间。
| |||
| 基线血小板计数 | 第一组 (n = 270) ≥150,000 / mm 3 | 2组 (n = 65) ≥100,000但≤149,000 / mm 3 | FIT研究 (n = 204) ≥150,000 / mm 3 |
| Y-90 Zevalin剂量 | 0.4立方厘米/千克 (14.8 MBq /千克) | 0.3立方厘米/千克 (11.1 MBq /千克) | 0.4立方厘米/千克 (14.8 MBq /千克) |
| 非国大 | |||
| 中位数最低点(每mm 3 ) | 800 | 600 | 721 |
| 每患者发病率 ANC <1000 /毫米3 | 57% | 74% | 65% |
| 每患者发病率 ANC <500 / mm 3 | 30% | 35% | 26% |
| 中位天数(天) * ANC <1000 / mm 3 | 22 | 29 | 29 |
| 恢复时间中位数† | 12 | 13 | 15 |
| 血小板 | |||
| 中位数最低点(每mm 3 ) | 41,000 | 24,000 | 42,000 |
| 每患者发病率 血小板<50,000 / mm 3 | 61% | 78% | 61% |
| 每患者发病率 血小板<10,000 / mm 3 | 10% | 14% | 4% |
| 中位天数(天) ‡血小板<50,000 / mm 3 | 24 | 35 | 26 |
| 恢复时间中位数† | 13 | 14 | 14 |
与接受不含氟达拉滨方案的患者相比,在一线氟达拉滨或含氟达拉滨的化疗方案后接受泽伐林治疗的十一例(5%)患者中,Cytopenias更为严重,并且更长。在这11例患者中,中位血小板最低点为13,000 / mm 3 ,其中血小板持续时间低于50,000 / mm 3的56天,中位血小板从最低点恢复为1级毒性或基线的中位时间为35天。 ANC的中位值为355 / mm 3 ,ANC的中位持续时间低于1,000 / mm 3 ,为37天,ANC从最低点恢复为1级毒性或基线的中位时间为20天。
在复发/难治性NHL患者和完成一线化疗的患者中,血细胞减少的中位时间相似,Y后中位ANC最低点在61-62天,血小板最低点在49-53天,血红蛋白最低点在Y后68-69天-90-Zevalin管理。
有关使用造血生长因子和血小板输注的信息基于211例复发/难治性NHL患者和206例在一线化疗后的患者。复发或难治性疾病患者给予非格司亭13%,促红细胞生成素8%;一线化疗后接受Zevalin的患者中,有14%接受了粒细胞集落刺激因子,而5%接受了红血球生成剂。在所有Zevalin治疗的患者中约有22%接受了血小板输注。一线化疗后,有20%的复发性或难治性NHL患者和2%的接受泽伐林治疗的患者接受了红细胞输血。
传染病
在复发或难治的NHL患者中,在开始使用Zevalin治疗方案后的前3个月内,有349位患者中有29%发生了感染,而3%的患者出现了严重感染(尿路感染,发热性中性粒细胞减少,败血症,肺炎,蜂窝织炎,结肠炎,腹泻,骨髓炎和上呼吸道感染)。据报道,威胁生命的感染占2%(败血症,脓胸,肺炎,发热性中性粒细胞减少,发烧和胆道支架相关性胆管炎)。 Zevalin治疗后3个月至4年,有6%的患者感染。严重的占2%(尿路感染,细菌性或病毒性肺炎,高热性中性粒细胞减少,肝门周围浸润,心包炎和静脉内与药物相关的病毒性肝炎)和1%的威胁生命的感染(细菌性肺炎,呼吸系统疾病和败血症)。
一线化疗后(表2)给药时,在8%的Zevalin治疗患者和2%的对照患者中发生3-4级感染,包括中性粒细胞减少性败血症(1%),支气管炎,导管败血症,憩室炎,带状疱疹,流感,下呼吸道感染,鼻窦炎和上呼吸道感染。
白血病和骨髓增生异常综合症
在746例复发/难治性NHL患者中,有19例(2.6%)发生了MDS / AML,中位随访时间为4.4年。临床研究中包括的211例患者中MDS / AML的总发生率为5.2%(11/211),中位随访时间为6.5年,中位发展为MDS / AML的时间为2.9年。在该患者人群中,Kaplan-Meier估计的MDS /继发性白血病累积发病率在2年时为2.2%,在5年时为5.9%。在扩展访问计划的535例患者中,MDS / AML的发生率为1.5%(8/535),中位随访时间为4.4年,中位发展为MDS / AML时间为1.5年。描述了多种细胞遗传学异常,最常见的是5号和/或7号染色体。MDS/ AML的风险与既往治疗的次数无关(0-1对2-10)。
在接受一线治疗后接受Y-90-Zevalin的204位患者中,有7位(3%)患者在服用Zevalin约2至7年之间出现MDS / AML [见警告和注意事项( 5.4 ) ]。
上市后经验
在血液恶性肿瘤中批准使用Zevalin治疗方案后,已确认出现以下不良反应。由于这些反应是从不确定大小的人群中自愿报告的,因此并非总是能够可靠地估计其发生频率或建立与药物暴露的因果关系。在标签中包括这些反应的决定通常基于以下因素中的一个或多个:(1)反应的严重性,(2)报告的频率或(3)与Zevalin治疗方案的因果关系强度。
已知总共有228种药物与Zevalin(ibritumomab)相互作用。
- 117种主要药物相互作用
- 108种中等程度的药物相互作用
- 3次轻微的药物相互作用
检查互动
已知与Zevalin(ibritumomab)相互作用的药物
注意:仅显示通用名称。
- 阿昔单抗
- 阿卡鲁替尼
- 阿达木单抗
- 腺病毒疫苗
- 阿莱法西普
- 阿仑单抗
- 阿替普酶
- 阿那格雷
- 阿纳金拉
- 茴香醚
- 止痛药
- 吸附的炭疽疫苗
- 抗凝血酶(重组)
- 抗凝血酶iii
- 阿哌沙班
- 阿德帕林
- 阿加曲班
- 阿司匹林
- 硫唑嘌呤
- 巴立替尼
- bcg
- BCG疫苗
- 贝曲西班
- 婴儿双歧杆菌
- 比尼替尼
- 比伐卢定
- 啤酒酵母
- 溴芬酸
- 溴芬酸眼药
- 卡博替尼
- 卡那基单抗
- 白色念珠菌提取物
- 坎格雷洛
- 卡帕珠单抗
- 辣椒
- 塞妥珠单抗
- 洋甘菊
- 氯霉素
- 氯霉素眼药
- 霍乱疫苗
- 霍乱疫苗,活的
- 西洛他唑
- 西酞普兰
- 克拉屈滨
- 氯米帕明
- 氯吡格雷
- 氯氮平
- 球蛋白皮肤测试
- 达比加群
- 达肝素
- 丹那普利
- 达沙替尼
- 地拉罗司
- 去铁酮
- 去纤蛋白
- 地诺单抗
- 脱氧胆酸
- 去甲文拉法辛
- 右芬氟拉明
- 双氯芬酸
- 双氯芬酸眼药
- 双氯芬酸局部用药
- 双香豆酚
- 双氟尼醛
- 富马酸二甲酯
- 双嘧达莫
- 富马酸酯
- drotrecogin阿尔法
- 度洛西汀
- 依多沙班
- 依法珠单抗
- 恩可拉非尼
- 依诺肝素
- 松香醇
- 依替巴肽
- 依他普仑
- 依那西普
- 依托度酸
- 替拉替尼
- 芬氟拉明
- 非诺洛芬
- 胡芦巴
- 非格司亭
- 芬戈莫德
- 氟西汀
- 氟比洛芬
- 氟比洛芬眼药水
- 氟伏沙明
- 磺达肝素
- 更昔洛韦
- 戈利木单抗
- 嗜血杆菌b结合物(hboc)疫苗
- 嗜血杆菌b结合物(prp-omp)疫苗
- 嗜血杆菌b结合物(prp-t)疫苗
- 血红素
- 肝素
- 甲型肝炎成人疫苗
- 肝炎小儿疫苗
- 乙肝成人疫苗
- 乙肝儿科疫苗
- 组织浆蛋白
- 七叶树
- 人乳头瘤病毒疫苗
- 依鲁替尼
- 布洛芬
- 依达拉西布
- 伊洛前列素
- 消炎痛
- 英夫利昔单抗
- 流感病毒疫苗,h1n1,已灭活
- 流感病毒疫苗,h1n1,活
- 流感病毒疫苗,h5n1
- 流感病毒疫苗,灭活的
- 活三价流感病毒疫苗
- 伊诺特森
- 碘I 131 Tositumomab
- 日本entph疫苗sa14-14-2,已灭活
- 日本脑炎病毒疫苗中山
- 酮洛芬
- 酮咯酸
- 酮咯酸眼药
- 嗜酸乳杆菌
- 罗伊氏乳杆菌
- 鼠李糖乳杆菌
- 鼠李糖乳杆菌gg
- 来氟米特
- 瘦素
- 左旋米那普仑
- 莱姆病疫苗
- 麻疹病毒疫苗
- 甲氯芬酸钠
- 甲芬那酸
- 美洛昔康
- 脑膜炎球菌结合疫苗
- B型脑膜炎球菌疫苗
- 脑膜炎球菌多糖疫苗
- 米那普仑
- 混合呼吸道疫苗
- 富马酸单甲酯
- 腮腺炎皮肤测试抗原
- 腮腺炎病毒疫苗
- 萘丁美酮
- 萘普生
- 那他珠单抗
- 尼帕芬酸眼药
- 尼拉帕利布
- 奥珠单抗
- 奥拉帕尼
- 奥马他汀
- 奥沙普嗪
- 奥扎尼莫德
- palifermin
- 帕罗西汀
- 吡非司亭
- 戊聚糖多硫酸钠
- 苯丁zone
- 吡罗昔康
- 鼠疫疫苗
- 普霉素
- 肺炎球菌13价疫苗
- 肺炎球菌23多价疫苗
- 肺炎球菌7价疫苗
- 脊髓灰质炎病毒疫苗,灭活的
- 脊髓灰质炎病毒活三价疫苗
- 帕那替尼
- 普拉格雷
- 狂犬病疫苗,人类二倍体细胞
- 狂犬病疫苗,纯化的鸡胚细胞
- 223氯化镭
- 雷莫昔单抗
- 雷戈非尼
- 替普酶
- 利罗那普
- 利伐沙班
- 罗氟司特
- 轮状病毒疫苗
- 风疹病毒疫苗
- 鲁索替尼
- 布尔酵母菌
- sm sm 153 lexidronam
- sargramostim
- 舍曲林
- 西布曲明
- 西波莫德
- 西普赛尔
- 皮肤测试抗原,多种
- 天花疫苗
- 磷酸钠p32
- staphage裂解液(spl)
- 链激酶
- 89氯化锶
- 亚砜吡嗪
- 舒林酸
- 舒洛芬眼科
- 他莫替丁
- 博非司亭
- 替奈普酶
- 特氟米特
- 破伤风类毒素
- 替卡格雷
- 噻氯匹定
- 替扎肝素
- 提拉那韦
- 替罗非班
- 托法替尼
- 托美汀
- 拓扑替康
- 托西单抗
- 曲前列素
- 癣菌皮试验
- 结核菌素纯化蛋白衍生物
- 伤寒疫苗,灭活
- 伤寒疫苗,活
- 达帕替尼
- 尿激酶
- 乌斯替单抗
- 缬更昔洛韦
- 水痘病毒疫苗
- 文拉法辛
- 维拉唑酮
- 伏拉帕沙
- 伏替西汀
- 华法林
- 黄热病疫苗
- 扎那鲁替尼
- 齐多夫定
- 带状疱疹疫苗活
- 带菌疫苗,灭活
Zevalin(ibritumomab)疾病相互作用
Zevalin(ibritumomab)与3种疾病的相互作用包括:
- 血细胞减少症
- 预防接种
- 血液学毒性
药物相互作用分类
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
- 审批历史 FDA的药物史
美国日本医生

Heather Benjamin MD

Heather Benjamin MD

Suzanne Reitz MD

Heather Miske DO

Heather Miske DO

渡邊剛

宮崎総一郎 中部大学特聘教授

百村伸一 教授

村上和成 教授

中山秀章 教授
临床试验
- 复发/难治性T细胞非霍奇金淋巴瘤患者的CPI-613与Bendamustine结合使用Bendamustine
- 自体人性化抗CD19和抗CD20双重CAR-T细胞在弥漫性大B细胞淋巴瘤患者中的安全性(A-02)
- R-CHOP与漫纳替麦胺在一线治疗中结合了弥漫性大B细胞淋巴瘤患者的一线治疗
- DCV在治疗复发和难治性儿童实体瘤中
- 特殊药物使用监测brentuximab vedotin静脉输注“复发或难治性CD30阳性外周T细胞淋巴瘤或小儿霍奇金淋巴瘤”
- JNJ-64264681在非霍奇金淋巴瘤和慢性淋巴细胞性白血病的参与者中的研究
- duvelisib用于耐二替尼的慢性淋巴细胞性白血病/小淋巴细胞淋巴瘤
- CD19特异性嵌合抗原受体阳性T细胞(CAR-T)和NHL的研究(Isikok-19)
- 血液学恶性肿瘤患者的嵌合抗原受体T细胞治疗后复发,难治或可检测的疾病的Nivolumab
- INBRX-106和INBRX-106与Pembrolizumab结合的研究受试者(局部晚期或转移性实体瘤)(六价OX40激动剂)