获取国外肉毒杆菌化妆品药品价格,使用等信息,最快 24 小时回馈
肉毒杆菌化妆品
肉毒杆菌化妆品
什么是肉毒杆菌化妆品(肉毒杆菌)?
肉毒杆菌毒素在成人中用于治疗宫颈肌张力障碍(头部异常姿势和颈部疼痛)。
肉毒杆菌毒素也可用于治疗2岁以上成人和儿童的肌肉痉挛和手臂,手,腿和脚的僵硬(痉挛)。肉毒杆菌毒素化妆品不能治疗由脑瘫引起的痉挛。
肉毒杆菌毒素还可用于治疗至少12岁的成人和儿童的神经疾病引起的某些眼部肌肉疾病。这包括眼睑不受控制的眨眼或痉挛,以及眼睛未指向同一方向的情况。
肉毒杆菌毒素也可用于成人,以治疗膀胱过度活动症和尿失禁(尿液渗漏),而其他药物则无济于事。肉毒杆菌毒素可用于治疗由神经疾病(如脊髓损伤或多发性硬化症)引起的失禁。
肉毒杆菌毒素也用于成年人,以预防每月超过15天且持续4小时或更长时间的慢性偏头痛。肉毒杆菌毒素不应该用于治疗普通的紧张性头痛。
肉毒杆菌毒素也用于治疗成年人的严重腋下出汗(多汗症)。
肉毒杆菌化妆品用于暂时减轻成人面部皱纹的出现。
肉毒杆菌毒素也可用于本用药指南中未列出的目的。
重要信息
该药物中所含的肉毒杆菌毒素可以扩散到注射部位以外的其他身体部位。这可能会导致严重的威胁生命的副作用。
如果声音嘶哑,眼睑下垂,视力问题,严重的眼睛刺激感,严重的肌肉无力,膀胱失去控制或呼吸,说话或吞咽困难,请立即致电医生。
在服药之前
如果您对肉毒杆菌毒素过敏,或者患有以下疾病,则不应使用肉毒杆菌毒素治疗:
注射药物区域的感染;要么
(用于膀胱过度活动症和大小便失禁),如果您当前患有膀胱感染或无法排尿并且不定期使用导管。
告诉医生您是否曾经:
其他肉毒杆菌毒素注射,例如Dysport或Myobloc(尤其是最近4个月内);
肌萎缩性侧索硬化症(ALS,或“卢格氏病”);
重症肌无力;
Lambert-Eaton综合征;
事先使用肉毒杆菌毒素后的副作用;
呼吸系统疾病,例如哮喘或肺气肿;
吞咽问题;
面部肌肉无力(眼睑下垂,前额无力,抬眉毛困难);
脸部正常外观的变化;
出血问题;要么
手术(尤其是脸部手术)。
肉毒杆菌毒素是由捐赠的人血浆制成的,可能含有病毒或其他传染因子。对捐赠的血浆进行了测试和处理,以减少污染的风险,但仍有很小的可能传播疾病。向您的医生询问任何可能的风险。
告诉医生您是孕妇还是母乳喂养。
肉毒杆菌毒素如何服用?
肉毒杆菌毒素注射仅应由训练有素的医疗专业人员进行,即使用于美容目的。
Botox Cosmetic由医疗保健提供者注入肌肉。肉毒杆菌毒素注射应间隔至少3个月。
视情况而定,一次可将肉毒杆菌毒素注射到一个以上的区域。
在接受针对眼部肌肉疾病的注射时,您可能需要使用滴眼剂,药膏,特殊的隐形眼镜或其他保护眼睛表面的装置。遵循医生的指示。
如果您因出汗过多而需要治疗,请在注射前约24小时刮除腋下。接受注射之前或之后的24小时内,请勿使用止汗剂或除臭剂。注射前30分钟内避免运动和热食或饮料。
注射后最多可能需要2周的时间,颈部肌肉痉挛症状才会开始改善。您可能会在6周后注意到最大的改善。
注射后可能只需要1-3天,眼肌痉挛症状就会开始改善。您可能会在2到6周后注意到最大的改善。
肉毒杆菌毒素注射的作用是暂时的。您的症状可能会在3个月内完全恢复。重复注射后,症状恢复所需的时间可能会越来越少,尤其是当您的身体对肉毒杆菌毒素产生抗体时。
请勿一次从多个医务人员处寻求肉毒杆菌毒素注射。如果您转用医疗保健提供者,请告诉您的新提供者距您上次注射肉毒杆菌毒素已有多长时间了。
比处方更频繁地使用这种药物不会使其更有效,并可能导致严重的副作用。
如果我错过剂量怎么办?
由于肉毒杆菌毒素具有暂时的作用,并且间隔很宽,因此不大可能不会造成伤害。
如果我服药过量怎么办?
寻求紧急医疗护理或致电1-800-222-1222,拨打毒药帮助热线。
服药过量的症状可能不会立即出现,但可能包括肌肉无力,吞咽困难以及呼吸弱或浅。
收到肉毒杆菌毒素后应该避免什么?
肉毒杆菌毒素可能会损害您的视力或深度感知。除非您知道肉毒杆菌化妆品会如何影响您,否则请避免驾驶或危险活动。
避免在注射后过快地恢复正常的身体活动。
肉毒杆菌毒素的副作用
如果您有过敏反应迹象,请寻求紧急医疗救助:荨麻疹,瘙痒;喘息,呼吸困难;感觉自己可能会昏倒;脸,嘴唇,舌头或喉咙肿胀。
肉毒杆菌毒素所含的肉毒杆菌毒素可以扩散到注射部位以外的其他身体部位。在一些接受肉毒杆菌毒素注射的人中,即使是出于美容目的,这也造成了严重的威胁生命的副作用。
如果您有以下任何一种副作用,请立即致电医生(注射后长达数小时或数周):
异常或严重的肌肉无力(尤其是在未注射药物的身体部位);
呼吸,说话或吞咽困难;
失去膀胱控制;
声音嘶哑,眼皮下垂;
视力变化,眼睛疼痛,严重干燥或眼睛不适(您的眼睛可能对光线更敏感);
胸痛或压力,疼痛蔓延到您的下巴或肩膀,不规则的心跳;
小便时疼痛或烧灼,排空膀胱有麻烦;
喉咙痛,咳嗽,胸闷,呼吸急促;要么
眼睑肿胀,结s或流眼,视力问题。
常见的副作用可能包括:
注射药物附近的肌肉无力;
治疗后数月吞咽困难;
肌肉僵硬,颈部疼痛,手臂或腿部疼痛;
视力模糊,眼睑浮肿,眼睛干燥,眉毛下垂;
口干;
头痛,疲倦;
腋下以外区域的出汗增加;要么
注射部位有瘀伤,出血,疼痛,发红或肿胀。
这不是副作用的完整列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响肉毒杆菌毒素?
告诉您的医生您所有其他药物的信息,尤其是:
肌肉放松剂;
感冒或过敏药;
睡眠药
注射用抗生素要么
血液稀释剂-华法林,香豆素,扬托芬。
此列表不完整。其他药物可能会影响肉毒杆菌毒素,包括处方药和非处方药,维生素和草药产品。此处未列出所有可能的药物相互作用。
版权所有1996-2018 Cerner Multum,Inc.版本:7.01。
注意:本文档包含有关onabotulinumtoxinA的副作用信息。此页面上列出的某些剂型可能不适用于Botox Cosmetic品牌。
综上所述
Botox Cosmetic的常见副作用包括:抗体开发。有关不良影响的完整列表,请参见下文。
对于消费者
适用于肉毒杆菌毒素A:溶液粉
警告
注射途径(溶液粉)
毒素作用的远距离传播-肉毒杆菌毒素A和所有肉毒杆菌毒素产品的作用可能会从注射区域扩散,产生与肉毒杆菌毒素作用一致的症状。注射后数小时至数周已报告了这些症状。吞咽和呼吸困难可能会危及生命,并且已有死亡报告。在接受痉挛治疗的儿童中,症状的风险可能最大,但成人中也可能出现症状,尤其是那些患有潜在疾病的患者,这些疾病可能使他们容易出现这些症状。
需要立即就医的副作用
除其所需的作用外,肉毒杆菌毒素A(肉毒杆菌化妆品所含的活性成分)可能会引起一些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用肉毒杆菌毒素A时,如果有以下任何副作用,请立即与医生或护士联系:
比较普遍;普遍上
- 吞咽困难
罕见
- 呼吸或说话困难
- 肌肉无力
更常见-眼睑痉挛
- 眼睛干燥
- 无法完全闭上眼睑
较常见-上肢痉挛
- 身体酸痛或疼痛
- 发冷
- 咳嗽
- 耳部充血
- 发热
- 头痛
- 失去声音
- 流鼻涕或鼻塞
- 打喷嚏
- 咽喉痛
- 异常疲倦或虚弱
较常见-因膀胱过度活动引起的尿失禁
- 膀胱疼痛
- 血尿或浑浊
- 排尿困难,灼热或疼痛
- 尿频
- 下背部或侧面疼痛
不常见-眼睑痉挛
- 减少闪烁
- 刺激眼睛的角膜(有色部分)
- 从眼睑边缘向外或向内转动
不太常见-用于额头线
- 眉毛和上眼睑下垂
较不常见-用于睑缘线
- 上眼睑下垂
- 面部疼痛
- 肌肉无力
- 面部部分或轻微麻痹
较不常见-用于can侧线
- 眼睑肿胀
较不常见-上肢痉挛
- 咳嗽产生粘液
- 呼吸困难
- 肌肉无力
- 恶心
- 癫痫发作
- 胸闷
- 弱点
不需要立即就医的副作用
肉毒杆菌毒素A可能会发生某些副作用,通常不需要医治。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
更常见-眼睑痉挛
- 眼睑上有蓝色或紫色的瘀伤
- 上眼睑下垂
- 刺激眼睛或流泪
- 眼睛对光的敏感性
更常见-宫颈肌张力障碍
- 身体酸痛或疼痛
- 发冷
- 咳嗽
- 耳部充血
- 发热
- 头痛
- 失去声音
- 颈部疼痛
- 流鼻涕或鼻塞
- 打喷嚏
- 咽喉痛
- 异常疲倦或虚弱
更常见-慢性偏头痛
- 颈部疼痛
较常见-前额线
- 头痛
更常见-多汗症
- 身体酸痛或疼痛
- 发冷
- 拥塞
- 咳嗽
- 腹泻
- 喉咙干燥或酸痛
- 恐惧
- 发热
- 普遍感到不适或生病
- 头痛
- 拍摄地点流血严重
- 皮肤瘙痒
- 关节痛
- 食欲不振
- 恶心
- 紧张
- 排尿困难或困难
- 流鼻涕
- 发抖
- 出汗
- 脖子上的腺体肿胀
- 睡眠困难
- 吞咽麻烦
- 声音变化
- 呕吐
更常见的斜视
- 上眼睑下垂
- 眼睛向上或向下而不是笔直向前
较常见-上肢痉挛
- 手臂疼痛
不常见-眼睑痉挛
- 皮疹
- 眼睑皮肤肿胀
少见-慢性偏头痛
- 出血,起泡,灼热,发凉,皮肤变色,压力感,荨麻疹,感染,炎症,瘙痒,肿块,麻木,疼痛,皮疹,发红,疤痕,酸痛,刺痛,肿胀,压痛,刺痛,溃疡或注射部位的温度
- 模糊的视野
- 身体疼痛或疼痛
- 咳嗽产生粘液
- 呼吸困难
- 头晕
- 上眼睑下垂
- 头痛
- 肌肉酸痛
- 紧张
- 敲打耳朵
- 缓慢或快速的心跳
- 胸闷
不太常见-用于额头线
- 皮肤紧致
少见-下肢痉挛
- 背疼
- 身体疼痛或疼痛
- 发冷
- 咳嗽
- 呼吸困难
- 耳部充血
- 发热
- 头痛
- 失去声音
- 打喷嚏
- 咽喉痛
- 鼻塞
- 异常疲倦或虚弱
不太常见-对于斜视
- 难以找到物体的位置
- 双重视野
对于医疗保健专业人员
适用于onabotulinumumxinA:注射剂
一般
较常见的不良反应包括局部疼痛和头痛,否则反应会根据所治疗的病情而变化。注射的肌肉的局部无力代表了预期的药理作用,而附近肌肉的无力也可能由于毒素的传播而发生。 [参考]
胃肠道
肉毒杆菌毒素导致死亡,是严重吞咽困难的并发症。在宫颈肌张力障碍患者中,有19%的患者出现吞咽困难。据报道大多数吞咽困难为轻度或中度,但是在这些病例中约有20%伴有呼吸困难。 [参考]
非常常见(10%或更多):吞咽困难(高达19%)
常见(1%至10%):便秘,恶心
罕见(0.1%至1%):口腔干燥
未报告频率:吞咽困难,下巴疼痛
上市后报告:腹痛,腹泻,口干,呕吐,厌食[参考]
呼吸道
与安慰剂组相比,在第1、6、12周时,基线时呼吸功能稳定,降低,呼吸功能降低的上肢痉挛试验患者的事件发生率变化更大(15%或更大或20%或更大的下降)。与安慰剂的这些差异在统计学上不显着,但值得注意。在患有神经肌肉病因性限制性肺疾病和与神经系统疾病相关的逼尿肌过度活动的患者中,与安慰剂相比,治疗患者的强迫肺活量(FVC)降低的发生率达15%或20%或更高。与安慰剂相比,治疗上肢痉挛的患者发生支气管炎的频率更高(3%比1%)。在接受上肢痉挛治疗的肺功能下降的患者中,与安慰剂相比,接受治疗的患者报告上呼吸道感染的频率更高(高达11%比6%)。在接受下肢痉挛治疗的患者中,与安慰剂相比,上呼吸道感染的发生率更高(2%比1%)。在接受上肢痉挛治疗的儿科患者中,上呼吸道感染的发生率比安慰剂高(17%[6单位/ kg]; 10%[3单位/ kg]; 9%[安慰剂])。 [参考]
非常常见(10%或更多):上呼吸道感染
常见(1%至10%):支气管炎,咳嗽,鼻炎,呼吸困难,咽炎,鼻漏,鼻充血
上市后报告:吸入性肺炎,呼吸抑制和/或呼吸衰竭[参考]
神经系统
常见(1%至10%):头痛,偏头痛恶化,面部轻瘫,头晕,高渗,语言障碍,癫痫发作
罕见(0.1%至1%):眩晕
未报告频率:VII神经障碍
上市后报告:臂丛神经病变,面神经麻痹,感觉不足,局部麻木,重症肌无力,感觉异常,周围神经病,神经根病,晕厥[参考]
泌尿生殖
非常常见(10%或更高):尿路感染(高达26%),尿retention留(高达17%)
常见(1%至10%):排尿困难,血尿,尿尿,残余尿量
在患有膀胱过度活动症(OAB)的患者中进行的试验中,在注射异义肌注射后的前12周内最常见的不良反应是尿路感染(UTI; 18%),排尿困难(9%),尿retention留(6%),细菌尿(4%)和剩余尿量(3%)。与没有糖尿病的患者相比,糖尿病患者的尿路感染发生率更高(分别为31%和26%)。与PVR尿量为200 mL或更少的患者相比,注射后经历最大空洞残留(PVR)尿量超过200 mL的患者的UTI发生率增加(44%比23%)。
在逼尿肌过度活跃并伴有神经系统疾病的患者中,尿路感染和尿retention留分别发生在24%和17%。
肌肉骨骼
常见(1%至10%):肢体疼痛,肌肉无力,乏力,乏力,背痛,肌张力亢进,僵硬,跌倒,步态障碍,肌肉痉挛,颈部疼痛,肌肉骨骼僵硬,肌痛
罕见(0.1%至1%):下颚疼痛
上市后报告:失神经/肌肉萎缩,局部肌肉抽搐/不自主肌肉收缩,构音障碍, [参考]
心血管的
肉毒杆菌毒素:
常见(1%至10%):高血压
未报告频率:心律不齐,心肌梗塞(有时致命) [参考]
本地
常见(1%至10%):注射部位疼痛[参考]
眼科
非常常见(10%或更多):眼睑下垂(高达21%)
常见(1%至10%):眼睑下垂,眉毛下垂,浅点状角膜炎,干眼
罕见(0.1%至1%):眼睑浮肿,眼部感染,复视,眼球后出血
非常罕见(小于0.01%):角膜穿孔
未报告的频率:刺激眼睑,注射液,眼角膜炎,畏光,外翻,角膜炎,复视,眼睑注射后眼睑皮肤局部肿胀持续数天,眨眼减少(注射眼轮状肌肉可能导致严重的角膜暴露)持续性上皮缺损
售后报告:视觉障碍,斜视,视力模糊[参考]
过敏症
据报致命的过敏反应。在这种情况下,使用利多卡因作为稀释剂,因此无法确定其原因。
未报告频率:过敏反应,血清病,荨麻疹,软组织水肿,呼吸困难
其他
常见(1%至10%):疲劳,虚弱,发烧,
未报告频率:局部面部麻痹,晕厥,重症肌无力加重
上市后报告:垂耳,感觉不足,不适,神经根病,耳鸣[参考]
皮肤科
常见(1%至10%):瘙痒,皮肤紧绷
未报告频率:弥漫性皮疹
上市后报告:脱发(包括疟疾),多汗症,瘙痒,皮疹,多形性红斑,牛皮癣性皮炎,牛皮癣性皮疹[参考]
免疫学的
常见(1%至10%):流感综合征,感染
未报告的频率:免疫原性(形成抗A型肉毒杆菌毒素的中和抗体,可能会降低治疗效果) [参考]
血液学
常见(1%至10%):出血[参考]
精神科
常见(1%至10%):焦虑[参考]
参考文献
1.“产品信息。肉毒杆菌化妆品(onabotulinumtoxinA)。”加利福尼亚州欧文市的Allergan Inc.
2.“产品信息。肉毒杆菌毒素(纳肉毒素)。”加利福尼亚州欧文市的Allergan Inc.
某些副作用可能没有报道。您可以将其报告给FDA。
2.3管理
将至少0.5 mL(对于g状线),0.6 mL(对于lateral侧线)或1 mL(对于与g状线一起处理的前额线)吸入适当重构的毒素到无菌注射器中,最好是结核菌素注射器并排出注射器筒中的任何气泡。取下用于重构产品的针头,然后安装30-33号针头。确认针头是否通畅。
眉线
皱纹和皱纹圆盘肌的活动产生了眉间线。这些肌肉使眉毛向内移动,而前列腺和压迫器下部则将眉毛拉低。这会产生皱眉或“皱眉”。肌肉的位置,大小和使用在各个人之间明显不同。由面部表情引起的线条垂直于收缩面部肌肉的作用方向而出现。面部线条的有效剂量取决于对患者激活所注射浅表肌肉的能力的总体观察。
为了减少上睑的并发症,应采取以下步骤:
•避免在上睑提肌附近注射,尤其是在额头压低型复合体较大的患者中。
•侧面瓦楞纸箱注射应放置在骨眶上上方至少1 cm处。
•确保注射量/剂量准确,并在可行的情况下将其降至最低。
•请勿在中央眉毛上方1厘米处注入毒素。
注入4单位(0.1 mL)的重新配制的BOTOX Cosmetic 肌内注射进入5个部位中的每一个,每个波纹肌中2个,在前列腺肌中1个,总剂量为20单位(见图1)。通常,重新配制的BOTOX Cosmetic的初始剂量会在注射后一到两天引起注射肌肉的化学神经支配,在第一周内强度会增加。
BOTOX Cosmetic的效果持续时间 眉毛线大约需要3-4个月。
图1:
侧Can线
眼外侧lines线主要是由于眼周围的眼球眼眼球活动引起眼睑眨眼和眼睑闭合所致。眼轮匝的强行收缩会导致侧can的径向和外侧折叠(鱼尾纹)。这些放射线的分布在患者之间有所不同。
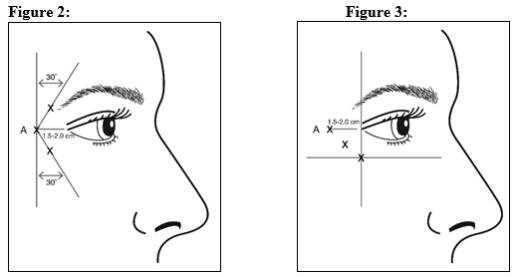
注射时应使针尖斜角朝上并远离眼睛。将4个单位/0.1 mL的重组BOTOX Cosmetic注射到眼轮状眼外侧肌的每侧3个部位(总共6个注射点),总共注入24个单位/0.6 mL(每侧12个单位)。第一次注射(A)距颞侧眼约1.5-2.0 cm,正好距眼眶沿。如果外侧can管区域中的线在外侧can骨的上方和下方,则按图2进行注入。或者,如果外侧can管区域中的线主要位于外侧can骨的下方,则按图3进行注入。
对于同时使用眉label线进行治疗,外侧can管的剂量为24单位,对label眉线的剂量为20单位(请参见“眉线”管理和图1),总剂量为44单位。
额头纹
前额线主要来自额肌的活动。该肌肉使眉毛向上运动,与前列腺,轮状,波纹状和压迫性超睫毛相互作用。额肌收缩引起眉毛升高。肌肉的位置,大小和使用在各个人之间明显不同。
与前眉线一起治疗前额线(参见眉线管理和图1),以最大程度地减少眉毛下垂的可能性。与额唇线(20单位[0.5 mL])结合使用时,治疗前额线(20单位[0.5 mL])的建议总剂量为40单位(1mL)。
当确定额肌中适当注射部位的位置时,请评估受试者前额的大小与额肌活动分布之间的总体关系。
通过轻触额头在静止和最大抬高眉毛的位置,找到以下水平治疗行:
- 额肌活动的上缘:最上额折痕上方约1厘米
- 下治疗排:额肌活动的上缘和眉毛之间的中点,至少在眉毛上方2 cm
- 上治疗排:额肌活动上缘与下治疗排之间的中途
将4单位(0.1毫升)重构的BOTOX Cosmetic注入额肌的5个部位,总共20单位(0.5毫升)。将5次注射放置在水平治疗行与以下垂直界标的相交处(请参见图4):
- 在面部中线下方的治疗行上,在触诊的颞骨融合线(颞顶)内侧0.5 – 1.5 cm处;重复另一面。
- 在上部治疗排上,在下部治疗排的外侧和内侧之间的中间;重复另一面。
图4:

对于同时使用外侧can线治疗,总剂量为64单位,包括前额线20单位,眉间线20单位和外侧and线24单位(请参阅外侧Can线管理和图2和3)。
上市后的报告表明,肉毒杆菌化妆品和所有肉毒杆菌毒素产品的作用可能会从注射区域扩散,产生与肉毒杆菌毒素作用一致的症状。这些可能包括乏力,全身性肌无力,复视,上睑下垂,吞咽困难,声音障碍,构音障碍,尿失禁和呼吸困难。注射后数小时至数周已报告了这些症状。吞咽和呼吸困难可能会危及生命,并且已有死亡报告。在接受痉挛治疗的儿童中,症状的风险可能最大,但在进行了痉挛和其他疾病的成人中,也可能出现症状,特别是在那些具有潜在症状的儿童中。未经批准的用途 在批准的适应症中,已经报道了与用于治疗宫颈肌张力障碍和痉挛的剂量相当的剂量和较低剂量的作用扩散病例。 [请参阅警告和注意事项( 5.2 )]
1适应症和用途
肉毒杆菌毒素化妆品(onabotulinumtoxinA)适用于成年患者,可暂时改善以下症状:
- 中度至重度的皱纹与皱纹和/或直肠肌肉活动有关
- 中度至重度can侧睑缘球菌活动
- 中额至重度额额线与额肌的活动有关
2剂量和给药
2.1安全使用说明
注射用肉毒杆菌化妆品的功效单位(onabotulinumtoxinA)特定于所用的制备和测定方法。它们不能与肉毒杆菌毒素产品的其他制剂互换使用,因此,肉毒杆菌化妆品的生物活性单位不能与通过其他任何特定测定方法评估的任何其他肉毒杆菌毒素产品的单位进行比较或转化为该单位[请参阅警告和注意事项( 5.1 )和说明( 11 )] 。
适应症的具体剂量和给药建议 应该遵循。用BOTOX和Botox Cosmetic对成年患者进行一种或多种适应症治疗时,最大累积剂量通常应在3个月间隔内不超过400单位。
BOTOX Cosmetic的安全性和有效性 更频繁 比每三个月 尚未经过临床评估。
Botox Cosmetic的安全有效使用取决于产品的正确储存,正确剂量的选择以及正确的重构和给药技术。施用肉毒杆菌化妆品的医师必须了解涉及区域的相关神经肌肉和结构解剖结构,以及由于先前的外科手术程序和疾病而导致的任何解剖结构变化。
如果出现以下情况,请勿使用肉毒杆菌化妆品并联系Allergan(1-800-890-4345)
- 纸箱标签上不包含带有半透明Allergan银色徽标的完整封条(在纸箱的两端),或者封条上有一个黑色的圆圈,并带有对角线(即禁止标志)。
- 样品瓶标签不包含在彩虹色水平线上带有“ Allergan”名称的全息胶片
- 小瓶标签和纸箱标签上没有美国许可证号1145 [请参阅如何提供/存储和处置( 16 )]
2.2制备与稀释技术
Botox Cosmetic以每瓶50单位和100单位的单剂量提供。肌内注射之前,用无菌,不含防腐剂的0.9%氯化钠注射液USP重建每个真空干燥的Botox Cosmetic小瓶(请参见表1)。用适当大小的针头和注射器吸取适量的稀释剂,以得到浓度为4个单位/0.1 mL的复溶溶液,对于唇唇线,其总治疗剂量为0.5毫升中的20单位,对于外侧为0.6毫升中的24个单位th线和额头线和眉间线的1毫升中40单位。然后将稀释剂缓慢注入样品瓶中。如果真空没有将稀释剂拉入小瓶,则丢弃小瓶。轻轻混合肉毒杆菌化妆品 旋转小瓶加盐水。在标签的空白处记录重新配制的日期和时间。复原后24小时内应施用肉毒杆菌化妆品。在这段时间内,复原后的肉毒杆菌化妆品应存放在冰箱中(2°至8°C)。 Botox化妆品小瓶仅适用于单剂量。丢弃所有剩余的溶液。
| 稀释剂*已添加至 100单位样品瓶 | 每0.1 mL的最终剂量单位 | 稀释剂*已添加至 50单位瓶 | 每0.1 mL的最终剂量单位 |
| 2.5毫升 | 4伙 | 1.25毫升 | 4伙 |
*不含防腐剂的0.9%氯化钠注射液,仅USP
复原的肉毒杆菌化妆品应透明,无色且无颗粒物质。给药前以及溶液和容器允许的情况下,应目视检查肠胃外药品是否有颗粒物和变色。不要冷冻重组的肉毒杆菌化妆品。
2.3管理
将至少0.5 mL(对于g状线),0.6 mL(对于lateral侧线)或1 mL(对于与g状线一起处理的前额线)吸入适当重构的毒素到无菌注射器中,最好是结核菌素注射器并排出注射器筒中的任何气泡。取下用于重构产品的针头,然后安装30-33号针头。确认针头是否通畅。
眉线
皱纹和皱纹圆盘肌的活动产生了眉间线。这些肌肉使眉毛向内移动,而前列腺和压迫器下部则将眉毛拉低。这会产生皱眉或“皱眉”。肌肉的位置,大小和使用在各个人之间明显不同。由面部表情引起的线条垂直于收缩面部肌肉的作用方向而出现。面部线条的有效剂量取决于对患者激活所注射浅表肌肉的能力的总体观察。
为了减少上睑的并发症,应采取以下步骤:
•避免在上睑提肌附近注射,尤其是在额头压低型复合体较大的患者中。
•侧面瓦楞纸箱注射应放置在骨眶上上方至少1 cm处。
•确保注射量/剂量准确,并在可行的情况下将其降至最低。
•请勿在中央眉毛上方1厘米处注入毒素。
注入4单位(0.1 mL)的重组肉毒杆菌化妆品 肌内注射进入5个部位中的每一个,每个波纹肌中2个,在前列腺肌中1个,总剂量为20单位(见图1)。通常,重新配制的肉毒杆菌化妆品的初始剂量会在注射后一到两天引起注射肌肉的化学神经支配,在第一周内强度会增加。
BOTOX Cosmetic的效果持续时间 眉毛线大约需要3-4个月。
图1:

侧Can线
眼外侧lines线主要是由于眼周围的眼球眼眼球活动引起眼睑眨眼和眼睑闭合所致。眼轮匝的强行收缩会导致侧can的径向和外侧折叠(鱼尾纹)。这些放射线的分布在患者之间有所不同。
注射时应使针尖斜角朝上并远离眼睛。将4单位/0.1 mL的重组肉毒杆菌毒素注射到眼轮状外侧眼肌的每侧3个部位(总共6个注射点),总共注入24单位/0.6 mL(每侧12单位)。第一次注射(A)距颞侧眼约1.5-2.0 cm,正好距眼眶沿。如果外侧can管区域中的线在外侧can骨的上方和下方,则按图2进行注入。或者,如果外侧can管区域中的线主要位于外侧can骨的下方,则按图3进行注入。

对于同时使用眉label线进行治疗,外侧can管的剂量为24单位,对label眉线的剂量为20单位(请参见“眉线”管理和图1),总剂量为44单位。
前额线
前额线主要来自额肌的活动。该肌肉使眉毛向上运动,与前列腺,轮状,波纹状和压迫性超睫毛相互作用。额肌收缩引起眉毛升高。肌肉的位置,大小和使用在各个人之间明显不同。
与前眉线一起治疗前额线(参见眉线管理和图1),以最大程度地减少眉毛下垂的可能性。与额唇线(20单位[0.5 mL])结合使用时,治疗前额线(20单位[0.5 mL])的建议总剂量为40单位(1mL)。
当确定额肌中适当注射部位的位置时,请评估受试者前额的大小与额肌活动分布之间的总体关系。
通过轻触额头在静止和最大抬高眉毛的位置,找到以下水平治疗行:
- 额肌活动的上缘:最上额折痕上方约1厘米
- 下治疗排:额肌活动的上缘和眉毛之间的中点,至少在眉毛上方2 cm
- 上治疗排:额肌活动上缘与下治疗排之间的中途
将4单位(0.1 mL)的重组肉毒杆菌化妆品注入额肌的5个部位,总计20单位(0.5 mL)。将5次注射放置在水平治疗行与以下垂直界标的相交处(请参见图4):
- 在面部中线下方的治疗行上,在触诊的颞骨融合线(颞顶)内侧0.5 – 1.5 cm处;重复另一面。
- 在上部治疗排上,在下部治疗排的外侧和内侧之间的中间;重复另一面。
图4:

对于同时使用外侧can线治疗,总剂量为64单位,包括前额线20单位,眉间线20单位和外侧and线24单位(请参阅外侧Can线管理和图2和3)。
3剂型和强度
- 注射用:50单位真空干燥的粉末装在单剂量小瓶中,以进行重构
- 注射用:100单位真空干燥粉末放在单剂量小瓶中,以进行重构
4禁忌症
4.1已知对肉毒杆菌毒素过敏
BOTOX Cosmetic被禁止对任何肉毒杆菌毒素制剂或制剂中的任何成分过敏的人禁用[见警告和注意事项( 5.4 )] 。
4.2注射部位感染
建议在注射部位感染时禁忌使用BOTOX Cosmetic。
5警告和注意事项
5.1肉毒杆菌毒素产品之间缺乏互换性
Botox Cosmetic的效能单位特定于所用的制备和测定方法。它们不能与肉毒杆菌毒素产品的其他制剂互换,因此,不能将肉毒杆菌化妆品的生物活性单位与通过任何其他特定测定方法评估的任何其他肉毒杆菌毒素产品的单位进行比较或转化为该单位[请参见说明( 11 )] 。
5.2毒素效应的传播
Botox Cosmetic和其他批准的肉毒杆菌毒素的上市后安全性数据表明,在某些情况下,可以在局部注射部位以外观察到肉毒杆菌毒素的作用。症状与肉毒杆菌毒素的作用机理一致,可能包括乏力,全身性肌肉无力,复视,上睑下垂,吞咽困难,声音障碍,构音障碍,尿失禁和呼吸困难。注射后数小时至数周已报告了这些症状。吞咽和呼吸困难可能会危及生命,并且有报告称死亡与毒素影响有关。在接受痉挛治疗的儿童中,症状的风险可能最大,但是在进行了痉挛和其他疾病的成人中,也可能出现症状,特别是在那些具有潜在症状使其易患这些症状的患者中。在未经批准的用途和经批准的适应症中,已经报道了与毒素作用扩散相一致的症状,其剂量与用于治疗颈肌张力障碍和痉挛的剂量相当或更低。如果发生吞咽,言语或呼吸系统疾病,应建议患者或护理人员立即就医。
没有确定的严重不良事件报告,表明与BOTOX / Botox Cosmetic皮肤病学治疗有关的毒素作用远距离传播 标记剂量为20单位(用于睑缘线),24单位(用于侧can骨线),40单位(用于带有前突线的前额线),44单位(用于同时治疗侧can线和白喉线),64单位(用于同时治疗外侧can管,眉间线和前额线)或100单位(用于严重的原发性腋窝多汗症)。
没有明确的严重不良事件报道与BOTOX相关的毒素作用远距离传播 推荐剂量(30单位及以下)用于睑缘痉挛,斜视或慢性偏头痛。
5.3未经批准的严重不良反应
曾有未经批准使用BOTOX注射的患者发生严重不良反应,包括过度虚弱,吞咽困难和吸入性肺炎,以及与致命后果相关的一些不良反应。在这些情况下,不良反应不一定与毒素的远距离传播有关,而可能是由于向注射部位和/或邻近结构施用BOTOX引起的。在某些情况下,患者患有吞咽困难或其他严重残疾。没有足够的信息来确定与未经批准使用BOTOX相关的不良反应风险增加的相关因素。尚未确定BOTOX未经批准使用的安全性和有效性。
5.4过敏反应
已经报道了严重和/或立即的超敏反应。这些反应包括过敏反应,血清病,荨麻疹,软组织水肿和呼吸困难。如果发生这种反应,请进一步注射肉毒杆菌化妆品 应该停药并立即开始适当的医学治疗。已经报道了一种致命的过敏反应,其中使用利多卡因作为稀释剂,因此不能可靠地确定病因。
5.5心血管系统
有报道称,使用BOTOX / Botox Cosmetic化妆品后,涉及心血管系统的不良事件,包括心律不齐和心肌梗塞,有些会致命。这些患者中有些具有包括先前存在的心血管疾病在内的危险因素。对已患有心血管疾病的患者用药时要小心。
5.6既往存在神经肌肉疾病的临床意义重大的风险增加
给予肉毒杆菌毒素时,应监测患有周围运动神经性疾病,肌萎缩性侧索硬化或神经肌肉连接障碍(例如重症肌无力或兰伯特-伊顿综合征)的个体。患有神经肌肉疾病可能是在临床显著效果,包括全身肌肉无力,复视,眼睑下垂,发音困难,构音障碍,吞咽困难严重和呼吸妥协从onabotulinumtoxinA风险增加[见警告和注意事项( 5.2 , 5.7 )]。
5.7吞咽困难和呼吸困难
用BOTOX和其他肉毒杆菌毒素产品治疗可能会导致吞咽或呼吸困难。已有吞咽或呼吸困难的患者可能更容易出现这些并发症。在大多数情况下,这是注射或呼吸控制口咽或呼吸的口咽部肌肉中肌肉减弱的结果[请参阅警告和注意事项( 5.2 )] 。
据报道,肉毒杆菌毒素治疗后死亡是严重吞咽困难的并发症。吞咽困难可能会持续数月,并且需要使用喂食管来维持足够的营养和水分。严重吞咽困难可能导致误吸,在吞咽或呼吸功能已受到损害的患者接受治疗时,这是一个特别的风险。
肉毒杆菌毒素的治疗可能会削弱作为通气辅助肌肉的颈部肌肉。这可能会导致呼吸系统疾病患者严重丧失呼吸能力,而这些患者可能已经变得依赖这些辅助肌肉。上市后有严重呼吸困难的报道,包括呼吸衰竭。
据报道,颈部肌肉质量较小的患者和需要向胸锁乳突肌双向注射以治疗宫颈肌张力障碍的患者吞咽困难的风险较高。限制注射入胸锁乳突肌的剂量可以减少吞咽困难的发生。注射到肩骨肩may骨可能与上呼吸道感染和吞咽困难的风险增加有关。
如果肉毒杆菌毒素患者吞咽,说话或呼吸系统出现问题,则可能需要立即就医。这些反应可在注射肉毒杆菌毒素后数小时至数周内发生[见警告和注意事项( 5.2 )] 。
5.8注射部位已有的条件
当在建议的注射部位发炎,眼睑下垂或目标肌肉过度虚弱或萎缩时使用肉毒杆菌毒素美容治疗时,应谨慎行事。
5.9 BOTOX治疗睑裂痉挛的患者的角膜暴露和溃疡
在圆形眼球眼内或附近注射肉毒杆菌毒素产品而减少的眨眼可导致角膜暴露,持续的角膜上皮缺损和角膜溃疡,特别是在患有VII神经疾病的患者中。
应对任何角膜上皮缺损进行大力治疗。这可能需要保护性滴剂,软膏,治疗性软性隐形眼镜或通过修补或其他方式闭眼。
5.10肉毒杆菌毒素化妆品治疗的患者的干眼症
有报道称眼球周围或附近的肉毒杆菌毒素化妆品注射会引起干眼症。如果干眼症状(例如,眼睛刺激,畏光或视觉改变)持续存在,请考虑将患者转诊给眼科医生[请参阅警告和注意事项( 5.9 )] 。
5.11斜视治疗患者的空间定向障碍,复视或偏点
在一个或多个眼外肌中引起麻痹可能会导致空间定向障碍,复视或过去的指向。遮盖患眼可缓解这些症状。
5.12人白蛋白与病毒性疾病的传播
该产品含有人血衍生物白蛋白。基于有效的捐献者筛选和产品制造过程,它具有极低的传播病毒性疾病和变异性克雅氏病(vCJD)的风险。克雅氏病(CJD)的传播存在理论上的风险,但如果确实存在这种风险,那么传播的风险也将被认为是极小的。从未发现许可白蛋白或其他许可产品中所含白蛋白的病毒性疾病,CJD或vCJD传播病例。
6不良反应
在标签的其他部分中,对注射用肉毒杆菌化妆品(onabotulinumtoxinA)产生的以下不良反应进行了详细讨论:
- 毒素效应的传播[请参阅警告和注意事项( 5.2 )]
- 超敏反应[见禁忌症( 4.1 )和警告和注意事项( 5.4 )]
- 吞咽困难和呼吸困难[请参阅警告和注意事项( 5.7 )]
6.1临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此不能将药物在临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映在临床实践中观察到的不良反应率。
BOTOX和肉毒杆菌化妆品 在相同的配方中含有相同的活性成分,但标记的适应症和用法不同。因此,使用BOTOX观察到不良事件 使用肉毒杆菌化妆品也有可能被观察到。
通常,不良反应在注射肉毒杆菌化妆品后的第一周内发生,虽然通常是短暂的,但可能持续数月或更长时间。局部疼痛,感染,炎症,压痛,肿胀,红斑和/或出血/淤青可能与注射有关。针头相关的疼痛和/或焦虑症可能导致血管迷走神经反应(包括晕厥,低血压),可能需要适当的药物治疗。
注射的肌肉的局部无力代表肉毒杆菌毒素的预期药理作用。但是,由于毒素的传播,附近的肌肉也可能会虚弱[见警告和注意事项( 5.2 )] 。
眉线
表2列出了选择的不良反应报道>肉毒杆菌化妆品的1%处理谁在随机化,安慰剂对照的临床研究中评估,以评估在外观的改善使用肉毒杆菌化妆品的受试者(N = 405)年龄18〜75纹线。
| 按系统器官分类的不良反应 | 肉毒杆菌毒素 化妆品 (N = 405) | 安慰剂 (N = 130) |
| 一般疾病和管理场所状况 面部疼痛 | 6(1%) | 0(0%) |
| 神经系统疾病 面部轻瘫 | 5(1%) | 0(0%) |
| 眼疾 眼睑下垂 | 13(3%) | 0(0%) |
| 肌肉骨骼和结缔组织疾病 肌无力 | 6(1%) | 0(0%) |
侧Can线
表3列出了在注射后90天内报告的所选不良反应,其中> 1%的18至75岁的Botox用化妆品治疗的受试者(N = 526)在两项随机,双盲,安慰剂对照的临床研究中进行了评估,以评估其使用的BOTOX Cosmetic 仅在改善外can线的外观方面。
| 按系统器官分类的不良反应 | 肉毒杆菌毒素 化妆品 24伙 (N = 526) | 安慰剂 (N = 530) |
| 眼疾 眼睑浮肿 | 5(1%) | 0(0%) |
前额线
表4列出了由18%至77岁的接受肉毒杆菌毒素化妆品治疗的受试者(N = 665)超过1%报告的选定不良反应,他们在两项随机,双盲,安慰剂对照的临床研究中进行了评估,以评估肉毒杆菌毒素化妆品的使用 在改善前额线与眉状线的外观。
| 按系统器官分类的不良反应 | 肉毒杆菌化妆品 (20根额头线 20单位的银纹线) (N = 665) | 安慰剂 (N = 315) |
| 神经系统疾病 头痛 | 58(9%) | 17(5%) |
| 眼疾 眼睑下垂 | 12(2%) | 1(0%) |
| 皮肤和皮下 组织疾病 眉毛下垂 皮肤紧致 | 13(2%) 10(2%) | 0(0%) 0(0%) |
同时治疗前额线,眉间线和lateral侧线没有其他药物不良反应的报道。
6.2免疫原性
与所有治疗性蛋白质一样,具有免疫原性的潜力。抗体形成的检测高度依赖于测定的灵敏度和特异性。另外,在测定中观察到的抗体(包括中和抗体)阳性的发生率可能受到几个因素的影响,这些因素包括测定方法,样品处理,样品收集的时机,伴随用药和基础疾病。由于这些原因,将以下描述的研究中针对Botox Cosmetic的抗体发生率与其他研究中或针对其他产品的抗体发生率进行比较可能会产生误导。肉毒杆菌毒素治疗 可能导致中和抗体的形成,这可能通过使毒素的生物活性失活而降低后续治疗的有效性。
在三项Canthal Line侧向试验中,对Botox Cosmetic进行治疗的916名受试者(24个单位的517名受试者和44个单位的399名受试者)进行了抗体形成标本分析。在916名接受肉毒杆菌毒素化妆品治疗的受试者中,有14名受试者(1.5%)产生了结合抗体,没有受试者(0%)出现了中和抗体。
数据反映了在小鼠保护性检测中测试结果对Botox Cosmetic的中和活性为阳性或阴性的受试者。
中和抗体形成的关键因素尚未很好地表征。一些研究的结果表明,以更频繁的间隔或以更高的剂量注射肉毒杆菌毒素可能会导致抗体形成的发生率更高。通过以两次注射之间的最长可行间隔给予的最低有效剂量进行注射,可以最大程度地降低抗体形成的可能性。
6.3上市后的经验
由于这些反应是从不确定大小的人群中自愿报告的,因此并非总是能够可靠地估计其发生频率或建立与药物暴露的因果关系。
已经有死亡的自发报告,有时有吞咽困难,肺炎和/或其他显著衰弱或过敏反应有关,A型肉毒毒素治疗后[见警告和注意事项( 5.4 , 5.7 )]。
也有关于心血管系统的不良事件的报道,包括心律不齐和心肌梗塞,其中一些具有致命的后果。这些患者中有些具有包括心血管疾病在内的危险因素。
还已经报道了新的发作或复发性癫痫发作,通常发生在倾向于发生这些事件的患者中。
在BOTOX / Botox Cosmetic的批准后使用过程中,已发现按系统器官分类的以下不良反应:
耳朵和迷宫疾病
耳垂;耳鸣;眩晕
眼疾
复视;眼干泻湖斜视视觉障碍;视力模糊
胃肠道疾病
腹痛;腹泻;口干;恶心;呕吐
一般疾病和给药部位情况
去神经不适发热
代谢与营养失调
厌食症
肌肉骨骼和结缔组织疾病
局部肌肉抽搐/不自主的肌肉收缩;肌肉萎缩;肌痛
神经系统疾病
臂丛神经病变;构音障碍面神经麻痹感觉不足局部麻木;重症肌无力;感觉异常周围神经病神经根病;昏厥
呼吸,胸和纵隔疾病
吸入性肺炎;呼吸困难呼吸抑制和/或呼吸衰竭
皮肤和皮下组织疾病
脱发,包括疟疾;多汗症瘙痒皮疹(包括多形性红斑,牛皮癣皮炎和牛皮癣皮疹)
7药物相互作用
Botox Cosmetic(onabotulinumtoxinA)尚未进行正式的药物相互作用研究。
7.1氨基糖苷类和其他干扰神经肌肉传递的药物
肉毒杆菌化妆品和氨基糖苷类或其他干扰神经肌肉传递的药物(例如库拉类化合物)的共同给药应谨慎进行,因为可能会增强毒素的作用。
7.2抗胆碱药
施用肉毒杆菌毒素化妆品后使用抗胆碱能药物可能会增强全身性抗胆碱能作用。
7.3其他肉毒杆菌神经毒素产品
同时或彼此之间几个月内施用不同肉毒杆菌神经毒素产品的效果尚不清楚。在解决先前服用的肉毒杆菌毒素的作用之前,先服用另一种肉毒杆菌毒素可能会加剧神经肌肉的无力。
7.4肌肉松弛剂
在施用肉毒杆菌化妆品之前或之后施用肌肉松弛剂也可能会加剧肌无力。
8在特定人群中的使用
8.1怀孕
风险摘要
上市后的监测尚无研究或与孕妇使用肉毒杆菌化妆品相关的发育风险的充分数据。
在动物研究中,妊娠期间服用肉毒杆菌毒素化妆品会对临床上相关剂量的胎儿生长产生不利影响(降低胎儿体重和骨骼骨化),这与母体毒性有关[见数据]。
在美国普通人群中,临床公认的怀孕中主要先天缺陷和流产的估计背景风险分别为2-4%和15-20%。对于所指示的人群,主要出生缺陷和流产的背景风险尚不清楚。
数据
动物资料
在器官发生期间(妊娠第5天和第13天)两次对怀孕的小鼠或大鼠肌肉注射Botox Cosmetic(4、8或16单位/ kg)时,观察到胎儿体重减少和胎儿骨骼骨化减少。在两个最高剂量。在这些研究中,对发育毒性的无影响剂量(4单位/千克)约为人体平均体重的高剂量,用于人体的鹰嘴线,侧can线和前额线为64单位(单位/千克) 。
当在器官发生期间每天对怀孕的大鼠(0.125、0.25、0.5、1、4或8单位/ kg)或兔子(0.063、0.125、0.25或0.5单位/ kg)肌肉内注射Botox Cosmetic时(总计在大鼠的两个最高剂量和兔子的最大剂量下,观察到大鼠12剂,兔子13剂,胎儿体重减少和胎儿骨骼骨化减少。这些剂量还与明显的孕产妇毒性有关,包括流产,早期分娩和孕产妇死亡。在这些研究中,每只大鼠1单位/千克的发育无影响剂量大约等于基于单位/千克的人类平均高剂量64单位,而在兔中0.25单位/千克的发育无影响剂量小于人的平均高剂量,基于单位/千克。
当怀孕的大鼠在三个不同的发育时期(植入,植入或器官发生之前)接受单次肌内注射(1、4或16单位/ kg)时,未观察到对胎儿发育的不利影响。在大鼠中单一母体剂量(16单位/千克)的发育无影响水平约为人类平均高剂量64单位(基于单位/千克)的16倍。
8.2哺乳
风险摘要
没有关于人或动物乳汁中Botox Cosmetic的存在,对母乳喂养的孩子的影响或对牛奶产量的影响的数据。
应考虑母乳喂养的发育和健康益处,以及母亲对肉毒杆菌素化妆品的临床需求以及肉毒杆菌素化妆品或潜在母体状况对母乳喂养婴儿的任何潜在不利影响。
8.4小儿使用
尚未确定18岁以下患者的安全性和有效性。
8.5老年用途
眉线
在Botox Cosmetic的两个最初的眉间线临床研究中,年龄小于65岁的受试者的应答率似乎高于65岁或以上的受试者[见临床研究( 14 )] 。
侧Can线
在Botox Cosmetic的两条侧can线临床研究中,年龄小于65岁的受试者的缓解率似乎高于65岁或以上的受试者。
前额线
在Botox Cosmetic的两条前额线临床研究中,年龄小于65岁的受试者的应答率似乎高于65岁或以上的受试者。
10过量
过量的肉毒杆菌化妆品 注射(onabotulinumtoxinA)可能会导致神经肌肉无力并伴有多种症状。
注射后可能不会立即出现用药过量的症状。如果发生意外注射或口服或怀疑服药过量,应考虑对这些患者进行进一步的医学评估,并立即采取适当的药物治疗,包括住院治疗。因人制宜医疗监督几个星期的体征和全身肌肉无力症状可能是局部的,或者从注射部位较远[见黑框警告和警告和注意事项( 5.2 , 5.7 )]。
如果口咽和食道的肌肉组织受到影响,可能会发生误吸,导致吸入性肺炎的发生。如果呼吸肌麻痹或足够虚弱,则可能需要插管和辅助呼吸,直到恢复。除其他一般支持治疗外,支持治疗还可能需要气管切开术和/或长时间的机械通气。
如果服药过量,可以从佐治亚州亚特兰大市疾病控制与预防中心(CDC)获得针对肉毒杆菌毒素产生的抗毒素。然而,抗毒素将不会逆转任何抗肉毒杆菌毒素诱导的作用,这些作用在施用抗毒素时已经很明显。如果怀疑或实际发生肉毒杆菌毒素中毒,请联系当地或州卫生部门,以通过CDC处理抗毒素要求。如果您在30分钟内未收到答复,请直接致电1-770-488-7100与CDC联系。有关更多信息,请访问http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5232a8.htm。
11说明
肉毒杆菌化妆品 (onabotulinumtoxinA) 用于注射的是无菌的,真空干燥的,纯化的A型肉毒杆菌毒素,是由用于肌肉内使用的霍尔菌株A型肉毒梭菌发酵产生的。通过透析和一系列酸沉淀将其从培养液中纯化成由神经毒素和几种辅助蛋白组成的复合物。将复合物溶解在含有人白蛋白的无菌氯化钠溶液中,并在填充和真空干燥之前进行无菌过滤(0.2微米)。
肉毒杆菌化妆品的主要释放程序 使用基于细胞的效能测定法来确定相对于参考标准品的效能。该测定法是针对Allergan产品BOTOX和Botox Cosmetic的。一单位的肉毒杆菌毒素化妆品对应于小鼠中计算出的腹膜内致死剂量中位数(LD 50 )。由于该测定法的具体细节,例如载体,稀释方案和实验室规程,因此不能将肉毒杆菌化妆品的生物活性单位与任何其他肉毒杆菌毒素或通过任何其他特定测定法评估的任何毒素的单位进行比较或转换。 Botox Cosmetic的比活性约为20单位/纳克神经毒素复合物。
每小瓶BOTOX化妆品 包含50单位的肉毒梭菌 A型神经毒素复合物,0.25毫克人白蛋白和0.45毫克氯化钠;或100个单位 肉毒梭菌 A型神经毒素复合物,0.5 mg人白蛋白和0.9 mg氯化钠,无菌,真空干燥形式,不含防腐剂。
12临床药理学
12.1行动机制
肉毒杆菌化妆品通过与运动神经末梢的受体位点结合,进入神经末梢并抑制乙酰胆碱的释放来阻断神经肌肉的传递。这种抑制作用发生在神经毒素裂解SNAP-25时,SNAP-25是一种突触前蛋白,是乙酰胆碱从神经末梢的囊泡成功对接和释放所必需的。当以治疗剂量肌肉注射时,肉毒杆菌化妆品 产生肌肉的部分化学去神经,导致肌肉活动的局部减少。此外,肌肉可能会萎缩,可能会出现轴突发芽,并可能形成结外乙酰胆碱受体。有证据表明可能发生肌肉的神经支配,从而慢慢逆转了肉毒杆菌化妆品产生的肌肉神经支配。
12.2药效学
Botox Cosmetic(onabotulinumtoxinA)尚未进行正式的药效学研究。
12.3药代动力学
使用当前可用的分析技术,不可能在建议剂量的肌肉内注射后在外周血中检测肉毒杆菌毒素化妆品。
13毒理学
13.1致癌,诱变,生育力受损
Long term studies in animals have not been performed to evaluate carcinogenic potential of Botox Cosmetic.
Botox Cosmetic was negative in a battery of in vitro (microbial reverse mutation assay, mammalian cell mutation assay, and chromosomal aberration assay) and in vivo (micronucleus assay) genetic toxicologic assays.
In fertility studies of Botox Cosmetic (4, 8, or 16 Units/kg) in which either male or female rats were injected intramuscularly prior to mating and on the day of mating (3 doses, 2 weeks apart for males, 2 doses, 2 weeks apart for females) to untreated animals, reduced fertility was observed in males at the intermediate and high doses and in females at the high dose. The no-effect doses for reproductive toxicity (4 Units/kg in males, 8 Units/kg in females) are approximately 4-8 times the average high human dose for glabellar lines, lateral canthal lines, and forehead lines of 64 Units on a body weight basis (Units/kg).
14 CLINICAL STUDIES
14.1 Glabellar Lines
Two randomized, multi-center, double-blind, placebo-controlled studies of identical design were conducted to evaluate Botox Cosmetic for use in the temporary improvement of the appearance of moderate to severe glabellar facial lines. The studies enrolled healthy adults (ages 18 to 75) with glabellar lines of at least moderate severity at maximum frown. Subjects were excluded if they had ptosis, deep dermal scarring, or an inability to substantially lessen glabellar lines even by physically spreading them apart. Subjects received a single treatment with Botox Cosmetic (N=405, combined studies) or placebo (N=132, combined studies). Injection volume was 0.1 mL/injection site, for a dose/injection site in the active treatment groups of 4 Units. Subjects were injected intramuscularly in five sites, 1 in the procerus muscle and 2 in each corrugator supercilii muscle, for a total dose in the active treatment groups of 20 Units.
The co-primary efficacy endpoints were the investigator's rating of glabellar line severity at maximum frown and the subject's global assessment of change in appearance of glabellar lines, both at Day 30 post-injection. For the investigator rating, using a 4-point grading scale (0=none, 3=severe) a responder was defined as having a severity grade of 0 or 1. For the subject's global assessment of change, the ratings were from +4 (complete improvement) to -4 (very marked worsening). A responder was defined as having a grade of at least +2 (moderate improvement). After completion of the randomized studies, subjects were offered participation in an open label, repeat treatment study to assess the safety of repeated treatment sessions.
The combined results of these two efficacy studies are presented here. The mean age was 46 years, with 32 subjects (6%) ≥65 years of age. Most of the subjects were women (82%), and Caucasian (84%). At baseline, 210 subjects (39%) had glabellar line severity scores at rest of moderate or severe.
In these studies, the severity of glabellar lines was reduced for up to 120 days in the BOTOX Cosmetic group compared to the placebo group as measured both by investigator rating of glabellar line severity at maximum frown (Table 5), and by subject's global assessment of change in appearance of glabellar lines (Table 6).
| 天 | BOTOX Cosmetic | 安慰剂 | Difference a |
| 7 | 74% 299/405 | 6% 8/132 | 68% (62, 74) |
| 30 b | 80% 325/405 | 3% 4/132 | 77% (72, 82) |
| 60 | 70% 283/403 | 2% 2/130 | 69% (64, 74) |
| 90 | 48% 192/403 | 2% 3/128 | 45% (40, 51) |
| 120 | 25% 102/403 | 2% 2/128 | 24% (19, 29) |
a 95% confidence intervals are shown in parenthesis
b Day 30: Co-Primary Efficacy Time point, p<0.001
| 天 | BOTOX Cosmetic | 安慰剂 | Difference a |
| 7 | 82% 334/405 | 9% 12/132 | 73% (68, 80) |
| 30 b | 89% 362/405 | 7% 9/132 | 83% (77, 88) |
| 60 | 82% 330/403 | 4% 5/130 | 78% (73, 83) |
| 90 | 63% 254/403 | 3% 4/128 | 60% (54, 66) |
| 120 | 39% 157/403 | 1% 1/128 | 38% (33, 43) |
a 95% confidence intervals are shown in parenthesis
b Day 30: Co-Primary Efficacy Time point, p<0.001
In the subset of subjects with resting severity scores of moderate or severe, the investigator assessment of a resting severity of mild or none at Day 30 was also achieved by more Botox Cosmetic treated subjects (74%, 119/161) than placebo treated subjects (20%, 10/49).
Analysis of the limited number of subjects 65 years or older suggested a lower treatment-associated response compared to subjects less than 65 years of age (Table 7).
| Assessment | Age Group | BOTOX Cosmetic (N=405) | Placebo (N=132) | Difference a |
| Investigators (maximal frown) | <65 | 83% 316/382 | 2% 2/123 | 81% (77, 86) |
| 科目 | <65 | 91% 346/382 | 7% 8/123 | 84% (79, 90) |
| Investigators (maximal frown) | > 65 | 39% 9/23 | 22% 2/9 | 17% (-17, 51) |
| 科目 | > 65 | 70% 16/23 | 11% 1/9 | 58% (31, 86) |
a 95% confidence intervals are shown in parenthesis
Exploratory analyses by gender suggested that responder rates in the Botox Cosmetic treated group were higher for women than for men for both the investigator assessment (Day 30; 85% of 334 women, 59% of 71 men) and the Subject Assessment (Day 30; 93% of women, 72% of men). In the limited number of non-Caucasian subjects (n=64 in the Botox Cosmetic treated group) the responder rates were similar to those observed in the Caucasian subjects.
14.2 Lateral Canthal Lines
Two multicenter, randomized, double-blind, placebo-controlled studies evaluated Botox Cosmetic (N=833, randomized to receive any Botox Cosmetic treatment or N=529 randomized to receive placebo) for the temporary improvement in the appearance of moderate to severe lateral canthal lines (LCL). Study 1 assessed Botox Cosmetic treatment of LCL alone; Study 2 also assessed simultaneous treatment of LCL and glabellar lines (GL). Both studies enrolled healthy adults with moderate to severe LCL at maximum smile at baseline; Study 2 also required subjects to have moderate to severe GL at maximum frown at baseline.
In the 5-month Study 1, subjects were randomized to receive a single blinded treatment of 24 Units/0.6 mL (12 Units per side) consisting of 4 Units/0.1 mL into 3 sites of each orbicularis oculi muscle with either Botox Cosmetic (N=222) or placebo (N=223).
In the 7-month Study 2, subjects were randomized to receive either Botox Cosmetic in the LCL region and placebo in the GL region (24 Units; N=306), or Botox Cosmetic in the LCL and GL regions (44 Units [24 Units for LCL and 20 Units for GL]; N=305), or placebo in the LCL and GL regions (0 Units; N=306). Subjects received the same 24 Units regimen for LCL as in Study 1, and the labeled 20 Units (5 injections, 4 Units per site) for GL. Subjects received the same treatment at days 1 and 120.
The primary efficacy measure was the assessment of LCL severity at maximum smile using the 4-point Facial Wrinkle Scale with Photonumeric Guide (FWS; 0=none, 1= mild, 2=moderate, 3=severe). The FWS assessment was performed independently by both investigators and subjects. The primary timepoint was day 30 following the first treatment, as compared to baseline.
The primary efficacy response definition was a composite ≥2-grade improvement from baseline in LCL severity at maximum smile, assessed by both investigator and subject on a per-subject basis. For Studies 1 and 2, the proportion of responders was statistically significant favoring BOTOX Cosmetic (24 Units [LCL alone] and 44 Units [LCL and GL]) compared to placebo at day 30 (Table 8).
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
- 审批历史 FDA的药物史
美国日本医生

Suzanne Reitz MD

Bert Hepner DO

Gregory Aaen MD

Gregory Aaen MD

Gregory Aaen MD

渡邊剛

宮崎総一郎 中部大学特聘教授

百村伸一 教授

村上和成 教授

中山秀章 教授
临床试验
- 用于用一线osimertinib(LAT-Flosi)处理的少殖民NSCLC的LAT
- 针对口腔癌患者的个性化幸存者护理计划 - 对身体心理功能和重返工作
- 使用Tritanium®C前颈笼进行一或两层的前颈椎切除术和融合(Stryker)
- 躯干稳定练习对脑瘫生活质量和沟通的影响
- 食管测量和CT扫描测量的比较
- 可口的利多卡因凝胶对接受胃肠道上镜检查的患者的GAG反射作用
- 口咽运动和中风后阻塞性睡眠呼吸暂停
- 幽门螺杆菌幽门螺杆菌消除了不同的二氮四核治疗疗法
- 对青少年和成年人中的lanadelumab的研究,以防止与正常C1抑制剂(C1-INH)对非高 - 抗敏力血管性水肿的急性攻击
- TY-9591在晚期非小细胞肺癌(NSCLC)患者EGFR阳性突变患者中的研究