获取国外Infumorph(注射)药品价格,使用等信息,最快 24 小时回馈
Infumorph(注射)
Infumorph(注射)
摩芬
神经轴给药的风险:单剂量神经轴给药可能导致长达24小时的急性或延迟呼吸抑制。由于通过硬膜外或鞘内施用途径施用硫酸吗啡(Duramorph?)时有发生严重不良反应的风险,因此必须在设备齐全且配备人员的环境中观察患者的初始剂量后至少24小时。由于通过硬膜外或鞘内给药途径给予硫酸吗啡(Infumorph(R))有发生严重不良反应的风险,因此在初次(单次)注射后至少24小时内必须在设备齐全且配备人员的环境中对患者进行观察测试剂量,以及在导管植入后的头几天(视情况而定)。危及生命的呼吸抑制:使用硫酸吗啡可能会导致严重,危及生命或致命的呼吸抑制。监测呼吸抑制,尤其是在开始服用吗啡硫酸盐期间或增加剂量后。由于静脉注射药物(30分钟)延迟最大的中枢神经系统作用,快速静脉注射可能导致用药过量。每次测试剂量的Infumorph(R)后,必须在设备齐全且配备人员的环境中观察患者至少24小时,并按照指示在手术后的头几天观察患者。成瘾,滥用和误用:硫酸吗啡会使患者暴露于其他使用者可能会遭受阿片类药物上瘾,滥用和滥用的风险,这可能会导致服用过量和死亡。服用硫酸吗啡之前应评估每位患者的风险,并定期监测所有患者的这些行为和状况的发展。新生儿阿片类药物戒断综合症:怀孕期间长时间使用硫酸吗啡可导致新生儿阿片类药物戒断综合症,这可能危及生命。如果未得到认可和治疗,则需要根据新生儿科专家制定的协议进行管理。如果孕妇长时间需要使用阿片类药物,请告知患者新生儿阿片类戒断综合症的风险,并确保可以采取适当的治疗方法。与苯二氮卓类或其他中枢神经系统抑制剂同时使用的风险:与阿片类药物同时使用苯二氮卓类或其他中枢神经系统(CNS)抑制剂,包括酒精,可能会导致严重的镇静,呼吸抑制,昏迷和死亡。将剂量和持续时间限制在所需的最低限度。跟踪患者的呼吸抑制和镇静症状和体征。
常用品牌名称
在美国
- 黄芪PF
- 杜拉吗
- 薰衣草
可用的剂型:
- 解
治疗类别:止痛药
化学类别:阿片类药物
用于Infumorph
吗啡注射液用于缓解中度至重度疼痛。它也可以在麻醉前(使您入睡的药物)在手术前或手术中使用。吗啡属于一种叫做麻醉止痛药(止痛药)的药物。它作用于中枢神经系统(CNS)以减轻疼痛。
长时间使用麻醉药可能会形成习惯,导致精神或身体上的依赖性。但是,持续疼痛的人不应让对依赖的恐惧阻止他们使用麻醉剂缓解疼痛。当麻醉品用于此目的时,不太可能发生精神依赖(成瘾)。如果突然停止治疗,身体依赖性可能会导致戒断副作用。但是,通常可以通过在完全停止治疗之前的一段时间内逐渐减少剂量来预防严重的戒断副作用。
这种药物只能在医生的处方下使用。
使用Infumorph之前
在决定使用药物时,必须权衡服用药物的风险和所能带来的好处。这是您和您的医生会做出的决定。对于这种药物,应考虑以下几点:
过敏症
告诉您的医生您是否曾经对此药物或任何其他药物有任何异常或过敏反应。如果您还有其他类型的过敏症,例如食物,染料,防腐剂或动物,也请告知您的医疗保健专业人员。对于非处方产品,请仔细阅读标签或包装成分。
小儿科
迄今为止进行的适当研究尚未显示出儿科特异性问题,该问题会限制吗啡注射液对1个月及以上儿童的有效性。尚未确定1个月以下婴儿的安全性和有效性。不建议儿童向后注射吗啡。
老年医学
迄今为止进行的适当研究尚未显示出老年人特异性问题,这些问题会限制吗啡注射剂在老年人中的有效性。但是,老年患者更容易出现与年龄有关的肾脏,肝脏或肺部疾病,这可能需要谨慎,并应调整吗啡注射剂患者的剂量。
哺乳
妇女没有足够的研究来确定在母乳喂养期间使用这种药物的婴儿风险。在母乳喂养期间服用这种药物之前,要权衡潜在收益与潜在风险。
与药物的相互作用
尽管某些药物根本不能同时使用,但在其他情况下,即使可能发生相互作用,也可以同时使用两种不同的药物。在这些情况下,您的医生可能希望更改剂量,或者可能需要其他预防措施。当您服用这种药物时,让您的医疗保健专业人员知道您是否在服用以下列出的任何药物尤为重要。已根据其潜在重要性选择了以下相互作用,并且不一定是包罗万象的。
不建议将本药与以下任何药物一起使用。您的医生可能决定不使用这种药物治疗您,或更改您服用的其他一些药物。
- 纳美芬
- 纳曲酮
- 沙非酰胺
通常不建议将此药物与以下任何一种药物一起使用,但在某些情况下可能需要使用。如果两种药物一起开处方,您的医生可能会更改剂量或使用一种或两种药物的频率。
- 乙酰丙嗪
- 阿芬太尼
- 阿莫曲坦
- 阿普唑仑
- Alvimopan
- 氨if啶
- 氨基肽
- 胺碘酮
- 氨磺必利
- 阿米替林
- 阿米替林
- 阿莫巴比妥
- 阿莫沙平
- 安非他命
- 茴香胺
- 阿立哌唑
- 阿塞那平
- 阿奇霉素
- 巴氯芬
- 苯哌啶醇
- 苯氢可酮
- 苯丙胺
- 溴西epa
- 溴溴化物
- 溴苯那敏
- 丁丙诺啡
- 丁螺环酮
- 丁巴比妥
- 布托啡诺
- 卡那比二醇
- 卡托普利
- 卡马西平
- 羧胺
- 卡立普洛多
- 苯丙嗪
- 卡维地洛
- 西替利嗪
- 氯水合物
- 氯氮卓
- 扑尔敏
- 氯丙嗪
- 氯唑酮
- 西咪替丁
- 西酞普兰
- 克拉霉素
- 氯巴赞
- 氯米帕明
- 氯硝西am
- 氯吡格雷
- 氯硝西ate
- 氯氮平
- 考比司他
- 可卡因
- 可待因
- 康尼伐坦
- 环苯扎林
- 环孢菌素
- 地西拉明
- 去氨加压素
- 去甲文拉法辛
- 右美托咪定
- 右苯丙胺
- 右美沙芬
- 地佐辛
- 地西p
- 地苯ze平
- 二氯苯甲酮
- 地非辛
- 二氢可待因
- 地尔硫卓
- 苯海拉明
- 二苯氧基化物
- 多拉司琼
- 多奈哌齐
- 多塞平
- 阿霉素
- 盐酸阿霉素脂质体
- 多西拉敏
- 决奈达隆
- 氟哌啶醇
- 度洛西汀
- 依曲曲坦
- 恩氟烷
- 红霉素
- 依他普仑
- 氯胺酮
- 依他唑仑
- 依佐匹克隆
- 乙草胺醇
- 乙丙嗪
- 乙吗啡
- 非洛地平
- 芬太尼
- 氟班色林
- 氟西汀
- 氟奋乃静
- 氟西epa
- 氟吡咯烷
- 氟伏沙明
- 异丙酚
- 夫拉曲坦
- 呋喃唑酮
- 加巴喷丁
- 加巴喷丁
- Granisetron
- 哈拉西epa
- 氟哌啶醇
- 氟烷
- 己烯比妥
- 氢可酮
- 氢吗啡酮
- 羟色氨酸
- 羟嗪
- 丙咪嗪
- 异烟肼
- 异卡波肼
- 异氟烷
- 伊曲康唑
- 依伐卡托
- 氯胺酮
- 酮贝米酮
- 酮康唑
- Lasmiditan
- 左旋米那普仑
- 左啡烷
- 利奈唑胺
- 葡糖胺
- 锂
- 罗非帕明
- 洛非替丁
- 罗匹那韦
- 劳拉西m
- 氯酪蛋白
- 洛沙平
- 美克利嗪
- Melitracen
- 甲哌隆
- 哌替啶
- 甲巴比妥
- 甲丙酸酯
- 美他嗪醇
- 美索达嗪
- 美他沙酮
- 美沙酮
- 甲基苯丙胺
- 甲地拉嗪
- 甲硫脲
- 甲氧基
- 甲基三嗪
- 亚甲蓝
- 甲基纳曲酮
- 甲氧氯普胺
- 咪达唑仑
- 米那普兰
- 米氮平
- 吗氯贝胺
- 莫林酮
- 莫西嗪
- 纳布啡
- 纳洛啡
- 纳洛酮
- 纳拉曲普坦
- 奈法唑酮
- 尼酰胺
- 尼可吗啡
- 尼洛替尼
- 硝西p
- 笑气
- 去甲替林
- 奥氮平
- 恩丹西酮
- 奥匹拉莫尔
- 鸦片
- 鸦片生物碱
- 奋乃静
- 奥沙西m
- 羟考酮
- 羟吗啡酮
- 帕洛诺司琼
- 罂粟属
- Paregoric
- 帕罗西汀
- 喷他佐辛
- 戊巴比妥
- 紫杉醇
- 百嗪
- 哌嗪嗪
- 奋乃静
- 苯乙嗪
- 苯巴比妥
- 吡im嗪
- 哌嗪
- 吡pot嗪
- 吡rit胺
- 普拉西p
- 普瑞巴林
- 普立米酮
- 丙卡巴嗪
- 氯丙嗪
- 丙嗪
- 异丙嗪
- 异丙酚
- 普鲁替林
- 奎西epa
- 槲皮素
- 喹硫平
- 奎尼丁
- 拉默尔通
- 雷诺嗪
- 雷沙吉兰
- 瑞芬太尼
- 瑞莫必利
- 利托那韦
- 利扎曲普坦
- 萨米多芬
- 东pol碱
- 司可巴比妥
- 司来吉兰
- 丝丁多
- 舍曲林
- 西布曲明
- 西美普韦
- 氧化钠
- 圣约翰草
- 舒芬太尼
- 舒必利
- 苏门曲普坦
- 舒尼替尼
- 舒维生
- 他喷他多
- 特拉普韦
- 替马西m
- 硫乙基哌嗪
- 硫喷妥钠
- 硫丙嗪
- 硫哒嗪
- 天肽
- 替卡格雷洛
- 替丁
- 替扎尼定
- 生育酚
- 氯化lon
- 托吡酯
- 曲马多
- 丙基环丙胺
- 三唑仑
- 三氟拉嗪
- 三氟哌啶醇
- 三氟丙嗪
- 曲美拉嗪
- 曲米帕明
- 色氨酸
- 文拉法辛
- 维拉帕米
- 维拉唑酮
- 伏氧西汀
- 扎来普隆
- 齐帕西酮
- 佐米曲普坦
- 唑吡坦
- 佐匹克隆
- 佐特品
将此药物与以下任何药物同时使用可能会增加某些副作用的风险,但同时使用这两种药物可能是您的最佳治疗方法。如果两种药物一起开处方,您的医生可能会更改剂量或使用一种或两种药物的频率。
- 艾司洛尔
- 利福平
- 生长抑素
- 育亨宾
与食物/烟草/酒精的相互作用
在进食食物或进食某些类型的食物时或前后,不应使用某些药物,因为可能会发生相互作用。在某些药物上使用烟酒也可能引起相互作用。已根据其潜在重要性选择了以下相互作用,并且不一定是包罗万象的。
通常不建议同时使用以下任何一种药物,但在某些情况下可能不可避免。如果一起使用,您的医生可能会更改剂量或使用这种药物的频率,或者为您提供有关使用食物,酒精或烟草的特别说明。
- 乙醇
其他医疗问题
其他医疗问题的存在可能会影响该药的使用。确保您告诉医生是否还有其他医疗问题,尤其是:
- 艾迪生氏病(肾上腺问题)或
- 酗酒或有或
- 哮喘,严重或
- 严重的呼吸问题(例如,缺氧)或
- 慢性阻塞性肺疾病(COPD)或
- 肺心病(严重的心脏病)或
- 药物依赖性,尤其是麻醉药品依赖性,或
- 前列腺肥大(BPH,前列腺肥大)或
- 胆囊疾病或胆结石或
- 头部受伤,有或有病史
- 心脏病或
- 甲状腺功能低下(甲状腺功能低下)或
- 低血容量(低血容量)或
- 脊柱后凸畸形(脊柱弯曲并伴有呼吸问题)或
- 尿液通过的问题或
- 呼吸抑制(呼吸非常缓慢)或
- 溃疡性结肠炎-谨慎使用。可能增加产生更严重副作用的风险。
- 脑肿瘤或
- 肺部疾病引起的心力衰竭或
- 心律问题(例如房扑,心动过速)—不适用于患有这些疾病的患者。
- 低血压(低血压)或
- 癫痫发作的历史-谨慎使用。可能会使这些情况恶化。
- 肾脏疾病或
- 肝病-谨慎使用。由于从体内清除药物的速度较慢,因此效果可能会增强。
正确使用Infumorph
本节提供有关正确使用许多含有吗啡的产品的信息。它可能不特定于Infumorph。请仔细阅读。
护士或其他受过训练的保健专业人员将在医院为您提供这种药物。这种药物可以通过皮下注射,肌肉注射或通过一根静脉内的针头给药。也可以通过针头或导管将其注入背部。
您的医生会给您一些剂量的这种药物,直到您的病情好转为止,然后将您切换为以相同方式起作用的口服药物。如果对此有任何疑问,请咨询您的医生。
使用Infumorph时的注意事项
您的医生或您或您的孩子在接受此药时检查进展情况非常重要。这将使您的医生查看该药是否正常工作,并决定是否应继续使用该药。
这种药物会增加酒精和其他中枢神经系统抑制剂的作用(可能使您昏昏欲睡或戒备不佳的药物)。中枢神经系统抑制剂的一些例子是抗组胺药或用于过敏或感冒的药物。镇静剂,镇静剂或安眠药;其他处方止痛药或麻醉药;癫痫或巴比妥类药物;肌肉松弛剂或麻醉剂,包括一些牙科麻醉剂。在您或您的孩子使用这种药物之前,请先咨询您的医生,然后再服用上述任何药物。
这种药可能会养成习惯。如果您或您的孩子觉得这种药物效果不好,请不要使用超出处方剂量的剂量。致电您的医生以获取指示。
长时间使用麻醉品会导致严重的便秘。为防止这种情况,您的医生可能会指导您或您的孩子服用泻药,喝大量液体或增加饮食中的纤维含量。一定要仔细按照指示进行,因为持续的便秘会导致更严重的问题。
当您或您的孩子从躺着或坐着的姿势突然起床时,可能会出现头晕,头晕或昏厥。慢慢起床可能有助于减轻此问题。另外,躺一会可能会减轻头晕或头晕。
这种药可能会使您头昏,昏昏欲睡,困惑或迷失方向。在开车,使用机器或做其他可能使人头昏眼花或不警惕的危险之前,请确保您知道对这种药物有何反应。
在进行任何类型的手术(包括牙科手术)或紧急治疗之前,请告知主管医生或牙医您或您的孩子正在使用这种药物。如果将某些药物与吗啡注射剂一起使用,可能会产生严重的不良后果。
如果您或您的孩子定期使用这种药物数周或更长时间,请勿在未咨询医生的情况下突然停止使用该药物。您的医生可能希望您在完全停止使用之前逐渐减少使用量。这可能有助于防止病情恶化,并减少出现戒断症状的可能性,例如腹部或胃痉挛,焦虑,发烧,恶心,流鼻涕,出汗,震颤或睡眠困难。
除非与您的医生讨论过,否则请勿服用其他药物。这包括处方药或非处方药(非处方药[OTC])以及草药或维生素补充剂。
Infumorph副作用
除了所需的作用外,药物还可能引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
如果出现以下任何副作用,请立即与您的医生或护士联系:
比较普遍;普遍上
- 呼吸困难或困扰
- 不规则,快速或缓慢或呼吸浅
- 嘴唇,指甲或皮肤苍白或发蓝
- 气促
- 呼吸很慢
发病率未知
- 模糊的视野
- 抽搐
- 排尿次数减少
- 尿量减少
- 排尿困难(运球)
- 从躺着或坐着的姿势突然起床时头晕,晕眩或头晕
- 排尿疼痛
- 出汗
- 异常疲倦或虚弱
如果出现以下任何过量现象,请立即寻求紧急帮助:
服用过量的症状
- 嘴唇或皮肤发蓝
- 头晕
- 晕倒
- 心律不齐
- 头昏眼花
- 低血压或脉搏
- 心跳缓慢
- 无意识
可能会发生一些通常不需要医疗的副作用。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
发病率未知
- 月经期缺席,遗漏或不规律
- 焦虑
- 混乱
- 对性交的兴趣减少
- 妄想
- 去个人化
- 排便困难(凳子)
- 错误或异常的幸福感
- 幻觉
- 头痛
- 无法勃起或勃起
- 皮肤瘙痒
- 性能力,欲望,动力或表现丧失
- 月经变化
- 恶心和呕吐
- 停止月经出血
未列出的其他副作用也可能在某些患者中发生。如果您发现任何其他影响,请咨询您的医疗保健专业人员。
打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
注意:本文档包含有关吗啡的副作用信息。此页面上列出的某些剂型可能不适用于品牌名称Infumorph。
对于消费者
适用于吗啡:口服胶囊缓释,口服胶囊缓释24小时,口服液,口服片剂,口服片剂缓释
其他剂型:
- 注射液
警告
口服途径(胶囊剂,延长释放;溶液;片剂;片剂,延长释放)
成瘾,滥用和滥用硫酸吗啡使使用者面临成瘾,滥用和滥用的风险,这可能导致用药过量和死亡。阿片类镇痛风险评估和缓解策略(REMS)为确保阿片类镇痛药的益处超过成瘾,滥用和滥用的风险,在开药前评估每个患者的风险并定期监测这些行为和状况。 (FDA)要求这些产品具有风险评估和缓解策略(REMS)。危及生命的呼吸抑制可能会导致严重,威胁生命或致命的呼吸抑制。密切监视,尤其是在开始或增加剂量后。指导患者整个吞咽硫酸吗啡以避免暴露于致命剂量的吗啡意外摄入意外摄入硫酸吗啡(尤其是儿童)会导致致命的吗啡过量新生儿阿片类药物戒断综合症怀孕期间长时间使用硫酸吗啡可导致新生儿阿片类戒断综合征,如果不加以识别和治疗,可能会危及生命。如果孕妇需要长时间使用阿片类药物,请告知患者新生儿阿片类戒断综合症的风险,并确保可以采取适当的治疗方法。与苯二氮卓类或其他中枢神经系统抑制剂同时使用的风险与阿片类与苯二氮卓类或其他中枢神经系统同时使用系统(CNS)抑制剂,包括酒精,可能会导致严重的镇静,呼吸抑制,昏迷和死亡。保留相应的处方,以供其他治疗选择不足的患者使用;将剂量和持续时间限制在所需的最低限度;并关注患者的呼吸抑制和镇静症状和体征。
需要立即就医的副作用
吗啡(Infumorph中包含的活性成分)及其所需的作用可能会引起一些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用吗啡时,如果出现以下任何副作用,请立即咨询医生:
不常见
- 模糊的视野
- 婴儿头部隆起的软斑
- 灼烧,爬行,发痒,麻木,刺,“针刺”或刺痛感
- 看到颜色的能力变化,尤其是蓝色或黄色
- 胸痛或不适
- 发冷
- 混乱
- 咳嗽
- 排尿减少
- 从躺着或坐着的姿势突然起床时头晕,晕眩或头晕
- 晕倒
- 快速,剧烈或不规则的心跳或脉搏
- 头痛
- 荨麻疹,瘙痒或皮疹
- 出汗增加
- 食欲不振
- 恶心
- 紧张
- 敲打耳朵
- 眼睑或眼睛,面部,嘴唇或舌头周围浮肿或肿胀
- 严重便秘
- 严重呕吐
- 腿,手臂,手或脚的晃动
- 心跳缓慢
- 肚子痛
- 出汗
- 呕吐
发病率未知
- 搅动
- 黑色,柏油样凳子
- 寒冷,湿滑的皮肤
- 皮肤变黑
- 腹泻
- 吞咽困难
- 温暖或热的感觉
- 发热
- 皮肤潮红或发红,尤其是在脸部和颈部
- 不规则,快速或缓慢或呼吸浅
- 头昏眼花
- 意识丧失
- 低血压或脉搏
- 精神抑郁
- 过度反应
- 排尿疼痛
- 嘴唇,指甲或皮肤苍白或发蓝
- 皮肤苍白
- 查明皮肤上的红色斑点
- 协调不良
- 敲打耳朵
- 眼睑或眼睛,面部,嘴唇或舌头周围浮肿或肿胀
- 躁动
- 晃动和不稳定的步行
- 发抖
- 说话或激动时无法控制
- 胸闷
- 抽搐
- 肌肉控制或协调不稳,发抖或其他问题
- 异常出血或瘀伤
- 异常疲倦或虚弱
- 心跳非常缓慢
如果服用吗啡时出现以下任何过量症状,请立即寻求紧急帮助:
服用过量的症状
- 瞳孔缩小,瞄准或小瞳孔(眼睛的黑色部分)
- 意识或反应能力下降
- 极度嗜睡
- 发热
- 血压升高
- 口渴
- 下背部或侧面疼痛
- 肌肉痉挛,痉挛,疼痛或僵硬
- 没有肌肉张力或运动
- 严重嗜睡
- 面部,手指或小腿肿胀
- 体重增加
不需要立即就医的副作用
吗啡可能会发生一些副作用,通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 抽筋
- 排便困难
- 睡意
- 错误或异常的幸福感
- 放松而平静的感觉
- 嗜睡或异常嗜睡
- 减肥
不常见
- 月经期缺席,遗漏或不规律
- 味道差,异常或不愉快(后味)
- 视力改变
- 口干
- 漂浮的感觉
- 光晕
- 胃灼热或消化不良
- 性能力,欲望,动力或表现丧失
- 肌肉僵硬或紧绷
- 夜盲症
- 灯光过高的外观
- 肌肉控制问题
- 胃部不适或心烦
- 睡眠困难
- 眼球运动不受控制
发病率未知
- 异常的梦想
- 步行和平衡变化
- 精液改变或出精问题
- 笨拙或不稳定
- 时间,地点或人的困惑
- 事实无法改变的错误信念
- 自我或周围环境不断运动的感觉
- 普遍感到不适或生病
- 持有无法通过事实改变的错误信念
- 缺乏洞察力和判断力
- 记忆或言语问题
- 看到,听到或感觉不到的东西
- 旋转感
- 难以识别物体
- 麻烦的思想和计划
- 行走困难
- 异常兴奋,紧张或躁动
对于医疗保健专业人员
适用于吗啡:复方散剂,注射液,可注射片剂,静脉内溶液,口服胶囊,口服胶囊缓释,口服浓缩液,口服液,口服液,口服片剂,口服片剂缓释,直肠栓剂,脊髓液
神经系统
很常见(10%或更多):嗜睡(28%)
常见(1%至10%):头晕,镇静,发烧,焦虑,精神错乱,震颤,发汗,嗜睡,感到温暖
罕见(0.1%至1%):药物突然戒断或快速减量后出现戒断症状,头痛,发冷,流感综合征,全身不适,戒断综合征,苍白,面部潮红,晕厥,注意力不集中,失眠,健忘,感觉异常,躁动,眩晕,脚步下降,共济失调,过敏,言语不清,幻觉,欣快感,冷漠,癫痫发作,肌阵挛
未报告频率:通过鞘管内导管持续输注阿片类药物的患者,包括肉芽肿在内的炎性肿块(其中一些引起了包括神经麻痹的浆液性神经系统损害) [参考]
中枢神经系统的副作用可能是抑郁或兴奋性的。兴奋性症状有时会被忽略为吗啡可能的副作用。阿片类拮抗剂纳洛酮可治疗严重的不良反应,例如呼吸抑制。
通过留置鞘内导管连续输注硫酸吗啡的患者应进行监测,以寻找新的神经系统症状或体征。进一步的评估或干预应基于个体患者的临床情况。
接受高剂量吗啡的患者可能会发生肌阵挛性痉挛,特别是在肾功能不全的情况下。还已经报道了高剂量的痛觉过敏。 [参考]
呼吸道
常见(1%至10%):呼吸抑制
罕见(0.1%至1%):打H,鼻炎,肺不张,哮喘,缺氧,声音改变,咳嗽反射减弱,非心源性肺水肿,支气管痉挛[参考]
胃肠道
吗啡可能会导致胆总管收缩和Oddi括约肌痉挛,从而增加胆道内压力并恶化而不是缓解胆绞痛。
此外,吗啡(Infumorph中所含的活性成分)可能会导致剧烈但不协调的十二指肠收缩并减少胃排空。 [参考]
常见(1%至10%):口干,便秘,恶心,腹泻,厌食,腹痛,呕吐
罕见(0.1%至1%):吞咽困难,消化不良,胃无力症,胃食管反流,胃排空延迟,胆绞痛,胃食管反流增加,肠梗阻[Ref]
心血管的
常见(1%至10%):胸痛
罕见(0.1%至1%):心动过速,房颤,高血压,低血压,心pit,心动过缓,血管舒张[参考]
精神科
罕见(0.1%至1%):思维异常,梦境异常,沮丧,恐惧,躁动,妄想症,精神病,警惕,幻觉,del妄
频率未报告:突然停止治疗后出现戒断症状[参考]
泌尿生殖
当硬膜外或鞘内注射吗啡(Infumorph所含的活性成分)时,急性尿retention留的风险非常高。在这种情况下,临床医生应注意增加尿道感染的风险,尤其是在需要使用尿路的情况下。 [参考]
罕见(0.1%至1%):尿液异常,尿retention留,尿路犹豫[Ref]
血液学
常见(1%至10%):贫血,白细胞减少
罕见(0.1%至1%):血小板减少症[参考]
内分泌
罕见(0.1%至1%):低钠血症是由于ADH分泌不当,男性乳房发育,闭经,性欲降低,效能降低,劳动时间延长[参考]
肌肉骨骼
常见(1%至10%):虚弱,意外伤害
罕见(0.1%至1%):背痛,骨痛,关节痛
频率未报道:阿片类药物引起的慢性高剂量非自愿性肌肉过度活动[参考]
皮肤科
普通(1%至10%):皮疹
罕见(0.1%至1%):褥疮,瘙痒,皮肤潮红[Ref]
眼科
罕见(0.1%至1%):弱视,结膜炎,瞳孔缩小,视力模糊,眼球震颤,复视[参考]
过敏症
非常罕见(少于0.01%):过敏反应,过敏反应[参考]
肝的
罕见(0.1%至1%):肝酶升高[参考]
新陈代谢
常见(1%至10%):周围水肿
罕见(0.1%至1%):低钠血症
参考文献
1. Littrell RA,Kennedy LD,WE伯明翰,WD泄漏“鞘内吗啡治疗相关的肌肉痉挛:咪达唑仑治疗”。临床药物11(1992):57-9
2. Covington EC,Gonsalves-Ebrahim L,Currie KO等人,“肾功能衰竭患者自控镇痛导致的严重呼吸抑制”。心理疗法30(1989):226-8
3. Morley JS,Watt JWG,Wells JC,Miles JB,Finnegan MJ,Leng G“美沙酮在吗啡无法控制的痛苦中”。柳叶刀342(1993):1243
4. Bellville JW,Forrest WH,Elashoff J,Laska E“在合作临床研究中评估镇痛药的副作用”。临床药理学杂志9(1968):303-13
5. Sylvester RK,Levitt R,Steen PD“阿片类药物引起的肌肉活动:对控制慢性疼痛的意义”。 Ann Pharmacother 29(1995):1118-21
6. Westerling D,Frigren L,Hoglund P“在健康志愿者中,吗啡的药代动力学及其对唾液分泌和持续反应时间的影响”。 Ther Drug Monit 15(1993):364-74
7. Sjogren P,Dragsted L,Christensen CB“在肾衰竭中用大剂量静脉吗啡治疗期间的肌强直性痉挛”。麻醉麻醉学报(1993):780-2
8. Patt RB,Wu C,Bressi J,卡塔尼亚JA“再次发生了脊柱内意外用药过量”。 Anesth Analg 76(1993):202
9.蚀刻RC“与患者自控镇痛相关的呼吸抑制-八例回顾。” Can J Anaesth 41(1994):125-32
10. Sjogren P,Jonsson T,Jensen NH,Drenck NE,Jensen TS“连续静脉吗啡治疗的晚期癌症患者的痛觉过敏和肌阵挛”。疼痛55(1993):93-7
11. Ogawa K,Iranami H,Yoshiyama T,Maeda H,Hatano Y是“强直性营养不良患者中硬膜外吗啡后的严重呼吸抑制”。 Can J Anaesth 40(1993):968-70
12. Houghton IT,Aun CST,Wong YC,Chan K,Lau JTF,Oh TE“吗啡的呼吸抑制作用-在三个种族中的比较研究。”麻醉49(1994):197-201
13. Bigler D,Eriksen J和Christensen CB“缓慢释放的吗啡引起的长时间呼吸抑制”。柳叶刀06/30/84(1984):1477
14. Kwan A“患者控制的镇痛泵产生的吗啡过量”。 Anaesth重症监护24(1996):254-6
15. Chambers FA,Mccarroll M,Macsullivan R,“多发性痛和闭经作为鞘内注射吗啡和双月桂酸的并发症,用于治疗慢性良性背痛。” Br J Anaesth 72(1994):734
16. Morley AD“老年患者中吗啡患者自控镇痛导致严重的呼吸抑制。”麻醉重症监护24(1996):287
17.“产品信息。Roxanol(吗啡)。”俄亥俄州哥伦布市Roxane LaboratoriesInc。
18. Thorn SE,Wattwil M,Kallander A“硬膜外吗啡和硬膜外布比卡因对禁食期和进食后胃十二指肠蠕动的影响。”麻醉麻醉学报(38)(1994):57-62
19. Zsigmond EK,Vieira ZEG,Duarte B,Renigers SA,Hirota K“用吗啡使胆总管收缩的双盲安慰剂对照超声检查证实”。 Int J临床Pharmacol Ther Toxicol 31(1993):506-9
20. White MJ,Berghausen EJ,Dumont SW等,“硬膜外连续注入吗啡和芬太尼时的副作用”。 Can J Anaesth 39(1992):576-82
21. Lang DW,Pilon RN,“纳洛酮逆转吗啡诱导的胆绞痛”。 Anesth Analg 59(1980):619-20
22. Semenkovich CF,Jaffe AS,“硫酸吗啡引起的不良反应:对以前的临床学说的挑战。”美国医学杂志79(1985):325-30
23. Christie JM,Meade WR,Markowsky S“鞘内注射吗啡后的类狂妄症”。 Anesth Analg 77(1993):1298-9
24. D'Souza M“对吗啡的异常反应。”柳叶刀07/11/87(1987):98
25. Petersen TK,Husted SE,Rybro L等,“ IM和硬膜外吗啡镇痛期间的尿retention留”。 Br J Anaesth 54(1982):1175-8
26. Petros JG,Mallen JK,Howe K,Rimm EB,Robillard RJ“开放式阑尾切除术后的患者自控镇痛和术后尿retention留”。 Surg Gynecol Obstet 177(1993):172-5
27. Cimo PL,Hammond JJ,Moake JL,《吗啡诱导的免疫性血小板减少症》。大院实习医生142(1982):832-4
28. Paice JA,Penn RD“与脊髓内吗啡相关的闭经”。 J疼痛症状管理10(1995):582-3
29. Kardaun SH,de Monchy JG,“由吗啡引起的急性全身性皮疹性脓疱病,通过阳性斑贴试验和淋巴细胞转化试验得到证实。” J Am Acad Dermatol 55(2增刊)(2006):S21-3
30. Galea M“脊髓麻醉后吗啡引起的瘙痒”。 Br J Anaesth 97(2006):426
31. Goldstein JH,“药物对角膜,结膜和眼睑的影响”。国际眼科临床杂志11(1971):13-34
32. Knaggs RD,Crighton IM,Cobby TF,Fletcher AJ,Hobbs GJ“志愿者体内静脉吗啡,可待因和曲马多的瞳孔效应”。 Anesth Analg 99(2004):108-12
33. Hasselstrom J,Eriksson S,Persson A,Rane A,Svensson JO,Sawe J“吗啡在严重肝硬化患者中的代谢和生物利用度”。 Br J Clin Pharmacol 29(1990):289-97
34. Olsen GD,Bennett WM,Porter GA“在肾功能衰竭和肝功能衰竭中,吗啡和苯妥英与血浆蛋白的结合”。临床药理学杂志17(1975):677-84
某些副作用可能没有报道。您可以将其报告给FDA。
硬膜外给药剂量
对于不耐受阿片类药物的患者,建议的初始硬膜外剂量为3.5至7.5 mg /天。根据对阿片耐受程度有一定限制的患者的有限数据,连续硬膜外输注的通常起始剂量为4.5至10 mg /天。在治疗期间剂量需求可能会显着增加,经常增加到20-30 mg /天。每个患者的每日上限必须个性化。
鞘内给药剂量
不耐受阿片类药物的患者建议的初始腰椎鞘内剂量范围为0.2至1 mg /天。对于具有一定程度的阿片类药物耐受性的个体,已公开的剂量范围从1到10毫克/天不等。每个患者的每日剂量上限必须个性化。
- 鞘内剂量通常是硬膜外剂量的1/10。
滴定和维持治疗
分别将INFUMORPH滴定至可提供足够镇痛作用并最大程度减少不良反应的剂量。不断重新评估接受INFUMORPH治疗的患者,以评估疼痛控制的维持情况和不良反应的相对发生率,并监测成瘾,滥用或滥用的发生[参见警告和注意事项(5.3)] 。在改变止痛要求(包括初始滴定)期间,处方者,医疗团队的其他成员,患者以及护理人员/家庭之间的频繁交流非常重要。
如果剂量稳定后疼痛程度增加,请尝试在增加INFUMORPH剂量之前确定疼痛加剧的根源。鞘内连续注入吗啡的有限经验表明,日剂量必须随时间增加。尽管维持镇痛所需的剂量随时间的增加速率变化很大,但下图显示了预期的增加速率的估算值。
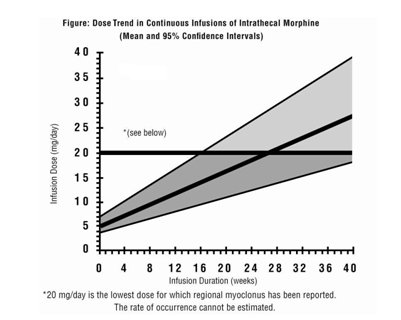
超过20毫克/天的剂量应谨慎使用,因为它们可能会带来更大的严重副作用[见警告和注意事项(5.2,5.7)和不良反应(6)] 。
如果观察到与阿片类药物有关的不良反应,请考虑减少剂量。调整剂量以在疼痛和阿片类药物相关的不良反应之间取得适当的平衡。
终止INFUMORPH
当定期服用INFUMORPH且可能身体依赖或不再需要INFUMORPH治疗的患者时,请逐渐减少剂量,同时仔细监测停药的体征和症状。如果患者出现这些症状或体征,可通过增加减小之间的间隔,减小剂量的变化量或两者,将剂量提高到先前的水平并逐渐减量。请勿在身体依赖的患者中突然停止INFUMORPH [参见警告和注意事项(5.15),药物滥用和依赖性(9.3)] 。
神经轴给药的风险
由于通过硬膜外或鞘内给药途径给药Infumorph时有发生严重不良反应的风险,因此在初始(单次)测试剂量后(视情况而定),必须在设备齐全且配备人员的环境中观察患者至少24小时。导管植入后的头几天[请参阅警告和注意事项(5.1) ] 。
危及生命的呼吸抑制
使用Infumorph可能会导致严重的,威胁生命的或致命的呼吸抑制。监测呼吸抑制,尤其是在开始Infumorph期间或增加剂量后。每次测试剂量后,必须在设备齐全且配备人员的环境中观察患者至少24小时,并按照指示在手术后的头几天观察患者[参见警告和注意事项(5.2) ] 。
上瘾,滥用和滥用
Infumorph使患者和其他使用者面临阿片类药物成瘾,滥用和滥用的风险,这可能导致用药过量和死亡。在开具Infumorph处方之前,应评估每位患者的风险,并定期监测所有患者的这些行为和状况的发展[请参阅警告和注意事项(5.3) ] 。
新生儿阿片类药物戒断综合征
怀孕期间长期使用Infumorph会导致新生儿阿片类戒断综合征,如果不加以识别和治疗,可能会危及生命,并需要根据新生儿科专家制定的方案进行管理。如果孕妇需要长时间使用阿片类药物,则应告知患者新生儿阿片类药物戒断综合征的风险,并确保可获得适当的治疗[见警告和注意事项(5.4) ] 。
与苯二氮卓类或其他中枢神经系统抑制剂并用的风险
阿片类药物与苯二氮卓类或其他中枢神经系统(CNS)抑制剂(包括酒精)并用可能会导致严重的镇静,呼吸抑制,昏迷和死亡[见警告和注意事项(5.5) ,药物相互作用(7) ]
- 保留伴随用药Infumorph和苯二氮杂类或其他中枢神经系统抑制剂的处方,以供其他治疗选择不足的患者使用。
- 将剂量和持续时间限制在所需的最低限度。
- 跟踪患者的呼吸抑制和镇静症状和体征。
Infumorph的适应症和用法
Infumorph用于连续微输注设备,仅适用于鞘内或硬膜外输注,用于治疗严重的顽固性慢性疼痛,严重程度需要使用阿片类镇痛药,并且对于控制疼痛的微创手段不足。
使用限制
由于存在过量的风险,因此不适用于单剂量静脉内,肌内或皮下给药。
不适用于单剂量神经注射,因为Infumorph过于浓缩,无法精确递送用于此设置的较小剂量。
Infumorph剂量和给药
重要剂量和管理说明
Infumorph应由具有硬膜外或鞘内给药技术经验并熟悉与硬膜外或鞘内给药相关的患者管理问题的医师或在其指导下给药。
- 由于存在延迟呼吸抑制的风险,应在每次试药后至少24小时内,在设备齐全且配备人员的环境中对患者进行观察,并应按照指示在手术后的头几天观察患者。
- 由于硬膜外给药与鞘内给药相比,具有即时或晚期不良反应的可能性较小,因此应尽可能采用硬膜外途径。
- 出于安全原因,建议通过鞘内途径给药Infumorph 200和500(分别为10和25 mg / mL)仅限于腰椎区域。
- Infumorph 200和500(分别为10和25 mg / mL)不应用于单剂量神经轴注射,因为使用DURAMORPH的标准制剂(0.5和1 mg / mL)可以更可靠地给予较低剂量。
在连续微输注设备中对Infumorph进行神经轴给药的候选人应住院,以在评估对单剂量鞘内或硬膜外吗啡的反应期间提供足够的患者监测。手术后应持续住院几天,包括输液器,以进一步监测和调整每日剂量。该设施必须配备复苏设备,氧气,纳洛酮注射液和其他复苏药物。
每次补充或操作储药器后,均应进行一段适合临床情况的观察期。出院前,患者和护理人员应接受有关器械和插入部位的适当家庭护理,以及对过量使用神经吗啡的识别和实际治疗的指导。
熟悉连续微输注设备至关重要。所需量的吗啡应通过微量过滤器从安瓿瓶中取出。为了最大程度地减少玻璃或其他颗粒带来的风险,必须先将产品通过5 µ(或更小)的微过滤器过滤,然后再注入微输液设备。如果需要稀释,建议注射0.9%的氯化钠。
必须按照设备制造商提供的说明,由经过充分培训的合格人员来进行储液箱注水。在选择合适的补充频率时应格外小心,以防止储液器耗尽,否则将导致剧烈疼痛加剧,阿片类药物戒断症状发作和/或脑脊液回流到某些装置中。需要严格的无菌技术,以避免细菌污染和严重感染。在尝试重新填充储液器之前,必须格外小心,以确保将针头正确插入设备的填充口。将溶液注射到装置周围的组织中(或在装置具有多个端口的情况下),尝试将再填充剂量注射到直接注射端口中,将给患者带来大量的,临床上显着的过量剂量。
安全和处理说明:
Infumorph以密封的安培瓶形式提供。意外的皮肤接触应通过脱掉所有被污染的衣服并用水冲洗患处来进行处理。
打开琥珀色安瓿瓶之前,请检查肠胃外药品是否含有颗粒物质;从安瓿瓶中取出内容物后,请再次检查颜色。如果未打开的安瓿瓶中的溶液含有沉淀物,该沉淀物在摇动后不会消失,则不要使用。去除后,除非溶液为无色或浅黄色,否则请勿使用。
Infumorph仅用于一次性使用。避光,丢弃任何未使用的部分。请勿进行热消毒。
初始剂量
Infumorph的起始剂量必须根据院内对常规DURAMORPH(硫酸吗啡注射液)0.5 mg / mL或1 mg / mL的连续单剂量硬膜外或鞘内推注的反应进行院内评估,并密切观察涉及连续微输注设备的手术前的止痛效果和不良反应。
- 根据个体患者的治疗目标,在最短的时间内使用最低的有效剂量[请参阅警告和注意事项(5.3) ]。
- 考虑到患者的疼痛严重程度,患者反应,先前的止痛治疗经验以及成瘾,滥用和误用的危险因素,分别为每个患者启动给药方案[请参阅警告和注意事项(5.3) ] 。
- 密切监测患者的呼吸抑制,尤其是在开始治疗的最初24-72小时内,并随着Infumorph的增加剂量并相应地调整剂量[见警告和注意事项(5.2) ]。
硬膜外给药剂量
对于不耐受阿片类药物的患者,建议的初始硬膜外剂量为3.5至7.5 mg /天。根据对阿片耐受程度有一定限制的患者的有限数据,连续硬膜外输注的通常起始剂量为4.5至10 mg /天。在治疗期间剂量需求可能会显着增加,经常增加到20-30 mg /天。每个患者的每日上限必须个性化。
鞘内给药剂量
不耐受阿片类药物的患者建议的初始腰椎鞘内剂量范围为0.2至1 mg /天。对于具有一定程度的阿片类药物耐受性的个体,已公开的剂量范围从1到10毫克/天不等。每个患者的每日剂量上限必须个性化。
- 鞘内剂量通常是硬膜外剂量的1/10。
滴定和维持治疗
分别滴定Infumorph的剂量,以提供足够的镇痛作用并最大程度地减少不良反应。不断重新评估接受Infumorph的患者,以评估疼痛控制的维持情况和不良反应的相对发生率,以及监测成瘾,虐待或滥用的发展[参见警告和注意事项(5.3) ] 。在改变止痛要求(包括初始滴定)期间,处方者,医疗团队的其他成员,患者以及护理人员/家庭之间的频繁交流非常重要。
如果剂量稳定后疼痛程度增加,请尝试在增加Infumorph剂量之前确定增加疼痛的根源。鞘内连续注入吗啡的有限经验表明,日剂量必须随时间增加。尽管维持镇痛所需的剂量随时间的增加速率变化很大,但下图显示了预期的增加速率的估算值。

超过20毫克/天的剂量应谨慎使用,因为它们可能会带来更大的严重副作用[见警告和注意事项( 5.2、5.7)和不良反应(6) ] 。
如果观察到与阿片类药物有关的不良反应,请考虑减少剂量。调整剂量以在疼痛和阿片类药物相关的不良反应之间取得适当的平衡。
停止Infumorph
当定期服用Infumorph且可能在身体上依赖或不再需要Infumorph进行治疗的患者时,请逐渐减少剂量,同时仔细监测戒断的症状和体征。如果患者出现这些症状或体征,可通过增加减小之间的间隔,减小剂量的变化量或两者,将剂量提高到先前的水平并逐渐减量。请勿在身体依赖的患者中突然停止Infumorph的使用[请参阅警告和注意事项(5.15) ,药物滥用和依赖性(9.3) ] 。
剂型和优势
注射剂:每20毫升200毫克(10毫克/毫升)无防腐剂的琥珀色玻璃安瓿瓶
注射剂:每20毫升500毫克(25毫克/毫升)无防腐剂的琥珀色玻璃安瓿瓶
禁忌症
下列患者禁用Infumorph:
- 严重的呼吸抑制[请参阅警告和注意事项(5.2) ]
- 在不受监视的环境中或没有复苏设备的情况下进行的急性或重度支气管哮喘[请参阅警告和注意事项(5.8) ]
- 在过去14天内同时使用单胺氧化酶抑制剂(MAOI)或使用MAOI [请参阅警告和注意事项(5.9) /药物相互作用(7) ]
- 已知或怀疑的胃肠道梗阻,包括麻痹性肠梗阻[请参阅警告和注意事项(5.13) ]
- 对吗啡过敏(例如过敏反应) [请参阅不良反应(6) ]
患有以下情况的患者禁用神经支配Infumorph:
- 注射微量输注部位的感染[请参阅警告和注意事项(5.1) ]
- 伴随抗凝治疗[请参阅警告和注意事项(5.1) ]
- 不受控制的出血素质[请参阅警告和注意事项(5.1) ]
- 存在任何其他伴随疗法或医学状况,会导致硬膜外或鞘内给药特别危险。
5警告和注意事项
神经轴给药的风险
使用连续的微输注设备通过神经鸦片输送来控制疼痛总是伴随着对患者的相当大的风险,并且需要高水平的技能才能成功完成。治疗这些患者的任务必须由经验丰富的临床团队承担,他们精通患者选择,不断发展的技术和新兴的护理标准。
Infumorph应由具有硬膜外或鞘内给药技术经验并熟悉与硬膜外或鞘内给药相关的患者管理问题的医师或在其指导下给药。医师应熟悉患者的状况(例如注射部位的感染,血液透析,抗凝治疗等),这需要对获益与潜在风险进行特殊评估。
由于采用硬膜外或鞘内给药途径存在严重不良反应的风险,因此,在初次给药后至少24小时内,必须在设备齐全且配备人员的环境中对患者进行观察。
该设施必须配备有能够使严重阿片类药物过量的患者复苏的设备,并且人员必须熟悉这种情况下特定麻醉剂拮抗剂(纳洛酮,纳曲酮)的使用和局限性。
出于安全原因,建议通过鞘内途径给药Infumorph 200和500(分别为10和25 mg / mL)仅限于腰椎区域。
危及生命的呼吸抑制
据报告,即使使用阿片类药物,严重,威胁生命或致命的呼吸抑制也是如此。如果不立即识别和治疗呼吸抑制,可能会导致呼吸停止和死亡。呼吸抑制的管理可能包括密切观察,支持措施以及使用阿片类药物拮抗剂,具体取决于患者的临床状况[参见剂量过量(10) ] 。阿片类药物引起的呼吸抑制导致的二氧化碳(CO 2 )滞留会加剧阿片类药物的镇静作用。
尽管在使用Infumorph的任何时候都可能发生严重的,危及生命的或致命的呼吸抑制,但在治疗开始或剂量增加后风险最大。这种呼吸抑制和/或呼吸停止可能很严重,可能需要干预。
- 由于存在严重不良反应的风险,必须在设备齐全且人员配备齐全的环境中观察患者,在初始(单次)测试剂量后至少24小时,并视情况在导管植入后的头几天观察患者。该设施必须配备有足够的设备来使严重阿片类药物过量的患者复苏,并且人员必须熟悉这种情况下特定麻醉剂拮抗剂(纳洛酮,纳曲酮)的使用和局限性
- 据报道硬膜外或鞘内给药后长达24小时出现严重的呼吸抑制。
- 与硬膜外使用相比,鞘内使用与呼吸抑制的发生率更高。
- 接受硬膜外或鞘内注射吗啡的患者的肠胃外给药麻醉可能会导致药物过量。
为了降低呼吸抑制的风险,Infumorph的正确剂量和滴定是必不可少的[参见剂量和用法(2) ] 。从另一类阿片类药物治疗患者时,高估Infumorph剂量可能导致第一剂致命过量。
Infumorph 200或500(分别为10或25 mg / mL)的常规硬脂磷(0.5或1 mg / mL)的不当或错误替代很可能导致严重的过量服用,导致精神分裂症,呼吸抑制和死亡。
阿片类药物可引起与睡眠有关的呼吸系统疾病,包括中枢性睡眠呼吸暂停(CSA)和与睡眠有关的低氧血症。阿片类药物的使用以剂量依赖性方式增加了CSA的风险。对于患有CSA的患者,请考虑使用最佳方法来减少阿片类药物的剂量,以减少阿片类药物的使用量[参见剂量和用法(2.6) ] 。
上瘾,滥用和滥用
Infumorph含有吗啡(附表II受控物质)。作为阿片类药物,Infumorph使使用者面临上瘾,滥用和误用的风险[请参阅药物滥用和依赖性(9) ] 。
尽管任何人上瘾的风险尚不明确,但可能会在适当处方Infumorph的患者中发生。如果滥用或滥用药物,则可能以推荐剂量上瘾。
在开处方Infumorph之前,应评估每个患者的阿片类药物成瘾,滥用或滥用的风险,并监测所有接受Infumorph的患者的这些行为和状况的发展。具有个人或家庭药物滥用史(包括吸毒或酗酒或成瘾)或精神疾病(例如严重抑郁症)的患者的风险增加。但是,这些潜在风险不应妨碍任何给定患者的疼痛适当管理。可能会给风险增加的患者开具阿片类药物,例如Infumorph,但在此类患者中使用时,必须对Infumorph的风险和正确使用进行深入的咨询,并密切监视成瘾,滥用和滥用的迹象。
阿片类药物是吸毒者和成瘾性疾病患者所寻求的,并且会被转用于刑事犯罪。处方或分配Infumorph时请考虑这些风险。减少这些风险的策略包括以最小的适当数量开处方。请与当地的州专业许可委员会或州控制的物质管理局联系,以获取有关如何预防和检测此产品的滥用或转移的信息。
每个安非他酮都含有大量的强效麻醉剂,这些麻醉剂与医疗保健提供者之间的滥用和依赖性有关。由于该产品的适应症有限,有服用过量的风险以及其转移和滥用的风险,因此建议在医院或诊所内采取特殊措施来控制该产品。 Infumorph应该严格核算,严格控制浪费并限制使用。
新生儿阿片类药物戒断综合征
怀孕期间长期使用Infumorph可能导致新生儿停药。与成人类鸦片戒断综合征不同,新生儿类鸦片戒断综合征如果不得到认可和治疗,可能会危及生命,并且需要根据新生儿科专家制定的方案进行管理。观察新生儿的新生儿阿片戒断综合征的征兆,并据此进行处理。建议孕妇长时间使用阿片类药物有新生儿阿片戒断综合症的风险,并确保可获得适当的治疗[见在特殊人群中使用(8.1) ,患者咨询信息(17) ] 。
与苯二氮卓类或其他中枢神经系统抑制剂同时使用的风险
因富吗啡与苯并二氮杂卓或其他中枢神经系统抑制剂并用(例如,非苯二氮卓类镇静剂/催眠药,抗焦虑药,镇定剂,肌肉松弛剂,全身麻醉剂,抗精神病药,其他阿片类药物,酒精)可能会导致深度镇静,呼吸抑制,昏迷和死亡。 )。由于存在这些风险,因此这些药物应同时开具处方,以供其他治疗选择不足的患者使用。
将抗精神病药与神经吗啡联合使用可能会增加呼吸抑制的风险。
观察性研究表明,与单独使用阿片类镇痛药相比,同时使用阿片类镇痛药和苯二氮卓类药物会增加与药物相关的死亡风险。由于具有相似的药理特性,可以合理预期与其他使用阿片类镇痛药的中枢神经系统抑制药同时使用的风险相似[见药物相互作用(7) ] 。
如果决定与阿片类镇痛药同时开具苯二氮杂或其他中枢神经系统抑制剂,则开出最低有效剂量和最短持续使用时间。在已经接受阿片类镇痛药的患者中,开处方的苯二氮卓类或其他中枢神经系统抑制剂的起始剂量要比不存在阿片类药物时要低,并根据临床反应进行滴定。如果已经服用苯二氮卓类药物或其他中枢神经系统抑制剂的患者开始使用阿片类镇痛剂,则应开始降低阿片类镇痛剂的初始剂量,并根据临床反应进行滴定。密切关注患者的呼吸抑制和镇静症状和体征。
当将Infumorph与苯并二氮杂卓或其他中枢神经系统抑制剂(包括酒精和非法药物)一起使用时,建议患者和护理人员有关呼吸抑制和镇静的风险。建议患者不要驾驶或操作重型机械,直到确定同时使用苯二氮卓类药物或其他中枢神经系统抑制剂为止。筛查患者是否存在滥用药物的风险,包括阿片类药物滥用和滥用,并警告他们与使用其他中枢神经系统抑制剂(包括酒精和非法药物)有关的用药过量和死亡风险[请参阅药物相互作用(7) ,患者咨询信息( 17) ] 。
炎性肿块的风险
据报道,通过留置鞘内导管连续输注阿片类镇痛药(包括Infumorph)的患者中发生了炎性肿块,如肉芽肿,其中一些引起严重的神经系统损害,包括麻痹。通过留置鞘内导管连续输注Infumorph的患者应仔细监测是否有新的神经系统症状或体征。进一步的评估或干预应基于个体患者的临床情况。
耐受和肌阵挛活动的风险
患者有时会表现出神经轴吗啡需求量的异常加速,这可能引起对全身吸收和大剂量危害的担忧;这些患者可能会从住院和排毒中受益。据报道,每天接受鞘内吗啡剂量超过20 mg的患者有2例下肢肌阵挛样痉挛。排毒后,有可能以较低的剂量恢复治疗,并且一些患者已成功地从连续硬膜外吗啡变为连续鞘内吗啡。以后可能会指示重复排毒。在继续治疗期间,每个患者的每日剂量上限必须个性化。
慢性肺病患者或老年人,恶病质或虚弱患者的危及生命的呼吸抑制
禁忌在不受监测的情况下或在没有复苏设备的情况下,在急性或重度支气管哮喘患者中使用Infumorph。
慢性肺病患者:患有严重的慢性阻塞性肺疾病或肺心病的患者,以及呼吸储备,低氧血症,高碳酸血症或已存在的呼吸抑制显着降低的患者,即使在推荐的情况下,呼吸驱动力下降的风险也增加了剂量的Infumorph [请参阅警告和注意事项(5.2) ] 。
老人,恶病质,或体弱者:危及生命的呼吸抑制更可能发生在老年人,恶病质或虚弱的病人发生,因为他们可能已经改变的药代动力学或改变间隙相比,更年轻,更健康的患者[见警告和注意事项(5.2) ] 。
密切监视此类患者,特别是在开始和滴定Infumorph以及与其他抑制呼吸的药物同时给予Infumorph时[见警告和注意事项(5.2) ] 。或者,考虑在这些患者中使用非阿片类镇痛药。
与单胺氧化酶抑制剂的相互作用
单胺氧化酶抑制剂(MAOI)可能会增强吗啡的作用,包括呼吸抑制,昏迷和神志不清。服用吗啡的患者或在停止此类治疗的14天内,不应使用吗啡硫酸盐注射液[请参阅药物相互作用(7) ] 。
肾上腺功能不全
据报道,使用阿片类药物导致肾上腺皮质功能不全的病例,多于使用一个月以上。肾上腺功能不全的表现可能包括非特异性症状和体征,包括恶心,呕吐,厌食,疲劳,虚弱,头晕和低血压。如果怀疑肾上腺功能不全,请尽快通过诊断测试确认诊断。如果诊断出肾上腺功能不全,请使用生理替代剂量的皮质类固醇治疗。使患者断奶,以使肾上腺功能恢复,并继续皮质类固醇治疗直至肾上腺功能恢复。可以尝试使用其他阿片类药物,因为有些病例报道使用了其他阿片类药物,但没有肾上腺功能不全的复发。可用的信息不能确定任何特定的阿片类药物更可能与肾上腺功能不全有关。
严重低血压
Infumorph可能会导致非卧床患者严重低血压,包括体位性低血压和晕厥。降低血压或同时服用某些中枢神经系统抑制药(例如吩噻嗪或全身麻醉剂)已经损害了维持血压能力的患者的风险增加[见药物相互作用(7) ] 。在开始或滴定Infumorph剂量后,监测这些患者的低血压迹象。在患有循环休克的患者中,Infumorph可能会引起血管舒张,从而进一步降低心输出量和血压。循环休克患者应避免使用Infumorph。
颅内压增高,脑肿瘤,头部受伤或意识受损的患者使用的风险
在可能对CO 2保留的颅内作用敏感的患者(例如,那些有颅内压升高或脑肿瘤的证据的患者)中,Infumorph可能会降低呼吸驱动力,并且所产生的CO 2保留可以进一步增加颅内压。监视此类患者的镇静和呼吸抑制迹象,尤其是在开始使用Infumorph疗法时。在颅脑外伤或颅内压增高的患者中应谨慎使用Infumorph。吗啡引起的瞳孔变化(瞳孔缩小)可能掩盖了颅内病理的存在,程度和病程。高剂量的神经吗啡可产生肌阵挛性事件[见警告和注意事项(5.7) ] 。当评估接受这种治疗方式的患者精神状态改变或运动异常时,临床医生应高度怀疑药物不良反应。
阿片类药物也可能使头部受伤患者的临床病情变得模糊。避免在意识障碍或昏迷患者中使用Infumorph。
胃肠道疾病患者的使用风险
已知或怀疑胃肠道梗阻(包括麻痹性肠梗阻)的患者禁用Infumorph。
Infumorph中的吗啡可能引起Oddi括约肌痉挛。阿片类药物可能导致血清淀粉酶增加。监测包括急性胰腺炎在内的胆道疾病患者的症状是否恶化。由于神经吗啡将大量吗啡释放到全身循环中,随之而来的平滑肌高渗性可能导致胆绞痛。
癫痫病患者的癫痫发作风险增加
Infumorph中的吗啡可能会增加癫痫发作患者的癫痫发作频率,并可能增加在其他与癫痫发作相关的临床环境中发生癫痫发作的风险。监测有癫痫病史的患者在Infumorph治疗期间癫痫发作控制恶化。
退出
在接受全阿片类激动剂镇痛剂(包括Infumorph)的患者中,避免使用混合的激动剂/拮抗剂(例如喷他佐辛,纳布啡和布托啡诺)或部分激动剂(例如丁丙诺啡)。在这些患者中,混合的激动剂/拮抗剂和部分激动剂镇痛药可能会降低镇痛作用和/或使戒断症状加重。
停用Infumorph时,逐渐减少剂量[参见剂量和用法(2.6) ] 。不要突然中断Infumorph [请参阅药物滥用和依赖性(9.3) ] 。
驾驶和操作机械的风险
Infumorph可能会损害执行潜在危险活动(如驾驶汽车或操作机器)所需的精神或身体能力。警告患者不要驾驶或操作危险的机器,除非他们能够耐受Infumorph的影响并且知道他们将如何对药物做出反应[请参阅患者咨询信息(17) ] 。
泌尿系统疾病患者的使用风险
尿retention留可能在单次硬膜外或鞘内给药后持续10至20小时,通常与神经轴阿片类药物给药有关,必须预料到,男性患者比女性患者更频繁。尿液retention留也可能在住院的最初几天内发生,以启动连续鞘内或硬膜外吗啡治疗。提示及早发现排尿困难,并在尿retention留情况下及时干预。发生尿retention留的患者对胆碱模拟治疗和/或明智使用导管有反应。
非卧床患者的使用风险
应监测循环血容量减少,心肌功能受损或使用了交感药物的患者是否存在体位性低血压,这是单剂量神经吗啡镇痛的常见并发症。
不良反应
在其他部分中描述或更详细地描述了以下严重不良反应:
- 危及生命的呼吸抑制[请参阅警告和注意事项(5.2) ]
- 上瘾,滥用和滥用[请参阅警告和注意事项(5.3) ]
- 新生儿阿片类药物戒断综合征[请参阅警告和注意事项(5.4) ]
- 与CNS苯二氮卓类或其他抑制剂的相互作用[请参阅警告和注意事项(5.5) ]
- 炎性肿块[请参阅警告和注意事项(5.6) ]
- 肌阵挛活动[请参阅警告和注意事项(5.7) ]
- 肾上腺功能不全[请参阅警告和注意事项(5.10) ]
- 严重低血压[请参阅警告和注意事项(5.11) ]
- 胃肠道不良反应[请参阅警告和注意事项(5.13) ]
- 癫痫发作[请参阅警告和注意事项(5.14) ]
- 提款[请参阅警告和注意事项(5.15) ]
- 尿Re留[见警告和注意事项(5.17) ]
- 体位性低血压[请参阅警告和注意事项(5.18) ]
在临床研究或上市后报告中发现了与使用吗啡相关的以下不良反应。由于其中一些反应是自愿报告的,来自不确定的人群,因此,并非总是能够可靠地估计其发生频率或建立与药物暴露的因果关系。
连续鞘内或硬膜外注射Infumorph期间遇到的最严重不良反应是呼吸抑制,肌阵挛和炎性肿块的形成。
心血管系统:虽然小剂量静脉内注射吗啡对心血管稳定性几乎没有影响,但大剂量是兴奋性的,这是由于交感神经过度活跃和循环儿茶酚胺增加所致。兴奋中枢神经系统,导致惊厥,可能伴随着静脉注射高剂量的吗啡。
中枢神经系统:肌阵挛,癫痫发作,烦躁不安反应,中毒性精神病,头晕,欣快,焦虑,意识模糊,头痛。在鞘内导管植入后的几天中,少数情况下会遇到腰穿式头痛,并且通常会对卧床休息和/或其他常规疗法产生反应。
胃肠系统:恶心,呕吐,便秘
皮肤:瘙痒,荨麻疹,风疹和/或局部组织刺激。
生殖泌尿系统:输液装置植入手术后,男性患者的尿retention留,少尿,原因不明的生殖器肿胀。
其他:吗啡治疗后报道的其他不良经历包括咳嗽反射减弱,干扰热调节,周围水肿。
5-羟色胺综合症:在与阿片类药物同时使用5-羟色胺能药物的过程中,已经报告了5-羟色胺综合症的病例,这可能危及生命。
肾上腺皮质功能不全:有报告称使用阿片类药物会导致肾上腺皮质功能不全,使用时间超过一个月以上。
过敏反应:据报道,Infumorph中含有过敏反应。
雄激素缺乏症:长期使用阿片类药物已引起雄激素缺乏症[见临床药理学(12.2) ] 。
药物相互作用
表1包括与Infumorph具有临床意义的药物相互作用。
表1.与Infumorph具有临床意义的药物相互作用
| 苯二氮卓类和其他中枢神经系统抑制剂 | |
| 临床影响: | 由于具有附加的药理作用,苯并二氮杂卓或其他中枢神经系统抑制剂(包括酒精)的并用可能增加低血压,呼吸抑制,镇静,昏迷和死亡的风险。其他中枢神经系统抑制剂的存在会增强吗啡的抑制作用。将抗精神病药与神经吗啡联合使用可能会增加呼吸抑制的风险。 |
| 介入: | 保留这些药物的处方,以供其他治疗选择不足的患者使用。将剂量和持续时间限制在所需的最低限度。密切注意患者的呼吸抑制和镇静症状[见警告和注意事项(5.5) ] 。 |
| 例子: | 酒精,苯二氮卓类和其他镇静剂/催眠药,抗焦虑药,镇静剂,肌肉松弛剂,全身麻醉剂,抗精神病药,精神药物,抗组胺药,抗精神病药,其他阿片类药物,酒精。 |
| 血清素药物 | |
| 临床影响: | 阿片类药物与其他影响5-羟色胺能神经递质系统的药物并用会导致血清素综合征。 |
| 介入: | 如果需要同时使用,请仔细观察患者,尤其是在治疗开始和剂量调整期间。如果怀疑血清素综合症,则停用Infumorph。 |
| 例子: | 选择性5-羟色胺再摄取抑制剂(SSRIs),5-羟色胺和去甲肾上腺素再摄取抑制剂(SNRIs),三环抗抑郁药(TCA),曲坦类,5-HT3受体拮抗剂,影响5-羟色胺神经递质系统的药物(例如,米氮平,曲唑酮,曲马多),某些肌肉松散剂(即环苯扎林,美他沙酮),单胺氧化酶(MAO)抑制剂(旨在治疗精神疾病的抑制剂以及其他药物,如利奈唑胺和静脉注射亚甲蓝)。 |
| 单胺氧化酶抑制剂(MAOIs) | |
| 临床影响: | MAOI与阿片类药物的相互作用可能表现为5-羟色胺综合征或阿片类药物毒性(例如,呼吸抑制,昏迷) [见警告和注意事项(5.9) ]。 |
| 介入: | 服用MAOI的患者或停止此类治疗的14天内,请勿使用Infumorph。 |
| 例子: | 苯乙肼,环丙亚胺,利奈唑胺 |
| 混合激动剂/拮抗剂和部分激动剂阿片类镇痛药 | |
| 临床影响: | 可能会降低Infumorph的镇痛作用和/或引起戒断症状。 |
| 介入: | 避免同时使用。 |
| 例子: | 布托啡诺,纳布啡,喷他佐辛,丁丙诺啡。 |
| 肌肉松弛剂 | |
| 临床影响: | 吗啡可以增强骨骼肌松弛剂的神经肌肉阻滞作用,并增加呼吸抑制的程度。 |
| 介入: | 监测患者的呼吸抑制症状,其可能比预期的要大,并在必要时减少Infumorph和/或肌肉松弛剂的剂量。 |
| 利尿剂 | |
| 临床影响: | 阿片类药物可通过诱导抗利尿激素的释放而降低利尿剂的功效。 |
| 干预措施: | 监测患者的利尿迹象和/或对血压的影响,并根据需要增加利尿剂的剂量。 |
| 抗胆碱药 | |
| 临床影响: | 伴随使用抗胆碱能药物可能会增加尿retention留和/或严重便秘的风险,这可能导致麻痹性肠梗阻。 |
| 介入: | 当将Infumorph与抗胆碱能药物同时使用时,监测患者的尿retention留或胃动力降低的迹象。 |
| 口服P2Y 12抑制剂 | |
| 临床影响: | 口服P2Y 12抑制剂和静脉硫酸吗啡的共同给药可以减少口服P2Y 12抑制剂的吸收,峰浓度和延迟的抗血小板作用的发作。 |
| 介入: | 考虑在需要合并静脉注射吗啡硫酸盐的急性冠脉综合征中使用肠胃外抗血小板药。 |
| 例子: | 氯吡格雷,普拉格雷,替卡格雷 |
在特定人群中的使用
怀孕
风险摘要
怀孕期间长时间使用阿片类镇痛药会引起新生儿阿片类戒断综合征[见警告和注意事项(5.4) ]。目前尚无孕妇体内使用Infumorph的数据可告知与药物相关的重大先天缺陷和流产风险。怀孕期间使用吗啡的已发表研究尚未报道与吗啡和主要的先天缺陷有明确的关联[请参见《人类数据》。在已发表的动物生殖研究中,在妊娠早期皮下注射吗啡会导致仓鼠和小鼠的神经管缺陷(即脑啡和颅裂症),其剂量为人体每日60 mg的5和16倍(基于体表面积(HDD)),分别是兔的胎儿体重降低和HDD的0.4倍时流产发生率增加,大鼠的HDD的6倍时发育迟缓,小鼠的HDD的16倍时轴向骨骼融合和隐睾症。在器官形成过程中和通过哺乳期给怀孕的大鼠服用硫酸吗啡会导致发osis,体温过低,脑重量下降,幼仔死亡率降低,幼仔体重降低以及对生殖组织的不良影响,其作用是硬盘驱动器的3-4倍;以及后代大脑中长期的神经化学变化,这与行为反应的改变有关,这种行为反应在成年期持续存在,与HDD相当,但小于HDD [参见Animal Data ]。根据动物数据,告知孕妇胎儿的潜在危险。
对于指定人群,估计的主要先天缺陷和流产的背景风险尚不清楚。所有怀孕都有出生缺陷,流产或其他不良后果的背景风险。在美国普通人群中,临床公认的怀孕中主要先天缺陷和流产的估计背景风险分别为2-4%和15-20%。
临床注意事项
胎儿/新生儿不良反应
怀孕期间出于医学或非医学目的长期使用阿片类镇痛药可能会导致出生后不久新生儿和新生儿阿片类戒断综合征对身体产生依赖性。
新生儿阿片类药物戒断综合征表现为烦躁,活动过度和异常的睡眠方式,高声哭闹,震颤,呕吐,腹泻和体重增加。新生儿阿片类药物戒断综合征的发作,持续时间和严重程度根据使用的特定阿片类药物,使用时间,最后一次母体使用的时间和数量以及新生儿对药物的清除率而有所不同。 Observe newborns for symptoms of neonatal opioid withdrawal syndrome and manage accordingly [see Warnings and Precautions (5.4) ] .
人工或分娩
Infumorph 200 and 500 (10 and 25 mg/mL, respectively) are too highly concentrated for routine use in obstetric neuraxial analgesia. Opioids, including intravenously, epidurally, and intrathecally administered morphine, readily cross the placenta and may produce respiratory depression and psycho-physiologic effects in neonates. An opioid antagonist, such as naloxone, and resuscitative equipment must be available for reversal of opioid-induced respiratory depression in the neonate. Infumorph is not recommended for use in pregnant women during or immediately prior to labor, when other analgesic techniques are more appropriate. Opioid analgesics, including Infumorph, can prolong labor through actions which temporarily reduce the strength, duration, and frequency of uterine contractions.但是,这种效果并不一致,可能会因宫颈扩张速度的增加而抵消,这往往会缩短产程。监视分娩期间接触阿片类镇痛药的新生儿是否有过度镇静和呼吸抑制的迹象。
数据
人数据
The results from a population-based prospective cohort, including 70 women exposed to morphine during the first trimester of pregnancy and 448 women exposed to morphine at any time during pregnancy, indicate no increased risk for congenital malformations. However, these studies cannot definitely establish the absence of any risk because of methodological limitations, including small sample size and non-randomized study design.
动物资料
Formal reproductive and developmental toxicology studies for morphine have not been conducted. Exposure margins for the following published study reports are based on human daily dose of 60 mg morphine using a body surface area comparison (HDD).
Neural tube defects (exencephaly and cranioschisis) were noted following subcutaneous administration of morphine sulfate (35-322 mg/kg) on Gestation Day 8 to pregnant hamsters (4.7 to 43.5 times the HDD). A no adverse effect level was not defined in this study and the findings cannot be clearly attributed to maternal toxicity. Neural tube defects (exencephaly), axial skeletal fusions, and cryptorchidism were reported following a single subcutaneous (SC) injection of morphine sulfate to pregnant mice (100-500 mg/kg) on Gestation Day 8 or 9 at 200 mg/kg or greater (16 times the HDD) and fetal resorption at 400 mg/kg or higher (32 times the HDD). No adverse effects were noted following 100 mg/kg morphine in this model (8 times the HDD). In one study, following continuous subcutaneous infusion of doses greater than or equal to 2.72 mg/kg to mice (0.2 times the HDD), exencephaly, hydronephrosis, intestinal hemorrhage, split supraoccipital, malformed sternebrae, and malformed xiphoid were noted. The effects were reduced with increasing daily dose; possibly due to rapid induction of tolerance under these infusion conditions. The clinical significance of this report is not clear.
Decreased fetal weights were observed in pregnant rats treated with 20 mg/kg/day morphine sulfate (3.2 times the HDD) from Gestation Day 7 to 9. There was no evidence of malformations despite maternal toxicity (10% mortality). In a second rat study, decreased fetal weight and increased incidences of growth retardation were noted at 35 mg/kg/day (5.7 times the HDD) and there was a reduced number of fetuses at 70 mg/kg/day (11.4 times the HDD) when pregnant rats were treated with 10, 35, or 70 mg/kg/day morphine sulfate via continuous infusion from Gestation Day 5 to 20. There was no evidence of fetal malformations or maternal toxicity.
An increased incidence of abortion was noted in a study in which pregnant rabbits were treated with 2.5 (0.8 times the HDD) to 10 mg/kg morphine sulfate via subcutaneous injection from Gestation Day 6 to 10. In a second study, decreased fetal body weights were reported following treatment of pregnant rabbits with increasing doses of morphine (10-50 mg/kg/day) during the pre-mating period and 50 mg/kg/day (16 times the HDD) throughout the gestation period. No overt malformations were reported in either publication; although only limited endpoints were evaluated.
In published studies in rats, exposure to morphine during gestation and/or lactation periods is associated with: decreased pup viability at 12.5 mg/kg/day or greater (2 times the HDD); decreased pup body weights at 15 mg/kg/day or greater (2.4 times the HDD); decreased litter size, decreased absolute brain and cerebellar weights, cyanosis, and hypothermia at 20 mg/kg/day (3.2 times the HDD); alteration of behavioral responses (play, social-interaction) at 1 mg/kg/day or greater (0.2 times the HDD); alteration of maternal behaviors (eg, decreased nursing and pup retrievals) in mice at 1 mg/kg or higher (0.08 times the HDD) and rats at 1.5 mg/kg/day or higher (0.2 times the HDD); and a host of behavioral abnormalities in the offspring of rats, including altered responsiveness to opioids at 4 mg/kg/day (0.7 times the HDD) or greater.
Fetal and/or postnatal exposure to morphine in mice and rats has been shown to result in morphological changes in fetal and neonatal brain and neuronal cell loss, alteration of a number of neurotransmitter and neuromodulator systems, including opioid and non-opioid systems, and impairment in various learning and memory tests that appear to persist into adulthood. These studies were conducted with morphine treatment usually in the range of 4 to 20 mg/kg/day (0.7 to 3.2 times the HDD).
Additionally, delayed sexual maturation and decreased sexual behaviors in female offspring at 20 mg/kg/day (3.2 times the HDD), and decreased plasma and testicular levels of luteinizing hormone and testosterone, decreased testes weights, seminiferous tubule shrinkage, germinal cell aplasia, and decreased spermatogenesis in male offspring were also observed at 20 mg/kg/day (3.2 times the HDD). Decreased litter size and viability were observed in the offspring of male rats that were intraperitoneally administered morphine sulfate for 1 day prior to mating at 25 mg/kg/day (4.1 times the HDD) and mated to untreated females. Decreased viability and body weight and/or movement deficits in both first and second generation offspring were reported when male mice were treated for 5 days with escalating doses of 120 to 240 mg/kg/day morphine sulfate (9.7 to 19.5 times the HDD) or when female mice treated with escalating doses of 60 to 240 mg/kg/day (4.9 to 19.5 times the HDD) followed by a 5-day treatment-free recovery period prior to mating. Similar multigenerational findings were also seen in female rats pre-gestationally treated with escalating doses of 10 to 22 mg/kg/day morphine (1.6 to 3.6 times the HDD).
哺乳期
风险摘要
Morphine is present in breast milk. Published lactation studies report variable concentrations of morphine in breast milk with administration of immediate-release morphine to nursing mothers in the early postpartum period with a milk-to-plasma morphine AUC ratio of 2.5:1 measured in one lactation study. However, there is insufficient information to determine the effects of morphine on the breastfed infant and the effects of morphine on milk production. Lactation studies have not been conducted with Infumorph, and no information is available on the effects of the drug on the breastfed infant or the effects of the drug on milk production.
The developmental and health benefits of breastfeeding should be considered along with the mother's clinical need for Infumorph and any potential adverse effects on the breastfed infant from Infumorph or from the underlying maternal condition.
临床注意事项
Monitor infants exposed to Infumorph through breast milk for excess sedation and respiratory depression. Withdrawal symptoms can occur in breastfed infants when maternal administration of morphine is stopped, or when breastfeeding is stopped.
生殖潜力的男性和女性
不孕症
长期使用阿片类药物可能导致生殖能力的男性和女性生育力下降。 It is not known whether these effects on fertility are reversible [see Adverse Reactions (6) , Clinical Pharmacology (12.2) ] .
In published animal studies, morphine administration adversely effected fertility and reproductive endpoints in male rats and prolonged estrus cycle in female rats [see Nonclinical Toxicology (13) ].
儿科用
Adequate studies to establish the safety and effectiveness of spinal morphine in pediatric patients have not been performed, and usage in this population is not recommended.
老人用
Elderly patients (aged 65 years or older) may have increased sensitivity to Infumorph.通常,在为老年患者选择剂量时要谨慎,通常从给药范围的低端开始,这反映出肝,肾或心脏功能下降以及伴随疾病或其他药物治疗的频率更高。
呼吸抑制是使用阿片类药物治疗的老年患者的主要风险,这种情况发生在不耐受阿片类药物的患者接受大剂量的初始剂量或与其他抑制呼吸的药物联合使用时。 Titrate the dosage of Infumorph slowly in geriatric patients and monitor closely for signs of central nervous system and respiratory depression [see Warnings and Precautions (5.8) ] .
The pharmacodynamic effects of neuraxial morphine in the elderly are more variable than in the younger population. Patients w
已知共有414种药物与Infumorph(吗啡)相互作用。
- 117种主要药物相互作用
- 289种中等程度的药物相互作用
- 8种次要药物相互作用
检查互动
最常检查的互动
查看有关Infumorph(吗啡)和以下所列药物的相互作用报告。
- 别嘌醇
- 阿司匹林
- 布比卡因
- 安非他酮
- 香豆素(华法林)
- 迪拉迪(氢吗啡酮)
- 多奈哌齐
- 内分泌(对乙酰氨基酚/羟考酮)
- 加巴喷丁
- 肝素
- Humira(阿达木单抗)
- 氢吗啡酮
- Linzess(利那洛肽)
- 甲氨蝶呤
- 美托洛尔
- Norco(对乙酰氨基酚/氢可酮)
- 奥昔布宁
- 普伐他汀
- 异丙嗪
- 罗匹尼罗
Infumorph(吗啡)酒精/食物相互作用
酒精/食物与Infumorph(吗啡)有1种相互作用
Infumorph(吗啡)疾病相互作用
与Infumorph(吗啡)有17种疾病相互作用,包括:
- 胃肠动力受损
- 传染性腹泻
- 肝病
- 早熟
- 急性酒精中毒
- 药物依赖
- 胃肠道阻塞
- 低血压
- 颅内压
- 呼吸抑制
- 肾上腺功能不全
- 胆道痉挛
- 甲状腺功能减退
- 肾功能不全
- 癫痫发作
- 尿retention留
- 心律失常
药物相互作用分类
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 滥用的可能性很高
- 审批历史 FDA的药物史
- 世界反兴奋剂机构 反兴奋剂分类
美国日本医生

Heather Benjamin MD

Heather Benjamin MD

Heather Miske DO

Heather Miske DO

Bert Hepner DO

渡邊剛

宮崎総一郎 中部大学特聘教授

百村伸一 教授

村上和成 教授
