获取国外Natesto鼻凝胶药品价格,使用等信息,最快 24 小时回馈
Natesto鼻凝胶
Natesto鼻凝胶
在本页面
- 适应症和用法
- 剂量和给药
- 剂型和优势
- 禁忌症
- 警告和注意事项
- 不良反应/副作用
- 药物相互作用
- 在特定人群中使用
- 药物滥用和依赖性
- 过量
- 描述
- 临床药理学
- 非临床毒理学
- 临床研究
- 供应/存储和处理方式
- 病人咨询信息
1.适应症和用途
Natesto适用于成年男性因内源性睾丸激素缺乏或缺乏而引起的替代治疗。
- 原发性性腺功能低下(先天性或后天性):由于隐睾症,双侧扭转,睾丸炎,睾丸消失,睾丸切除术,克氏综合征,化学疗法或酒精或重金属引起的中毒导致的睾丸衰竭。这些男性通常血清睾丸激素水平低,促性腺激素(促卵泡激素[FSH],促黄体生成激素[LH])高于正常范围。
- 促性腺激素减低性腺功能减退症(先天性或后天性):促性腺激素或促黄体生成激素释放激素(LHRH)缺乏或由于肿瘤,创伤或放射引起的垂体-下丘脑损伤。这些人的睾丸激素血清浓度低,但促性腺激素水平正常或低。
使用限制:
- Natesto在患有“与年龄有关的性腺功能低下”(也称为“迟发性性腺功能低下”)的男性中的安全性和有效性尚未确定。
- 尚未确定Natesto在18岁以下男性中的安全性和有效性[请参阅在特定人群中使用( 8.4 )] 。
2.剂量和给药
启动Natesto之前,请确保至少在两天前的早晨测量了血清睾丸激素的浓度,并确保这些血清睾丸激素的浓度低于正常范围,以确认是否患有性腺功能低下症。
。加药
Natesto的推荐剂量是11毫克的睾丸激素(2次泵促动;每个鼻孔1次促动),每天鼻内给药3次,每日总剂量为33 mg。
开始使用Natesto治疗后一个月,应定期检查血清总睾丸激素浓度。当总睾丸激素浓度持续超过1050 ng / dL时,应停止使用Natesto的治疗。如果总睾丸激素浓度始终低于300 ng / dL,则应考虑替代治疗。
。管理说明
Natesto每天一次,每天一次,下午一次和晚上一次(间隔6至8小时),每天一次,鼻内给药3次,最好每天一次。应指导患者在每个鼻孔中完全按下泵1次以接受总剂量。不要将Natesto施用到身体的其他部位。
准备泵
初次使用Natesto时,应指导患者倒转泵,压下泵10次,并丢弃直接分配到水槽中的少量产品,然后用温水将凝胶彻底洗净,以启动泵。尖端应用干净的干纸巾擦拭。如果患者手上沾有Natesto凝胶,建议他们用温水和肥皂洗手。底漆应仅在首次使用每个分配器之前进行。
剂量管理
要给予剂量,应指导患者执行以下步骤:
- the鼻子
- 从分配器上取下盖子。
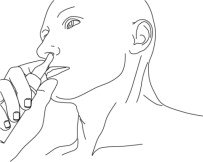
- 将右手食指放在执行器的泵上,并在镜子前面时,将执行器的尖端缓慢向上推入左鼻孔,直到其在泵上的手指到达鼻根。

- 倾斜执行器,使执行器尖端上的开口与鼻孔侧壁接触,以确保将凝胶涂在鼻壁上。

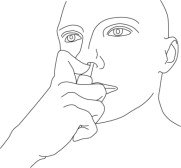
- 缓慢踩下泵直至停止。
- 从鼻孔中取出执行器,同时沿鼻孔侧壁的内部擦拭尖端,以完全转移凝胶。
- 使用左手食指,对右鼻孔重复第3至6项中概述的步骤。
- 用干净的干纸巾擦拭执行器的尖端。
- 盖上饮水机上的盖子。
- 在鼻梁下方的某个位置按一下鼻孔,然后轻轻按摩。
- 用药后1小时内请勿blowing鼻或闻鼻。
当分配器内部的活塞顶部到达内部标签顶部的箭头时,应更换分配器。可以通过从容器周围展开外盖来找到内部标签。

。与拟交感神经充血药不同的鼻用药物一起使用
Natesto和拟交感神经减充血剂以外的鼻腔给药药物之间的药物相互作用潜力尚不清楚。因此,除拟交感神经性减充血剂外,不建议将Natesto与经鼻给药的药物一起使用
(例如,羟甲唑啉) [请参阅药物相互作用( 7.4 )和临床药理学( 12.3 )] 。
。重症鼻炎暂时停用
如果患者经历了严重的鼻炎发作,请暂时停止Natesto治疗,直到严重的鼻炎症状消失。如果严重的鼻炎症状持续存在,建议使用替代性睾丸激素替代疗法。
3.剂量形式和强度
Natesto是一种鼻内使用的淡黄色凝胶,可在带有计量泵的分配器中使用。一泵致动可输送5.5 mg睾丸激素。
4.禁忌症
Natesto在患有乳腺癌或已知或疑似前列腺癌的男性中是禁忌的[见警告和注意事项( 5.3 )]。
Natesto在怀孕或可能怀孕或哺乳的妇女中禁用。 Natesto对孕妇使用可能会造成胎儿伤害。 Natesto可能会对哺乳婴儿造成严重的不良反应。胎儿或哺乳期婴儿接触雄激素可能导致不同程度的病毒化。如果孕妇接触Natesto,则应被告知她对胎儿的潜在危害[见警告和注意事项( 5.8 )和在特定人群中的使用( 8.1,8.3 )]。
5.警告和注意事项
鼻部不良反应和有关鼻部安全的长期信息有限
Natesto的临床试验经验报告了鼻部不良反应,包括鼻咽炎,鼻漏,鼻出血,鼻部不适和鼻sc伤。除1例(单例上呼吸道感染)外,所有鼻部不良反应均被报告为轻度或中度。然而,在少数受试者中可获得有关鼻安全性的长期临床试验数据[见不良反应( 6.2 )] 。应指导患者向其卫生保健专业人员报告任何鼻部症状或体征。在这种情况下,医疗保健专业人员应确定进一步的评估(例如耳鼻喉科咨询)或终止Natesto是否合适。
用于慢性鼻疾病和鼻解剖结构改变的患者
由于缺乏有关安全性或有效性的临床数据,因此不建议将Natesto用于以下患者:
- 鼻部疾病史;
- 鼻或鼻窦手术史;
- 过去6个月内有鼻骨折史或导致前鼻中隔偏斜的鼻骨折;
- 粘膜炎性疾病(例如,干燥综合征);和
- 鼻窦疾病。
良性前列腺增生症的恶化和前列腺癌的潜在风险
- 用雄激素治疗的BPH患者的BPH体征和症状恶化的风险增加。监测BPH患者的体征和症状是否恶化。
- 用雄激素治疗的患者患前列腺癌的风险可能更高。在开始治疗之前评估患者的前列腺癌。在开始治疗后3至6个月,然后根据前列腺癌筛查实践,对患者进行重新评估是适当的[参见禁忌症( 4 )]。
红细胞增多症
血细胞比容的增加反映了红细胞量的增加,可能需要停用Natesto。在开始睾丸激素治疗之前检查血细胞比容。开始睾丸激素治疗后3至6个月,应每年重新评估血细胞比容。如果血细胞比容升高,请停止治疗,直到血细胞比容降低至可接受的水平。红细胞数量增加可能会增加血栓栓塞事件的风险。
静脉血栓栓塞
在使用睾丸激素产品(例如Natesto)的患者中,有静脉血栓栓塞事件的上市后报道,包括深静脉血栓形成(DVT)和肺栓塞(PE)。评估报告下肢(DVT)有疼痛,浮肿,温暖和红斑症状的患者和PE表现为急性呼吸急促的患者。如果怀疑发生静脉血栓栓塞事件,请停止使用Natesto的治疗并开始适当的检查和处理[见不良反应( 6.2 )]。
心血管风险
尚未进行长期的临床安全性试验来评估男性睾丸激素替代疗法的心血管结局。迄今为止,流行病学研究和随机对照试验对于确定重大不良心血管事件(MACE)(如非致命性心肌梗塞,非致命性中风和心血管死亡)的风险尚无定论,与未使用睾丸激素相比, -采用。一些研究(并非全部)报告说,男性睾丸激素替代疗法的使用会增加MACE的风险。在决定是否使用或继续使用Natesto时应告知患者这种可能的风险。
滥用睾丸激素和监测血清睾丸激素浓度
睾丸激素已被滥用,通常以高于批准适应症推荐剂量并与其他合成代谢雄激素类固醇合用。合成代谢雄激素的类固醇滥用会导致严重的心血管和精神疾病不良反应[见药物滥用和依赖性(9)]。
如果怀疑睾丸激素滥用,请检查血清睾丸激素浓度以确保它们在治疗范围内。但是,滥用合成睾丸激素衍生物的男性的睾丸激素水平可能在正常或亚正常范围内。为患者提供有关滥用睾丸激素和合成代谢雄激素类固醇的严重不良反应的建议。相反,请考虑出现严重心血管或精神疾病不良事件的可疑患者中睾丸激素和合成代谢雄激素类固醇滥用的可能性。
在女性中使用
由于缺乏对女性的对照研究以及潜在的毒杀作用,Natesto并未指定用于女性。
对精子发生不利影响的潜力
如果使用大量内源性雄激素(包括Natesto),则可通过反馈抑制垂体卵泡刺激素(FSH)来抑制精子发生,这可能对精液参数(包括精子数量)产生不利影响。
肝不良反应
长期使用高剂量的口服活性17-α-烷基雄激素(甲基睾丸激素)与严重的肝脏不良反应(小儿肝炎,肝肿瘤,胆汁淤积性肝炎和黄疸)有关。腹泻性肝炎可能是威胁生命或致命的并发症。肌内睾丸酮庚酸酯的长期治疗已产生多种肝腺瘤。尚不清楚Natesto会导致这些不利影响。尽管如此,仍应指导患者报告肝功能不全的任何体征或症状(例如黄疸)。如果发生这种情况,请在评估原因时立即中止Natesto。
浮肿
包括Natesto在内的雄激素可能会促进钠和水的滞留。患有或未患有充血性心力衰竭的水肿可能是患有心脏病,肾病或肝病的患者的严重并发症。除了停药,还可能需要利尿剂治疗。
男性乳房发育
接受性腺功能减退症的包括Natesto在内的雄激素治疗的患者可能会发展成男性乳房发育症并可能持续存在[见不良反应(6.1)]。
睡眠呼吸暂停
对性腺功能低下的男性进行睾丸激素治疗可能会增强某些患者的睡眠呼吸暂停,特别是那些具有肥胖和慢性肺病等危险因素的患者。
血脂
血清脂质谱可能发生变化。定期监测脂质状况,尤其是在开始睾丸激素治疗后。血清脂质分布的变化可能需要停止睾丸激素治疗。
高钙血症
在有高钙血症(及相关高钙尿症)风险的癌症患者中,应谨慎使用包括Natesto在内的雄激素。建议这些患者定期监测血清钙浓度。
甲状腺素结合球蛋白减少
包括Natesto在内的雄激素可能会降低甲状腺素结合球蛋白的浓度,从而导致总T4血清浓度降低以及树脂对T3和T4的吸收增加。游离甲状腺激素浓度保持不变;但是,没有甲状腺功能异常的临床证据。
6.不良反应
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率与在另一种药物的临床试验中观察到的不良反应率直接进行比较,并且可能无法反映实际中观察到的不良反应率。
Natesto在一项多中心,开放标签,为期90天的临床研究中进行了评估。患者可以在两个开放标签的延长期内分别继续使用Natesto进行治疗,分别延长90天和180天。总共306名性腺功能减退的男性早晨睾丸激素浓度≤300 ng / dL。其中有78例接受Natesto的治疗,剂量为11毫克,每天3次。
90天临床研究
在为期90天的临床研究中,每天3次接受Natesto治疗的78名患者中,最常见的不良反应是:前列腺特异性抗原(PSA)增加,头痛,鼻漏,鼻epi,鼻腔不适,鼻咽炎,上呼吸道感染(URI) ),鼻窦炎,支气管炎和鼻sc。通过满足两个预先指定的标准之一可以认为PSA升高是一种不良反应:(1)从基线血清PSA升高至大于1.4 ug / L,或(2)血清PSA大于4.0 ug / L。
表1显示了在90天的临床研究中,≥3%的患者每天3次每天接受11 mg治疗后报告的不良反应。
| 不良反应 | 内斯托 (11睾甾酮)每日三倍 (N = 78) n(%) |
| PSA增加 | 4(5.1) |
| 头痛 | 3(3.8) |
| 鼻漏 | 3(3.8) |
| 鼻出血 | 3(3.8) |
| 鼻部不适 | 3(3.8) |
| 鼻咽炎 | 3(3.8) |
| 支气管炎 | 3(3.8) |
| 上呼吸道感染 | 3(3.8) |
| 鼻窦炎 | 3(3.8) |
| 鼻sc | 3(3.8) |
在为期90天的临床研究中,报告为> 2%但<3%的患者出现不良反应,包括:血压升高,消化不良,鼻干燥,鼻充血和咳嗽。
延长期
在90天的临床研究中,每天接受3次Nateto的78位患者中,在第一个90天的延长期内,每天接受3次Nateto的患者总计69位。
在这69例患者中,最常见的不良反应是:鼻咽炎,PSA升高,妄想症,鼻部不适,鼻漏和鼻sc。
表2显示了在90天的临床研究和90天的延长期内,每天接受3次Natesto治疗的患者中,≥3%的患者报告了不良反应。
| 不良反应 | Natesto 11毫克TID (N = 69) n(%) |
| 鼻咽炎 | 6(8.7) |
| 鼻漏 | 5(7.2) |
| PSA增加 | 4(5.8) |
| 妄想症 | 4(5.8) |
| 鼻部不适 | 4(5.8) |
| 鼻Sc | 4(5.8) |
| 上呼吸道感染 | 3(4.3) |
| 支气管炎 | 3(4.3) |
| 程序性疼痛 | 3(4.3) |
| 四肢疼痛 | 3(4.3) |
| 头痛 | 3(4.3) |
| 鼻出血 | 3(4.3) |
在这三个治疗期间(包括90天临床研究,第一个90天延长期和第二个180天延长期)中,共有18位患者每天接受Natesto 3次治疗。在这18例患者中,每一个以上的患者都有以下不良反应:鼻咽炎,妄想症,PSA升高,鼻腔不适,鼻sc和高血压。每个患者中报告了以下不良反应:恶心,鼻部剥脱,甲状腺刺激激素增加,食欲下降,肌痛,嗅觉失调,睾丸萎缩,鼻出血,鼻中隔失调,鼻腔不适和鼻漏。
每天接受Natesto 3次的患者在90、180和360天后平均血清PSA浓度分别增加0.2 ng / mL,0.1 ng / mL和0.2 ng / mL。
因不良反应停产
在90天临床研究及其90天和180天延长期中以任何剂量接受Natesto的所有受试者(n = 306)中,共有6名受试者因以下不良反应退出治疗,其中1名受试者报告每例:鼻部不适,头痛,消化不良,PSA增加,过敏反应(荨麻疹,嘴唇和舌头肿胀)以及1例肌痛,关节痛,发烧,发冷和瘀斑的患者。
血细胞比容增加
在90天临床研究及其90天和180天延长期中接受任何剂量Natesto的所有受试者(n = 306)中,共有4名受试者的血细胞比容水平> 55%。这4例患者的基线血细胞比容分别为48%和51%。在任何情况下,血细胞比容均未超过58%。
鼻不良反应
在90天临床研究及其90天和180天延长期中以任何剂量接受Natesto的所有受试者(n = 306)中,报告了以下鼻部不良反应:鼻咽炎(8.2%),鼻漏(7.8%) ),鼻epi(6.5%),鼻部不适(5.9%),妄想症(5.2%),鼻sc(5.2%),上呼吸道感染(4.2%),鼻干燥(4.2%)和鼻充血(3.9%) 。
上市后经验
在批准使用睾丸激素的过程中发现了以下不良反应。由于这些反应是从不确定大小的人群中自愿报告的,因此并非总是能够可靠地估计其发生频率或建立与药物暴露的因果关系。
心血管疾病:心肌梗塞,中风[请参阅警告和注意事项(5.6)]
血管疾病:静脉血栓栓塞[请参阅警告和注意事项( 5.5 )]
7.药物相互作用
胰岛素
雄激素治疗的患者可能会发生胰岛素敏感性或血糖控制的变化。在糖尿病患者中,雄激素的代谢作用可能会降低血糖,因此可能需要减少抗糖尿病药物的剂量。
口服抗凝剂
雄激素可能会引起抗凝活性的变化,因此建议对服用华法令的患者进行国际标准化剂量(INR)和凝血酶原时间的更频繁监测,尤其是在雄激素治疗的开始和终止时。
皮质类固醇
睾丸激素与皮质类固醇同时使用可能会导致体液retention留增加,尤其是在患有心脏,肾脏或肝脏疾病的患者中,需要进行监测。
羟甲唑啉
与未治疗时相比,在Natesto之前30分钟接受羟甲唑啉治疗的有症状的季节性鼻炎的男性中,平均睾丸激素的平均AUC(0-24)下降2.6%,总睾丸平均C max的下降3.6%。与Natesto并用时,羟甲唑啉不影响睾丸激素的吸收[见临床药理学( 12.3 )] 。尚未研究与羟甲唑啉以外的其他经鼻给药药物的相互作用潜力。
8.在特定人口中的使用
。怀孕
怀孕类别X-Natesto在怀孕期间或可能怀孕的妇女中禁用。睾丸激素具有致畸性,可能引起胎儿伤害。胎儿暴露于雄激素可能导致不同程度的病毒化。如果在怀孕期间使用该药物,或者如果患者在服用该药物时怀孕,则应告知患者对胎儿的潜在危害。
。护理母亲
尽管尚不清楚有多少睾丸激素会转移到人乳中,但Natesto在哺乳妇女中是禁忌的,因为在哺乳婴儿中可能发生严重的不良反应。
。儿科用
Natesto的安全性和有效性尚未在18岁以下的儿科患者中确立。使用不当可能会导致骨龄加速和骨phy过早闭合。
。老人用
尚无足够的老年患者参与使用Nates进行对照临床研究,以确定65岁以上人群的疗效是否与年轻受试者不同。
在使用Natesto进行的3期临床试验的306位患者中,有60位年龄在65岁或以上,有9位年龄在75岁或以上。老年患者的长期安全性数据不足,无法评估心血管疾病和前列腺癌风险增加的可能性。
接受雄激素治疗的老年患者也可能有BPH体征和症状恶化的危险[见警告和注意事项( 5.3 )]。
。肾功能不全
肾功能不全患者未进行任何研究。
。肝功能不全
肝功能不全患者未进行任何研究。
。用于体重指数大于35 kg / m2的男性
尚未确定Natesto在体重指数大于35 kg / m 2的男性中的安全性和有效性。
。过敏性鼻炎
有症状的过敏性鼻炎的男性,无论用鼻充血药(例如羟甲唑啉)治疗还是不治疗,血清总睾丸激素浓度均降低了21%至24% [参见临床药理学( 12.3 )] 。
9.药物滥用与依赖
。受控物质
Natesto含有睾丸激素,这是《管制物质法》中的附表III管制物质。
。滥用
药物滥用是一种有意的,非治疗性的药物使用,即使是一次,也可以带来有益的心理和生理效果。在男性和女性成年人和青少年中都发现滥用和滥用睾丸激素。睾丸激素通常与其他合成代谢雄激素类固醇(AAS)结合使用,但并非通过药房通过处方获得,可能会被运动员和健美运动员滥用。有报告称,尽管有不良事件或违反医学建议,服用合法合法睾丸激素剂量高于处方剂量并继续服用睾丸激素的男性滥用药物。
与滥用相关的不良反应
据报道,滥用合成代谢雄激素的人存在严重不良反应,包括心脏骤停,心肌梗塞,肥厚型心肌病,充血性心力衰竭,脑血管意外,肝毒性和严重的精神病表现,包括严重的抑郁症,躁狂症,妄想症,精神病,妄想,幻觉,敌对和侵略。
男性也有以下不良反应:短暂性脑缺血发作,抽搐,轻躁狂,烦躁不安,血脂异常,睾丸萎缩,不育和不育。
妇女还报告了以下其他不良反应:多毛症,男性化,声音加深,阴蒂增大,乳房萎缩,男性型秃头和月经不调。
在男性和女性青少年中已报告了以下不良反应:骨骨epi过早闭合并终止生长,以及性早熟。
由于这些反应是从规模不确定的人群中自愿报告的,并且可能包括对其他药物的滥用,因此,始终无法可靠地估计其发生频率或建立与药物暴露的因果关系。
。依存关系
与成瘾有关的行为
持续滥用睾丸激素和其他合成代谢类固醇,导致成瘾的特征在于以下行为:
- 服用比处方更大的剂量
- 尽管由于吸毒引起医疗和社会问题,仍继续吸毒
- 药物供应中断时,要花费大量时间来获取药物
- 与其他义务相比,对毒品使用给予更高的优先考虑
- 尽管有意愿和尝试,但仍难以停药
- 突然停止使用会出现戒断症状
身体依赖性的特征在于突然停药或药物剂量明显减少后出现戒断症状。服用睾丸上剂量的人可能会出现持续数周或数月的戒断症状,包括情绪低落,重度抑郁,疲劳,渴望,躁动,烦躁,厌食,失眠,性欲减退和性腺功能低下。
使用批准剂量的睾丸激素作为批准适应症的个体中的药物依赖性尚未得到记录。
10.过量
临床试验中没有报道过使用Natesto的过量病例。有1篇关于通过注射庚酸睾丸酮引起的急性过量的报告:脑血管意外涉及高达11400 ng / dL的睾丸激素浓度。
过量用药的治疗应包括停用Natesto以及适当的症状和支持治疗。
11.说明
Natesto(睾丸激素)鼻凝胶是一种浅黄色凝胶,在经鼻给药的122.5 mg Natesto凝胶中包含5.5 mg睾丸激素。 Natesto中的活性药理成分是睾丸激素,一种雄激素。睾丸激素是白色至几乎白色的结晶性粉末,化学上称为17β-Hydroxyandrost-4-en-3-one。结构式为:

非活性成分是蓖麻油,油酰基聚氧化甘油酯和胶体二氧化硅。
12.临床药理学
。作用机理
内源性雄激素,包括睾丸激素和二氢睾丸激素(DHT),负责男性性器官的正常生长和发育以及维持第二性征。这些影响包括前列腺,精囊,阴茎和阴囊的生长和成熟。男性毛发分布的发育,例如面部,阴毛,胸部和腋毛;喉肿大,声带增粗,身体肌肉组织改变和脂肪分布。睾丸激素和DHT是继发性特征正常发育所必需的。
男性性腺功能低下是一种由于睾丸激素分泌不足而引起的临床综合征,主要有两个病因。原发性性腺功能低下是由性腺缺陷引起的,例如克氏综合征或莱迪格细胞发育不全,而继发性性腺功能低下是下丘脑(或垂体)不能产生足够的促性腺激素(FSH,LH)。
。药效学
未使用Natesto进行具体的药效学研究。
。药代动力学
吸收性
Natesto输送生理量的睾丸激素,产生的循环浓度接近健康男性正常的睾丸激素浓度(即300至1,050 ng / dL)。 Natesto的最大浓度在给药约40分钟内即可达到,半衰期为10至100分钟。
图1总结了在完成Natesto治疗90天的患者中,总睾丸激素的药代动力学特征,该患者每天服用33 mg睾丸激素(每天3次,每次11 mg)。
图1:每天三次以11 mg睾丸激素的Nate给药后第90天的平均血清总睾丸激素浓度(N = 69)

Natesto在第90天每天3次每天服用11 mg睾丸激素产生的平均每日睾丸激素浓度为421(±116)ng / dL。
分配
循环睾丸激素主要在血清中与性激素结合球蛋白(SHBG)和白蛋白结合。血浆中约40%的睾丸激素与SHBG结合,其余2%未被结合(游离),其余与白蛋白和其他蛋白质松弛结合。
代谢
睾丸激素通过2种不同的途径代谢为各种17-酮类固醇。睾丸激素的主要活性代谢物是雌二醇和二氢睾丸激素(DHT)。
Natesto治疗期间DHT浓度与睾丸激素浓度平行增加。治疗90天后,平均DHT /睾丸激素比为0.09,在正常范围内。
排泄
肌肉注射的睾丸激素约90%以葡萄糖醛酸和硫酸结合的睾丸激素及其代谢产物的形式从尿液中排出。约有6%的剂量从粪便中排泄,大部分形式是非结合形式。睾丸激素的失活主要发生在肝脏中。
药物相互作用
在变应性鼻炎和羟甲唑啉患者中的使用:在一项3交叉临床研究中,研究了变应性鼻炎的影响和羟甲唑啉对睾丸酮吸收的影响。 18名患有季节性过敏性鼻炎的男性经环境挑战试验室模型接受鼻内3剂11毫克睾丸激素治疗(睾丸激素剂量为33毫克/天),而这些患者处于无症状,有症状和有症状但已接受治疗(用羟甲唑啉)状态。
有症状的过敏性鼻炎的男性的血清总睾丸激素浓度降低了21%至24%。与未治疗时相比,在Natesto之前30分钟接受羟甲唑啉治疗的有症状的季节性鼻炎的男性中,平均睾丸激素的平均AUC(0-24)下降2.6%,总睾丸平均C max的下降3.6%。与Natesto并用时,羟甲唑啉不影响睾丸激素的吸收[见临床药理学( 12.3 )] 。与氧甲唑啉以外的鼻腔给药药物的相互作用潜力尚未进行研究。
13.非临床毒理学
。致癌,诱变和生育能力受损
致癌性
睾丸激素已经通过皮下注射和植入小鼠和大鼠中进行了测试。在小鼠中,植入物诱发子宫颈子宫肿瘤,在某些情况下转移。有迹象表明,向某些雌性小鼠体内注射睾丸激素会增加其对肝癌的敏感性。还已知睾丸激素会增加大鼠的肿瘤数量并降低化学诱导的肝癌的分化程度。
诱变
在体外Ames和体内小鼠微核试验中,睾丸激素呈阴性。
生育能力受损
据报道,外源性睾丸激素的给药可抑制大鼠,狗和非人灵长类动物的精子发生,这种精子生成在停止治疗时是可逆的。
14.临床研究
。睾丸激素替代疗法
Natesto在306名性腺功能减退男性的90天开放标签多中心研究中进行了疗效评估。符合条件的患者为18岁及以上(平均年龄54岁),并且早晨血清总睾丸激素浓度低于300 ng / dL。患者为白种人(89%),非裔美国人(6%),亚裔(5%)或其他种族(少于1%)。
指示患者每天两次或三次鼻内自用Natesto(11 mg睾丸激素)。
主要终点是在第90天的平均血清总睾丸激素浓度(C avg )在正常范围(300至1050 ng / dL)之间的患者百分比。
次要终点是最大总睾丸激素浓度(C max )高于三个预定限值的患者百分比:大于1500 ng / dL,介于1800和2500 ng / dL之间以及大于2500 ng / dL。
共有78名性腺功能减退的男性每天接受Natesto(11 mg睾丸激素)3次(每天33 mg睾丸激素)。其中,共有73名性腺功能减退的男性被纳入90天的统计评估(总睾丸激素药代动力学),该评估基于意向性治疗(ITT)人群,并进行了最后观察(LOCF)。在第90天,这73名患者中有90%(90%)的C avg处于正常范围(300至1050 ng / dL)。C avg的患者百分比低于正常范围(小于300 ng / dL)和在第90天高于正常范围(大于1050 ng / dL)的分别为10%和0%。
表3总结了69名患者的平均(SD)总血清睾丸激素浓度,这些患者具有完整的药代动力学采样特征,每天接受Natesto(11 mg睾丸激素)治疗90天,共90天。
C avg =平均浓度; C max =最大浓度; C min =最小浓度。 | |
| 内斯托 (11睾丸激素) 每日三遍 (N = 69) | |
| 平均值(ng / dL) | 421(116) |
| 最大C(ng / dL) | 1044(378) |
| C min (ng / dL) | 215(74) |
C max大于1500 ng / dL且介于1800和2500 ng / dL之间的患者百分比分别为15.9%和1.4%。没有患者的C max大于2500 ng / dL。
16.供应/存储和处理方式
。供应方式
Natesto(睾丸激素)鼻凝胶可作为定量泵使用,其中包含11克凝胶,以60次定量泵促动分配。一泵致动可在0.122克凝胶中递送5.5毫克睾丸激素。
。存储
将Natesto放在儿童无法触及的地方。
存放在20°C至25°C(68°F至77°F)下。允许远足到15°C到30°C(59°F到86°F)。请参阅USP控制的室温。
。处理与处置
用过的Natesto分配器应以防止儿童或宠物意外暴露的方式丢弃在家庭垃圾中。
17.患者咨询信息
建议患者阅读FDA批准的患者标签(患者信息)。
用于已知或怀疑患有前列腺癌或乳腺癌的男性
患有已知或疑似前列腺癌或乳腺癌的男性不应使用Natesto [请参阅禁忌症( 4 )和警告与注意事项( 5.3 )] 。
鼻不良反应
Natesto的临床试验报告了鼻部不良反应,包括鼻咽炎,鼻漏,鼻出血,鼻部不适和鼻伤。劝告患者向其卫生保健专业人员报告任何鼻部症状或体征。
与雄激素的潜在不良反应
应告知患者用雄激素治疗可能导致不良反应,包括:
- 排尿习惯的改变,例如晚上排尿增多,尿流开始困难,白天排尿多次,敦促您必须立即去洗手间,发生尿液意外,无法排尿,以及尿流较弱。
- 呼吸障碍,包括与睡眠或白天过度嗜睡有关的呼吸障碍。
- 阴茎勃起次数过多或持续。
- 恶心,呕吐,肤色改变或脚踝肿胀。
应告知患者以下使用说明
- 阅读每个Natesto计量泵随附的患者信息。
- 在首次使用泵之前,先将其压下10次以注水。以后使用该泵无需灌注。
- 鼻内施用Nates,而不是身体其他部位。每天3次,每天一次,早晨一次,下午一次和晚上一次(间隔6至8个小时),最好每天在鼻腔内服用Natesto。
- 将Natesto放在儿童接触不到的地方。
- 报告其健康状况的任何变化,例如尿习惯,呼吸,睡眠,情绪,鼻腔刺激或鼻炎的变化。
- 切勿与任何人分享Natesto。
| 患者信息 Natesto(Na-tes-to)CIII (睾丸激素)鼻凝胶 | ||
什么是Natesto?
| ||
| 谁不应该使用Natesto? 如果您执行以下操作,请勿使用Natesto:
| ||
| 如果您具有上述任何条件,请在使用Natesto之前与您的医疗保健提供者联系。 | ||
使用Natesto之前,请告知您的医疗保健提供者所有您的医疗状况,包括是否您:
| ||
| 告知您的医疗保健提供者您所服用的所有药物,包括处方药和非处方药,维生素或草药补品。 将Natesto与某些其他药物一起使用可能会相互影响。尤其要告诉您的医疗保健提供者您是否服用: | ||
|
|
|
我应该如何使用Natesto?
| ||
Natesto可能有哪些副作用? Natesto可能会导致严重的副作用,包括:
| ||
| 如果您有上述任何严重的副作用,请立即致电您的医疗保健提供者。这些并非Natesto的所有可能的副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。 Natesto最常见的副作用包括:
| ||
| 其他副作用包括勃起次数多于正常情况或勃起时间长。 | ||
我应该如何存放Natesto?
| ||
| 有关安全有效使用Natesto的一般信息。 | ||
| 有时出于患者信息手册中列出的目的以外的目的开出药物。请勿在没有规定的条件下使用Natesto。即使他人有与您相同的症状,也不要将其交给他人。可能会伤害他们。 如果您想了解有关Natesto的更多信息,请与您的医疗保健提供者联系。您可以向您的药剂师或医疗保健提供者索取有关Natesto的信息,这些信息是为卫生专业人员编写的。有关更多信息,请访问www.natesto.com或致电1-855-298-8246。 | ||
| Natesto中的成分是什么? 有效成分:睾丸激素 非活性成分:蓖麻油,油酰聚氧化甘油酯和胶体二氧化硅 市场销售商:Aytu BioScience,Inc.,Englewood,CO 80112 制造商:Haupt Pharma Amareg GmbH,Donaustaufer Str.。 378,雷根斯堡,巴伐利亚D-93055,德国 | ||
使用说明
纳特斯托(Na-tes-to)
CIII(睾丸激素)
鼻凝胶
服用Natesto所需的用品:
- 1个Natesto点胶机
- 2张干净,干燥的纸巾
- 干净,平坦的表面,例如桌子
- 一面镜子
Natesto点胶机的零件(见图A)
 |
| (图A) |
有关您的Natesto的信息:
- 使用Natesto后,请勿在1个小时内blow鼻涕或闻鼻涕。
- 首次使用Natesto之前,您需要准备Natesto泵的填料。
如何灌注Natesto泵:
- 将Natesto分配器放在水槽上方,将其倒置(倒置),然后慢慢按下泵并释放10次(请参见图B)。
 |
| (图B) |
- 给泵注水时出现的所有Natesto都应用温水冲洗下来。
- 启动后,如果Natesto执行器的尖端上有Natesto,请用干净的干纸巾擦拭尖端。
- 如果任何Natesto凝胶沾到手上,建议用温水和肥皂洗手。
给予Natesto剂量:
步骤1: low鼻涕。
步骤2:取下Natesto盖。
步骤3:在照镜子的同时,将右手(食指)放在Natesto执行器的泵上,然后将执行器的尖端缓慢向上滑入您的左鼻孔,直到泵上的手指接触到鼻子的底部(参见图C)。
 |
| (图C) |
步骤4:轻轻倾斜Natesto执行器,使尖端的孔接触到鼻孔的侧壁(侧面)。这将确保Natesto的位置正确(请参见图D)。
 |
| (图D) |
步骤5:将执行器安装到位,慢慢向下推泵直至停止,然后从鼻子上卸下执行器。
第6步:在照镜子时,将左手(食指)放在Natesto执行器的泵上,然后将执行器的尖端缓慢向上滑入右鼻孔,直到泵上的手指接触到鼻子的底部(参见图E)。
 |
| (图E) |
步骤7:轻轻倾斜Natesto执行器的尖端,以使尖端中的孔接触到鼻孔的侧壁(侧面)。这样可以确保将Natesto放在正确的位置(请参见图F)。
 |
| (图F) |
步骤8:慢慢向下推泵,直到泵停止,然后从鼻子上卸下执行器。
步骤9:用干净的干纸巾擦拭执行器的尖端。
步骤10:盖上盖子。
步骤11:将鼻孔紧贴在鼻子中间(鼻梁)的下方,然后轻轻地将它们揉在一起(见图G)。
 |
| (图G) |
- 回覆
注意:本文包含有关睾丸激素的副作用信息。此页面上列出的某些剂型可能不适用于Natesto品牌。
对于消费者
适用于睾丸激素:颊部贴剂延长释放
其他剂型:
- 植入物,油,溶液
- 鼻凝胶/果冻
- 透皮贴剂缓释
需要立即就医的副作用
除了所需的作用,睾丸激素(Natesto中包含的活性成分)可能会引起一些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用睾丸激素时,如果出现以下任何副作用,请立即与医生联系:
发病率未知
- 手臂或腿部疼痛,发红或肿胀
- 呼吸困难
如果在服用睾丸激素时出现以下任何过量症状,请立即获得紧急帮助:
服用过量的症状
- 模糊的视野
- 头痛
- 癫痫发作
- 言语不清
- 突然严重的无法说话
- 暂时失明
- 身体一侧手臂或腿无力,突然而严重
不需要立即就医的副作用
可能会发生睾丸激素的一些副作用,通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 口香糖或口腔刺激
不常见
- 味道差,异常或令人不快
- 牙龈出血
- 皮肤上的斑点
- 乳房疼痛
- 口味改变
- 咳嗽
- 哭了
- 去个人化
- 腹泻
- 灰心
- 头晕
- 口干
- 烦躁不安
- 乳房增大
- 欣快感
- 恐惧或紧张
- 感到悲伤或空虚
- 牙龈疼痛或水泡
- 嘶哑
- 消化不良
- 易怒
- 皮肤瘙痒
- 食欲不振
- 失去兴趣或愉悦
- 下背部或侧面疼痛
- 口腔溃疡
- 恶心
- 嘈杂的呼吸
- 排尿困难或困难
- 偏执狂
- 气体通过
- 敲打耳朵
- 情绪上反应迅速或反应过度
- 快速变化的心情
- 牙龈发红和肿胀
- 缓慢或快速的心跳
- 嘴唇刺痛
- 胃痉挛,疼痛,饱胀或不适
- 牙龈肿胀
- 鼻子肿胀
- 疲倦
- 牙疼
- 麻烦集中
- 睡眠困难
- 异常疲倦或虚弱
- 呕吐
对于医疗保健专业人员
适用于睾丸激素:颊膜缓释,复方散剂,肌内溶液,鼻凝胶,口服胶囊,皮下植入物,皮下溶液,透皮乳膏,透皮膜缓释,透皮凝胶,透皮软膏,透皮溶液
一般
该药物最常报告的副作用是在注射过程中或注射后立即出现水肿,痤疮,部位疼痛,注射部位红斑,咳嗽或呼吸困难。
睾丸激素(Natesto中所含的活性成分)局部最常报告的副作用是皮肤反应(16.1%)和过敏性接触性皮炎(高达37%)。 [参考]
皮肤科
非常常见(10%或更多):局部睾丸激素:皮肤反应(16.1%),烧伤样水疱(12%),瘙痒,过敏性接触性皮炎(高达37%)
常见(1%至10%):痤疮,硬结,燃烧
罕见(0.1%至1%):脱发,红斑,皮疹(包括流行的皮疹),瘙痒,皮肤干燥,毛囊炎(局部使用睾丸激素(Natesto中的活性成分))
未报告频率:皮脂溢,荨麻疹,男性型秃发,多毛症注射部位发炎
上市后报告:血管性水肿,血管神经性水肿,多汗症,头发变色,白细胞碎裂性血管炎[参考]
内分泌
很常见(10%或更多):加速增长
常见(1%至10%):雌二醇增加,性腺功能减退
罕见(0.1%至1%):血液睾丸激素(纳西托(Natesto)中的活性成分)增加未报告的频率:女性出现病毒化的迹象(例如,声音嘶哑,痤疮,多毛症,月经不调,阴蒂增大和脱发),性早熟(青春期前男性)
上市后报道:甲状旁腺功能亢进,催乳素增加,睾丸激素增加[参考]
胃肠道
十分常见(10%或更多):睾丸激素(Natesto中所含的活性成分)颊膜:牙龈炎(32.6%)
常见(1%至10%):腹泻,油性大便(由于IM注射油性溶剂);局部睾丸激素:胃食管反流病,胃肠道出血,牙龈或口腔刺激(9.2%),味苦,牙龈疼痛,牙龈压痛,牙龈浮肿,味觉变态
罕见(0.1%至1%):恶心
罕见(少于0.1%):腹痛
未报告频率:腹部疾病,腹腔内出血
上市后报告:呕吐;睾酮颊膜:口干,牙龈肿胀,嘴唇肿胀,口腔溃疡,口腔炎[参考]
大多数与牙龈相关的不良事件都是短暂的。 [参考]
本地
非常常见(10%或更多):局部睾丸激素:应用部位瘙痒症(高达37%),应用部位起泡(12%)
常见(1%至10%):注射部位疼痛,注射部位不适,注射部位瘙痒,红斑,注射部位血肿,注射部位刺激,注射部位发炎;注射部位反应局部睾丸激素(Natesto中所含的活性成分)涂抹部位红斑,涂抹部位发热,涂抹部位发炎,涂抹部位囊泡,涂抹部位脱落,涂抹部位灼烧,涂抹部位硬结,涂抹部位硬大疱,涂抹部位机械刺激,皮疹在施工现场,施工现场的污染
上市后报告:注射部位脓肿,程序疼痛,应用部位肿胀(局部睾丸激素) [参考]
心血管的
常见(1%至10%):潮热,高血压
罕见(0.1%至1%):心血管疾病
未报告频率:静脉血栓栓塞
上市后报告:心绞痛,心搏停止,心力衰竭,冠状动脉疾病,冠状动脉闭塞,心肌梗塞,心动过速,脑梗塞,脑血管意外,循环衰竭,深静脉血栓形成,晕厥,血栓栓塞,血栓形成,静脉功能不全,中风[ ]
泌尿生殖
常见(1%至10%):前列腺检查异常,良性前列腺增生(BPH),射精障碍,前列腺炎
罕见(0.1%至1%):前列腺硬结,前列腺疾病,睾丸疼痛,尿流减少,尿retention留,尿路疾病,夜尿,排尿困难
罕见(少于0.1%):排尿障碍,附睾炎,膀胱烦躁,阳imp,睾丸功能受到抑制和睾丸萎缩
未报告频率:少精子症,阴茎异常勃起,前列腺增生(前列腺生长至性腺状态),勃起的次数和持续时间过多;小儿科:性发育过早,勃起次数增加,阴茎增大
上市后报告:前列腺感染,尿路结石,排尿困难,血尿,尿路疾病,尿频,无精子症[参考]
血液学
常见(1%至10%):红细胞增多症,血细胞比容升高
罕见(0.1%至1%):红细胞计数增加,血红蛋白增加,部分凝血活酶活化时间延长,凝血酶原时间延长
未报告的频率:血液和淋巴系统疾病,抑制凝血因子II,V,VII和X,伴随抗凝治疗的患者出血
上市后报告:血小板减少症,贫血[参考]
新陈代谢
常见(1%至10%):体重增加,食欲增加,液体fluid留(钠,氯化物,水,钾,钙和无机磷酸盐)
罕见(0.1%至1%):糖基化血红蛋白增加,高胆固醇血症,甘油三酸酯增加
未报告频率:血脂异常(血清低密度脂蛋白,高密度脂蛋白和甘油三酸酯减少),代谢和营养障碍,高钙血症
上市后报道:低血糖,糖尿病,体液retention留,高脂血症,高甘油三酯血症,血糖升高[参考]
肌肉骨骼
常见(1%至10%):腰酸背痛,关节血肿(局部使用睾丸激素(Natesto中的活性成分))
罕见(0.1%至1%):关节痛,四肢疼痛,肌肉痉挛,肌肉劳损,肌痛,肌肉骨骼僵硬,肌酸磷酸激酶升高
未报告频率:儿科:骨epi过早闭合,骨形成增加
上市后报告:肌肉骨骼性胸痛,肌肉骨骼性疼痛,肌痛,骨质减少,骨质疏松,系统性红斑狼疮[参考]
神经系统
常见(1%至10%):头痛,眩晕(局部睾丸激素(内塞托所含的有效成分)
罕见(0.1%至1%):偏头痛,震颤,头晕
未报告频率:神经质,感觉异常
上市后报道:脑血管机能不全,可逆性缺血性神经功能缺损,短暂性脑缺血发作,健忘症[参考]
肿瘤的
常见(1%至10%):前列腺特异性抗原(PSA)增加,前列腺癌
罕见(0.1%至1%):前列腺上皮内瘤变
罕见(小于0.1%):良性,恶性和未明确的肿瘤(包括囊肿和息肉) [参考]
其他
常见(1%至10%):疲劳,多汗症;发冷,身体疼痛,气味障碍
罕见(0.1%至1%):乳房硬结,乳房疼痛,乳头敏感,男性乳房发育症,雌二醇增加,睾丸激素(Natesto中的有效成分)增加,乏力,盗汗
稀有(少于0.1%):发烧,全身不适
未报告频率:水肿
上市后报告:突然的听力下降,耳鸣,像流感一样的疾病[参考]
精神科
常见(1%至10%):烦躁,失眠,情绪波动,攻击性,
罕见(0.1%至1%):抑郁症,情绪障碍,躁动不安,性欲增加,性欲降低
未报告频率:敌意,焦虑
上市后报告:科萨科夫(Korsakoff)精神病非酒精性,男性性高潮障碍,躁动不安,睡眠障碍[参考]
呼吸道
肺微栓塞的体征和症状可能在注射过程中或注射后立即发生,并且是可逆的。 [参考]
常见(1%至10%):鼻窦炎,鼻咽炎,上呼吸道感染,支气管炎
罕见(0.1%至1%):咳嗽,呼吸困难,打呼,、发声困难
罕见(小于0.1%):油性溶液引起的肺微栓塞(POME)(咳嗽,呼吸困难,不适,多汗症,胸痛,头晕,感觉异常或晕厥)
未报告频率:睡眠呼吸暂停
上市后报告:胸痛,哮喘,慢性阻塞性肺疾病,过度换气,阻塞性气道疾病,咽水肿,咽喉痛,肺栓塞,呼吸窘迫,鼻炎,睡眠呼吸暂停综合征[参考]
肝的
罕见(0.1%至1%):LFT异常,AST增加
罕见(小于0.1%):肝功能异常
未报告频率:黄疸,良性肝肿瘤,恶性肝肿瘤,肝脏肿大,骨质疏松症肝炎
上市后报告:ALT升高,AST升高,胆红素升高,转氨酶升高,γ-谷氨酰转移酶升高[参考]
过敏症
罕见(0.1%至1%):过敏反应
未报告频率:过敏反应
上市后报告:过敏性休克[参考]
眼科
罕见(0.1%至1%):睾丸激素(内塞中所含的有效成分)局部:流泪增加
上市后报告:局部睾丸激素:眼压升高,玻璃体脱离[参考]
肾的
上市后报告:肾结石,肾绞痛,肾痛[参考]
参考文献
1.“产品信息。Fortesta(睾丸激素)。”马萨诸塞州列克星敦市的Endo Pharmaceuticals(以前是Indevus Pharmaceuticals Inc)。
2.“产品信息。AndroGel(睾丸激素)。”伊利诺伊州布法罗格罗夫的Unimed Pharmaceuticals。
3.“产品信息。Axiron(睾丸激素)。”印第安纳州印第安纳波利斯的礼来公司和礼来公司。
4.“产品信息。庚酸睾丸酮(睾丸激素)。”西新泽西州伊顿镇西沃德制药公司。
5. Cerner Multum,Inc.“澳大利亚产品信息”。 00
6. Cerner Multum,Inc.“英国产品特性摘要”。 00
7.“产品信息。睾丸(睾丸激素)。”纽约州拉伊市Bartor Pharmacal Co,Inc.
8.“产品信息。Testim(睾丸激素)。” AS药物解决方案,伊利诺伊州芝加哥。
9.“产品信息。雄激素(局部使用睾丸激素)。” SmithKline Beecham,宾夕法尼亚州费城。
10.“产品信息。Aveed(睾丸激素)。” Endo Pharmaceuticals Solutions Inc,宾夕法尼亚州马尔文。
11.“产品信息。Depo-睾丸激素(睾丸激素)。”辉瑞美国制药集团,纽约,纽约。
12. O'Driscoll JB,八月PJ“由雌二醇-睾丸激素植入物导致的牛皮癣加重。”临床皮肤病学杂志15(1990):68-9
13. Traupe H,von Muhlendahl KE,Bramswig J,Happle R“在三个身高过高的男孩接受睾丸激素治疗后,暴发性痤疮”。大皮肤病学杂志124(1988):414-7
14. Dobs AS,Meikle AW,Arver S,Sanders SW,Caramelli KE,Mazer NA“与每两周注射一次睾丸酮庚酸酯相比,渗透增强的睾丸激素透皮系统的药代动力学,功效和安全性。”临床内分泌代谢杂志(1999):3469-78
15. Bates GW,康威尔行政长官“多毛症的医源性原因”。妇产科临床杂志34(1991):848-51
16. Fyrand O,Fiskaadal HJ,Trygstad O“痤疮在接受雄激素治疗的青春期男孩中”。 Acta Derm Venereol 72(1992):148-9
17. Buckley DA,Wilkinson SM,Higgins EM“接触对睾丸激素贴剂过敏”。接触性皮炎39(1998):91-2
18. DeSanctis V,Vullo C,Urso L,Rigolin F,Cavallini A,Caramelli K,Daugherty C,Mazer N“在性腺功能低下的青少年和患有β地中海贫血的年轻人中使用Androderm(R)睾丸激素透皮系统的临床经验。” J Pediatr内分泌代谢11(1998):891-900
19. Wu FC,Farley TM,Peregoudov A,Waites GM“庚酸酯对正常男性的影响:多中心避孕功效研究的经验。世界卫生组织男性生殖力调节方法工作组。” Fertil Steril 65(1996):626-36
20. Bennett NJ:“由睾丸激素透皮系统引起的烧伤样病变。”伯恩斯24(1998):478-80
21. Matsumoto AM“长期服用睾丸激素对正常男性的影响:高剂量睾丸激素的安全性和有效性以及黄体生成激素,促卵泡激素和精子产生的平行剂量依赖性抑制。” J临床内分泌代谢70(1990):282-7
22. Cefalu WT,Pardridge WM,Premachandra BN“在家族性dysalbuminemic高甲状腺素血症中甲状腺素和睾丸激素的肝生物利用度”。 J临床内分泌代谢61(1985):783-6
23. Tripathy D,Shah P,Lakshmy R,Reddy KS“睾丸激素替代对特发性性腺功能减退性性腺功能减退男性的全身葡萄糖利用和其他心血管危险因素的影响。”荷尔蒙代谢研究30(1998):642-5
24. Becker U,Gluud C,Bennett P“口服睾丸激素对酒精性肝硬化男性血清TBG水平的影响。”肝脏8(1988):219-24
25. Ferrera PC,Putnam DL,Verdile副总裁“使用类固醇作为扩张型心肌病的可能诱因”。心脏病学88(1997):218-20
26. Jackson JA,Waxman J,Spiekerman AM,“睾丸激素替代疗法的前列腺并发症”。 Arch Intern Med 149(1989):2365-6
27. Zelissen PM,Stricker BH“严重的阴茎异常勃起是睾丸激素替代疗法的并发症。”美国医学杂志85号(1988):273-4
28. Wang C,Leung A,Superlano L,Steiner B,Swerdloff RS“由外源性睾丸激素诱导的少精症与正常运作的残余精子有关。” Fertil Steril 68(1997):149-53
29.派克·鲁(Parker LU),伯格费尔德·WF(Bergfeld WF)“继发于局部睾丸激素的验证”。 Cleve Clin J Med 58(1991):43-6
30. Endres W,Shin YS,Rieth M,T座,Schmiedt E,Knorr D“睾丸激素治疗期间法布里氏病的精神分裂症”。 Klin Wochenschr 65(1987):925
31. Zhang GY,Gu YQ,Wang XH,Cui YG,Bremner WJ“可注射的十一酸睾丸酮作为正常中国男性潜在的男性避孕药的临床试验。”临床内分泌代谢杂志(1999):3642-7
32. Anderson FH,Francis RM,Faulkner K“对患有骨质疏松症的性腺癌男性补充雄激素-治疗6个月对骨矿物质密度和心动镜危险因素的影响。” Bone 18(1996):171-7
33. Bhasin S,TW商店,Javanbakht M等。 “体重减轻和睾丸激素水平低的受艾滋病毒感染的男性的睾丸激素替代和抵抗运动。”牙买加283(2000):763-70
34. Bagatell CJ,Heiman JR,Matsumoto AM,Rivier JE,Bremner WJ“大剂量外源睾丸激素对健康男人的代谢和行为影响”。临床内分泌代谢杂志79(1994):561-7
35. Lajarin F,Zaragoza R,Tovar I,Martinezhernandez P“使用合成代谢类固醇在两个男性健美运动员中血脂的演变”。临床化学42(1996):970-2
36. Zmuda JM,Thompson PD,Dickenson R,Bausserman LL“睾丸激素可减少男性的脂蛋白(a)”。美国心脏病学会杂志77(1996):1244
37. Stannard JP,Bucknell AL“与类固醇注射有关的肱三头肌腱破裂”。美国运动医学杂志21(1993):482-5
38. Pollard M“睾丸激素的致瘤作用”。柳叶刀336(1990):1518
39. Uzych L“合成雄性类固醇与精神病相关的影响:综述。” Can J精神病学37(1992):23-8
40. Nuzzo JL,Manz HJ,Maxted WC“长期雄激素治疗后肝硬化肝硬化”。泌尿科25(1985):518-9
41. Carrasco D,Prieto M,Pallardo L,Moll JL,Cruz JM,Munoz C,Berenguer J“长期使用庚酸酯庚酸酯治疗后的多个肝腺瘤。文献综述。”肝病杂志1(1985):573-8
42. Falk H,Thomas LB,Popper H,Ishak KG“与雄激素合成代谢类固醇有关的肝血管肉瘤”。柳叶刀2(1979):1120-3
43. Yu MW,Chen CJ:“血清睾丸激素水平升高和肝细胞癌风险增加”。癌症研究53(1993):790-4
某些副作用可能没有报道。您可以将其报告给FDA。
剂量管理
要给予剂量,应指导患者执行以下步骤:
- the鼻子
- 从分配器上取下盖子。
- 将右手食指放在执行器的泵上,并在镜子前面时,将执行器的尖端缓慢向上推入左鼻孔,直到其在泵上的手指到达鼻根。
- 倾斜执行器,使执行器尖端上的开口与鼻孔侧壁接触,以确保将凝胶涂在鼻壁上。
- 缓慢踩下泵直至停止。
- 从鼻孔中取出执行器,同时沿鼻孔侧壁的内部擦拭尖端,以完全转移凝胶。
- 使用左手食指,对右鼻孔重复第3至6项中概述的步骤。
- 用干净的干纸巾擦拭执行器的尖端。
- 盖上饮水机上的盖子。
- 在鼻梁下方的某个位置按一下鼻孔,然后轻轻按摩。
- 用药后1小时内请勿blowing鼻或闻鼻。
当分配器内部的活塞顶部到达内部标签顶部的箭头时,应更换分配器。可以通过从容器周围展开外盖来找到内部标签。

与拟交感神经充血药不同的鼻用药物一起使用
Natesto和拟交感神经减充血剂以外的鼻腔给药药物之间的药物相互作用潜力尚不清楚。因此,除拟交感神经性减充血剂外,不建议将Natesto与经鼻给药的药物一起使用
(例如,羟甲唑啉) [请参阅药物相互作用( 7.4 )和临床药理学( 12.3 )] 。
重症鼻炎暂时停用
如果患者经历了严重的鼻炎发作,请暂时停止Natesto治疗,直到严重的鼻炎症状消失。如果严重的鼻炎症状持续存在,建议使用替代性睾丸激素替代疗法。
1.适应症和用途
Natesto适用于成年男性因内源性睾丸激素缺乏或缺乏而引起的替代治疗。
- 原发性性腺功能低下(先天性或后天性):由于隐睾症,双侧扭转,睾丸炎,睾丸消失,睾丸切除术,克氏综合征,化学疗法或酒精或重金属引起的中毒导致的睾丸衰竭。这些男性通常血清睾丸激素水平低,促性腺激素(促卵泡激素[FSH],促黄体生成激素[LH])高于正常范围。
- 促性腺激素减低性腺功能减退症(先天性或后天性):促性腺激素或促黄体生成激素释放激素(LHRH)缺乏或由于肿瘤,创伤或放射引起的垂体-下丘脑损伤。这些人的睾丸激素血清浓度低,但促性腺激素水平正常或低。
使用限制:
- Natesto在患有“与年龄有关的性腺功能低下”(也称为“迟发性性腺功能低下”)的男性中的安全性和有效性尚未确定。
- 尚未确定Natesto在18岁以下男性中的安全性和有效性[请参阅在特定人群中使用( 8.4 )] 。
2.剂量和给药
启动Natesto之前,请确保至少在两天前的早晨测量了血清睾丸激素的浓度,并确保这些血清睾丸激素的浓度低于正常范围,以确认是否患有性腺功能低下症。
。加药
Natesto的推荐剂量是11毫克的睾丸激素(2次泵促动;每个鼻孔1次促动),每天鼻内给药3次,每日总剂量为33 mg。
开始使用Natesto治疗后一个月,应定期检查血清总睾丸激素浓度。当总睾丸激素浓度持续超过1050 ng / dL时,应停止使用Natesto的治疗。如果总睾丸激素浓度始终低于300 ng / dL,则应考虑替代治疗。
。管理说明
Natesto每天一次,每天一次,下午一次和晚上一次(间隔6至8小时),每天一次,鼻内给药3次,最好每天一次。应指导患者在每个鼻孔中完全按下泵1次以接受总剂量。不要将Natesto施用到身体的其他部位。
准备泵
初次使用Natesto时,应指导患者倒转泵,压下泵10次,并丢弃直接分配到水槽中的少量产品,然后用温水将凝胶彻底洗净,以启动泵。尖端应用干净的干纸巾擦拭。如果患者手上沾有Natesto凝胶,建议他们用温水和肥皂洗手。底漆应仅在首次使用每个分配器之前进行。
剂量管理
要给予剂量,应指导患者执行以下步骤:
- the鼻子
- 从分配器上取下盖子。
- 将右手食指放在执行器的泵上,并在镜子前面时,将执行器的尖端缓慢向上推入左鼻孔,直到其在泵上的手指到达鼻根。

- 倾斜执行器,使执行器尖端上的开口与鼻孔侧壁接触,以确保将凝胶涂在鼻壁上。

- 缓慢踩下泵直至停止。
- 从鼻孔中取出执行器,同时沿鼻孔侧壁的内部擦拭尖端,以完全转移凝胶。
- 使用左手食指,对右鼻孔重复第3至6项中概述的步骤。
- 用干净的干纸巾擦拭执行器的尖端。
- 盖上饮水机上的盖子。
- 在鼻梁下方的某个位置按一下鼻孔,然后轻轻按摩。
- 用药后1小时内请勿blowing鼻或闻鼻。
当分配器内部的活塞顶部到达内部标签顶部的箭头时,应更换分配器。可以通过从容器周围展开外盖来找到内部标签。

。与拟交感神经充血药不同的鼻用药物一起使用
Natesto和拟交感神经减充血剂以外的鼻腔给药药物之间的药物相互作用潜力尚不清楚。因此,除拟交感神经性减充血剂外,不建议将Natesto与经鼻给药的药物一起使用
(例如,羟甲唑啉) [请参阅药物相互作用( 7.4 )和临床药理学( 12.3 )] 。
。重症鼻炎暂时停用
如果患者经历了严重的鼻炎发作,请暂时停止Natesto治疗,直到严重的鼻炎症状消失。如果严重的鼻炎症状持续存在,建议使用替代性睾丸激素替代疗法。
3.剂量形式和强度
Natesto是一种鼻内使用的淡黄色凝胶,可在带有计量泵的分配器中使用。一泵致动可输送5.5 mg睾丸激素。
4.禁忌症
Natesto在患有乳腺癌或已知或疑似前列腺癌的男性中是禁忌的[见警告和注意事项( 5.3 )]。
Natesto在怀孕或可能怀孕或哺乳的妇女中禁用。 Natesto对孕妇使用可能会造成胎儿伤害。 Natesto可能会对哺乳婴儿造成严重的不良反应。胎儿或哺乳期婴儿接触雄激素可能导致不同程度的病毒化。如果孕妇暴露于Natesto,她应该被告知潜在危害胎儿[见警告和注意事项( 5.8 )和特殊人群中使用( 8.1 , 8.3 )]。
5.警告和注意事项
鼻部不良反应和有关鼻部安全的长期信息有限
Natesto的临床试验经验报告了鼻部不良反应,包括鼻咽炎,鼻漏,鼻出血,鼻部不适和鼻sc伤。除1例(单例上呼吸道感染)外,所有鼻部不良反应均被报告为轻度或中度。然而,在少数受试者中可获得有关鼻安全性的长期临床试验数据[见不良反应( 6.2 )] 。应指导患者向其卫生保健专业人员报告任何鼻部症状或体征。在这种情况下,医疗保健专业人员应确定进一步的评估(例如耳鼻喉科咨询)或终止Natesto是否合适。
用于慢性鼻疾病和鼻解剖结构改变的患者
由于缺乏有关安全性或有效性的临床数据,因此不建议将Natesto用于以下患者:
- 鼻部疾病史;
- 鼻或鼻窦手术史;
- 过去6个月内有鼻骨折史或导致前鼻中隔偏斜的鼻骨折;
- 粘膜炎性疾病(例如,干燥综合征);和
- 鼻窦疾病。
良性前列腺增生症的恶化和前列腺癌的潜在风险
- 用雄激素治疗的BPH患者的BPH体征和症状恶化的风险增加。监测BPH患者的体征和症状是否恶化。
- 用雄激素治疗的患者患前列腺癌的风险可能更高。在开始治疗之前评估患者的前列腺癌。在开始治疗后3至6个月,然后根据前列腺癌筛查实践,对患者进行重新评估是适当的[参见禁忌症( 4 )]。
红细胞增多症
血细胞比容的增加反映了红细胞量的增加,可能需要停用Natesto。在开始睾丸激素治疗之前检查血细胞比容。开始睾丸激素治疗后3至6个月,应每年重新评估血细胞比容。如果血细胞比容升高,请停止治疗,直到血细胞比容降低至可接受的水平。红细胞数量增加可能会增加血栓栓塞事件的风险。
静脉血栓栓塞
在使用睾丸激素产品(例如Natesto)的患者中,有静脉血栓栓塞事件的上市后报道,包括深静脉血栓形成(DVT)和肺栓塞(PE)。评估报告下肢(DVT)有疼痛,浮肿,温暖和红斑症状的患者和PE表现为急性呼吸急促的患者。如果怀疑发生静脉血栓栓塞事件,请停止使用Natesto的治疗并开始适当的检查和处理[见不良反应( 6.2 )]。
心血管风险
尚未进行长期的临床安全性试验来评估男性睾丸激素替代疗法的心血管结局。迄今为止,流行病学研究和随机对照试验对于确定重大不良心血管事件(MACE)(如非致命性心肌梗塞,非致命性中风和心血管死亡)的风险尚无定论,与未使用睾丸激素相比, -采用。一些研究(并非全部)报告说,男性睾丸激素替代疗法的使用会增加MACE的风险。在决定是否使用或继续使用Natesto时应告知患者这种可能的风险。
滥用睾丸激素和监测血清睾丸激素浓度
睾丸激素已被滥用,通常以高于批准适应症推荐剂量并与其他合成代谢雄激素类固醇合用。合成代谢雄激素的类固醇滥用会导致严重的心血管和精神疾病不良反应[参见药物滥用和依赖性( 9 )]。
如果怀疑睾丸激素滥用,请检查血清睾丸激素浓度以确保它们在治疗范围内。但是,滥用合成睾丸激素衍生物的男性的睾丸激素水平可能在正常或亚正常范围内。为患者提供有关滥用睾丸激素和合成代谢雄激素类固醇的严重不良反应的建议。相反,请考虑出现严重心血管或精神疾病不良事件的可疑患者中睾丸激素和合成代谢雄激素类固醇滥用的可能性。
在女性中使用
由于缺乏对女性的对照研究以及潜在的毒杀作用,Natesto并未指定用于女性。
对精子发生不利影响的潜力
如果使用大量内源性雄激素(包括Natesto),则可通过反馈抑制垂体卵泡刺激素(FSH)来抑制精子发生,这可能对精液参数(包括精子数量)产生不利影响。
肝不良反应
长期使用高剂量的口服活性17-α-烷基雄激素(甲基睾丸激素)与严重的肝脏不良反应(小儿肝炎,肝肿瘤,胆汁淤积性肝炎和黄疸)有关。腹泻性肝炎可能是威胁生命或致命的并发症。肌内睾丸酮庚酸酯的长期治疗已产生多种肝腺瘤。尚不清楚Natesto会导致这些不利影响。尽管如此,仍应指导患者报告肝功能不全的任何体征或症状(例如黄疸)。如果发生这种情况,请在评估原因时立即中止Natesto。
浮肿
包括Natesto在内的雄激素可能会促进钠和水的滞留。患有或未患有充血性心力衰竭的水肿可能是患有心脏病,肾病或肝病的患者的严重并发症。除了停药,还可能需要利尿剂治疗。
男性乳房发育
接受性腺功能减退症的包括Natesto在内的接受雄激素治疗的患者可能会发展成男性乳房发育症并可能持续存在[见不良反应( 6.1 )]。
睡眠呼吸暂停
对性腺功能低下的男性进行睾丸激素治疗可能会增强某些患者的睡眠呼吸暂停,特别是那些具有肥胖和慢性肺病等危险因素的患者。
血脂
血清脂质谱可能发生变化。定期监测脂质状况,尤其是在开始睾丸激素治疗后。血清脂质分布的变化可能需要停止睾丸激素治疗。
高钙血症
在有高钙血症(及相关高钙尿症)风险的癌症患者中,应谨慎使用包括Natesto在内的雄激素。建议这些患者定期监测血清钙浓度。
甲状腺素结合球蛋白减少
包括Natesto在内的雄激素可能会降低甲状腺素结合球蛋白的浓度,从而导致总T4血清浓度降低以及树脂对T3和T4的吸收增加。游离甲状腺激素浓度保持不变;但是,没有甲状腺功能异常的临床证据。
6.不良反应
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率与在另一种药物的临床试验中观察到的不良反应率直接进行比较,并且可能无法反映实际中观察到的不良反应率。
Natesto在一项多中心,开放标签,为期90天的临床研究中进行了评估。患者可以在两个开放标签的延长期内分别继续使用Natesto进行治疗,分别延长90天和180天。总共306名性腺功能减退的男性早晨睾丸激素浓度≤300 ng / dL。其中有78例接受Natesto的治疗,剂量为11毫克,每天3次。
90天临床研究
在为期90天的临床研究中,每天3次接受Natesto治疗的78名患者中,最常见的不良反应是:前列腺特异性抗原(PSA)增加,头痛,鼻漏,鼻epi,鼻腔不适,鼻咽炎,上呼吸道感染(URI) ),鼻窦炎,支气管炎和鼻sc。通过满足两个预先指定的标准之一可以认为PSA升高是一种不良反应:(1)从基线血清PSA升高至大于1.4 ug / L,或(2)血清PSA大于4.0 ug / L。
表1显示了在90天的临床研究中,≥3%的患者每天接受3 mg每天3次治疗所报告的不良反应。
| 不良反应 | 内斯托 (11睾甾酮)每日三倍 (N = 78) n(%) |
| PSA增加 | 4(5.1) |
| 头痛 | 3(3.8) |
| 鼻漏 | 3(3.8) |
| 鼻出血 | 3(3.8) |
| 鼻部不适 | 3(3.8) |
| 鼻咽炎 | 3(3.8) |
| 支气管炎 | 3(3.8) |
| 上呼吸道感染 | 3(3.8) |
| 鼻窦炎 | 3(3.8) |
| 鼻sc | 3(3.8) |
在为期90天的临床研究中,报告为> 2%但<3%的患者出现不良反应,包括:血压升高,消化不良,鼻干燥,鼻充血和咳嗽。
延长期
在90天的临床研究中,每天接受3次Nateto的78位患者中,在第一个90天的延长期内,每天接受3次Nateto的患者总计69位。
在这69例患者中,最常见的不良反应是:鼻咽炎,PSA升高,妄想症,鼻部不适,鼻漏和鼻sc。
表2显示了在90天的临床研究和90天的延长期内,每天接受3次Natesto治疗的患者中,≥3%的患者报告了不良反应。
| 不良反应 | Natesto 11毫克TID (N = 69) n(%) |
| 鼻咽炎 | 6(8.7) |
| 鼻漏 | 5(7.2) |
| PSA增加 | 4(5.8) |
| 妄想症 | 4(5.8) |
| 鼻部不适 | 4(5.8) |
| 鼻Sc | 4(5.8) |
| 上呼吸道感染 | 3(4.3) |
| 支气管炎 | 3(4.3) |
| 程序性疼痛 | 3(4.3) |
| 四肢疼痛 | 3(4.3) |
| 头痛 | 3(4.3) |
| 鼻出血 | 3(4.3) |
在这三个治疗期间(包括90天临床研究,第一个90天延长期和第二个180天延长期)中,共有18位患者每天接受Natesto 3次治疗。在这18例患者中,每一个以上的患者都有以下不良反应:鼻咽炎,妄想症,PSA升高,鼻腔不适,鼻sc和高血压。每个患者中报告了以下不良反应:恶心,鼻部剥脱,甲状腺刺激激素增加,食欲下降,肌痛,嗅觉失调,睾丸萎缩,鼻出血,鼻中隔失调,鼻腔不适和鼻漏。
每天接受Natesto 3次的患者在90、180和360天后平均血清PSA浓度分别增加0.2 ng / mL,0.1 ng / mL和0.2 ng / mL。
因不良反应停产
在90天临床研究及其90天和180天延长期中以任何剂量接受Natesto的所有受试者(n = 306)中,共有6名受试者因以下不良反应退出治疗,其中1名受试者报告每例:鼻部不适,头痛,消化不良,PSA增加,过敏反应(荨麻疹,嘴唇和舌头肿胀)以及1例肌痛,关节痛,发烧,发冷和瘀斑的患者。
血细胞比容增加
在90天临床研究及其90天和180天延长期中接受任何剂量Natesto的所有受试者(n = 306)中,共有4名受试者的血细胞比容水平> 55%。这4例患者的基线血细胞比容分别为48%和51%。在任何情况下,血细胞比容均未超过58%。
鼻不良反应
在90天临床研究及其90天和180天延长期中以任何剂量接受Natesto的所有受试者(n = 306)中,报告了以下鼻部不良反应:鼻咽炎(8.2%),鼻漏(7.8%) ),鼻epi(6.5%),鼻部不适(5.9%),妄想症(5.2%),鼻sc(5.2%),上呼吸道感染(4.2%),鼻干燥(4.2%)和鼻充血(3.9%) 。
上市后经验
在批准使用睾丸激素的过程中发现了以下不良反应。由于这些反应是从不确定大小的人群中自愿报告的,因此并非总是能够可靠地估计其发生频率或建立与药物暴露的因果关系。
心血管疾病:心肌梗塞,中风[请参阅警告和注意事项( 5.6 )]
血管疾病:静脉血栓栓塞[请参阅警告和注意事项( 5.5 )]
7.药物相互作用
胰岛素
雄激素治疗的患者可能会发生胰岛素敏感性或血糖控制的变化。在糖尿病患者中,雄激素的代谢作用可能会降低血糖,因此可能需要减少抗糖尿病药物的剂量。
口服抗凝剂
雄激素可能会引起抗凝活性的变化,因此建议对服用华法令的患者进行国际标准化剂量(INR)和凝血酶原时间的更频繁监测,尤其是在雄激素治疗的开始和终止时。
皮质类固醇
睾丸激素与皮质类固醇同时使用可能会导致体液retention留增加,尤其是在患有心脏,肾脏或肝脏疾病的患者中,需要进行监测。
羟甲唑啉
在有症状的季节性鼻炎雄性中观察到的平均AUC(0-24)和在平均C最大值总睾酮的3.6%下降2.6%减少当与之前Natesto羟甲唑啉处理30分钟时相比,不治疗到。与Natesto并用时,羟甲唑啉不影响睾丸激素的吸收[见临床药理学( 12.3 )] 。尚未研究与羟甲唑啉以外的其他经鼻给药药物的相互作用潜力。
8.在特定人口中的使用
。怀孕
怀孕类别X-Natesto在怀孕期间或可能怀孕的妇女中禁用。睾丸激素具有致畸性,可能引起胎儿伤害。胎儿暴露于雄激素可能导致不同程度的病毒化。如果在怀孕期间使用该药物,或者如果患者在服用该药物时怀孕,则应告知患者对胎儿的潜在危害。
。护理母亲
尽管尚不清楚有多少睾丸激素会转移到人乳中,但Natesto在哺乳妇女中是禁忌的,因为在哺乳婴儿中可能发生严重的不良反应。
。儿科用
Natesto的安全性和有效性尚未在18岁以下的儿科患者中确立。使用不当可能会导致骨龄加速和骨phy过早闭合。
。老人用
尚无足够的老年患者参与使用Nates进行对照临床研究,以确定65岁以上人群的疗效是否与年轻受试者不同。
在使用Natesto进行的3期临床试验的306位患者中,有60位年龄在65岁或以上,有9位年龄在75岁或以上。老年患者的长期安全性数据不足,无法评估心血管疾病和前列腺癌风险增加的可能性。
接受雄激素治疗的老年患者也可能有BPH体征和症状恶化的危险[见警告和注意事项( 5.3 )]。
。肾功能不全
肾功能不全患者未进行任何研究。
。肝功能不全
肝功能不全患者未进行任何研究。
。用于体重指数大于35 kg / m2的男性
尚未确定Natesto在体重指数大于35 kg / m 2的男性中的安全性和有效性。
。过敏性鼻炎
有症状的过敏性鼻炎的男性,无论用鼻充血药(例如羟甲唑啉)治疗还是不治疗,血清总睾丸激素浓度均降低了21%至24% [参见临床药理学( 12.3 )] 。
9.药物滥用与依赖
。受控物质
Natesto含有睾丸激素,这是《管制物质法》中的附表III管制物质。
。滥用
药物滥用是一种有意的,非治疗性的药物使用,即使是一次,也可以带来有益的心理和生理效果。在男性和女性成年人和青少年中都发现滥用和滥用睾丸激素。睾丸激素通常与其他合成代谢雄激素类固醇(AAS)结合使用,但并非通过药房通过处方获得,可能会被运动员和健美运动员滥用。有报告称,尽管有不良事件或违反医学建议,服用合法合法睾丸激素剂量高于处方剂量并继续服用睾丸激素的男性滥用药物。
与滥用相关的不良反应
据报道,滥用合成代谢雄激素的人存在严重不良反应,包括心脏骤停,心肌梗塞,肥厚型心肌病,充血性心力衰竭,脑血管意外,肝毒性和严重的精神病表现,包括严重的抑郁症,躁狂症,妄想症,精神病,妄想,幻觉,敌对和侵略。
男性也有以下不良反应:短暂性脑缺血发作,抽搐,轻躁狂,烦躁不安,血脂异常,睾丸萎缩,不育和不育。
妇女还报告了以下其他不良反应:多毛症,男性化,声音加深,阴蒂增大,乳房萎缩,男性型秃头和月经不调。
在男性和女性青少年中已报告了以下不良反应:骨骨epi过早闭合并终止生长,以及性早熟。
由于这些反应是从规模不确定的人群中自愿报告的,并且可能包括对其他药物的滥用,因此,始终无法可靠地估计其发生频率或建立与药物暴露的因果关系。
。依存关系
与成瘾有关的行为
持续滥用睾丸激素和其他合成代谢类固醇,导致成瘾的特征在于以下行为:
- 服用比处方更大的剂量
- 尽管由于吸毒引起医疗和社会问题,仍继续吸毒
- 药物供应中断时,要花费大量时间来获取药物
- 与其他义务相比,对毒品使用给予更高的优先考虑
- 尽管有意愿和尝试,但仍难以停药
- 突然停止使用会出现戒断症状
身体依赖性的特征在于突然停药或药物剂量明显减少后出现戒断症状。服用睾丸上剂量的人可能会出现持续数周或数月的戒断症状,包括情绪低落,重度抑郁,疲劳,渴望,躁动,烦躁,厌食,失眠,性欲减退和性腺功能低下。
使用批准剂量的睾丸激素作为批准适应症的个体中的药物依赖性尚未得到记录。
10.过量
临床试验中没有报道过使用Natesto的过量病例。有1篇关于通过注射庚酸睾丸酮引起的急性过量的报告:脑血管意外涉及高达11400 ng / dL的睾丸激素浓度。
过量用药的治疗应包括停用Natesto以及适当的症状和支持治疗。
11.说明
Natesto(睾丸激素)鼻凝胶是一种浅黄色凝胶,在经鼻给药的122.5 mg Natesto凝胶中包含5.5 mg睾丸激素。 Natesto中的活性药理成分是睾丸激素,一种雄激素。睾丸激素是白色至几乎白色的结晶性粉末,化学上称为17β-Hydroxyandrost-4-en-3-one。结构式为:

非活性成分是蓖麻油,油酰基聚氧化甘油酯和胶体二氧化硅。
12.临床药理学
。作用机理
内源性雄激素,包括睾丸激素和二氢睾丸激素(DHT),负责男性性器官的正常生长和发育以及维持第二性征。这些影响包括前列腺,精囊,阴茎和阴囊的生长和成熟。男性毛发分布的发育,例如面部,阴毛,胸部和腋毛;喉肿大,声带增粗,身体肌肉组织改变和脂肪分布。睾丸激素和DHT是继发性特征正常发育所必需的。
男性性腺功能低下是一种由于睾丸激素分泌不足而引起的临床综合征,主要有两个病因。原发性性腺功能低下是由性腺缺陷引起的,例如克氏综合征或莱迪格细胞发育不全,而继发性性腺功能低下是下丘脑(或垂体)不能产生足够的促性腺激素(FSH,LH)。
。药效学
未使用Natesto进行具体的药效学研究。
。药代动力学
吸收性
Natesto输送生理量的睾丸激素,产生的循环浓度接近健康男性正常的睾丸激素浓度(即300至1,050 ng / dL)。 Natesto的最大浓度在给药约40分钟内即可达到,半衰期为10至100分钟。
图1总结了在完成Natesto治疗90天的患者中,总睾丸激素的药代动力学曲线,每天服用33 mg睾丸激素(每天11次,每日3次)。
图1:每天三次以11 mg睾丸激素的Nate给药后第90天的平均血清总睾丸激素浓度(N = 69)

Natesto在第90天每天3次每天服用11 mg睾丸激素产生的平均每日睾丸激素浓度为421(±116)ng / dL。
分配
循环睾丸激素主要在血清中与性激素结合球蛋白(SHBG)和白蛋白结合。血浆中约40%的睾丸激素与SHBG结合,其余2%未被结合(游离),其余与白蛋白和其他蛋白质松弛结合。
代谢
睾丸激素通过2种不同的途径代谢为各种17-酮类固醇。睾丸激素的主要活性代谢物是雌二醇和二氢睾丸激素(DHT)。
Natesto治疗期间DHT浓度与睾丸激素浓度平行增加。治疗90天后,平均DHT /睾丸激素比为0.09,在正常范围内。
排泄
肌肉注射的睾丸激素约90%以葡萄糖醛酸和硫酸结合的睾丸激素及其代谢产物的形式从尿液中排出。约有6%的剂量从粪便中排泄,大部分形式是非结合形式。睾丸激素的失活主要发生在肝脏中。
药物相互作用
在变应性鼻炎和羟甲唑啉患者中的使用:在一项3交叉临床研究中,研究了变应性鼻炎的影响和羟甲唑啉对睾丸酮吸收的影响。 18名患有季节性过敏性鼻炎的男性经环境挑战试验室模型接受鼻内3剂11毫克睾丸激素治疗(睾丸激素剂量为33毫克/天),而这些患者处于无症状,有症状和有症状但已接受治疗(用羟甲唑啉)状态。
有症状的过敏性鼻炎的男性的血清总睾丸激素浓度降低了21%至24%。与未治疗时相比,在Natesto之前30分钟接受羟甲唑啉治疗的有症状的季节性鼻炎的男性中,平均睾丸激素的平均AUC(0-24)下降2.6%,总睾丸平均C max的下降3.6%。与Natesto并用时,羟甲唑啉不影响睾丸激素的吸收[见临床药理学( 12.3 )] 。与氧甲唑啉以外的鼻腔给药药物的相互作用潜力尚未进行研究。
13.非临床毒理学
。致癌,诱变和生育能力受损
致癌性
睾丸激素已经通过皮下注射和植入小鼠和大鼠中进行了测试。在小鼠中,植入物诱发子宫颈子宫肿瘤,在某些情况下转移。有迹象表明,向某些雌性小鼠体内注射睾丸激素会增加其对肝癌的敏感性。还已知睾丸激素会增加大鼠的肿瘤数量并降低化学诱导的肝癌的分化程度。
诱变
在体外Ames和体内小鼠微核试验中,睾丸激素呈阴性。
生育能力受损
据报道,外源性睾丸激素的给药可抑制大鼠,狗和非人灵长类动物的精子发生,这种精子生成在停止治疗时是可逆的。
14.临床研究
。睾丸激素替代疗法
Natesto在306名性腺功能减退男性的90天开放标签多中心研究中进行了疗效评估。符合条件的患者为18岁及以上(平均年龄54岁),并且早晨血清总睾丸激素浓度低于300 ng / dL。患者为白种人(89%),非裔美国人(6%),亚裔(5%)或其他种族(少于1%)。
指示患者每天两次或三次鼻内自用Natesto(11 mg睾丸激素)。
主要终点是在第90天的平均血清总睾丸激素浓度(C avg )在正常范围(300至1050 ng / dL)之间的患者百分比。
次要终点是最大总睾丸激素浓度(C max )高于三个预定限值的患者百分比:大于1500 ng / dL,介于1800和2500 ng / dL之间以及大于2500 ng / dL。
共有78名性腺功能减退的男性每天接受Natesto(11 mg睾丸激素)3次(每天33 mg睾丸激素)。其中,共有73名性腺功能减退的男性被纳入90天的统计评估(总睾丸激素药代动力学),该评估基于意向性治疗(ITT)人群,并进行了最后观察(LOCF)。在第90天,这73名患者中有90%(90%)的C avg处于正常范围(300至1050 ng / dL)。C avg的患者百分比低于正常范围(小于300 ng / dL)和在第90天高于正常范围(大于1050 ng / dL)的分别为10%和0%。
表3总结了69名患者的平均(SD)总血清睾丸激素浓度,这些患者具有完整的药代动力学采样特征,每天接受Natesto(11 mg睾丸激素)治疗90天,共90天。
C avg =平均浓度; C max =最大浓度; C min =最小浓度。 | |
| 内斯托 (11睾丸激素) 每日三遍 (N = 69) | |
| 平均值(ng / dL) | 421(116) |
| 最大C(ng / dL) | 1044(378) |
| C min (ng / dL) | 215(74) |
C max大于1500 ng / dL且介于1800和2500 ng / dL之间的患者百分比分别为15.9%和1.4%。没有患者的C max大于2500 ng / dL。
16.供应/存储和处理方式
。供应方式
Natesto(睾丸激素)鼻凝胶可作为定量泵使用,其中包含11克凝胶,以60次定量泵促动分配。一泵致动可在0.122克凝胶中递送5.5毫克睾丸激素。
。存储
将Natesto放在儿童无法触及的地方。
存放在20°C至25°C(68°F至77°F)下。允许远足到15°C到30°C(59°F到86°F)。请参阅USP控制的室温。
。处理与处置
用过的Natesto分配器应以防止儿童或宠物意外暴露的方式丢弃在家庭垃圾中。
17.患者咨询信息
建议患者阅读FDA批准的患者标签(患者信息)。
用于已知或怀疑患有前列腺癌或乳腺癌的男性
患有已知或疑似前列腺癌或乳腺癌的男性不应使用Natesto [请参阅禁忌症( 4 )和警告与注意事项( 5.3 )] 。
鼻不良反应
Natesto的临床试验报告了鼻部不良反应,包括鼻咽炎,鼻漏,鼻出血,鼻部不适和鼻伤。劝告患者向其卫生保健专业人员报告任何鼻部症状或体征。
与雄激素的潜在不良反应
应告知患者用雄激素治疗可能导致不良反应,包括:
- 排尿习惯的改变,例如晚上排尿增多,尿流开始困难,白天排尿多次,敦促您必须立即去洗手间,发生尿液意外,无法排尿,以及尿流较弱。
- 呼吸障碍,包括与睡眠或白天过度嗜睡有关的呼吸障碍。
- 阴茎勃起次数过多或持续。
- 恶心,呕吐,肤色改变或脚踝肿胀。
应告知患者以下使用说明
- 阅读每个Natesto计量泵随附的患者信息。
- 在首次使用泵之前,先将其压下10次以注水。以后使用该泵无需灌注。
- 鼻内施用Nates,而不是身体其他部位。每天3次,每天一次,早晨一次,下午一次和晚上一次(间隔6至8个小时),最好每天在鼻腔内服用Natesto。
- 将Natesto放在儿童接触不到的地方。
- 报告其健康状况的任何变化,例如尿习惯,呼吸,睡眠,情绪,鼻腔刺激或鼻炎的变化。
- 切勿与任何人分享Natesto。
| 患者信息 Natesto(Na-tes-to)CIII (睾丸激素)鼻凝胶 | ||
什么是Natesto?
| ||
| 谁不应该使用Natesto? 如果您执行以下操作,请勿使用Natesto:
| ||
| 如果您具有上述任何条件,请在使用Natesto之前与您的医疗保健提供者联系。 | ||
使用Natesto之前,请告知您的医疗保健提供者所有您的医疗状况,包括是否您:
| ||
| 告知您的医疗保健提供者您所服用的所有药物,包括处方药和非处方药,维生素或草药补品。 将Natesto与某些其他药物一起使用可能会相互影响。尤其要告诉您的医疗保健提供者您是否服用: | ||
|
|
|
我应该如何使用Natesto?
| ||
Natesto可能有哪些副作用? Natesto可能会导致严重的副作用,包括:
| ||
| Call your healthcare provider right away if you have any of the serious side effects listed above. These are not all the possible side effects of Natesto.打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。 The most common side effects of Natesto include:
| ||
| Other side effects include more erections than normal for you or erections that last a long time. | ||
How should I store Natesto?
| ||
| General information about the safe and effective use of Natesto. | ||
| 有时出于患者信息手册中列出的目的以外的目的开出药物。 Do not use Natesto for a condition for which it was not prescribed. Do not give Natesto to other people, even if they have the same symptoms that you have.可能会伤害他们。 If you would like more information about Natesto, talk with your healthcare provider. You can ask your pharmacist or healthcare provider for information about Natesto that is written for health professionals. For more information go to www.natesto.com or call 1-855-298-8246. | ||
| What are the ingredients in Natesto? Active ingredient: testosterone Inactive ingredients: castor oil, oleoyl polyoxylglycerides, and colloidal silicon dioxide Marketed by: Aytu BioScience, Inc., Englewood, CO 80112 Manufactured by: Haupt Pharma Amareg GmbH, Donaustaufer Str. 378, Regensburg, Bavaria D-93055, Germany | ||
Instructions for Use
Natesto (Na-tes-to)
CIII (testosterone)
nasal gel
Supplies needed to give your Natesto dose:
- 1 Natesto dispenser
- 2 clean, dry tissues
- a clean and flat surface, like a table
- a mirror
Parts of your Natesto dispenser (See Figure A )
 |
| (图A) |
Information about your Natesto:
- Do not blow your nose or sniff for 1 hour after using Natesto.
- Before you use Natesto for the first time, you will need to prime your Natesto pump.
How to prime your Natesto pump:
- Hold your Natesto dispenser over a sink, turn it upside down (invert) and slowly press the pump and release 10 times (See Figure B ).
 |
| (图B) |
- All the Natesto that comes out when you prime your pump should be rinsed down the sink with warm water.
- If there is any Natesto on the tip of your Natesto actuator after priming, wipe the tip with a clean, dry tissue.
- If any Natesto gel gets on your hands, it is recommended to wash your hands with warm water and soap.
Giving your Natesto dose:
Step 1: Blow your nose.
Step 2: Remove the Natesto cap.
Step 3: While looking in the mirror, put your right first (index) finger on the pump of your Natesto actuator and slowly slide the tip of the actuator up into your left nostril until your finger on the pump touches the bottom of your nose (See Figure C ).
 |
| (Figure C) |
Step 4: Gently tilt the Natesto actuator so that the hole in the tip touches the lateral (side) wall of your nostril. This will make sure that Natesto is given in the correct place (See Figure D ).
 |
| (Figure D) |
Step 5: With the actuator in place, slowly push the pump down until it stops and remove the actuator from your nose.
Step 6: While looking in the mirror, put your left first (index) finger on the pump of your Natesto actuator and slowly slide the tip of the actuator up into your right nostril until your finger on the pump touches the bottom of your nose (See Figure E ).
 |
| (Figure E) |
Step 7: Gently tilt the tip of the Natesto actuator so that the hole in the tip touches the lateral (side) wall of your nostril. This will make sure that Natesto is given in the correct place (See Figure F ).
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 中度潜在滥用
- 审批历史 FDA的药物史
- 世界反兴奋剂机构 反兴奋剂分类
美国日本医生

Heather Benjamin MD

Heather Benjamin MD

Suzanne Reitz MD

Heather Miske DO

Heather Miske DO

渡邊剛

渡邊剛

渡邊剛

宮崎総一郎 中部大学特聘教授

百村伸一 教授
临床试验
- 不同剂量的SY-004在2型糖尿病患者中的功效和安全性
- 现代疗法治疗的癌症患者的血液,唾液和尿液的拉曼光谱的临床研究
- 曲妥珠单抗生物仿制药(Samfenet®)加上HER2阳性实体瘤(BIOS-HER)患者的医师选择(TPC)的治疗
- Anlotinib与肝细胞癌患者的TACE结合了手术后复发的高风险(Alter-H-004)
- Toripalimab加lenvatinib作为晚期胆道癌的二线治疗
- 比较HCC高风险的CEU和EOB-MRI的诊断效率
- Sonazoid-Ceus和EOB-MRI的诊断效率对HCC高风险的患者
- MGD013单一治疗和与晚期肝癌患者的Brivanib剂量升级和扩张研究的结合
- 用TAF与TDF进行母体治疗,以防止肝炎的垂直传播
- PLX038(Pegypated SN38)和鲁卡帕里(Rucaparib)在实体瘤和小细胞癌中



