获取国外Actiq药品价格,使用等信息,最快 24 小时回馈
Actiq
什么是Actiq?
Actiq(柠檬酸芬太尼)是一种阿片类止痛药,有时也称为麻醉药。
Actiq治疗不受其他药物控制的“突破性”癌症疼痛。该药物不适用于治疗与癌症无关的疼痛,例如偏头痛或手术后的疼痛。
Actiq也可用于本用药指南中未列出的目的。
重要信息
Actiq会减慢或停止您的呼吸,并且可能会养成习惯。仅使用您规定的剂量。切勿与他人共享此药。
滥用ACTIQ可能会导致死亡,尤其是在握住Actiq装置并将其放入口中的孩子中。将此药物放在儿童接触不到的地方。
在怀孕期间使用这种药物可能会导致新生儿危及生命的戒断症状。
如果将这种药物与酒精或其他引起嗜睡或呼吸缓慢的药物一起使用,可能会导致致命的副作用。
在服药之前
如果您对芬太尼过敏,或者尚未接受类似的阿片类(麻醉性)止痛药治疗并且对它耐受,则不要使用Actiq。请勿将Actiq单位交给没有该药个人处方的任何人。
为确保该药对您安全,请告知您的医生是否曾经:
呼吸困难,睡眠呼吸暂停;
头部受伤,脑瘤或精神疾病;
酗酒或吸毒;
癫痫发作;
肝脏或肾脏疾病;要么
血压低,心脏病,心律缓慢。
未批准Actiq被16岁以下的任何人使用。
如果您在怀孕期间使用Actiq,则婴儿可能会依赖该药物。这可能会导致婴儿出生后危及生命的戒断症状。依赖习惯养成药物出生的婴儿可能需要数周的医疗。
芬太尼可能会进入母乳,并可能引起哺乳婴儿的困倦或呼吸问题。芬太尼还可能引起哺乳婴儿戒断症状。使用Actiq时请勿母乳喂养。
我应该如何使用Actiq?
严格按照规定使用Actiq。遵循处方标签上的所有指示。切勿大量使用该药物,或使用时间长于处方。告诉您的医生该药在缓解疼痛方面是否也似乎停止起作用。
芬太尼可能会形成习惯。切勿与他人(尤其是有吸毒或成瘾史的人)共享这种药物。将药物放在其他人无法获得的地方。出售或赠送这种药是违法的。
芬太尼可以减慢或停止呼吸。滥用ACTIQ可能会导致死亡,尤其是在握住Actiq装置并将其放入口中的孩子中。使用这种药物之前,请仔细阅读所有患者说明。
Actiq透粘膜单位是附着在塑料手柄上的柠檬酸芬太尼锭剂。每个单元都包装在防儿童的泡罩包装中。准备使用单元时,请用剪刀将泡罩包装切开。
将药物放在脸颊和牙龈之间的口腔中,然后用手指握住手柄。旋转手柄以在吸吮时在您的嘴中移动药物。
让药物在您的口腔中溶解15分钟。必要时吞下。不要咬或咀嚼锭剂。本机在嘴里时请勿进食或喝任何东西。如果需要使用第二台设备,请在完成第一台设备后至少等待15分钟。一次仅使用1个Actiq设备。
如果您在药物完全溶解之前感到头晕或胃不适,请停止使用该装置并致电医生。
不要停止使用医生为您开的其他止痛药。
如果您从使用Actiq切换为使用其他形式的芬太尼,则将不会使用相同剂量。许多形式的芬太尼以比Actiq更低的剂量给予。如果每种药物使用相同剂量,可能会出现威胁生命的过量症状。
要特别注意您的牙齿卫生。 Actiq会引起口干,导致蛀牙。
不要突然停止使用芬太尼,否则可能会有不愉快的戒断症状。询问您的医生如何安全地停止使用这种药物。
存放在室温下,远离湿气和热源。将每个单元放在防儿童的泡罩包装中,直到可以使用为止。
跟踪您的药物。柠檬酸芬太尼是一种滥用药物,您应该知道是否有人使用药物不当或未开处方。
将使用过的和未使用的Actiq设备都放在儿童或宠物够不到的地方。 Actiq装置中的柠檬酸芬太尼含量可能会对意外吮吸或吞咽该装置的孩子致命。如果发生这种情况,请寻求紧急医疗救助。
Actiq随附用于存储和处置Actiq单元的套件和说明。
不要保留剩余的阿片类药物。仅一剂就可能导致使用该药的人意外或不当死亡。询问您的药剂师在哪里可以找到药物回收处置计划。如果没有回收计划,则在处置未使用的药物时请遵循Actiq随附的说明。
如果我错过剂量怎么办?
由于Actiq用于止痛,因此您不太可能会错过剂量。如果快到下一次预定的剂量了,就跳过任何错过的剂量。不要使用多余的药物来弥补错过的剂量。
如果我服药过量怎么办?
寻求紧急医疗护理或致电1-800-222-1222,拨打毒药帮助热线。过量服用芬太尼可能会致命,尤其是对于未处方使用药物的儿童或其他人。服药过量的症状可能包括呼吸缓慢和心跳加快,严重的嗜睡,肌肉无力,皮肤发凉和发粘,瞳孔缩小以及昏厥。
使用Actiq时应避免什么?
不要喝酒。可能发生危险的副作用或死亡。
除非您知道这种药会如何影响您,否则请避免驾驶或操作机械。头晕或严重嗜睡会导致跌倒或其他事故。
葡萄柚和葡萄柚汁可能会与芬太尼相互作用,并导致不良的副作用。与医生讨论如何使用柚子产品。
Actiq副作用
如果您对Actiq有过敏反应,请寻求紧急医疗救助。呼吸困难;脸,嘴唇,舌头或喉咙肿胀。
像其他麻醉药品一样,芬太尼可以减缓您的呼吸。如果呼吸太弱,可能会导致死亡。
从您的嘴中取出Actiq装置,如果有以下情况,请立即致电医生:
心律缓慢,叹气,浅呼吸,睡眠中停止的呼吸;
严重的睡意,觉得你可能会昏倒;
在药物完全溶解之前出现头晕或胃部不适;
混乱,极端恐惧,不寻常的思想或行为;要么
皮质醇水平低-恶心,呕吐,食欲不振,头晕,疲倦或无力加重。
如果您有5-羟色胺综合征的症状,请立即就医,例如:躁动,幻觉,发烧,出汗,发抖,心跳加快,肌肉僵硬,抽搐,失去协调能力,恶心,呕吐或腹泻。
老年人和超重,营养不良或虚弱的人更可能出现严重的副作用。
长期使用阿片类药物可能会影响男性或女性的生育能力(生育能力)。尚不知道阿片类药物对生育能力的影响是否持久。
常见的Actiq副作用可能包括:
头晕,轻度嗜睡,情绪低落;
睡眠问题(失眠);
头痛,无力,焦虑;
恶心,呕吐,便秘;要么
轻度皮疹。
这不是副作用的完整列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响Actiq?
有些药物可以升高或降低血液中的芬太尼水平,这可能会引起副作用或使Actiq无效。告诉医生您是否还使用某些抗生素,抗真菌药物,心脏或血压药物或治疗HIV或AIDS的药物。
芬太尼可与许多其他药物相互作用并引起危险的副作用或死亡。确保您的医生知道您是否还使用:
其他麻醉药-阿片类止痛药或处方止咳药;
镇静剂,如安定-地西epa,阿普唑仑,劳拉西m,Ativan,克洛诺平,Restoril,Tranxene,Versed,Xanax等;
使您昏昏欲睡或呼吸困难的药物-安眠药,肌肉松弛剂,镇定剂,抗抑郁药或抗精神病药;
影响体内血清素水平的药物-抑郁症,帕金森氏病,偏头痛,严重感染或预防恶心和呕吐的药物。
此列表不完整。其他药物可能与芬太尼相互作用,包括处方药和非处方药,维生素和草药产品。本药物指南中并未列出所有可能的相互作用。
版权所有1996-2020 Cerner Multum,Inc.版本:8.01。
注意:本文档包含有关芬太尼的副作用信息。此页面上列出的某些剂型可能不适用于Actiq品牌。
综上所述
Actiq的常见副作用包括:呼吸抑制。有关不良影响的完整列表,请参见下文。
对于消费者
适用于芬太尼:锭剂/锭剂,喷雾剂,片剂
其他剂型:
- 注射液
- 鼻喷雾剂
- 透皮贴剂辅助,透皮贴剂缓释
警告
舌下途径(喷雾)
警告:危及生命的呼吸抑制,意外摄入;细胞色素P450 3A4相互作用;与苯二氮卓类或其他中枢神经系统抑制剂并用的风险;用药错误的风险;上瘾,滥用和滥用; REMS;和新生儿阿片类药物戒断综合征发生严重,威胁生命和/或致命的呼吸抑制。密切监视,尤其是在开始或增加剂量后。由于致命的呼吸抑制风险,在非阿片类药物耐受性患者以及急性或术后疼痛(包括头痛/偏头痛)的治疗中禁忌使用芬太尼舌下喷雾剂,误服芬太尼舌下喷雾剂(尤其是儿童)可能导致致命性过量服用芬太尼。请将本品放在儿童不能接触的地方。确保适当的存储和处置与CYP3A4抑制剂同时使用(或终止CYP3A4诱导剂)会导致致命的过量芬太尼过量的阿片类药物与苯二氮卓类或其他中枢神经系统抑制剂一起使用,包括酒精可能会导致严重的镇静,呼吸抑制,昏迷和死亡。保留相应的处方,以供其他治疗选择不足的患者使用;将剂量和持续时间限制在所需的最低限度,并根据患者的呼吸抑制和镇静症状和体征进行处方。在处方时,请勿将患者以mcg / mcg的剂量从任何其他经口粘膜芬太尼产品转换为芬太尼舌下喷雾剂。芬太尼舌下喷雾剂会使使用者面临成瘾,滥用和误用的风险,这可能导致用药过量和死亡。在开处方并定期监测这些行为和状况之前评估患者的风险。芬太尼舌下喷剂只能通过称为TIRF REMS Access程序的受限程序使用。门诊,药房和分销商开出的门诊医生,医疗专业人员必须参加该计划。怀孕期间长时间使用芬太尼舌下喷剂可能会导致新生儿阿片类药物戒断综合征,如果不加以认可和治疗,可能会危及生命。如果孕妇需要长时间使用阿片类药物,请告知患者新生儿阿片类药物戒断综合征的风险,并确保可获得适当的治疗。
颊粘膜途径(电影;锭剂/锭剂;片剂)
由于存在致命的呼吸抑制的危险,因此阿片类非耐受性患者以及包括头痛/偏头痛在内的急性或术后疼痛的治疗均禁止使用透粘膜柠檬酸芬太尼柠檬酸盐。在治疗期间监测呼吸抑制。意外摄入芬太尼可能导致致命的过量服用,尤其是在儿童中;请将本品放在儿童不能接触的地方。与CYP3A4抑制剂或诱导剂一起使用可能会改变芬太尼的血浆水平,导致致命的过量芬太尼过量,建议进行监测。阿片类药物与苯二氮卓类或其他中枢神经系统抑制剂(包括酒精)并用可能会导致严重的镇静,呼吸抑制,昏迷和死亡。对于没有足够的替代治疗选择的患者,应预留相应的处方,将剂量和持续时间限制在所需的最低限度,并监测呼吸抑制和镇静作用。开处方时,请勿将患者从其他任何芬太尼产品中以每mcg为基础转换为mcg。分配时,请勿用任何其他芬太尼产品替代。芬太尼是一种附表II受控物质,具有与其他阿片类镇痛药相似的滥用责任。在开始治疗之前评估风险,并监测治疗期间滥用,滥用和成瘾的迹象。仅可通过称为透粘膜即时释放芬太尼风险评估和缓解策略(TIRF REMS)访问程序的受限制程序获得。要求门诊病人,药房和分销商开处方的门诊病人,医疗保健专业人员。怀孕期间长时间使用可能会导致新生儿阿片戒断综合征。如果孕妇需要长时间使用,请告知患者潜在的胎儿风险并确保可获得适当的治疗。
舌下途径(平板电脑)
由于致命的呼吸抑制危险,阿片类非耐受性患者以及急性或术后疼痛(包括头痛/偏头痛)的治疗均禁止使用舌下柠檬酸芬太尼。在治疗期间监测呼吸抑制。意外摄入芬太尼可能导致致命的过量服用,尤其是在儿童中;请将本品放在儿童不能接触的地方。与CYP3A4抑制剂或诱导剂一起使用可能会改变芬太尼的血浆水平,导致致命的剂量过量,建议进行监测。阿片类药物与苯二氮卓类或其他中枢神经系统抑制剂(包括酒精)并用可能会导致严重的镇静,呼吸抑制,昏迷和死亡。对于没有足够的替代治疗选择的患者,应预留相应的处方,将剂量和持续时间限制在所需的最低限度,并监测呼吸抑制和镇静作用。开处方时,请勿将患者从其他任何芬太尼产品中以每mcg为基础转换为mcg。分配时,请勿用任何其他芬太尼产品替代。芬太尼是一种附表II受控物质,具有与其他阿片类镇痛药相似的滥用责任。在开始治疗之前评估风险,并监测治疗期间滥用,滥用和成瘾的迹象。仅可通过称为透粘膜即时释放芬太尼风险评估和缓解策略(TIRF REMS)访问程序的受限制程序获得。要求门诊病人,药房和分销商开处方的门诊病人,医疗保健专业人员。怀孕期间长时间使用可能会导致新生儿阿片戒断综合征。如果孕妇需要长时间使用,请告知患者潜在的胎儿风险并确保可获得适当的治疗。
需要立即就医的副作用
除其所需的作用外,芬太尼(Actiq中包含的活性成分)可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用芬太尼时,如果有下列任何副作用,请立即与医生联系:
比较普遍;普遍上
- 黑色柏油凳
- 模糊的视野
- 胸痛
- 混乱
- 抽搐
- 咳嗽
- 尿量减少
- 呼吸困难或劳累
- 头晕
- 口干
- 晕倒
- 发烧或发冷
- 口渴
- 心律不齐
- 头昏眼花
- 食欲不振
- 下背部或侧面疼痛
- 情绪变化
- 肌肉疼痛或抽筋
- 恶心或呕吐
- 紧张
- 手,脚或嘴唇麻木或刺痛
- 排尿困难或困难
- 皮肤苍白
- 敲打耳朵
- 快速呼吸
- 打喷嚏
- 咽喉痛
- 凹陷的眼睛
- 手,脚踝,脚或小腿肿胀
- 胸闷
- 劳累呼吸困难
- 口腔溃疡,疮或白斑
- 异常出血或瘀伤
- 异常疲倦或虚弱
- 皱纹的皮肤
不常见
- 腹部或胃痛
- 步行和平衡变化
- 笨拙或不稳定
- 意识或反应能力下降
- 排尿次数减少
- 头痛
- 肌肉抽搐或抽搐
- 敲打耳朵
- 肌肉的节奏运动
- 看到,听到或感觉不到的东西
- 癫痫发作
- 严重便秘
- 严重嗜睡
- 腿,手臂,手或脚的晃动
- 缓慢或快速的心跳
- 思维异常
- 手或脚颤抖或颤抖
如果服用芬太尼时出现以下任何过量症状,请立即寻求紧急帮助:
服用过量的症状
- 呼吸极浅或缓慢
不需要立即就医的副作用
芬太尼可能会产生某些副作用,通常不需要医治。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 背疼
- 腹泻
- 排便困难(凳子)
- 移动困难
- 灰心
- 感到悲伤或空虚
- 易怒
- 力量不足或丧失
- 失去兴趣或愉悦
- 肌肉僵硬
- 关节疼痛
- 嗜睡或异常嗜睡
- 疲倦
- 麻烦集中
- 睡眠困难
- 减肥
不常见
- 视力变化
- 肌肉过度紧张
- 自我或周围环境不断运动的感觉
- 温暖或热的感觉
- 皮肤潮红或发红,尤其是在脸部和颈部
- 使用部位的刺激,疼痛或疮
- 皮肤瘙痒
- 肌肉紧张或紧绷
- 皮疹
- 旋转感
- 出汗
发病率未知
- 牙疼
- 牙龈不适
- 牙齿麻烦
对于医疗保健专业人员
适用于芬太尼:颊膜,颊片,复方散剂,注射液,静脉内溶液,鼻喷雾剂,口服锭剂,口服透粘膜锭剂,舌下喷雾剂,舌下片剂,经皮装置,经皮薄膜缓释
一般
最常见的不良反应包括头痛,恶心,呕吐,头晕和便秘。 [参考]
神经系统
很常见(10%或更多):嗜睡,头晕
常见(1%至10%):镇静,发热,疲劳,嗜睡,震颤,头痛,发冷,烦躁,不适,精神错乱,思维异常,焦虑,烦躁不安
罕见(0.1%至1%):感觉过敏
非常罕见(少于0.01%):严重偏瘫性偏头痛
未报告的频率:口齿不清,感觉异常,感觉异常,震颤
上市后报告:意识丧失,眩晕,昏迷,休克,抽搐[Ref]
偶尔有癫痫发作的报道,但一些研究者建议,报道的癫痫样事件可能是芬太尼引起的僵硬发作。 [参考]
心血管的
常见(1%至10%):心动过速
罕见(0.1%至1%):窦性心动过速,胸痛,高血压,低血压,心
罕见(少于0.1%):心律不齐,心脏骤停
未报告频率:晕厥,血管舒张,心动过缓,重婚,心肌梗塞
上市后报告:循环性抑郁症[参考]
一项报告表明,由于其他原因,硬膜外芬太尼可能掩盖了接受芬太尼治疗的患者的心肌缺血性疼痛。另一报告提示某些接受相关麻醉药舒芬太尼的患者可能发生QTc间隔延长。另一个报告暗示芬太尼可能是主动脉瓣狭窄和充血性心力衰竭患者发生脉动交替的潜在原因。
然而,芬太尼已被一些人主张为冠状动脉手术的令人满意的药物。 [参考]
胃肠道
非常常见(10%或更多):恶心(18%),呕吐(10%),便秘
常见(1%至10%):口干,腹胀,胃炎,吞咽困难,消化不良,胃食管反流病,腹水,呕血,味觉变态,腹痛,脱水,厌食,恶病质,呕吐,口干,口腔溃疡/口腔炎,舌头浮肿
罕见(0.1%至1%):腹部膨大,肠胃胀气
罕见(少于0.1%):胆管十二指肠括约肌痉挛
未报告频率:腹泻
上市后报告:肠梗阻,龋齿,牙齿脱落,牙龈萎缩,牙龈炎,牙龈出血,嘴唇浮肿,咽水肿,牙龈出血,溃疡[参考]
泌尿生殖
罕见(0.1%至1%):尿retention留
非常稀有(少于0.01%):暴行
未报告频率:尿路感染,排尿障碍,血尿,尿急,排尿困难[参考]
皮肤科
非常常见(10%或更多):离子电渗透皮系统:应用部位反应-红斑(14%)
常见(1%至10%):应用部位刺激,瘙痒
罕见(0.1%至1%):多汗症,皮疹
罕见(少于0.1%):全身性皮疹
未报告的频率:囊泡,丘疹/脓疱,皮肤干燥和剥落,囊泡性皮疹伤口部位渗血/出血,伤口部位炎症/红斑
上市后报告:应用部位排出,应用部位出血,应用部位感染,皮疹和结ab,糜烂,感觉异常,应用部位坏死[参考]
去除离子电渗透皮系统后24小时,约60%的患者皮肤部位出现红肿。多数皮肤事件分类为轻度,红斑和丘疹。 2例患者在应用部位色素沉着持续2至3周; 3名患者在应用部位出现矩形标记,并持续了3个月。 [参考]
过敏症
稀有(小于0.1%):过敏[参考]
血液学
观察到的溶血可能与大量低渗的芬太尼(Actiq中包含的活性成分)溶液的快速注射有关。因此,作者建议降低等渗液中的注射速度和/或混合速度。 [参考]
常见(1%至10%):贫血,中性粒细胞减少,淋巴结病,血小板减少,白细胞减少,天冬氨酸转氨酶升高,血碱性磷酸酶升高,血糖升高,血液乳酸升高,白蛋白血症,血管舒张[参考]
免疫学的
罕见(0.1%至1%):口腔念珠菌病,蜂窝组织炎,肺炎,尿路感染,口腔疱疹,肠胃炎,喉炎
非常罕见(少于0.01%):硬膜外给药后复发性单纯疱疹感染[参考]
新陈代谢
常见(1%至10%):乏力,周围水肿,体重减轻,低钾血症,低钠血症,低钙血症
非常罕见(少于0.01%):抗利尿激素不当综合征
未报告频率:异常愈合,脱水[参考]
内分泌
罕见(0.1%至1%):冲洗[参考]
肌肉骨骼
常见(1%至10%):跌倒/意外伤害,背痛,关节痛,关节肿胀,肌肉无力,肌阵挛,不自主的肌肉收缩,肌肉僵硬(涉及包括呼吸道在内的呼吸肌组织)
未报告频率:腿抽筋,肌痛
上市后报告:步态/协调异常[参考]
眼科
罕见(0.1%至1%):视力模糊,干眼
稀有(小于0.1%):视力异常[参考]
精神科
常见(1%至10%):抑郁,精神错乱,幻觉,失眠
罕见(0.1%至1%):焦虑,烦躁,躁动,躁动,神志不清,异常的梦,人格解体,抑郁,情绪低落,欣快,del妄
未报告频率:紧张[参考]
呼吸道
常见(1%至10%):呼吸困难,鼻炎,打哈欠,呼吸窘迫,呼吸暂停,呼吸缓慢,通气不足,呼吸抑制
罕见(0.1%至1%):咳嗽,支气管分泌增加,发声困难,咽喉痛,喘息,缺氧,劳累性呼吸困难
非常罕见(少于0.01%):急性非心源性肺水肿
未报告频率:哮喘,打ic,肺不张,换气过度
上市后报告:呼吸停止[参考]
参考文献
1.“产品信息。Ionsys(芬太尼)。” Ortho McNeil Pharmaceutical,新泽西州Raritan。
2. Weinger MB,Swerdlow NR,Millar WL“先前健康的产后急性Ac妄和锥体外系体征。” Anesth Analg 67(1988):291-5
3. Goroszeniuk T,Albin M,Jones RM“从简单的芬太尼-依托咪酯麻醉中恢复后的全身性大发作。” Anesth Analg 65(1986):979-81
4. Noble DW,Morrison LM,Brockway MS,Mcclure JH“硬膜外芬太尼后的呼吸抑制”。 Br J Anaesth 72(1994):251
5. Palmer CM“鞘内注射芬太尼-吗啡后,早期呼吸抑制”。麻醉学74(1991):1153-5
6. Smith NT,Benthuysen JL,Bickford RG,Sanford TJ,Blasco T,Duke PC,N头,Dec-Silver H“阿片类药物麻醉诱导期间发作–它们是阿片类药物诱导的刚性吗?”麻醉学71(1989):852-62
7. Sebel PS,Bovill JG,“芬太尼和抽搐”。 Anesth Analg 62(1983):858-9
8. Cerner Multum,Inc.“英国产品特性摘要”。 00
9. Rao TL,Mummaneni N,El-Etr AA“抽搐:对静脉注射芬太尼的异常反应。” Anesth Analg 61(1982):1020-1
10. Eisenach JC“鞘内阿片类药物引起的呼吸抑制”。麻醉学75(1991):712
11. Bernstein KJ,Klausner MA,“用于术后疼痛的与透皮芬太尼(duragesic(r))有关的潜在危险。” Dis Colon Rectum 37(1994):1339-40
12. Comstock MK,Carter JG,Moyers JR,Stevens WC“与高剂量芬太尼诱导麻醉相关的刚性和高碳酸血症”。 Anesth Analg 60(1981):362-3
13.丹尼尔·D·萨夫瓦特(Safwat AM),“服用芬太尼后出现巨大的癫痫发作”。麻醉学59(1983):78
14. Mirenda J,Tabatabai M,Wong K“大剂量芬太尼麻醉后,僵硬和延长的硬度大于24小时。”麻醉学69(1988):624-5
15. Crawford RD,Baskoff JD“与芬太尼有关的man妄。”麻醉学53(1980):168-9
16. Sandler AN,Baxter AD,Katz J,Samson B,Friedlander M,Norman P,Koren G,Roger S,Hull K,KleinJ。呼吸和药代动力学作用。”麻醉学81(1994):1169-80
17. Jackson FW“芬太尼和木箱。”胃肠病学106(1994):820-1
18. Benthuysen JL,Stanley TH“关于已报告的芬太尼癫痫发作的可能性质。”麻醉学62(1985):205
19. Varrassi G,Celleno D,Capogna G等。 “蛛网膜下腔芬太尼对老年人的通气作用。”麻醉47(1992):558-62
20. Arandia HY,Patil VU“大剂量芬太尼后声门闭合。”麻醉学66(1987):574-5
21. Streisand JB,Bailey PL,LeMaire L,MA Ashburn,Tarver SD,Varvel J,Stanley TH“芬太尼诱导的人类志愿者僵化和意识丧失。发病率,持续时间和血浆浓度。”麻醉学78(1993):629-34
22. Harper MH,Hickey RF,Cromwell TH,Linwood S“芬太尼和芬太尼加氟哌啶对人的呼吸抑制作用的程度和持续时间。” Pharmacol Exp Ther 199(1976):464-8
23. Gil-Gouveia R,宾夕法尼亚州威尔金森,Kaube H:“用于食管胃镜检查的芬太尼镇静引起的严重偏瘫偏头痛发作。”神经学63(2004):2446-7
24. Steinberg RB,Gilman DE,Johnson F,3d“使用透皮芬太尼治疗的患者的急性毒性del妄。” Anesth Analg 75(1992):1014-6
25. Hoien AO“服用芬太尼后发生的另一例重大癫痫发作”。麻醉学60(1984):387-8
26. Brockway MS,Noble DW,Sharwood-Smith GH,McClure JH,“硬膜外芬太尼后严重呼吸抑制。” Br J Anaesth 64(1990):243-5
27. Hays LR,Stillner V,Littrell R“与口服摄入有关的芬太尼依赖性”。麻醉学77(1992):819-20
28. Blair JR,Pruett JK,Crumrine RS,Balser JJ“延长QT间隔与大剂量鸦片的给药有关”。麻醉学67(1987):442-3
29. Oden RV,卡拉贾内斯TG“术后心肌缺血可能被硬膜外芬太尼镇痛所掩盖。”麻醉学74(1991):941-3
30. Freeman AB,Steinbrook RA“芬太尼注射后,主动脉瓣狭窄和充血性心力衰竭患者的脉搏交替发生复发。” Can Anaesth Soc J 32(1985):654-7
31. Sebel PS,Bovill JG,Boekhorst RA,Rog N“大剂量芬太尼麻醉的心血管作用”。麻醉麻醉学报(26)(1982):308-15
32. Hilgenberg JC,Johantgen WC“蛛网膜下腔麻醉期间静脉注射芬太尼后心动过缓”。 Anesth Analg 59(1980):162-3
33. Sosis M“芬太尼和呕吐”。 Can Anaesth Soc J 32(1985):314-5
34. Gaskey NJ,Ferriero L,Pournaras L,Seecof J“使用芬太尼明显增加了妇科短期住院患者的恶心和呕吐。” AANA J 54(1986):309-11
35. White MJ,Berghausen EJ,Dumont SW,Tsueda K,Schroeder JA,Vogel RL,Heine MF,Huang KC“连续硬膜外输注吗啡和芬太尼时的副作用”。 Can J Anaesth 39(1992):576-82
36. McCammon RL,Viegas OJ,Stoelting RK,Dryden GE“与麻醉药相关的纳洛酮逆转了胆总管十二指肠括约肌痉挛。”麻醉学48(1978):437
37.“ Multum Information Services,Inc.专家评审小组”
38. Chin JL,Sharpe JR,“精神分裂症和麻醉:新的考虑”。乌克兰杂志130(1983):371
39. Stoukides CA,Stegman M“与透皮芬太尼相关的弥漫性皮疹。”临床药物11(1992):222
40. Bennett MJ,Anderson LK,McMillan JC,Ebertz JM,Hanifin JM,Hirshman CA“麻醉期间与芬太尼皮内皮肤试验阳性有关的过敏反应。” Can Anaesth Soc J 33(1986):75-8
41. Zucker-Pinchoff B,Ramanathan S“对硬膜外芬太尼的过敏反应。”麻醉学71(1989):599-601
42. Furuya H,Okumura F“大剂量芬太尼给药后的溶血作用”。 Anesth Analg 65(1986):207-8
43. Valley MA,Bourke DL,McKenzie AM“接受硬膜外芬太尼治疗的患者的胸,唇单纯疱疹病毒感染复发。”麻醉学76(1992):1056-7
44. Kokko H,PD馆,Afrin LB“抗利尿激素分泌不当的芬太尼相关综合征”。药物疗法22(2002):1188-92
45. Soto J,Sacristan JA,Alsar MJ“由于芬太尼引起的肺水肿?”。麻醉47(1992):913-4
46. Ananthanarayan C“芬太尼的令人讨厌的效果”。麻醉45(1990):595
47. Bohrer H,Fleischer F,Werning P“通过中央静脉导管施用的芬太尼推注的药效”。麻醉45(1990):18-21
48. Phua WT,Teh BT,Jong W,Lee TL,Tweed WA“芬太尼大剂量的推翻效果”。 Can J Anaesth 38(1991):330-4
49. Tweed WA,Dakin D:“大剂量注射芬太尼后出现爆炸性咳嗽。” Anesth Analg 92(2001):1442-3
某些副作用可能没有报道。您可以将其报告给FDA。
剂量滴定
从初始剂量开始,密切跟踪患者并改变剂量强度,直到患者达到每例突破性癌症疼痛发作使用单一ACTIQ剂量单位即可提供足够镇痛作用的剂量。如果在服用该类药物之前出现了阿片类药物作用过度的迹象,应立即从患者的口腔中取出该剂量单位,并妥善处置,并应减少后续剂量。患者应记录自己在几次突破性癌症疼痛发作中对ACTIQ的使用情况,并与他们的医生一起回顾经验以确定是否需要调整剂量。
如果ACTIQ装置完成后15分钟(该装置开始后30分钟)不能缓解突破性疼痛发作,则患者在该发作中仅可再服用一剂相同强度的药物。因此,对于任何突破性疼痛发作,患者最多应服用两剂ACTIQ。
患者必须至少等待4个小时才能使用ACTIQ治疗另一例发作性疼痛。为了降低滴定期间用药过量的风险,患者在任何时候都只能使用一种ACTIQ浓度。
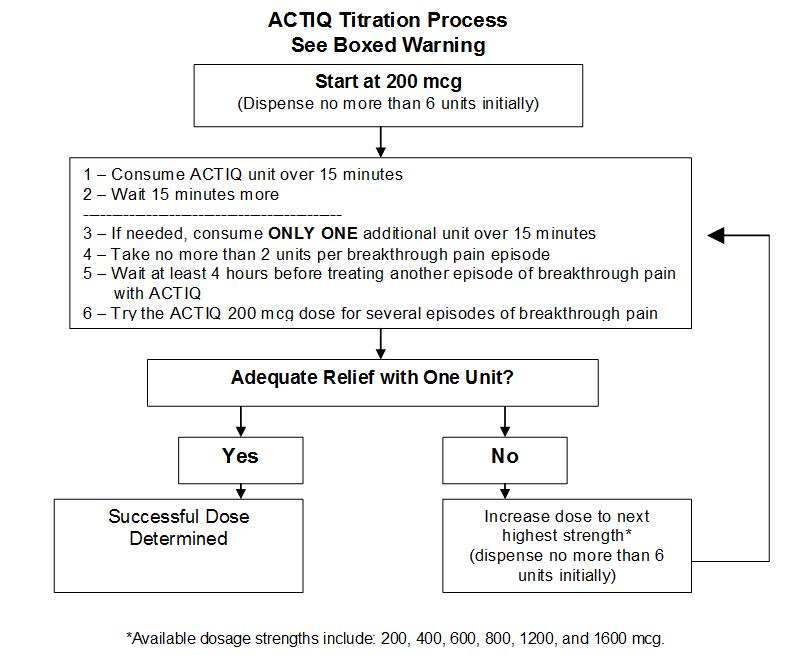
维护剂量
- 滴定至有效剂量后,患者通常应在每次突破性疼痛发作时仅使用一个具有适当强度的ACTIQ单位。
- 在ACTIQ装置完成15分钟后突破性疼痛发作仍未缓解的情况下,患者仅可使用相同剂量的另一剂量服药。
- 患者必须至少等待4个小时,才能使用ACTIQ治疗另一例发作性疼痛。一旦找到成功的剂量(即,平均发作用一个单位治疗),患者应将每天的消耗量限制在四个或更少的单位。
- 在某些患者中可能需要调整ACTIQ的剂量,以继续缓解突痛。
- 通常,仅当单次给药当前剂量未能连续数次连续治疗突破性疼痛发作时,才应增加ACTIQ剂量。
- 如果患者每天经历超过四次突破性疼痛发作,则应重新评估用于持续性疼痛的维持性(全天候)阿片类药物的剂量。
ACTIQ的管理
在使用产品之前,立即用剪刀打开泡罩包装。患者应将ACTIQ装置放在他的或她的口中的脸颊和下部牙龈之间,偶尔使用手柄将药物基质从一侧移到另一侧。 ACTIQ单元应被吸住,而不要咀嚼。如果咀嚼和吞咽,单位剂量的ACTIQ可能会导致其峰值浓度和生物利用度低于按指示食用时的浓度[见临床药理学(12.3)] 。
ACTIQ单位应在15分钟内消耗掉。更长或更短的食用时间可能比ACTIQ临床试验中报道的疗效更差。如果在食用该装置之前出现了阿片类药物作用过度的迹象,请立即从患者的口腔中取出药物基质,并减少以后的剂量。
终止ACTIQ
当不再需要阿片类药物治疗时,请考虑停用ACTIQ并逐渐减少其他阿片类药物的剂量(滴定),以最大程度地减少可能的戒断效果。对于继续接受慢性阿片类药物治疗而引起的持续性疼痛,但不再需要突破性疼痛的患者,通常可以立即停用ACTIQ治疗。 [请参阅药物滥用和依赖性(9.3)]
处置ACTIQ
设备消耗完并且基质完全溶解后,将手柄丢入儿童无法触及的垃圾容器中。
- 如果手柄上残留有任何药物基质,请将手柄放在热自来水下,直到所有药物基质溶解,然后将手柄放在儿童接触不到的地方。
- 每天至少一次将手柄放入儿童安全容器中(如步骤1和2中所述)。
如果有作为ACTIQ儿童安全工具包的一部分提供的临时存储瓶,则可以将用完的部分食物存放在儿童无法拿到的特殊提供的儿童安全容器中,直到可以妥善处置为止。
处方中剩余的未开封单位必须在不再需要时妥善处理。
处置未使用的ACTIQ单元:
- 使用剪刀将ACTIQ组件从泡罩包装中取出,然后将其手柄握在马桶上。
- 用钳子剪断药物基质的一端,使其落入马桶中。
- 将手柄放置在儿童接触不到的地方。
- 对每个ACTIQ设备重复步骤1、2和3。切下5个单位并放入马桶后,冲洗马桶两次。
请勿沿马桶冲洗整个ACTIQ设备,ACTIQ手柄,泡罩包装或纸箱。将把手放在儿童无法触及的地方。
如果看护者需要其他协助以处置患者过期后仍留在家里的多余的不可用单元,请指示他们拨打Teva Pharmaceuticals的免费电话(1-888-483-8279)或寻求帮助从他们当地的DEA办公室。
危及生命的呼吸抑制
用Actiq治疗的患者发生了严重的,威胁生命的和/或致命的呼吸抑制,包括在非阿片类药物耐受患者中使用和剂量不当。监测呼吸抑制,尤其是在Actiq启动期间或增加剂量后[见警告和注意事项( 5.1 )] 。用Actiq替代任何其他芬太尼产品可能会导致致命的过量[请参阅警告和注意事项( 5.2 )] 。
由于存在呼吸抑制的危险,Actiq在包括头痛/偏头痛在内的急性或术后疼痛以及阿片类药物非耐受性患者的治疗中禁忌使用[见禁忌症( 4 )] 。
意外摄入
意外摄入一剂Actiq,尤其是儿童,可能会导致致命过量的芬太尼[见警告和注意事项( 5.2 )] 。
据报道,意外摄入Actiq的儿童死亡。必须将Actiq放在儿童接触不到的地方[请参阅患者咨询信息以及如何提供/存储和处置( 16 )] 。
细胞色素P450 3A4相互作用
与所有细胞色素P450 3A4抑制剂同时使用Actiq可能导致芬太尼血浆浓度增加,这可能会增加或延长不良反应并可能导致致命的呼吸抑制。另外,终止同时使用的细胞色素P450 3A4诱导剂可能导致芬太尼血浆浓度增加。监测接受Actiq和任何CYP3A4抑制剂或诱导剂的患者[见警告和注意事项( 5.3 ),药物相互作用( 7 ),临床药理学( 12.3 )] 。
与苯二氮卓类或其他中枢神经系统抑制剂同时使用的风险
阿片类药物与苯二氮卓类或其他中枢神经系统(CNS)抑制剂(包括酒精)并用可能会导致严重的镇静,呼吸抑制,昏迷和死亡[请参阅警告和注意事项( 5.4 ),药物相互作用( 7 )] 。
- 保留伴随使用Actiq和苯二氮卓类药物或其他CNS抑制剂的处方,以供其他治疗选择不足的患者使用。
- 将剂量和持续时间限制在所需的最低限度。
- 跟踪患者的呼吸抑制和镇静症状和体征。
用药错误的风险
与其他芬太尼产品相比,Actiq的药代动力学特征存在实质性差异,这导致芬太尼吸收程度在临床上存在重要差异,并可能导致致命的过量[参见剂量和用法( 2.1 ),警告和注意事项( 5.5 )]。 。
- 处方时,请勿将患者从每其他mcg的mcg的任何其他芬太尼产品转换为Actiq [请参阅剂量和给药方法( 2.1 )] 。
- 分配时,请勿用Actiq处方替代其他芬太尼产品。
上瘾,滥用和滥用
Actiq使患者和其他使用者面临阿片类药物成瘾,滥用和滥用的风险,这可能导致用药过量和死亡。在处方Actiq之前评估每个患者的风险,并定期监测所有患者的这些行为和状况的发展[请参阅警告和注意事项( 5.6 )] 。
风险评估和缓解策略(REMS)访问计划
由于存在滥用,滥用,成瘾和用药过量的风险,Actiq仅可通过食品和药物管理局要求的受限计划(称为风险评估和缓解策略(REMS))获得。根据透粘膜立即释放芬太尼(TIRF)REMS Access计划,门诊患者,向门诊患者,药房和分销商开具处方的医疗保健专业人员必须加入该计划[请参阅警告和注意事项( 5.7 )] 。有关更多信息,请访问www.TIRFREMSAccess.com或致电1-866-822-1483。
新生儿阿片类药物戒断综合征
怀孕期间长时间使用Actiq会导致新生儿阿片类药物戒断综合征,如果不加以识别和治疗,可能会危及生命,并且需要根据新生儿科专家制定的方案进行管理。如果孕妇需要长时间使用阿片类药物,则应告知患者新生儿阿片类药物戒断综合征的风险,并确保可获得适当的治疗[见警告和注意事项( 5.8 )] 。
Actiq的适应症和用法
Actiq被指定用于治疗16岁及以上的癌症患者的突破性疼痛,这些患者已在接受治疗并且对于其潜在的持续性癌症疼痛可以全天候接受阿片类药物治疗。
被认为是阿片类药物耐受的患者是每天连续服用至少一周,每天至少60毫克吗啡,每小时至少25 mcg透皮芬太尼,至少30毫克口服阿片类药物的患者每天羟考酮,每天至少8毫克口服氢吗啡酮,每天至少25毫克口服羟吗啡酮,每天至少60毫克口服氢吗啡酮或等镇痛剂量的其他阿片类药物。服用Actiq时,患者必须全天候使用阿片类药物。
使用限制:
- 不适用于阿片类药物非耐受性患者。
- 不适用于治疗急性或术后疼痛,包括头痛/偏头痛和牙齿疼痛[见禁忌症( 4 )] 。
- 作为TIRF REMS Access计划的一部分,Actiq只能分配给参加该计划的门诊病人[请参阅警告和注意事项( 5.7 )] 。对于Actiq的住院管理(例如,医院,疗养院和开具住院使用处方的长期护理机构),不需要患者和开药者注册。
Actiq剂量和管理
重要剂量和管理说明
- 在门诊开具Actiq的医疗保健专业人员必须参加TIRF REMS Access计划,并遵守REMS的要求,以确保安全使用Actiq [请参阅警告和注意事项( 5.7 )] 。
- 根据个体患者的治疗目标,在最短的时间内使用最低的有效剂量[请参阅警告和注意事项( 5 )] 。
- 重要的是,在任何时候都应尽量减少可供患者使用的力量,以防止混乱和可能的药物过量。
- 考虑到患者的疼痛程度,患者的反应,先前的止痛治疗经验以及成瘾,滥用和误用的危险因素,分别为每个患者启动给药方案[请参阅警告和注意事项( 5.1 )]。
- 密切监测患者的呼吸抑制,尤其是在开始治疗的最初24-72小时内,并在用Actiq增加剂量后,并相应地调整剂量[请参阅警告和注意事项( 5.1 )]。
- 指导患者和医护人员采取措施妥善处置闲置ACTIQ的存储ACTIQ安全,尽快不再需要[见警告和注意事项( 5.1 , 5.2 ),患者咨询资料( 17 )]。
- 其他TIRF公式和Actiq不等效。在任何情况下,请勿用Actiq处方替代任何其他TIRF处方。不要将患者从任何其他芬太尼产品中以每mcg的mcg转换为Actiq [请参阅警告和注意事项( 5.5 )] 。
初始剂量
单独滴定Actiq的剂量可提供足够的镇痛作用并最大程度地减少副作用。 Actiq治疗突破性癌症疼痛发作的初始剂量始终为200 mcg。 Actiq单元应消耗15分钟以上。应为患者开具六个200 mcg Actiq单位的初始滴定药,从而限制了滴定过程中家中的单位数量。患者应在增加剂量之前用尽所有单位,以防止混乱和可能的过量。
重复加药
- 如果在完成Actiq装置后15分钟(装置开始后30分钟)内无法缓解突破性疼痛发作,则患者仅可使用相同剂量的另一剂量服用该发作。因此,对于任何突破性疼痛发作,患者最多应服用两剂Actiq。
- 患者必须至少等待4个小时,才能使用Actiq治疗另一例发作性疼痛。
剂量滴定
从初始剂量开始,密切关注患者并改变剂量强度,直到患者达到每一次突破性癌症疼痛发作使用单一Actiq剂量单位即可提供足够镇痛作用的剂量。如果在服用该类药物之前出现了阿片类药物作用过度的迹象,应立即从患者的口腔中取出该剂量单位,并妥善处置,并应减少后续剂量。患者应记录其在突破性癌症疼痛的数次发作中对Actiq的使用情况,并与他们的医生一起回顾经验以确定是否需要调整剂量。
如果Actiq装置完成后15分钟(装置开始后30分钟)不能缓解突破性疼痛发作,则患者在该发作中仅可再服用一剂相同强度的药物。因此,对于任何突破性疼痛发作,患者最多应服用两剂Actiq。
患者必须等待至少4个小时,才能使用Actiq治疗另一例发作性疼痛。为了降低滴定期间用药过量的风险,患者在任何时候都只能使用一种强度的Actiq。

维护剂量
- 一旦滴定至有效剂量,患者通常应在每次突破性疼痛发作中仅使用一个具有适当强度的Actiq单位。
- 在Actiq装置完成15分钟后突破性疼痛发作仍未缓解的情况下,患者仅可使用相同剂量的另一剂量服药。
- 患者必须至少等待4个小时,才能使用Actiq治疗另一例发作性疼痛。一旦找到成功的剂量(即,平均发作用一个单位治疗),患者应将每天的消耗量限制在四个或更少的单位。
- 在某些患者中,可能需要调整Actiq的剂量,以便继续缓解突破性疼痛。
- 通常,仅当单次给药当前剂量未能连续数次连续治疗突破性疼痛发作时,才应增加Actiq剂量。
- 如果患者每天经历超过四次突破性疼痛发作,则应重新评估用于持续性疼痛的维持性(全天候)阿片类药物的剂量。
Actiq管理
在使用产品之前,立即用剪刀打开泡罩包装。患者应将Actiq装置放在他的或她的口中的脸颊和下部牙龈之间,偶尔使用手柄将药物基质从一侧移到另一侧。 Actiq装置应被吸吮,而不要咀嚼。如果咀嚼和吞咽单位剂量的Actiq,可能会导致其峰值浓度和生物利用度低于按指示食用时的浓度[见临床药理学( 12.3 )] 。
Actiq单位应在15分钟内消耗掉。与Actiq临床试验中报道的相比,更长或更短的消耗时间可能产生的疗效更低。如果在食用该装置之前出现了阿片类药物作用过度的迹象,请立即从患者的口腔中取出药物基质,并减少以后的剂量。
终止Actiq
当不再需要阿片类药物治疗时,请考虑停用Actiq并逐渐减少其他阿片类药物的剂量(逐渐滴定),以最大程度地减少可能的戒断作用。对于继续采用慢性阿片类药物治疗持续性疼痛但不再需要突破性疼痛治疗的患者,通常可以立即停用Actiq治疗。 [见药物滥用和依赖性( 9.3 )]
处置Actiq
设备消耗完并且基质完全溶解后,将手柄丢入儿童无法触及的垃圾容器中。
- 如果手柄上残留有任何药物基质,请将手柄放在热自来水下,直到所有药物基质溶解,然后将手柄放在儿童接触不到的地方。
- 每天至少一次将手柄放入儿童安全容器中(如步骤1和2中所述)。
如果有作为Actiq儿童安全工具包的一部分提供的临时存储瓶,则可以将部分用完的单元存放在儿童无法拿到的特殊提供的儿童安全容器中,直到可以适当处置为止。
处方中剩余的未开封单位必须在不再需要时妥善处理。
处置未使用的Actiq单元:
- 用剪刀将Actiq装置从泡罩包装中取出,并用其手柄将Actiq握在马桶上。
- 用钳子剪断药物基质的一端,使其落入马桶中。
- 将手柄放置在儿童接触不到的地方。
- 对每个Actiq设备重复步骤1、2和3。切下5个单位并放入马桶后,冲洗马桶两次。
请勿沿马桶冲洗整个Actiq设备,Actiq手柄,泡罩包装或纸箱。将把手放在儿童无法触及的地方。
如果看护者需要其他协助以处置患者过期后仍留在家里的多余的不可用单元,请指示他们拨打Teva Pharmaceuticals的免费电话(1-888-483-8279)或寻求帮助从他们当地的DEA办公室。
剂型和优势
固体口服透粘膜锭剂:每个剂量单位为白色至灰白色,在手柄上为固体药物基质。每个强度都标记在单个固体药物基质和手柄标签上。 Actiq的强度为200 mcg,400 mcg,600 mcg,800 mcg,1200 mcg和1600 mcg [请参阅供应/存储和处理方式( 16 )]。
禁忌症
Actiq禁忌于:
- 阿片类药物非耐受性患者:任何剂量的阿片类药物非耐受性患者都可能发生危及生命的呼吸抑制和死亡。 [见适应症和用法( 1 )];警告和注意事项( 5.1 )[请参阅适应症和用法( 1 )]。
- 严重的呼吸抑制[请参阅警告和注意事项( 5.1 )] 。
- 急性或术后疼痛,包括头痛/偏头痛和牙齿疼痛,或急诊科的急性疼痛。
- 急性或重度支气管哮喘,处于不受监视的环境中或没有复苏设备[见警告和注意事项( 5.9 )] 。
- 已知或怀疑的胃肠道梗阻,包括麻痹性肠梗阻[见警告和注意事项( 5.14 )] 。
- 已知的对芬太尼或Actiq成分的超敏反应(例如,过敏反应,超敏反应) [请参阅不良反应( 6.2 )] 。
警告和注意事项
危及生命的呼吸抑制
据报告,即使使用阿片类药物,严重,威胁生命或致命的呼吸抑制也是如此。如果不立即识别和治疗呼吸抑制,可能会导致呼吸停止和死亡。呼吸抑制的治疗可能包括密切观察,采取支持措施以及使用阿片类药物拮抗剂,具体取决于患者的临床状况[参见剂量过量( 10 )] 。阿片类药物引起的呼吸抑制导致的二氧化碳(CO 2 )滞留会加剧阿片类药物的镇静作用。
虽然在使用Actiq的任何时候都可能发生严重的,威胁生命的或致命的呼吸抑制,但在治疗开始或剂量增加后,风险最大。密切监测患者的呼吸抑制,尤其是在Actiq剂量增加后以及开始治疗后的头24-72小时内。
为了降低呼吸抑制的风险,Actiq的正确剂量和滴定至关重要[见剂量和用法( 2 )] 。高估Actiq剂量可能导致第一剂致命过量。用Actiq替代任何其他芬太尼产品可能会导致致命的过量[参见警告和注意事项( 5.5 )] 。
Actiq可能会对未开处方的人和不耐受阿片类药物的人致命。
ACTIQ的甚至一个剂量的意外摄取,尤其是儿童,可导致呼吸抑制和死亡由于芬太尼的过量[见警告和注意事项( 5.1 , 5.2 )]。
阿片类药物可引起与睡眠有关的呼吸系统疾病,包括中枢性睡眠呼吸暂停(CSA)和与睡眠有关的低氧血症。阿片类药物的使用以剂量依赖性方式增加了CSA的风险。对于患有CSA的患者,请考虑使用最佳方法来减少阿片类药物的剂量,以减少阿片类药物的使用量[参见剂量和用法( 2.6 )]。
意外摄入或接触导致儿童服用过量的风险增加
据报道,意外摄入Actiq的儿童死亡。
必须告知患者及其监护人,Actiq所含药物的量可能对儿童致命。医疗保健提供者和配药的药剂师必须特别向患者或看护者询问孩子是否在家中(全时或探视),并就不慎暴露对孩子的危害向他们提供咨询。
必须指示患者及其看护者将使用和未使用的剂量单位放在儿童接触不到的地方。虽然所有设备在使用后都应立即丢弃,但部分消耗的设备会对儿童构成特殊风险。如果未完全消耗掉某个装置,则必须尽快对其进行适当处置[请参阅患者咨询信息( 17 )] 。
《 Actiq药物治疗指南》中提供了有关正确储存,管理,处置的详细说明,以及管理过量的Actiq的重要说明。鼓励患者完整阅读此信息,并给他们机会回答他们的问题。
同时使用或停用细胞色素P450 3A4抑制剂和诱导剂的风险
将Actiq与CYP3A4抑制剂(例如大环内酯类抗生素(例如红霉素),唑类抗真菌药(例如酮康唑)和蛋白酶抑制剂(例如利托那韦))同时使用可能会增加血浆中的芬太尼浓度并延长阿片类药物的不良反应,这可能会导致潜在的致命性呼吸抑制[请参阅警告和注意事项( 5.1 )] ,尤其是在达到稳定剂量的Actiq之后添加抑制剂的情况下。同样,在接受Actiq治疗的患者中停用CYP3A4诱导剂(如利福平,卡马西平和苯妥英钠)可能会增加芬太尼的血浆浓度并延长阿片类药物的不良反应。当在Actiq治疗的患者中使用具有CYP3A4抑制剂的Actiq或停用CYP3A4诱导剂时,应频繁监测患者并考虑减少Actiq的剂量,直至达到稳定的药物作用[见药物相互作用( 7 )] 。
Actiq与CYP3A4诱导剂同时使用或CYP3A4抑制剂的停用可能降低芬太尼血浆浓度,阿片类药物疗效或可能导致对芬太尼产生身体依赖性的患者出现戒断综合征。当将Actiq与CYP3A4诱导剂一起使用或停用CYP3A4抑制剂时,应经常密切监测患者,并在需要维持足够的镇痛或出现阿片类药物戒断症状时考虑增加阿片类药物的剂量[见药物相互作用( 7 )] 。
与苯二氮卓类或其他中枢神经系统抑制剂(包括酒精)同时使用的风险
Actiq与苯二氮卓类药物或其他中枢神经系统抑制剂(例如非苯二氮卓类镇静剂/催眠药,抗焦虑药,镇定剂,肌肉松弛剂,全身麻醉剂,抗精神病药,其他阿片类药物,酒精类药物)同时使用可能会导致深度镇静,呼吸抑制,昏迷和死亡)。由于存在这些风险,因此这些药物应同时开具处方,以供其他治疗选择不足的患者使用。
观察性研究表明,与单独使用阿片类镇痛药相比,同时使用阿片类镇痛药和苯二氮卓类药物会增加与药物相关的死亡风险。由于具有相似的药理特性,可以合理预期与其他使用阿片类镇痛药的中枢神经系统抑制药同时使用的风险相似[见药物相互作用( 7 )] 。
如果决定与阿片类镇痛药同时开具苯二氮杂或其他中枢神经系统抑制剂,则应开出最低有效剂量和最短持续使用时间。在已经接受阿片类镇痛药的患者中,开处方的苯二氮卓类或其他中枢神经系统抑制剂的起始剂量要比不存在阿片类药物时要低,并根据临床反应进行滴定。如果已经服用苯二氮卓类药物或其他中枢神经系统抑制剂的患者开始使用阿片类镇痛剂,则应开始降低阿片类镇痛剂的初始剂量,并根据临床反应进行滴定。密切关注患者的呼吸抑制和镇静症状和体征。
将Actiq与苯二氮卓类或其他中枢神经系统抑制剂(包括酒精和非法药物)一起使用时,就呼吸抑制和镇静的风险向患者和护理人员提供建议。建议患者不要驾驶或操作重型机械,直到确定同时使用苯二氮卓类药物或其他中枢神经系统抑制剂为止。筛查患者是否存在滥用药物的风险,包括阿片类药物滥用和滥用,并警告他们与使用其他中枢神经系统抑制药(包括酒精和非法药物)有关的用药过量和死亡风险[请参阅药物相互作用( 7 )和患者咨询信息( 17 )] 。
用药错误的风险
处方时,请勿将患者从其他任何芬太尼产品转换为Actiq,以mcg / mcg为基础,因为以微克/微克为基础的Actiq和其他芬太尼产品并不等效。
Actiq不是其他透粘膜速释芬太尼(TIRF)制剂的通用版本。在分配时,在任何情况下都不要用Actiq处方替代任何其他TIRF处方。其他TIRF公式和Actiq不等效。与其他芬太尼产品(包括其他TIRF制剂)相比,Actiq的药代动力学特征存在实质性差异,这导致芬太尼吸收速率和程度的临床重要差异。这些差异的结果是,用Actiq替代任何其他芬太尼产品可能会导致致命的过量。
没有任何其他芬太尼产品的安全转换说明可用于患者。 (注:这包括芬太尼的口服,透皮或肠胃外制剂。)因此,对于阿片类药物耐受的患者,Actiq的初始剂量应始终为200 mcg。每个患者应单独滴定以提供足够的镇痛作用,同时最大程度减少副作用[见剂量和用法( 2.3 )] 。
上瘾,滥用和滥用
Actiq含有芬太尼,一种II类受控物质。作为阿片类药物,Actiq使使用者面临上瘾,滥用和滥用的风险[请参阅药物滥用和依赖性( 9 )] 。
尽管任何人上瘾的风险尚不明确,但可能会在适当处方Actiq的患者中发生。如果滥用或滥用药物,则可能以推荐剂量上瘾。
在开处方Actiq之前,应评估每个患者的阿片类药物成瘾,滥用或滥用的风险,并监测所有接受Actiq的患者的这些行为和状况的发展。具有个人或家庭药物滥用史(包括吸毒或酗酒或成瘾)或精神疾病(如严重抑郁症)的患者的风险增加。但是,这些潜在风险不应妨碍任何给定患者的疼痛适当管理。可能会给风险增加的患者服用阿片类药物,例如Actiq,但在此类患者中使用时,必须对Actiq的风险和正确使用进行深入的咨询,并对成瘾,滥用和滥用的迹象进行严格监控。
阿片类药物是吸毒者和成瘾性疾病患者所寻求的,并且会被转用于刑事犯罪。处方或分配Actiq时请考虑这些风险。减少这些风险的策略包括开出最小剂量的适当药物,并建议患者正确处置未使用的药物[请参阅患者咨询信息( 17 )] 。请与当地的州专业许可委员会或州控制的物质管理局联系,以获取有关如何预防和检测此产品的滥用或转移的信息。
透粘膜速释芬太尼(TIRF)风险评估和缓解策略(REMS)访问计划
由于存在滥用,滥用,成瘾和用药过量的风险[请参阅警告和注意事项( 5.6 )] ,因此仅可通过名为TIRF REMS Access程序的受限程序来使用Actiq。根据TIRF REMS Access计划,门诊病人,开门诊处方的医疗保健专业人员,药房和分销商必须参加该计划。对于Actiq的住院管理(例如,医院,疗养院和开具住院使用处方的长期护理设施),不需要患者和开处方者的注册。
TIRF REMS Access程序的必需组件是:
- 开处方Actiq供门诊患者使用的医疗保健专业人员必须查看TIRF REMS Access计划的开处方教育材料,加入该计划并遵守REMS要求。
- 要接受Actiq,门诊患者必须了解风险和收益,并签署患者处方协议。
- 分配Actiq的药房必须加入该计划,并同意遵守REMS要求。
- 分发Actiq的批发商和分销商必须注册该计划,并且只能分发给授权的药房。
- 有关更多信息,包括合格药房/分销商的列表,请访问www.TIRFREMSAccess.com或致电1-866-822-1483。
新生儿阿片类药物戒断综合征
怀孕期间长时间使用Actiq可能导致新生儿停药。与成人类鸦片戒断综合征不同,新生儿类鸦片戒断综合征如果不得到认可和治疗,可能会危及生命,并且需要根据新生儿科专家制定的方案进行管理。观察新生儿的新生儿阿片戒断综合征的征兆,并据此进行处理。建议孕妇长时间使用阿片类药物有新生儿阿片戒断综合症的风险,并确保可获得适当的治疗[见在特定人群中使用( 8.1 ),患者咨询信息( 17 )] 。
慢性肺病患者或老年人,恶病质或虚弱患者的危及生命的呼吸抑制
禁忌在没有监测的情况下或没有复苏设备的情况下,在急性或重度支气管哮喘患者中使用Actiq。
慢性肺病患者:经Actiq治疗的患有严重慢性阻塞性肺疾病或肺心病的患者,以及呼吸储备,低氧,高碳酸血症或既往存在呼吸抑制状态大幅下降的患者,其呼吸驱动力下降的风险增加,包括呼吸暂停,即使使用Actiq的推荐剂量也是如此[请参阅警告和注意事项( 5.1 )] 。
老年,恶病质或虚弱的患者:老年,恶病质或虚弱的患者更可能发生危及生命的呼吸抑制,因为与年轻,健康的患者相比,他们的药代动力学或清除率发生了变化[请参阅警告和注意事项( 5.1 )] 。
密切监视此类患者,尤其是在启动和滴定Actiq以及与其他抑制呼吸的药物同时使用Actiq时[见警告和注意事项( 5.1 )] 。或者,考虑在这些患者中使用非阿片类镇痛药。
血清素综合症与血清素能药物的同时使用
据报道,在Actiq与5-羟色胺能药物同时使用期间,5-羟色胺综合征的病例可能威胁生命。血清素能药物包括选择性5-羟色胺再摄取抑制剂(SSRIs),5-羟色胺和去甲肾上腺素再摄取抑制剂(SNRIs),三环抗抑郁药(TCA),曲坦类,5-HT3受体拮抗剂,影响血清素能神经递质系统的药物(例如,米氮平,曲唑酮,曲马多) ,某些肌肉松弛剂(例如环苯扎林,美他沙酮)和会削弱5-羟色胺代谢的药物(包括MAO抑制剂,既用于治疗精神疾病的抑制剂,也包括其他药物,如利奈唑胺和静脉注射亚甲蓝) [请参阅药物相互作用( 7 ) ] 。这可能发生在建议的剂量范围内。
5-羟色胺综合征的症状可能包括精神状态变化(例如,躁动,幻觉,昏迷),自主神经不稳定(例如,心动过速,不稳定的血压,体温过高),神经肌肉畸变(例如,反射亢进,不协调,僵硬)和/或胃肠道症状(例如恶心,呕吐,腹泻)。症状的发作通常在数小时至数天的同时使用中发生,但可能在此之后发生。如果怀疑血清素综合症,请停用Actiq。
肾上腺功能不全
据报道,使用阿片类药物导致肾上腺皮质功能不全的病例,多于使用一个月以上。肾上腺功能不全的表现可能包括非特异性症状和体征,包括恶心,呕吐,厌食,疲劳,虚弱,头晕和低血压。如果怀疑肾上腺功能不全,请尽快通过诊断测试确认诊断。如果诊断出肾上腺功能不全,请使用生理替代剂量的皮质类固醇治疗。使患者断奶,以使肾上腺功能恢复,并继续皮质类固醇治疗直至肾上腺功能恢复。可以尝试使用其他阿片类药物,因为有些病例报道使用了其他阿片类药物,但没有肾上腺功能不全的复发。可用的信息不能确定任何特定的阿片类药物更可能与肾上腺功能不全有关。
严重低血压
Actiq可能会导致非卧床患者严重低血压,包括体位性低血压和晕厥。降低血压或同时服用某些中枢神经系统抑制药(例如吩噻嗪或全身麻醉药)已经损害了维持血压能力的患者的风险增加[见药物相互作用( 7 )] 。启动或滴定Actiq剂量后,监测这些患者的低血压迹象。在患有循环休克的患者中,Actiq可能会引起血管舒张,从而进一步降低心输出量和血压。循环休克患者应避免使用Actiq。
颅内压增高,脑肿瘤,头部受伤或意识受损的患者使用的风险
在可能易受CO 2保留的颅内作用影响的患者(例如,那些有颅内压升高或脑肿瘤的证据的患者)中,Actiq可能会降低呼吸驱动力,并且所产生的CO 2保留会进一步增加颅内压。监视此类患者的镇静和呼吸抑制迹象,尤其是在开始使用Actiq进行治疗时。
阿片类药物也可能使头部受伤患者的临床病情变得模糊。避免在意识障碍或昏迷患者中使用Actiq。
胃肠道疾病患者的使用风险
Actiq在已知或疑似胃肠道梗阻(包括麻痹性肠梗阻)的患者中禁用。
Actiq中的芬太尼可能引起Oddi括约肌痉挛。阿片类药物可能导致血清淀粉酶增加。监测包括急性胰腺炎在内的胆道疾病患者的症状是否恶化。
癫痫病患者的癫痫发作风险增加
Actiq中的芬太尼可能会增加癫痫发作患者的癫痫发作频率,并可能增加在其他与癫痫发作相关的临床环境中发生癫痫发作的风险。监视有癫痫病史的患者,以防Actiq治疗期间癫痫发作控制恶化。
驾驶和操作机械的风险
Actiq可能会损害执行潜在危险活动(如驾驶汽车或操作机器)所需的智力或身体能力。警告患者不要驾驶或操作危险的机器,除非他们能够容忍Actiq的影响并且知道他们将如何对药物做出反应。
心脏疾病
静脉注射芬太尼可能会导致心动过缓。因此,对于心律失常患者应谨慎使用Actiq。
不良反应
在其他部分中描述或更详细地描述了以下严重不良反应:
- 危及生命的呼吸抑制[请参阅警告和注意事项( 5.1 )]
- 与苯二氮卓类药物和其他中枢神经系统抑制剂的相互作用[请参阅警告和注意事项( 5.4 )]
- 上瘾,滥用和滥用[请参阅警告和注意事项( 5.6 )]
- 新生儿阿片类药物戒断综合征[见警告和注意事项( 5.8 )]
- 5-羟色胺综合征[请参阅警告和注意事项( 5.10 )]
- 肾上腺功能不全[请参阅警告和注意事项( 5.11 )]
- 严重低血压[请参阅警告和注意事项( 5.12 )]
- 胃肠道不良反应[请参阅警告和注意事项( 5.14 )]
- 癫痫发作[请参阅警告和注意事项( 5.15 )]
临床研究经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
Actiq的安全性已在257名阿片耐受性慢性癌症疼痛患者中进行了评估。在开放标签研究期间,Actiq使用的持续时间有所不同。一些患者被随访超过21个月。开放标签研究的平均治疗时间为129天。
与Actiq相关的最严重的不良反应是呼吸抑制(可能导致呼吸暂停或呼吸暂停),循环压抑,低血压和休克。
由于Actiq的临床试验旨在评估治疗突破性癌症疼痛的安全性和有效性,因此所有患者还因持续的癌症疼痛而服用了阿片类药物,如持续释放的吗啡或经皮芬太尼。此处显示的不良事件数据反映了接受Actiq治疗突破性癌症疼痛以及伴随阿片类药物治疗持续性癌症疼痛的患者中经历每种不良反应的患者的实际百分比。没有尝试纠正其他阿片类药物的同时使用,Actiq治疗的持续时间或癌症相关症状。
在257例恶性肿瘤和突破性癌痛患者中进行了三个采用相似滴定方案的短期临床试验。有254位患者的数据可用。表1按剂量组列出了滴定期间发生的不良反应,其总发生频率为1%或更高。在这些研究中使用的滴定方案限制了为这些不良反应分配剂量-反应关系的能力。在每个身体系统中,不良反应的出现频率均按降序排列。
| ||||||||||
剂量组 | 报告事件的患者百分比 | |||||||||
200- 600微克 (n = 230) | 800- 1400微克(n = 138) | 1600 微克 (n = 54) | > 1600 微克 (n = 41) | 任何 剂量* (n = 254) | ||||||
身体整体 | ||||||||||
虚弱 | 6 | 4 | 0 | 7 | 9 | |||||
头痛 | 3 | 4 | 6 | 5 | 6 | |||||
误伤 | 1个 | 1个 | 4 | 0 | 2 | |||||
消化的 | ||||||||||
恶心 | 14 | 15 | 11 | 22 | 23 | |||||
呕吐 | 7 | 6 | 6 | 15 | 12 | |||||
便秘 | 1个 | 4 | 2 | 0 | 4 | |||||
紧张 | ||||||||||
头晕 | 10 | 16 | 6 | 15 | 17 | |||||
嗜睡 | 9 | 9 | 11 | 20 | 17 | |||||
混乱 | 1个 | 6 | 2 | 0 | 4 | |||||
焦虑 | 3 | 0 | 2 | 0 | 3 | |||||
步态异常 | 0 | 1个 | 4 | 0 | 2 | |||||
口干 | 1个 | 1个 | 2 | 0 | 2 | |||||
紧张 | 1个 | 1个 | 0 | 0 | 2 | |||||
血管扩张 | 2 | 0 | 2 | 0 | 2 | |||||
幻觉 | 0 | |||||||||
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 滥用的可能性很高
- 审批历史 FDA的药物史
- 世界反兴奋剂机构 反兴奋剂分类
美国日本医生

Heather Benjamin MD

Heather Benjamin MD

Heather Miske DO

Heather Miske DO

Bert Hepner DO

宮崎総一郎 中部大学特聘教授

百村伸一 教授

村上和成 教授

中山秀章 教授
