获取国外异丙酚植入物药品价格,使用等信息,最快 24 小时回馈
异丙酚植入物
异丙酚植入物
什么是丙丁啡?
丙丁啡(丁丙诺啡)是一种阿片类药物。阿片类药物有时被称为麻醉药。
在某些已经用其他形式的丁丙诺啡(例如Subutex或Suboxone)治疗和控制过瘾的人中,异丙酚植入物用于治疗麻醉瘾。异丙酚植入物适用于至少16岁的成人和青少年。
在特殊程序下,只能从经认证的药房购买普罗布定植入物。您必须先注册该程序,并了解使用该药物的风险和收益。植入物不能用作止痛药。
重要信息
插入和取出Probuphine植入物会导致严重的或危及生命的并发症。
与您的医生讨论使用这种药物的风险和益处。阅读提供给您的所有患者信息,用药指南和说明表。
在服药之前
如果您对丁丙诺啡过敏,则不应使用丙丁啡。
告诉医生您是否曾经:
呼吸困难,睡眠呼吸暂停;
肝病;
胆囊或甲状腺问题;
前列腺增大,排尿困难;
艾迪生氏病(肾上腺疾病);
脊柱弯曲异常,影响呼吸;
头部受伤,脑瘤或脊髓问题;
精神疾病或精神病;
酗酒;要么
皮肤问题,例如异常的疤痕或生长。
如果您在怀孕期间使用普罗布啡,您的宝宝可能会依赖这种药物。这可能会导致婴儿出生后危及生命的戒断症状。依靠丁丙诺啡出生的婴儿可能需要数周的医疗。告诉医生您是否怀孕或计划怀孕。
丁丙诺啡可进入母乳,并可能引起哺乳婴儿的嗜睡或呼吸问题。向您的医生询问任何风险。
未批准16岁以下年轻人使用的异丙酚植入物。
如何服用普鲁布非植入物?
Probuphine植入物是一根1英寸的棒,通过针(在局部麻醉下)插入上臂内侧的皮肤。您将总共收到4个植入物。
插入Probuphine植入物后,手臂将被2条绷带覆盖。 24小时后取下顶部绷带,但将较小的绷带保留3至5天。保持该区域清洁干燥。在第一天中,每隔2个小时将冰袋装到该区域,一次放置40分钟。
至少1周,检查切口区域是否有温暖,发红,肿胀或其他感染迹象。
如果在植入植入物后发现以下任何症状,请立即致电医生:
植入物从您的皮肤伸出或自行脱落;
您有疼痛,瘙痒,发红,肿胀,出血或严重刺激;
您的手臂麻木或虚弱;要么
您会感到呼吸急促。
告诉医生您是否不能感觉到皮肤下的植入物。您的医生可能会进行医学检查或将您转介给外科医生。
异丙酚植入物可以保留长达6个月的位置,必须通过手术将其移除。请勿尝试自行取出植入物。
如果植入物从您的手臂中出来,请将其放置在其他人无法接触到的地方。尽快将植入物退还给医生。滥用前列腺素会导致成瘾,过量或死亡,尤其是在儿童或其他人不正确或未开处方的情况下使用植入物。出售或赠送Probuphine植入物是违法的。
普罗布啡只是完整治疗计划的一部分,其中可能还包括咨询和其他类型的成瘾支持。告诉您的医生植入物是否无助于改善成瘾症状。
任何为您提供治疗的医疗服务提供者都应该知道您正在接受阿片类药物成瘾和使用丙丁啡的治疗。确保您的家人知道如何提供此信息,以防他们在紧急情况下需要为您讲话。
如果我错过剂量怎么办?
由于这种药物是植入您的皮肤下的,因此低剂量的丁丙诺啡将连续6个月不断地进入您的体内。
如果我服药过量怎么办?
寻求紧急医疗护理或致电1-800-222-1222,拨打毒药帮助热线。过量的丁丙诺啡可能是致命的。
服药过量的症状可能包括严重的嗜睡,精确的瞳孔,呼吸弱或浅,或失去知觉。
使用丙丁啡时应避免什么?
不要喝酒。可能发生危险的副作用或死亡。
除非您知道丙丁啡会如何影响您,否则请避免驾驶或操作机械。头晕或嗜睡会导致跌倒,事故或严重伤害。
未经医生许可,避免使用任何阿片类药物止痛药。阿片类止痛药在使用丁丙诺啡时效果不佳。与您的医生讨论其他缓解疼痛的方法。
异丙酚的副作用
如果您对普罗啡定有过敏反应迹象,请寻求紧急医疗帮助。呼吸困难;脸,嘴唇,舌头或喉咙肿胀。
插入或取出植入物会导致严重或危及生命的并发症,包括神经或血管受损。向您的医生询问这些风险。
如果您有以下情况,请立即致电您的医生:
阿片类药物戒断症状-瑟瑟发抖,鸡皮increased,出汗增加,感觉冷热,流鼻涕,水汪汪的眼睛,腹泻,呕吐;
精神状态混乱,激动或其他变化;
极度嗜睡,注意力难以集中;
头昏眼花的感觉,就像你可能昏昏欲睡;
呼吸微弱或浅浅,在睡眠期间停止呼吸;
视力模糊,言语不清,行走,反射或协调问题;要么
皮质醇水平低-恶心,呕吐,食欲不振,头晕,疲倦或无力加剧。
如果您有5-羟色胺综合征的症状,请立即就医,例如:躁动,幻觉,发烧,出汗,发抖,心跳加快,肌肉僵硬,抽搐,失去协调能力,恶心,呕吐或腹泻。
长期使用阿片类药物可能会影响男性或女性的生育能力(生育能力)。尚不知道阿片类药物对生育能力的影响是否持久。
常见的安非他命副作用可能包括:
植入植入物的地方疼痛,瘙痒,发红,肿胀,淤青或流血;
头痛,情绪低落;
恶心,呕吐,便秘;
背疼;
牙疼;要么
咽喉痛。
这不是完整的副作用列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响丙丁啡?
如果您开始或停止服用某些其他药物,可能会出现呼吸困难或戒断症状。告诉医生您是否还使用抗生素,抗真菌药,心脏或血压药,癫痫药或治疗HIV或丙型肝炎的药物。
丁丙诺啡可与许多其他药物相互作用并引起危险的副作用或死亡。确保您的医生知道您是否还使用:
感冒药或过敏药,支气管扩张剂哮喘/ COPD药物或利尿剂(“水丸”);
晕车,肠易激综合症或膀胱过度活动症的药物;
其他麻醉药-阿片类止痛药或处方止咳药;
镇静剂,如Valium-地西epa,阿普唑仑,劳拉西m,Xanax,克洛诺平,Versed等
使您昏昏欲睡或呼吸困难的药物-安眠药,肌肉松弛药,治疗情绪障碍或精神疾病的药物;要么
影响体内5-羟色胺水平的药物-一种兴奋剂,或用于治疗抑郁症,帕金森氏病,偏头痛,严重感染或恶心和呕吐的药物。
版权所有1996-2020 Cerner Multum,Inc.版本:4.03。
注意:本文档包含有关丁丙诺啡的副作用信息。此页面上列出的某些剂型可能不适用于Probuphine品牌。
对于消费者
适用于丁丙诺啡:薄膜,片剂
其他剂型:
- 注射液
- 皮内植入物
- 透皮贴剂缓释
警告
颊粘膜途径(电影)
成瘾,滥用和滥用丁丙诺啡使患者和其他使用者面临阿片类药物成瘾,滥用和滥用的风险,这可能导致用药过量和死亡。在处方丁丙诺啡之前评估每个患者的风险,并定期监测所有患者的这些行为或状况的发展。阿片类镇痛药风险评估和缓解策略(REMS)确保阿片类镇痛药的益处超过成瘾,滥用和滥用的风险,美国食品药品监督管理局(FDA)已要求这些产品具有REMS。根据REMS的要求,拥有批准的阿片类镇痛药的制药公司必须向医疗保健提供者提供符合REMS要求的教育计划。强烈建议医疗保健提供者:完成符合REMS的教育计划,为患者和/或其护理人员提供所有处方,以安全使用,严重风险,储存和处置这些产品,并向患者及其护理人员强调重要性每次由药师阅读《用药指南》,并考虑使用其他工具改善患者,家庭和社区的安全。危及生命的呼吸抑制丁丙诺啡可能会导致严重,危及生命或致命的呼吸抑制。监测呼吸抑制,尤其是在开始丁丙诺啡期间或增加剂量后。咀嚼,吞咽,吸食或吸食从颊膜中提取的丁丙诺啡而滥用或滥用丁丙诺啡会导致丁丙诺啡的释放不受控制,并有过量和死亡的显着风险偶然接触偶然接触甚至一剂丁丙诺啡,尤其是儿童新生阿片类药物戒断综合征怀孕期间长时间使用丁丙诺啡可导致新生儿阿片类药物戒断综合征,如果不加以识别和治疗,可能会危及生命,并且需要根据新生儿科专家制定的方案进行管理。如果孕妇长时间需要使用阿片类药物,请告知患者新生儿类阿片戒断综合征的风险,并确保可以采取适当的治疗方法。与苯二氮卓类或其他中枢神经系统抑制剂合用的风险保留与丁丙诺啡和苯并二氮杂类并用的处方或其他中枢神经系统抑制剂用于其他治疗选择不充分的患者。将剂量和持续时间限制在所需的最低限度。跟踪患者的呼吸抑制和镇静症状和体征。
需要立即就医的副作用
丁丙诺啡(丁丙诺啡中含有的活性成分)及其所需的作用可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用丁丙诺啡时,如果有下列任何副作用,请立即咨询医生:
不常见
- 膀胱疼痛
- 脸,手臂,手,小腿或脚肿胀或肿胀
- 血尿或浑浊
- 模糊的视野
- 咳嗽产生粘液
- 腹泻
- 排尿困难,灼热或疼痛
- 呼吸困难
- 头晕
- 发热
- 尿频
- 头痛
- 食欲不振
- 下背部或侧面疼痛
- 口腔或喉咙痛
- 恶心
- 紧张
- 皮肤苍白
- 敲打耳朵
- 体重快速增加
- 缓慢或快速的心跳
- 肚子痛
- 胸闷
- 手或脚刺痛
- 劳累呼吸困难
- 异常出血或瘀伤
- 异常疲倦或虚弱
- 体重异常增加或减少
罕见
- 皮肤破裂或撕裂
- 发冷
- 心律不齐,反复发作
- 皮肤刺激,瘙痒,疼痛,发红,肿胀,触痛或发热
- 不寻常的嗜睡,迟钝或呆滞感
发病率未知
- 搅动
- 灼烧,爬行,发痒,麻木,刺,“针刺”或刺痛感
- 模糊的视野
- 混乱
- 咳嗽
- 皮肤变黑
- 吞咽困难
- 从躺着或坐着的姿势突然起床时头晕,晕眩或头晕
- 睡意
- 头痛,剧烈和跳动
- 荨麻疹,皮疹
- 不规则,快速,缓慢或浅呼吸
- 精神抑郁
- 过度反应
- 嘴唇,指甲或皮肤苍白或发蓝
- 查明学生
- 协调不良
- 眼睑或眼睛,面部,嘴唇或舌头周围浮肿或肿胀
- 放松而平静的感觉
- 躁动
- 发抖
- 嗜睡
- 说话或激动时无法控制
- 颤抖或颤抖
- 抽搐
- 呕吐
不需要立即就医的副作用
丁丙诺啡的某些副作用可能会发生,通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 背疼
- 发冷
- 咳嗽
- 排便困难
- 嘶哑
- 排尿困难或困难
- 流鼻涕
- 打喷嚏
- 鼻塞
- 睡眠困难
不常见
- 焦虑
- 背疼
- 挫伤
- 食欲下降
- 秋季
- 温暖或热的感觉
- 皮肤潮红或发红,尤其是在脸部和颈部
- 瘙痒,皮疹
- 肌肉酸痛或垃圾邮件
- 眼睛和che骨周围的疼痛或压痛
- 咽喉痛
罕见
- 力量不足或丧失
- 肌肉或骨骼疼痛
- 颈部疼痛
- 胃部不适
- 牙疼
对于医疗保健专业人员
适用于丁丙诺啡:颊膜,复方散剂,注射液,皮下溶液缓释,皮下植入物,舌下片剂,透皮膜缓释
一般
最常见的不良反应包括头痛,失眠,疼痛,停药的体征和症状,恶心,便秘,应用部位瘙痒,应用部位红斑,呕吐,多汗症,头晕,嗜睡,口干和应用部位皮疹。 [参考]
精神科
非常常见(10%或更多):失眠(最高28%),戒断综合症(最高24%),焦虑症(最高14%),抑郁症(最高13%)
常见(1%至10%):敌意,躁动,偏执反应,思维异常,困惑
罕见(0.1%至1%):影响不稳定,人格解体,性欲下降,噩梦,欣快情绪,精神病,幻觉,欣快感
非常罕见(少于0.01%):依赖,情绪波动
未报告频率:做梦
上市后报道:新生儿戒断综合征[参考]
呼吸道
非常常见(10%或更多):鼻炎(高达15%)
常见(1%至10%):咳嗽加剧,咽炎,上呼吸道感染,流行性感冒,鼻窦炎,支气管炎,呼吸困难,咽喉痛,换气不足,打哈欠
罕见(0.1%至1%):哮喘加重,打h,过度换气,缺氧,喘息,呼吸暂停
罕见(少于0.1%):呼吸抑制,呼吸衰竭
上市后报告:窒息[参考]
胃肠道
非常常见(10%或更多):恶心(最高23%),便秘(最高14%),腹痛(11.7%),腹泻(最高10%)
常见(1%至10%):呕吐,消化不良,口干,胃部不适,上腹部疼痛,肠胃气胀
罕见(0.01%至0.1%):憩室炎,吞咽困难,肠梗阻,烧心
非常罕见(小于0.01%):抓取[参考]
皮肤科
非常常见(10%或更多):应用部位瘙痒(最高15%),出汗(最高13%),应用部位红斑(最高10%)
常见(1%到10%):皮疹,皮疹,多汗,瘙痒,皮疹,全身性瘙痒
罕见(0.1%至1%):接触性皮炎,应用部位皮炎,皮肤干燥,面部水肿,荨麻疹,苍白
非常罕见(少于0.01%):脓疱,囊泡
未报告频率:注射部位反应,血管性水肿,应用部位水肿[参考]
肌肉骨骼
非常常见(10%或更多):背痛(高达16%)
常见(1%至10%):关节痛,四肢疼痛,肌肉痉挛,肌肉骨骼疼痛,关节肿胀,颈部疼痛,肌痛,胸痛,腿抽筋,骨骼疼痛,全身痉挛,肌肉无力,肌酸磷酸激酶(CPK)增高
罕见(0.1%至1%):肌肉抽筋,僵硬,肌肉痉挛
非常罕见(少于0.01%):肌肉痉挛,耳痛[Ref]
其他
非常常见(10%或更多):疼痛(最高26%),乏力(最高16%)
常见(1%至10%):寒冷,发烧,意外伤害,疲劳,发热,跌倒,不适,疲倦,嗜睡
罕见(0.1%至1%):水肿
未报告的频率:死亡[参考]
免疫学的
非常常见(10%或更多):感染(高达22%),流感综合征(高达10%)
常见(1%至10%):脓肿[参考]
神经系统
很常见(10%或更多):头痛(高达34%)
常见(1%至10%):头晕/眩晕,神经质,嗜睡,感觉不足,震颤,偏头痛,感觉异常,晕厥,肌张力过高,消化不良,皮疹,镇静
罕见(0.1%至1%):耳鸣,注意力不集中,协调异常,构音障碍,记忆力障碍,躁动不安,镇静,睡眠障碍,口齿不清,昏迷
稀有(小于0.1%):不平衡,麻木
未报告频率:抽搐
上市后报告:新生儿震颤,血清素综合征[参考]
心血管的
常见(1%至10%):血管舒张,低血压,外周水肿,高血压,心
罕见(0.1%至1%):体位性低血压,心动过速,心绞痛,潮红,心动过缓,发,QT延长
未报告频率:温克巴赫区[参考]
已经观察到QT延长。在丁丙诺啡颊膜片的临床试验(n = 1590)中,每12小时最高900 mcg的剂量在2%的患者中观察到基线后QTcF值为450至480毫秒。在针对健康受试者的QT研究中,治疗剂量(10 mcg /小时的透皮贴剂)对QTc间隔没有影响,但更高的剂量(40 mcg /小时)平均延长5.9毫秒。
在临床试验期间,收集了连续的心电图,以评估丁丙诺啡的缓释皮下给药对QT延长的影响。 7名患者表现出QTc与基线相比增加了超过60毫秒。一名患者的QTc大于500毫秒。这些QTc发现被报告为散发性和短暂性,均未导致异常的心室节律。回顾心电图和不良事件数据,未发现晕厥,癫痫发作或室性心动过速或颤动的迹象。 [参考]
眼科
常见(1%至10%):流眼水,瞳孔缩小,瞳孔散大,流泪障碍
罕见(0.1%至1%):干眼,视力模糊,结膜炎
罕见(少于0.1%):眼睑浮肿,视力障碍
未报告频率:复视,视觉异常,弱视[参考]
泌尿生殖
常见(1%至10%):尿路感染,痛经
罕见(0.1%至1%):尿失禁,尿retention留
罕见(少于0.1%):尿he,勃起减少,性功能障碍[参考]
新陈代谢
常见(1%至10%):厌食
罕见(0.1%至1%):脱水,食欲不振,体重减轻
上市后报道:新生儿喂养障碍[参考]
血液学
常见(1%至10%):淋巴结肿大
过敏症
已经报道了植入物中所含成分的过敏反应。已经报道了缓释皮下注射中所含成分的过敏反应。 [参考]
罕见(0.1%至1%):过敏反应
稀有(0.01%至0.1%):过敏反应
非常罕见(小于0.01%):严重的过敏反应[参考]
肝的
常见(1%至10%):ALT升高,AST升高,γ-谷氨酰转移酶(GGT)升高
罕见(小于0.1%):胆绞痛
未报告频率:肝炎,黄疸,肝功能衰竭,肝坏死,肝肾综合征,肝性脑病,转氨酶升高[参考]
本地
非常常见(10%或更多):植入部位疼痛(13%),植入部位瘙痒(12%),植入部位红斑(10%)
常见(1%至10%):植入部位血肿,植入部位出血,植入部位水肿,注射部位疼痛,注射部位瘙痒,注射部位红斑,注射部位硬结
罕见(0.1%至1%):注射部位瘀伤,注射部位肿胀,注射部位不适,注射部位反应,注射部位蜂窝织炎,注射部位感染[参考]
内分泌
阿片类药物:
上市后报告:肾上腺功能不全和雄激素缺乏症[参考]
长期使用阿片类药物已引起雄激素缺乏的病例。据报道,使用阿片类药物会引起肾上腺功能不全,特别是使用1个月或更长时间。 [参考]
参考文献
1.“产品信息。Butrans(丁丙诺啡)。” Purdue Pharma LP,康涅狄格州斯坦福德。
2.“产品信息。子场所(丁丙诺啡)。” Reckitt Benckiser Pharmaceuticals Inc,弗吉尼亚州里士满。
3.“产品信息。Subutex(丁丙诺啡)。” Reckitt and Colman Pharmaceuticals Inc,弗吉尼亚州里士满。
4. Cerner Multum,Inc.“澳大利亚产品信息”。 00
5. Cerner Multum,Inc.“英国产品特性摘要”。 00
6.“产品信息。Buprenex(丁丙诺啡)。” Reckitt and Colman Pharmaceutical,弗吉尼亚州里士满。
7.“产品信息。丙丁啡(丁丙诺啡)。” Braeburn Pharmaceuticals,新泽西州普林斯顿。
某些副作用可能没有报道。您可以将其报告给FDA。
医疗保健提供者培训
打算开处方丙丁啡的所有医疗服务提供者必须成功完成现场培训计划[请参阅警告和注意事项(5.2)]。
所有执行PROBUPHINE插入和/或取出PROBUPHINE的医疗服务提供者必须成功完成现场培训计划,并在插入或取出植入物之前证明其程序能力。
可以通过致电1-844-859-6341获得有关插入和移除过程的信息。成功使用和随后去除PROBUPHINE的基础是按照说明正确正确地对四个植入物进行皮下植入。作为参加获得认证的实时培训计划的先决条件,医疗服务提供者必须在最近3个月中至少执行了一项合格的手术程序。合格程序是指使用无菌技术在局部麻醉下进行的程序,至少包括进行皮肤切口或缝合线[请参见警告和注意事项(5.2)] 。
患者选择
PROBUPHINE植入物仅用于满足以下所有条件的患者:
- 在跨粘膜丁丙诺啡上获得并持续延长的临床稳定性
- 目前维持Subutex或Suboxone舌下片剂或其透粘膜丁丙诺啡产品当量的维持剂量为每天8 mg或更少(透粘膜丁丙诺啡的剂量可提供可比或低于PROBUPHINE的血液水平)
- 不应仅将患者逐渐减少剂量以过渡到普罗布定
- 稳定的透粘膜丁丙诺啡剂量(每天舌下Subutex片或Suboxone舌下片剂或其透粘膜丁丙诺啡产品当量为8 mg或更少),三个月或更长时间,无需任何补充剂量或调整
可接受的透粘膜丁丙诺啡剂量包括:
- Subutex(丁丙诺啡)舌下片(一般等效量)8 mg或更少
- Suboxone(丁丙诺啡和纳洛酮)舌下片(通用当量)8 mg / 2 mg或更少
- Bunavail(丁丙诺啡和纳洛酮)颊膜4.2 mg / 0.7 mg以下
- Zubsolv(丁丙诺啡和纳洛酮)舌下片剂5.7 mg / 1.4 mg或更少
在确定PROBUPHINE治疗的临床稳定性和适用性时,请考虑以下因素:
- 没有非法使用阿片类药物的时期
- 生活环境稳定
- 参与结构化活动/工作
- 参与推荐的行为疗法/同伴支持计划的一致性
- 符合门诊要求的一致性
- 极少甚至没有欲望或需要使用非法阿片类药物
- 没有住院(成瘾或精神健康问题),急诊室就诊或危机干预的时间段
- 社会支持系统
临床监督
插入PROBUPHINE后一周检查插入部位是否有感染迹象或伤口愈合是否有问题,包括植入物从皮肤挤出的迹象。
对于大多数患者,建议的访视时间表应不少于每月一次,以进行持续的咨询和社会心理支持。
尽管有些患者可能偶尔需要补充丁丙诺啡剂量,但不应为患者提供按需使用经粘膜含丁丙诺啡产品的处方。取而代之的是,应该及时发现并评估需要补充剂量的患者。持续使用经粘膜丁丙诺啡补充剂的情况表明,PROBUPHINE输送的丁丙诺啡的量不足以进行稳定的维护。考虑使用替代丁丙诺啡产品以维持治疗。
插入PROBUPHINE
制备
在插入PROBUPHINE之前,请仔细阅读插入说明以及完整的处方信息。
插入PROBUPHINE之前,请确认:
- 患者没有使用丙丁啡的禁忌症[见禁忌症(4)] 。
- 该患者有病史和身体检查。
- 患者了解普罗布定的益处和风险。
- 患者已收到包装中随附的《用药指南》副本。
- 患者对插入期间使用的防腐剂和麻醉剂没有过敏。
在无菌条件下插入PROBUPHINE。
植入种植体需要以下设备:
- 供患者躺卧的检查床
- 仪器支架,无菌托盘
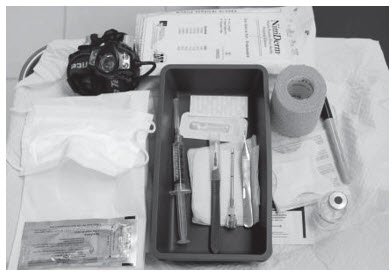
- 充足的照明(例如前照灯)
- 无菌开孔悬垂窗帘
- 不含乳胶和滑石粉的无菌手套
- 乙醇制备
- 手术标记
- 消毒液(如洗必泰)
- 局部麻醉(1%利多卡因与肾上腺素1:100,000)
- 带1.5英寸25g针的5 mL注射器
- Adson单牙组织钳
- #15刀片手术刀
- ¼英寸薄胶条(蝴蝶胶条)(例如,Steri条状皮肤封口)
- 4×4无菌纱布
- 创可贴
- 3英寸压力绷带
- 液体粘合剂(例如Mastisol)
- 4种PROBUPHINE植入物
- 1个PROBUPHINE一次性涂抹器(图1)
涂药器及其零件如图1所示。
正确执行植入物的皮下插入将有助于将其移除。植入物应放置在皮肤下,以避免皮下深层组织中的大血管。如果植入物放置不当,导致组织深处植入,则植入物将更难以取出。
图1

插入程序
步骤1.让患者躺在他/她的背上,使预定的手臂在肘部弯曲并向外旋转,以便将手放在头部旁边(图2)。
图2

步骤2.识别插入部位,该部位位于肱二头肌和肱三头肌之间的沟内肱骨上above上方上方8-10厘米(3-4英寸)处。让患者弯曲二头肌可以促进部位的识别(图3)。
图3

步骤3.在标记皮肤之前,用酒精准备垫清洁插入部位。
步骤4.用手术标记物标记插入部位。植入物将通过2.5 mm-3mm的皮下小切口插入。
步骤5.使用手术标记,通过画4条线(每条线的长度为4厘米)来标记每个植入物将插入的通道轨迹。植入物将以4-6 mm的紧密扇形分布放置,扇形朝向肩部开口(图4)。植入物在插入时彼此靠得越近,它们越容易被移除。正确放置植入物后,切口与植入物之间至少应有5 mm的距离。
图4

步骤6.戴上无菌手套。
步骤7.使用无菌技术,将无菌设备,PROBUPHINE植入物和涂药器放在仪器支架的无菌区域。一个施用器用于插入所有四个植入物。
步骤8.通过从套管中取出填塞器并将其重新锁定,检查涂抹器功能。
步骤9.反复反复反复使用消毒液(例如洗必泰)清洁插入部位30秒钟。使用三支棉签棒涂抹器时,请在30秒内依次使用每个棉签棒。让该区域风干约30秒钟,并且不要弄脏或擦去。
步骤10.将无菌的悬垂布应用于患者的手臂。
步骤11。使用局部麻醉剂(例如,以1%100,000肾上腺素注射5 mL利多卡因),沿计划插入通道麻醉切口部位和皮肤正下方的插入区域。
步骤12.在确定麻醉是适当且有效的之后,进行一个长度为2.5-3 mm的浅切口。
步骤13.用带齿的镊子抬起切口的边缘。在对皮肤施加反作用力时,仅以微小角度(不大于20度)将施药器的尖端插入皮下空间(皮肤下方3-4毫米的深度),并用斜角挡块套管上的标记朝上,闭塞器完全锁定在套管中时可见(图5)。
图5

图6

图7

步骤14.将施药器降低至水平位置,用施药器的尖端将皮肤提起,但将套管保持在皮下结缔组织中(图6)。拉伸(抬起)时,沿着皮肤上的通道标记将涂药器沿皮下轻轻推进,直到套管上的近端标记刚好消失在切口中(图7)。
步骤15.在将插管固定到位的同时,松开密闭器并卸下密闭器。
步骤16.将一种植入物插入套管(图8),重新插入密闭器,然后轻轻向前推动密闭器(应该感觉到轻微的阻力),直到密闭器止动线与斜面止动标记齐平为止植入物位于插管的尖端(图9)。请勿用闭塞器将植入物推到套管末端之外。正确放置植入物后,切口与植入物之间应至少有5 mm。
| 图8 | 图9 |
|
|
步骤17.在将填塞器固定在手臂上的位置的同时,沿着填塞器缩回套管,将植入物留在原处(图10)。注意:请勿推动闭孔器。通过将填塞器固定在手臂上的适当位置并缩回套管,植入物将留在其正确的皮下位置。
图10

步骤18.抽出套管,直到针座与填塞器齐平,然后顺时针旋转填塞器以锁定在套管上(图11)。缩回涂药器,向上倾斜,直到在切口开口处看到套管的远端标记(皮下空间中保留着锋利的尖端)。
图11

步骤19.将敷贴器重定向到下一个通道标记,同时用食指将先前插入的植入物稳定在远离尖头的位置(图12)。遵循步骤13到16,将三个剩余的植入物通过同一切口插入,将植入物以扇形分布的紧密形状放置在植入物顶部,间隔为4-6 mm。现在可以移除涂药器。
图12

步骤20.插入后立即通过触诊患者的手臂来验证每个植入物的存在。通过触摸植入物的两端,您应该能够确认26 mm植入物的存在(图13)。如果您无法感觉到四个植入物的每一个,或者对它们的存在有疑问,请使用其他方法来确认植入物的存在。合适的定位方法是:用高频线性阵列换能器(10 MHz或更高)进行超声检查或磁共振成像(MRI)。请注意,PROBUPHINE植入物不透射线,无法通过X射线或CT扫描看到。如果超声和MRI失败,请致电1-844-859-6341 。
图13

步骤21.如有必要,对切口部位施加压力约5分钟。
步骤22.清洁切口部位。在皮肤边缘上涂上液态粘合剂,并使其干燥,然后再用¼英寸薄的粘合带(蝴蝶带)(例如Steri条状皮肤闭合剂)闭合切口。
步骤23.在插入部位上放一个小的绷带。
步骤24.用无菌纱布包扎压力绷带,以最大程度地减少瘀伤。压力绷带可以在24小时内移除,而粘性绷带可以在三至五天内移除。
步骤25.填写患者识别卡并将其交给患者保存。另外,请完成“患者图表标签”并将其粘贴到患者病历或扫描或输入电子病历。向患者提供《用药指南》,并说明对插入部位的适当护理。
步骤26.涂抹器仅供一次性使用。按照疾病控制和预防中心关于危险废物的指南处理涂药器。
步骤27.指导患者在头24小时内根据需要每两小时在他/她的手臂上应用冰袋40分钟。
步骤28.填写PROBUPHINE REMS插入/删除日志表格。
脯氨酸的去除程序
在启动删除程序之前,请阅读删除说明。
通过咨询患者识别卡和/或患者图表贴纸来识别植入物的位置。手臂上所有植入物的确切位置(患者将有四个植入物)应通过触诊加以验证。
如果所有植入物都不可触及,请使用其他方法确认是否存在植入物。不可触及的植入物应始终放置在尝试移除之前。定位植入物的合适方法是:用高频线性阵列换能器(10 MHz或更高)进行超声检查或磁共振成像(MRI)。请注意,PROBUPHINE植入物不是不透射线的,并且无法通过X射线或CT扫描看到。
通过致电1-844-859-6341进行公司监视,以报告使用MRI或超声未能定位不可触及植入物的任何事件。
定位不可触及的植入物后,应在超声引导下进行切除。不建议进行不知道所有植入物确切位置的探索性手术。
在移除比皮下空间更深的植入物时,存在较大的神经和血管结构受伤风险。由于在移除深度插入的植入物时必须考虑这些结构的解剖位置,因此仅应由熟悉此解剖结构的医疗服务提供者尝试进行此手术。在REMS计划中无需咨询经过协助以进行困难切除的外科专家。
制备
去除PROBUPHINE之前,请确认:
- 患者对要使用的防腐剂或麻醉剂没有过敏。
植入物应在无菌条件下取出。
需要以下设备来去除种植体:
- 供患者躺卧的检查床
- 仪器架
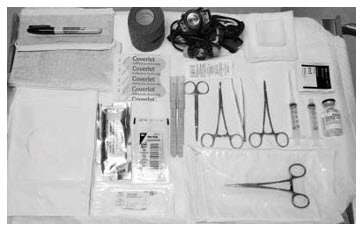
- 无菌托盘
- 充足的照明(例如前照灯)
- 无菌开窗的窗帘
- 不含乳胶和滑石粉的无菌手套
- 乙醇制备
- 消毒液(如洗必泰)
- 手术标记
- 局部麻醉(例如1%利多卡因与肾上腺素1:100,000)
- 带1.5英寸25g针头的5 mL注射器
- Adson单牙组织钳
- 蚊子钳
- 两个X形植物夹具(环直径2.5毫米的输精管固定夹具)
- 虹膜剪刀
- 针驱动器
- #15刀片手术刀
- 不育标尺
- 4×4无菌纱布
- 粘性绷带
- 3英寸压力绷带
- 缝合线(例如带有FS-2切割针的4-0 Prolene™)(可以吸收)
拆卸程序
步骤1.让患者仰卧,植入臂在肘部弯曲并向外旋转,以便将手放在头部旁边。
步骤2.通过触诊重新确认植入物的位置。
步骤3.在标记皮肤之前,用酒精准备垫清洁去除部位。
步骤4.用手术标记物标记植入物的位置。此外,在第二个和第三个植入物之间标记平行于手臂轴线的切口位置(图14)。
图14

步骤5.戴上无菌手套。
步骤6.使用无菌技术,将无菌设备放在仪器支架的无菌区域。
第7步。用消毒液(例如洗必泰)清洁移出部位,并反复轻柔地前后划动30秒钟。使用三支棉签棒涂抹器时,请在30秒内依次使用每个棉签棒。让该区域风干约30秒钟,并且不要弄脏或擦去。
第8步。将无菌的盖布套在患者的手臂上。
步骤9.麻醉切口部位和包含植入物的皮下空间(例如,通过注射1%肾上腺素5-7 mL利多卡因和1:100,000肾上腺素)。可将单独的针头用于切口部位和皮下注射。注意:请确保在植入物下方注入局部麻醉剂。这将有效地将植入物向皮肤提起,促进了植入物的去除。
步骤10.在确定麻醉是适当且有效的之后,在第二个和第三个植入物之间用解剖刀切开7-10 mm的切口,平行于手臂的轴线。
步骤11.用Adson单齿组织钳夹起皮肤边缘,并用虹膜剪刀或弯曲的蚊钳将第一个可视化植入物上方和下方的组织分开(图15)。用X植物夹夹住植入物的中心,并轻轻牵引。使用虹膜剪刀或蚊子钳撒布和闭合的技术分离纤维组织(图16)。如果植入物被封装,请使用手术刀刮除组织鞘并仔细解剖植入物周围的组织。然后可以去除植入物。
| 图15 | 图16 |
 |  |
第12步。将下一个可见的植入物向切开口缩回。如果周围的组织仍粘附在植入物上,此时您可能会看到皮肤的拉紧。继续对近端和远端进行解剖时,要对植入物保持轻柔的牵引力,直到植入物没有所有粘附的组织。此时,您可能需要使用第二个X植物夹来卸下植入物。如果植入物被封装,请使用手术刀刮除组织鞘并仔细解剖植入物周围的组织。然后可以去除植入物。
步骤13.取下每个植入物后,通过测量其长度,确认已去除了整个26 mm长的植入物。如果去除了部分植入物(小于26毫米),则应按照相同的去除说明去除剩余的部分。按照步骤11到13,通过同一切口取出剩余的植入物。目视确定是否已去除整个植入物是不可靠的。因此,重要的是测量植入物以确保整个植入物都已被移除。
步骤14.移除所有四个植入物后,清洁切口部位。
步骤15.用缝线闭合切口。
步骤16.在伤口上放置绷带。
步骤17。使用无菌纱布,对切口部位施加五分钟的压力以确保止血。
步骤18.用无菌纱布包扎压力绷带,以最大程度地减少瘀伤。可以在24小时内去除压力绷带,并在三到五天内去除粘合剂绷带。
步骤19.建议患者进行适当的无菌伤口护理。指导患者在头24小时内根据需要每两小时向他/她的手臂上敷一次冰袋40分钟。
步骤20.为要移除的缝线安排约会。
步骤21.取出的植入物包含大量残留的丁丙诺啡。必须按照表III药品的设施程序以及适用的联邦,州和地方法规,以足够的安全性,问责制和适当的处置方式来处理它。 PROBUPHINE植入物的处置也应符合管理药物生物危害性废物的地方,州和联邦法规。
步骤22.完成PROBUPHINE REMS插入/移除日志表格。
如果在移除尝试期间未移除植入物或植入物碎片,则患者应尽快进行成像以定位。随后的删除尝试应在本地化的同一天执行。如果在需要进行局部定位成像的最初去除尝试的同一天未进行定位和第二次去除尝试,则应在此期间使用缝合线闭合伤口。
自发驱逐
如果在插入后发生植入物的自发排出,应采取以下步骤。
- 为患者安排两次约会,以便他们尽快返回到插入的医疗保健提供者的办公室,再回到处方医疗保健提供者的办公室。
- 指示患者将植入物放在塑料袋中,安全地存放在儿童无法触及的地方,然后将其带到医疗保健提供者办公室以确定是否已将完整的植入物排出。
- 如果患者退回被驱逐的植入物,请对其进行测量以确保整个植入物都被驱逐了(26 mm)。
- 测量后,应按照管理药物生物危害性废物处置的地方,州和联邦法规,对取出的植入物进行处置。
- 检查切口部位是否感染。如果被感染,请进行适当处理并确定是否需要去除剩余的植入物。
- 如果被驱逐的植入物不是完整的,则触摸插入位置以识别任何剩余的部分植入物的位置。使用上述技术去除剩余的部分植入物。
- 致电1-844-859-6341以获取一个新套件,其中将包括四个植入物,并返回任何未使用的植入物的说明。
- 开处方的HCP必须仔细监测患者,直到更换植入物以评估戒断或其他可能需要补充经粘膜丁丙诺啡的临床指标为止。
- 安排预约以插入替换种植体。
- 将替换植入物从原位植入物的内侧或外侧插入同一臂。或者,可将替换植入物插入对侧臂中。
- 在PROBUPHINE REMS插入/移除日志表格中记录新的序列号
继续治疗:随后将PROBUPHINE插入对侧臂
除了在每个手臂中单次插入PROBUPHINE之外,没有临床经验。如果需要在前六个月的治疗周期结束时继续治疗,则在上述插入步骤之后,应将PROBUPHINE植入物从对侧臂中取出时用新的植入物替换,以找到合适的插入部位。
如果在摘除的同一天未插入新的植入物,则应在继续进行PROBUPHINE治疗之前维持患者先前的跨粘膜丁丙诺啡剂量(即转移至PROBUPHINE治疗的剂量) [请参阅剂量和用法( 2.6),警告和注意事项(5.1)] 。
没有将额外的植入物插入手臂的其他部位的经验,无法推荐再次插入以前使用过的手臂的方法。没有研究过重新插入先前使用的给药部位或上臂以外的部位。避免先前植入的部位很重要,因为尚未评估过往使用的插入部位的疤痕和纤维化对PROBUPHINE有效性或插入安全性的影响。每只手臂插入一次后,仅当继续使用PROBUPHINE的潜在益处大于其他插入和移除程序的潜在风险时,才应考虑其他治疗周期,并应考虑医疗保健提供者在PROBUPHINE程序及相关程序方面的经验,以及患者持续进行皮下药物治疗的临床需求。在大多数情况下,应将患者转回使用含黏膜丁丙诺啡的产品以继续治疗。
与插入和移除相关的风险
异丙酚的插入和去除与该过程导致植入物迁移,突出和排出的风险有关。罕见但严重的并发症,包括神经损伤和迁移导致栓塞和死亡,这可能是由于将药物植入物未正确插入上臂而导致的。其他并发症可能包括局部迁移,突出和排出。不完全的插入或感染可能导致突出或驱逐。 [请参阅警告和注意事项(5.1) ] 。
由于存在与插入和移除相关的风险,因此只能通过称为Probuphine REMS程序的受限程序来使用Probuphine。在进行插入或处方Probuphine植入物之前,所有医疗保健提供者必须成功完成有关插入和取出程序的现场培训计划并获得认证。必须对患者进行监视,以确保经执行插入操作的医疗保健提供者已将丙丁啡清除。 [请参阅警告和注意事项(5.2) ]。
1.适应症和用途
对于已经中和低剂量的经粘膜含丁丙诺啡的产品(即Subutex或Suboxone的每日剂量不超过8毫克),已经实现并持续延长临床稳定性的患者,普罗布啡适用于维持阿片类药物依赖性的治疗舌下平板电脑或同类通用)。
普罗布啡应作为完整治疗方案的一部分,以包括咨询和社会心理支持。
丙丁啡不适合新进入治疗的患者以及尚未达到和维持长期临床稳定性的患者,而丁丙诺啡每天维持8 mg或更少的Subutex或Suboxone舌下等效片或仿制药等效物维持。
2.剂量和给药
。药物成瘾治疗法
根据美国21法规(USC)823(g)编纂的《药物成瘾治疗法》(DATA),本产品用于治疗阿片类药物依赖性仅限于满足某些合格要求并已通知秘书的医疗保健提供者。美国卫生和人类服务部(HHS)打算开处方或分配该产品以治疗阿片类药物依赖性,并已分配了唯一的识别号,该号必须包含在每个处方中。
。重要剂量和管理信息
异丙酚植入物仅应用于阿片类药物耐受的患者。
每个剂量由四个Probuphine植入物组成,这些植入物被皮下插入上臂内侧。
普鲁啡精皮下植入物应放置6个月。在第六个月月底之前移走Probuphine植入物。
如果需要继续治疗,可将新的植入物皮下插入任一上臂内侧的区域,该区域在取出时以前未曾使用过。如果在摘除植入物的同一天未插入新的植入物,则在进行其他丙布啡治疗之前,应让患者保持其先前的跨粘膜丁丙诺啡剂量(即,从他们转入丙布啡治疗的剂量)。
每只手臂一次插入后,大多数患者应转回含跨粘膜的丁丙诺啡产品继续治疗。没有将额外的植入物插入手臂的其他部位的经验,无法推荐再次插入以前使用过的手臂的方法。既不重新插入先前使用的给药位点,也不成比上臂其他站点,已经研究[见剂量和给药(2.4 , 2.5 ,和2.9) ,警告和注意事项(5.1) ]。
。医疗保健提供者培训
所有打算开处方丙布啡的医疗服务提供者必须成功完成现场培训计划[请参阅警告和注意事项(5.2) ]。
所有执行异丙酚插入和/或取出的医疗服务提供者必须成功完成现场培训计划,并在插入或取出植入物之前证明其程序能力。
可以通过致电1-844-859-6341获得有关插入和移除过程的信息。成功使用和随后脱除Probuphine的基础是按照说明正确正确地对四个植入物进行皮下植入。作为参加获得认证的实时培训计划的先决条件,医疗服务提供者必须在最近3个月中至少执行了一项合格的手术程序。合格程序是使用无菌技术在局部麻醉下进行的程序,至少包括皮肤切口或缝合线[请参见警告和注意事项(5.2) ] 。
。患者选择
异丙酚植入物仅用于满足以下所有条件的患者:
- 在跨粘膜丁丙诺啡上获得并持续延长的临床稳定性
- 目前维持Subutex或Suboxone舌下片剂或其等效剂量的透粘膜丁丙诺啡产品的维持剂量为每天8 mg或更少(透粘膜丁丙诺啡的剂量可提供可比或低于丙丁啡的血液水平)
- 不应仅将患者逐渐减少剂量以转用普鲁啡定
- 稳定的透粘膜丁丙诺啡剂量(每天舌下Subutex片或Suboxone舌下片剂或其透粘膜丁丙诺啡产品当量为8 mg或更少),三个月或更长时间,无需任何补充剂量或调整
可接受的透粘膜丁丙诺啡剂量包括:
- Subutex(丁丙诺啡)舌下片(一般等效量)8 mg或更少
- Suboxone(丁丙诺啡和纳洛酮)舌下片(通用当量)8 mg / 2 mg或更少
- Bunavail(丁丙诺啡和纳洛酮)颊膜4.2 mg / 0.7 mg以下
- Zubsolv(丁丙诺啡和纳洛酮)舌下片剂5.7 mg / 1.4 mg或更少
在确定临床稳定性和适用于丙丁啡治疗的适用性时,请考虑以下因素:
- 没有非法使用阿片类药物的时期
- 生活环境稳定
- 参与结构化活动/工作
- 参与推荐的行为疗法/同伴支持计划的一致性
- 符合门诊要求的一致性
- 极少甚至没有欲望或需要使用非法阿片类药物
- 没有住院(成瘾或精神健康问题),急诊室就诊或危机干预的时间段
- 社会支持系统
。临床监督
异丙酚插入后一周检查插入部位是否有感染迹象或伤口愈合是否有问题,包括植入物从皮肤挤出的迹象。
对于大多数患者,建议的访视时间表应不少于每月一次,以进行持续的咨询和社会心理支持。
尽管有些患者可能偶尔需要补充丁丙诺啡剂量,但不应为患者提供按需使用经粘膜含丁丙诺啡产品的处方。取而代之的是,应该及时发现并评估需要补充剂量的患者。持续使用经粘膜丁丙诺啡补充给药表明丙丁啡输送的丁丙诺啡的量不足以稳定维持。考虑使用替代丁丙诺啡产品以维持治疗。
。插入布洛芬
制备
在插入普罗布啡之前,请仔细阅读插入说明以及完整的处方信息。
在插入普鲁啡定之前,请确认:
- 患者没有使用丙丁啡的禁忌症[见禁忌症(4) ] 。
- 该患者有病史和身体检查。
- 病人了解普罗布啡的益处和风险。
- 患者已收到包装中随附的《用药指南》副本。
- 患者对插入期间使用的防腐剂和麻醉剂没有过敏。
在无菌条件下插入丙丁啡。
植入种植体需要以下设备:
- 供患者躺卧的检查床
- 仪器支架,无菌托盘

- 充足的照明(例如前照灯)
- 无菌开孔悬垂窗帘
- 不含乳胶和滑石粉的无菌手套
- 乙醇制备
- 手术标记
- 消毒液(如洗必泰)
- 局部麻醉(1%利多卡因与肾上腺素1:100,000)
- 带1.5英寸25g针头的5 mL注射器
- Adson单牙组织钳
- #15刀片手术刀
- ¼英寸薄胶条(蝴蝶胶条)(例如,Steri条状皮肤封口)
- 4×4无菌纱布
- 创可贴
- 3英寸压力绷带
- 液体粘合剂(例如Mastisol)
- 4种异丙肾上腺素植入物
- 1个Probuphine一次性涂抹器(图1)
涂药器及其零件如图1所示。
正确执行植入物的皮下插入将有助于将其移除。植入物应放置在皮肤下,以避免皮下深层组织中的大血管。如果植入物放置不当,导致组织深处植入,则植入物将更难以取出。
图1

插入程序
步骤1.让患者躺在他/她的背上,使预定的手臂在肘部弯曲并向外旋转,以便将手放在头部旁边(图2)。
图2

步骤2.识别插入部位,该部位位于肱二头肌和肱三头肌之间的沟内肱骨上above上方上方8-10厘米(3-4英寸)处。让患者弯曲二头肌可以促进部位的识别(图3)。
图3

步骤3.在标记皮肤之前,用酒精准备垫清洁插入部位。
步骤4.用手术标记物标记插入部位。植入物将通过2.5 mm-3mm的皮下小切口插入。
步骤5.使用手术标记,通过画4条线(每条线的长度为4厘米)来标记每个植入物将插入的通道轨迹。植入物将以4-6 mm的紧密扇形分布放置,扇形朝向肩部开口(图4)。植入物在插入时彼此靠得越近,它们越容易被移除。正确放置植入物后,切口与植入物之间应至少有5 mm。
图4

步骤6.戴上无菌手套。
步骤7.使用无菌技术,将无菌设备,丙丁啡植入物和涂药器放在仪器支架的无菌区域。一个施用器用于插入所有四个植入物。
步骤8.通过从套管中取出填塞器并将其重新锁定,检查涂抹器功能。
步骤9.反复反复反复使用消毒液(例如洗必泰)清洁插入部位30秒钟。使用三支棉签棒涂抹器时,请在30秒内依次使用每个棉签棒。让该区域风干约30秒钟,并且不要弄脏或擦去。
步骤10.将无菌的悬垂布应用于患者的手臂。
步骤11。使用局部麻醉剂(例如,以1%100,000肾上腺素注射5 mL利多卡因),沿计划插入通道麻醉切口部位和皮肤正下方的插入区域。
步骤12.在确定麻醉是适当且有效的之后,进行一个长度为2.5-3 mm的浅切口。
步骤13.用带齿的镊子抬起切口的边缘。在对皮肤施加反作用力时,仅以微小角度(不大于20度)将施药器的尖端插入皮下空间(皮肤下方3-4毫米的深度),并用斜角挡块套管上的标记朝上,闭塞器完全锁定在套管中时可见(图5)。
图5

图6

图7

步骤14.将施药器降低至水平位置,用施药器的尖端将皮肤提起,但将套管保持在皮下结缔组织中(图6)。拉伸(抬起)时,沿着皮肤上的通道标记将涂药器沿皮下轻轻推进,直到套管上的近端标记刚好消失在切口中(图7)。
步骤15.在将插管固定到位的同时,松开密闭器并卸下密闭器。
步骤16.将一种植入物插入套管(图8),重新插入密闭器,然后轻轻向前推动密闭器(应该感觉到轻微的阻力),直到密闭器止动线与斜面止动标记齐平为止植入物位于插管的尖端(图9)。请勿用闭塞器将植入物推到套管末端之外。正确放置植入物后,切口与植入物之间应至少有5 mm。
| 图8 | 图9 |
|
|
步骤17.在将填塞器固定在手臂上的位置的同时,沿着填塞器缩回套管,将植入物留在原处(图10)。注意:请勿推动闭孔器。通过将填塞器固定在手臂上的适当位置并缩回套管,植入物将留在其正确的皮下位置。
图10

步骤18.抽出套管,直到针座与填塞器齐平,然后顺时针旋转填塞器以锁定在套管上(图11)。缩回涂药器,向上倾斜,直到在切口开口处看到套管的远端标记(皮下空间中保留着锋利的尖端)。
图11

步骤19.将敷贴器重定向到下一个通道标记,同时用食指将先前插入的植入物稳定在远离尖头的位置(图12)。遵循步骤13到16,将三个剩余的植入物通过同一切口插入,将植入物以扇形分布的紧密形状放置在植入物顶部,间隔为4-6 mm。现在可以移除涂药器。
图12

步骤20.插入后立即通过触诊患者的手臂来验证每个植入物的存在。通过触摸植入物的两端,您应该能够确认26 mm植入物的存在(图13)。如果您无法感觉到四个植入物的每一个,或者对它们的存在有疑问,请使用其他方法来确认植入物的存在。合适的定位方法是:用高频线性阵列换能器(10 MHz或更高)进行超声检查或磁共振成像(MRI)。请注意,Probuphine植入物不透射线,无法通过X射线或CT扫描看到。如果超声和MRI失败,请致电1-844-859-6341 。
图13

步骤21.如有必要,对切口部位施加压力约5分钟。
步骤22.清洁切口部位。在皮肤边缘上涂上液态粘合剂,并使其干燥,然后再用¼英寸薄的粘合带(蝴蝶带)(例如Steri条状皮肤闭合剂)闭合切口。
步骤23.在插入部位上放一个小的绷带。
步骤24.用无菌纱布包扎压力绷带,以最大程度地减少瘀伤。压力绷带可以在24小时内移除,而粘性绷带可以在三至五天内移除。
步骤25.填写患者识别卡并将其交给患者保存。另外,请完成“患者图表标签”并将其粘贴到患者病历或扫描或输入电子病历。向患者提供《用药指南》,并说明对插入部位的适当护理。
步骤26.涂抹器仅供一次性使用。按照疾病控制和预防中心关于危险废物的指南处理涂药器。
步骤27.指导患者在头24小时内根据需要每两小时在他/她的手臂上应用冰袋40分钟。
步骤28.填写Probuphine REMS插入/删除日志表格。
。异丙酚去除程序
在启动删除程序之前,请阅读删除说明。
通过咨询患者识别卡和/或患者图表贴纸来识别植入物的位置。手臂上所有植入物的确切位置(患者将有四个植入物)应通过触诊加以验证。
如果所有植入物都不可触及,请使用其他方法确认是否存在植入物。不可触及的植入物应始终放置在尝试移除之前。定位植入物的合适方法是:用高频线性阵列换能器(10 MHz或更高)进行超声检查或磁共振成像(MRI)。请注意,Probuphine植入物不是不透射线的,并且无法通过X射线或CT扫描看到。
通过致电1-844-859-6341进行公司监视,以报告使用MRI或超声未能定位不可触及植入物的任何事件。
定位不可触及的植入物后,应在超声引导下进行切除。不建议进行不知道所有植入物确切位置的探索性手术。
在移除比皮下空间更深的植入物时,存在较大的神经和血管结构受伤风险。由于在移除深度插入的植入物时必须考虑这些结构的解剖位置,因此仅应由熟悉此解剖结构的医疗服务提供者尝试进行此手术。在REMS计划中无需咨询经过协助以进行困难切除的外科专家。
制备
在去除异丙酚之前,请确认:
- 患者对要使用的防腐剂或麻醉剂没有过敏。
植入物应在无菌条件下取出。
需要以下设备来去除种植体:
- 供患者躺卧的检查床
- 仪器架

- 无菌托盘
- 充足的照明(例如前照灯)
- 无菌开窗的窗帘
- 不含乳胶和滑石粉的无菌手套
- 乙醇制备
- 消毒液(如洗必泰)
- 手术标记
- 局部麻醉(例如1%利多卡因与肾上腺素1:100,000)
- 带1.5英寸25g针头的5 mL注射器
- Adson单牙组织钳
- 蚊子钳
- 两个X形植物夹具(环直径2.5毫米的输精管固定夹具)
- 虹膜剪刀
- 针驱动器
- #15刀片手术刀
- 不育标尺
- 4×4无菌纱布
- 粘性绷带
- 3英寸压力绷带
- 缝合线(例如带有FS-2切割针的4-0 Prolene™)(可以吸收)
拆卸程序
步骤1.让患者仰卧,植入臂在肘部弯曲并向外旋转,以便将手放在头部旁边。
步骤2.通过触诊重新确认植入物的位置。
步骤3.在标记皮肤之前,用酒精准备垫清洁去除部位。
步骤4.用手术标记物标记植入物的位置。此外,在第二个和第三个植入物之间标记平行于手臂轴线的切口位置(图14)。
图14

步骤5.戴上无菌手套。
步骤6.使用无菌技术,将无菌设备放在仪器支架的无菌区域。
第7步。用消毒液(例如洗必泰)清洁移出部位,并反复轻柔地前后划动30秒钟。使用三支棉签棒涂抹器时,请在30秒内依次使用每个棉签棒。让该区域风干约30秒钟,并且不要弄脏或擦去。
第8步。将无菌的盖布套在患者的手臂上。
步骤9.麻醉切口部位和包含植入物的皮下空间(例如,通过注射1%肾上腺素5-7 mL利多卡因和1:100,000肾上腺素)。可将单独的针头用于切口部位和皮下注射。注意:请确保在植入物下方注入局部麻醉剂。这将有效地将植入物向皮肤提起,促进了植入物的去除。
步骤10.在确定麻醉是适当且有效的之后,在第二个和第三个植入物之间用解剖刀切开7-10 mm的切口,平行于手臂的轴线。
步骤11.用Adson单齿组织钳夹起皮肤边缘,并用虹膜剪刀或弯曲的蚊钳将第一个可视化植入物上方和下方的组织分开(图15)。用X植物夹夹住植入物的中心,并轻轻牵引。使用虹膜剪刀或蚊子钳撒布和闭合的技术分离纤维组织(图16)。如果植入物被封装,请使用手术刀刮除组织鞘并仔细解剖植入物周围的组织。然后可以去除植入物。
| 图15 | 图16 |
 |  |
第12步。将下一个可见的植入物向切开口缩回。如果周围的组织仍粘附在植入物上,此时您可能会看到皮肤的拉紧。继续对近端和远端进行解剖时,要对植入物保持轻柔的牵引力,直到植入物没有所有粘附的组织。此时,您可能需要使用第二个X植物夹来卸下植入物。如果植入物被封装,请使用手术刀刮除组织鞘并仔细解剖植入物周围的组织。然后可以去除植入物。
步骤13.取下每个植入物后,通过测量其长度,确认已去除了整个26 mm长的植入物。如果去除了部分植入物(小于26毫米),则应按照相同的去除说明去除剩余的部分。按照步骤11到13,通过同一切口取出剩余的植入物。目视确定是否已去除整个植入物是不可靠的。因此,重要的是测量植入物以确保整个植入物都已被移除。
步骤14.移除所有四个植入物后,清洁切口部位。
步骤15.用缝线闭合切口。
步骤16.在伤口上放置绷带。
步骤17。使用无菌纱布,对切口部位施加五分钟的压力以确保止血。
步骤18.用无菌纱布包扎压力绷带,以最大程度地减少瘀伤。可以在24小时内去除压力绷带,并在三到五天内去除粘合剂绷带。
步骤19.建议患者进行适当的无菌伤口护理。指导患者在头24小时内根据需要每两小时向他/她的手臂上敷一次冰袋40分钟。
步骤20.为要移除的缝线安排约会。
步骤21.取出的植入物包含大量残留的丁丙诺啡。必须按照表III药品的设施程序以及适用的联邦,州和地方法规,以足够的安全性,问责制和适当的处置方式来处理它。异丙酚植入物的处置也应符合管理药物生物危害性废物的地方,州和联邦法规。
步骤22.填写Probuphine REMS插入/移除日志表格。
如果在移除尝试期间未移除植入物或植入物碎片,则患者应尽快进行成像以定位。随后的删除尝试应在本地化的同一天执行。如果在需要进行局部定位成像的最初去除尝试的同一天未进行定位和第二次去除尝试,则应在此期间使用缝合线闭合伤口。
。自发驱逐
如果在插入后发生植入物的自发排出,应采取以下步骤。
- 为患者安排两次约会,以便他们尽快返回到插入的医疗保健提供者的办公室,再回到处方医疗保健提供者的办公室。
- 指示患者将植入物放在塑料袋中,安全地存放在儿童无法触及的地方,然后将其带到医疗保健提供者办公室以确定是否已将完整的植入物排出。
- 如果患者退回被驱逐的植入物,请对其进行测量以确保整个植入物都被驱逐了(26 mm)。
- 测量后,应按照管理药物生物危害性废物处置的地方,州和联邦法规,对取出的植入物进行处置。
- 检查切口部位是否感染。如果被感染,请进行适当处理并确定是否需要去除剩余的植入物。
- 如果被驱逐的植入物不是完整的,则触摸插入位置以识别任何剩余的部分植入物的位置。使用上述技术去除剩余的部分植入物。
- 致电1-844-859-6341以获取一个新套件,其中将包括四个植入物,并返回任何未使用的植入物的说明。
- 开处方的HCP必须仔细监测患者,直到更换植入物以评估戒断或其他可能需要补充经粘膜丁丙诺啡的临床指标为止。
- 安排预约以插入替换种植体。
- 将替换植入物从原位植入物的内侧或外侧插入同一臂。或者,可将替换植入物插入对侧臂中。
- 在Probuphine REMS插入/移除日志表格上记录新的序列号
。继续治疗:随后在对侧臂中插入异丙酚
除了在每只手臂中单次插入异丙酚外,没有临床经验。如果在头六个月的治疗周期结束时需要继续治疗,则在上述插入步骤之后,在对侧臂中取出合适的插入部位后,可将Probuphine植入物替换为对侧手臂中的新植入物。
如果在摘除当天未插入新的植入物,则应在继续进行异丙酚治疗之前维持患者以前的透粘膜丁丙诺啡剂量(即转移至异丙酚的剂量) [请参见剂量和用法( 2.6) ,警告和注意事项(5.1) ] 。
没有将额外的植入物插入手臂的其他部位的经验,无法推荐再次插入以前使用过的手臂的方法。没有研究过重新插入先前使用的给药部位或上臂以外的部位。避免先前植入的部位非常重要,因为尚未评估先前使用的插入部位的瘢痕形成和纤维化对异丙酚的有效性或插入安全性的影响。每只手臂插入一次后,只有在考虑到医护人员对异丙酚的操作及相关程序的经验后,继续服用异丙酚的潜在益处大于额外的插入和移除程序的潜在风险时,才应考虑额外的治疗周期。患者持续进行皮下药物治疗的临床需求。在大多数情况下,应将患者转回使用含黏膜丁丙诺啡的产品以继续治疗。
3.剂量形式和强度
每个Probuphine植入物均为无菌,单一,灰白色,柔软,柔软的棒状乙烯乙酸乙烯酯(EVA)植入物,长度为26 mm,直径为2.5 mm,包含74.2 mg丁丙诺啡(相当于80 mg buprenorphine)盐酸盐)。
4.禁忌症
有丙丁啡对丁丙诺啡或丙丁啡中任何其他成分(例如EVA)过敏的患者禁用。 [请参阅警告和注意事项(5.11) ]。
5.警告和注意事项
。异丙酚的插入和取出引起严重并发症
罕见但严重的并发症,包括神经损伤和迁移导致栓塞和死亡,这可能是由于将药物植入物未正确插入上臂而导致的。其他并发症可能包括局部迁移,突出和驱逐。
按照说明插入丙丁啡。 [参见适应症和用法(1) ,剂量和用法( 2.2、2.6) ] 。必须在皮下插入Probuphine,以便在插入后可以触摸到每个植入物。插入后立即通过触诊确认正确放置也很重要。如果Probuphine插入得太深(肌肉内或筋膜中),可能会发生神经或血管损伤。
不完全的插入或感染可能导致突出或驱逐。 [参见剂量和用法(2.8) ]。异丙酚的意外暴露可能是由于植入物的突出或排出引起的。 [请参阅警告和注意事项(5.8) ]。
如果植入物插入得太深,不可触摸或已迁移,则插入不当可能会导致复杂的切除。深度插入可能导致难以定位植入物。为了去除植入物,可能需要进行其他外科手术[参见剂量和用法( 2.6,2.7) ] 。取出深度插入的植入物时,可能会损伤手臂中较深的神经或血管结构。
在进行插入或处方Probuphine植入物之前,所有医疗保健提供者必须成功完成有关插入和取出程序的现场培训计划,并获得Probuphine REMS计划的认证。要获得插入普罗布定植入物的认证,还必须满足其他要求和先决条件。只有在过去三个月中执行过外科手术并且在现场培训中表现出异丙酚程序能力的医疗保健提供者才能获得执行插入手术的资格。必须对患者进行监控,以确保其被合格的可插入异丙酚植入物的医疗服务提供者去除了异丙酚。 [参见警告和注意事项(5.2) ] 。
。异丙酚REMS程序
异丙酚只能通过REMS的受限计划(称为Probuphine REMS计划)获得,因为存在与丙氨啡肽的插入和拔出相关的迁移,突出和驱逐以及神经损伤的并发症风险[请参阅警告和注意事项(5.1) ]。
Probuphine REMS程序的显着要求包括以下内容:
- 开处方丙丁啡的医疗保健提供者必须通过注册并完成实时培训而获得该计划的认证
- 插入异丙苯的医疗保健提供者必须
- 满足先决条件[请参阅剂量和管理(2.1)和警告和注意事项(5.1) ]
- 通过注册并完成实时培训获得该计划的认证,包括证明其具有Probuphine程序的能力
- 必须对患者进行监测,以确保其通过被许可插入异丙酚植入物的医疗服务提供者去除了异丙酚
- 异丙酚只能通过有限制的分发计划分发给认证的处方者
有关更多信息,请访问www.ProbuphineREMS.com或1-844-859-6341 。
。上瘾,滥用和滥用
丙丁啡含有丁丙诺啡,丁丙诺啡是一种附表三受控物质,可以类似于其他阿片类药物的方式滥用。丁丙诺啡是阿片类药物使用障碍患者寻求的药物,可能会被转移使用。在确定异丙酚是否适合患者时,应考虑这些风险以及患者对阿片类药物依赖的治疗稳定性。监测所有接受普鲁啡定的患者的症状,以指示阿片类药物依赖性和成瘾行为的转移或进展。
。危及生命的呼吸和中枢神经系统(CNS)抑郁症的风险
丁丙诺啡与威胁生命的呼吸抑制和死亡有关。关于昏迷和死亡的许多(但不是全部)上市后报告涉及自行注射误用或与丁丙诺啡和苯二氮卓类药物或其他中枢神经系统抑制剂(包括酒精)并用。
警告患者在用丙丁啡治疗期间可能会自行服用苯二氮卓类或其他中枢神经系统抑制剂[见警告和注意事项(5.5) ,药物相互作用(7) ,患者咨询信息(17) ] 。
对于呼吸功能受损的患者(例如,慢性阻塞性肺疾病,肺心病,呼吸储备降低,缺氧,高碳酸血症或先前存在的呼吸抑制),请谨慎使用普罗布啡。
阿片类药物可引起与睡眠有关的呼吸系统疾病,包括中枢性睡眠呼吸暂停(CSA)和与睡眠有关的低氧血症。阿片类药物的使用以剂量依赖性方式增加了CSA的风险。在患有CSA的患者中,可能需要去除异丙酚。
。并用苯二氮卓类或其他中枢神经系统抑制剂与丁丙诺啡的同时管理风险
丁丙诺啡和苯并二氮杂卓或其他中枢神经系统抑制剂同时使用会增加不良反应的风险,包括药物过量和死亡。但是,服用阿片类药物的患者不应绝对拒绝药物辅助治疗。单独由于阿片类药物使用障碍,禁止或创建治疗障碍会带来更高的发病率和死亡率风险。
作为丁丙诺啡治疗的常规常规部分,应教育患者有关并用苯二氮卓类,镇静剂,阿片类镇痛药和酒精的风险。
在开始丁丙诺啡治疗时或在治疗过程中出现问题时,制定策略来管理处方或非法的苯二氮卓类或其他中枢神经系统抑制剂的使用。可能需要对入职程序进行调整,并进行其他监视。没有证据支持限制剂量或任意限制丁丙诺啡作为解决在丁丙诺啡治疗患者中使用苯二氮卓类药物的策略。但是,如果在丁丙诺啡给药时给患者镇静,则在适当的情况下延迟或省略丁丙诺啡剂量。
在大多数同时使用的情况下,最好停止使用苯二氮卓类或其他中枢神经系统抑制剂。在某些情况下,对锥度进行更高级别的监护可能是合适的。在其他情况下,逐渐减少患者服用处方苯二氮卓或其他中枢神经系统抑制剂或降低至最低有效剂量可能是合适的。
对于丁丙诺啡治疗的患者,苯二氮卓不是焦虑或失眠的首选治疗方法。在共同处方苯二氮卓类药物之前,请确保已对患者进行了适当诊断,并考虑使用替代药物和非药物疗法来解决焦虑症或失眠症。确保开处方苯二氮卓类药物或其他中枢神经系统抑制剂的其他医疗保健提供者了解患者的丁丙诺啡治疗,并协调护理,以最大程度地减少伴随使用的风险。
此外,采取措施以确认患者正在按处方服用药物,并且没有转移或补充非法药物。毒理学筛查应测试处方和非法的苯二氮卓类药物[见药物相互作用(7) ]。
。新生儿阿片类药物戒断综合征
新生儿阿片类戒断综合征(NOWS)是妊娠期间长期使用阿片类药物的预期和可治疗结果,无论该使用是医疗许可还是非法的。与成人的阿片类药物戒断综合征不同,如果未在新生儿中发现和治疗,则NOWS可能会危及生命。医护人员应观察新生儿的NOWS征象,并进行相应的处理[请参见“在特定人群中使用(8.1) ” 。
建议使用丙丁啡接受阿片类药物成瘾治疗的孕妇新生儿类阿片戒断综合症的风险,并确保可获得适当的治疗[见在特殊人群中使用8.1 ] 。必须将这种风险与未经治疗的阿片类药物成瘾的风险相平衡,阿片类药物成瘾通常会导致持续或复发性的非法使用阿片类药物,并且与不良的妊娠结局有关。因此,处方者应讨论在整个怀孕期间控制阿片类药物成瘾的重要性和益处。
。肾上腺功能不全
据报道,使用阿片类药物导致肾上腺皮质功能不全的病例,多于使用一个月以上。肾上腺功能不全的表现可能包括非特异性症状和体征,包括恶心,呕吐,厌食,疲劳,虚弱,头晕和低血压。如果怀疑肾上腺功能不全,请尽快通过诊断测试确认诊断。如果诊断出肾上腺功能不全,请使用生理替代剂量的皮质类固醇治疗。使患者断奶,以使肾上腺功能恢复,并继续皮质类固醇治疗直至肾上腺功能恢复。可以尝试使用其他阿片类药物,因为有些病例报道使用了其他阿片类药物,但没有肾上腺功能不全的复发。可用的信息不能确定任何特定的阿片类药物更可能与肾上腺功能不全有关。
。意外小儿暴露
丁丙诺啡会导致意外接触的儿童严重,甚至致命的呼吸抑制。指导患者将被驱逐的植入物远离他人,尤其是儿童。
。阿片类药物突然停药后停用阿片类药物的风险
丁丙诺啡是μ阿片受体的部分激动剂,长期给药会产生阿片类药物的物理依赖性,其特征是突然停药或迅速减量后会出现戒断症状。戒断综合征比完全激动剂所见要轻,并且可能延迟发作[见药物滥用和依赖性( 9.2,9.3) ] 。如果在移除后不立即更换异丙酚植入物,则应维持患者以前的舌下丁丙诺啡剂量,直到恢复异丙酚治疗为止[见剂量和用法(2.2) ] 。选择停药的患者应进行退缩监测,并考虑使用逐渐减少剂量的透粘膜丁丙诺啡。
。肝炎,肝事件的风险
在临床试验和售后不良事件报告中,均已观察到接受舌下丁丙诺啡治疗阿片类药物依赖的个体发生了溶细胞性肝炎和黄疸性肝炎的病例。
异常的范围从肝转氨酶的短暂无症状升高到死亡,肝功能衰竭,肝坏死,肝肾综合征和肝性脑病的病例报告。在许多情况下,先前存在的肝酶异常,感染乙型肝炎或丙型肝炎病毒,同时使用其他潜在的肝毒性药物以及持续的注射毒品滥用可能起了致病或促成作用。在其他情况下,没有足够的数据来确定异常的病因。在某些情况下,丁丙诺啡可能会在肝异常的发生中起因或促进作用。建议在开始治疗之前进行肝功能检查以建立基线。还建议在治疗期间定期监测肝功能。如果怀疑有肝病事件,建议进行生物学和病因学评估。监测肝功能下降的患者的丁丙诺啡暴露量增加所引起的副作用。患者可能需要摘除Probuphine植入物。
。过敏反应
对丁丙诺啡和/或EVA的过敏反应是可能的。在临床试验和售后经验中都报告了对舌下丁丙诺啡过敏的病例。支气管痉挛,血管神经性水肿和过敏性休克的病例已有报道。最常见的体征和症状包括皮疹,荨麻疹和瘙痒。对丁丙诺啡或EVA过敏的病史是服用丙丁啡的禁忌症。
。完全激动剂阿片类药物依赖患者的阿片类药物戒断症状
由于丁丙诺啡的部分阿片样物质激动剂特性,在完全阿片样物质激动剂的作用减弱之前,丁丙诺啡可能会在目前身体上依赖于海洛因,吗啡或美沙酮等完全类阿片激动剂的人中引起类阿片戒断症状。在插入丙丁啡之前,请确保患者对跨粘膜丁丙诺啡临床稳定,并且不依赖于完全激动剂。
。与治疗急症相关的风险
在服用丙丁啡时,可能会出现需要急性疼痛治疗或可能需要麻醉的情况。尽可能用非阿片类镇痛药治疗接受丙丁啡的患者。需要镇痛用阿片类药物治疗的患者可以在医生的指导下接受高亲和力的完全阿片类镇痛药治疗,尤其要注意呼吸功能。为了止痛效果可能需要更高的剂量。因此,使用阿片类药物存在更高的毒性潜能。如果麻醉过程中需要使用阿片类药物治疗,则应由不参与手术或诊断程序的人员在麻醉护理中持续监测患者。阿片类药物的治疗必须由接受过麻醉药物使用和有效阿片类药物的呼吸作用管理(特别是建立和维持专利气道和辅助通气)培训的人员提供。
。用于肝功能受损的患者
在舌下丁丙诺啡的药代动力学研究中,发现丁丙诺啡的血浆水平较高,中度和重度肝功能不全患者的半衰期更长,但轻度肝功能不全患者则没有。尚未研究肝功能损害对植入的丁丙诺啡(如丙丁啡)的药代动力学的影响。
因为不能对丙啡肽进行滴定,所以已存在中度至重度肝功能不全的患者不适合使用丙啡肽治疗。在接受丙丁啡治疗期间发展为中度至重度肝功能不全的患者,应监测丁丙诺啡水平升高引起的毒性或用药过量的体征和症状,并且患者可能需要摘除丙丁啡植入物[请参见《特定人群的使用》(8.6) ,临床药理学(12) ]。
。驾驶和操作机械的能力受损
异丙酚可能会损害执行潜在危险任务(如驾驶汽车或操作机械)所需的智力或身体能力,尤其是在初次插入后的最初24-48小时内。警告患者驾驶或操作危险机械,直到他们合理地确定普罗啡定不会对他们从事此类活动的能力产生不利影响。
。体位性低血压
丙丁啡可在非卧床患者中产生体位性低血压。
。脑脊液压力升高
丁丙诺啡可能会升高脑脊液压力,在头部受伤,颅内病变以及其他可能增加脑脊液压力的情况下,应谨慎使用丁丙诺啡。丁丙诺啡可产生瞳孔缩小和意识水平改变,可能会干扰患者的评估。
。胆总管内压升高
已显示丁丙诺啡与其他阿片类药物一样会增加胆道内压,因此应谨慎对待胆道功能不全的患者。
。急性腹部疾病的影响
丁丙诺啡可能会掩盖急性腹部疾病患者的诊断或临床过程。
。植入部位感染
在插入或取出部位可能会发生感染。植入植入物后不久触诊过多可能会增加感染机会。清除不当会带来植入部位感染的风险。
6.不良反应
标签的其他部分详细讨论了以下不良反应:
- 插入和取出异丙酚引起的严重并发症[请参阅警告和注意事项(5.1) ]
- 上瘾,滥用和滥用[请参阅警告和注意事项(5.3) ]
- 呼吸系统和中枢神经系统抑郁症[请参阅警告和注意事项(5.4,5.5 ) ]
- 新生儿阿片类药物戒断综合征[请参阅警告和注意事项(5.6) ]
- 肾上腺功能不全[请参阅警告和注意事项(5.7) ]
- 阿片类药物戒断[请参阅警告和注意事项( 5.9,5.12) ]
- 肝炎,肝事件[请参阅警告和注意事项(5.10) ]
- 过敏反应[请参阅警告和注意事项(5.11) ]
- 体位性低血压[请参阅警告和注意事项(5.16) ]
- 脑脊液压力升高[请参阅警告和注意事项(5.17) ]
- 胆总管内压力升高[请参阅警告和注意事项(5.18) ]
- 感染[请参阅警告和注意事项(5.20) ]
。临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
丙丁啡的临床试验和其他使用丁丙诺啡片和丁丙诺啡舌下溶液的试验均支持丙丁啡的安全性。在三项双盲试验(n = 309)和两项开放标签延伸研究(n = 40)中,对349名阿片类药物依赖性受试者进行了丙丁啡的安全性评估。在这些研究中,共有258名受试者暴露于普罗啡至少24周,而82名受试者暴露于48周。在整个开发计划中,有568位独特的受试者接受了Probuphine植入物或安慰剂植入物的治疗,评估了Probuphine插入和去除程序的安全性,其中三项双盲试验中有507名受试者,两项开放标签延伸试验中有40名受试者,来自2个2期药代动力学研究的21名受试者。
总体上,可以从3000多个暴露于丁丙诺啡的阿片类药物依赖性受试者的临床研究中获得安全性数据,其剂量应在治疗阿片类药物依赖性的范围内。
表1显示了在三个为期6个月的双盲,三联丙丙啡第3期研究中,非联丙啡和比较组的非植入部位相关不良事件。 Probuphine组的患者接受了4-5种植入物的治疗,并且可能接受了舌下丁丙诺啡的补充治疗。安慰剂/ SL BPN比较组中的患者定期服用或根据需要舌下使用丁丙诺啡。有些有安慰剂植入物。不良事件使用《管制活动医学词典》(MedDRA,版本17)进行分类。
在表1中,Probuphine组中至少5%的患者中报告了MedDRA高水平组术语(HLGT),并且比对比例组中更常见,在其较高层组术语(HLGT)级别中列出了其下属的“首选术语” (PT)报告了2:1%的Probuphine患者(并且比比较者的频率高出至少0.5%)。下表中未涉及涉及植入物部位,插入或移除程序或并发症的事件,但表2中显示了这些事件。
| 系统器官分类 | 普鲁啡 | 安慰剂/ SL BPN * | ||||||
|---|---|---|---|---|---|---|---|---|
| 高层小组术语 | (N = 309) | (N = 317) | ||||||
| MedDRA首选术语 | n(%) † | n(%) † | ||||||
| ||||||||
| 胃肠疾病 | ||||||||
| 胃肠道症状和体征 | 42(14) | 39(12) | ||||||
| 恶心 | 20(6) | 15(5) | ||||||
| 呕吐 | 17(6) | 11(3) | ||||||
| 上腹痛 | 10(3) | 7(2) | ||||||
| 肠胃气胀 | 2(1) | 1(0.3) | ||||||
| 胃肠蠕动和脱钙条件 | 27(9) | 23(7) | ||||||
| 便秘 | 20(6) | 9(3) | ||||||
| 牙齿和牙龈疾病 | 16(5) | 12(4) | ||||||
| 牙疼 | 14(5) | 10(3) | ||||||
| 一般性疾病和管理场所条件 | ||||||||
| 一般系统故障NEC | 38(12) | 26(8) | ||||||
| 疼痛 | 12(4) | 9(3) | ||||||
| 疲劳 | 9(3) | 4(1) | ||||||
| 虚弱 | 5(2) | 1(0.3) | ||||||
| 胸痛 | 2(1) | 0 | ||||||
| 局部肿胀 | 2(1) | 0 | ||||||
| 身体温度条件 | 14(5) | 6(2) | ||||||
| 发热 | 8(3) | 4(1) | ||||||
| 寒意 | 5(2) | 2(1) | ||||||
| 感觉冷 | 2(1) | 0 | ||||||
| 伤害,中毒和程序并发症 | ||||||||
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 中度潜在滥用
- 审批历史 FDA的药物史
- 世界反兴奋剂机构 反兴奋剂分类
美国日本医生

Heather Benjamin MD

Heather Benjamin MD

Heather Miske DO

Heather Miske DO

Bert Hepner DO

渡邊剛

宮崎総一郎 中部大学特聘教授

百村伸一 教授

村上和成 教授









