获取国外Adynovate(重组)药品价格,使用等信息,最快 24 小时回馈
Adynovate(重组)
Adynovate(重组)
什么是重组Adynovate?
Adynovate(凝血因子)是血液中天然存在的蛋白质。患有A型血友病的人凝血因子VIII缺乏。重组该药可替代血液中的凝血因子VIII。
重组Adynovate用于治疗或预防A型血友病成人和儿童的出血事件。Adynovate有时在手术前使用。
重组Adynovate可以帮助预防A型血友病且以前没有关节损伤的儿童的关节损伤。
重组Adynovate不适用于治疗von Willebrand病。
Jivi不被12岁以下的任何人使用。
重组Adynovate也可用于本用药指南中未列出的目的。
重要信息
如果您过去曾对Adynovate发生过严重的过敏反应,则不应使用这种药物。
仔细遵循有关如何混合和储存这种药物的所有说明。不同品牌的重组Adynovate可能具有不同的存储说明。
您的身体可能会产生抗Adynovate的抗体,使其作用降低。如果这种药物似乎无法有效控制出血,请致电您的医生。
在服药之前
如果您曾经对Adynovate发生过严重的过敏反应,或者对鼠标或仓鼠蛋白过敏,则不应使用Adynovate。如果您对牛肉蛋白过敏,则不应使用“重组” 。
告诉医生您是否曾经:
心脏病;
乳胶过敏;要么
如果曾经被告知您有因子VIII抑制剂。
告诉医生您是孕妇还是母乳喂养。
我应该如何使用重组Adynovate?
您的医生将进行血液检查,以确保重组Adynovate对您的凝血因子缺乏症是正确的治疗方法。
遵循处方标签上的所有说明,并阅读所有用药指南或说明表。完全按照指示使用药物。
您的医生可能偶尔会改变您的剂量。务必检查标签上的药物强度,以确保使用正确的药效。
重组Adynovate是通过静脉输注给予的。医护人员会给您第一剂,并可能会教您如何正确使用药物。
阅读并认真遵循您的药物随附的所有使用说明。重组Adynovate在使用前必须与液体(稀释剂)混合。如果您不了解如何正确混合和储存药物,请咨询您的医生或药剂师。
在准备和注射之前,一定要洗手。
仅在准备好注射时才准备注射。如果药物改变了颜色或有微粒,不要使用。致电您的药剂师购买新药。
重组Adynovate剂量基于体重。如果体重增加或减少,您的剂量需求可能会改变。
您将需要频繁的医学检查。
您的身体可能会产生抗Adynovate的抗体,使其作用降低。如果这种药物似乎无法有效控制出血,请致电医生。
在完全用完药物之前,请先补充您的处方。出门旅行时,请确保您有足够的药品和注射用品。
将未混合的重组Adynovate储存在冰箱中的原始包装中。不要冻结。在准备剂量之前,将药物从冰箱中取出,使其达到室温。
您也可以在室温下存放未混合的重组Adynovate,但切勿将其返回冰箱。有些品牌的这种药物只能在室温下保存数月,或者直到有效期(以先到者为准)保存。
仔细遵循有关如何储存这种药物的所有说明。不同品牌的重组Adynovate可能具有不同的存储说明。
请勿存放在强光下。不要使用标签上的过期日期。
混合药物和稀释剂后,将混合物保持在室温下(不要放在冰箱中),并在3小时内使用。
每个小瓶(瓶)仅可使用一次。一次使用后将其扔掉,即使里面仍然有药物。
只能使用针头和注射器一次,然后将其放在防刺穿的“尖头”容器中。遵循州或当地有关如何处置此容器的法律。请将其放在儿童和宠物接触不到的地方。
万一发生紧急情况,佩戴或携带医疗证明以使他人知道您有出血或凝血障碍。
如果我错过剂量怎么办?
由于需要时使用重组Adynovate,因此您可能不在常规的给药时间表上。但是,您可能需要连续几天使用药物来控制出血发作。继续按照指示使用药物,并告诉医生您的出血是否继续。
记住时,请使用任何错过的剂量。不要一次使用两次。
如果我服药过量怎么办?
寻求紧急医疗护理或致电1-800-222-1222,拨打毒药帮助热线。
使用重组Adynovate时应避免什么?
关于食物,饮料或活动的任何限制,请遵循医生的指示。
重组Adynovate副作用
如果您有过敏反应迹象,请寻求紧急医疗救助:荨麻疹,瘙痒,皮疹,麻木,刺痛;发烧,头晕,恶心;心跳加快,胸闷,喘息,呼吸困难;皮肤苍白,冷汗,头晕目眩,晕倒;脸,嘴唇,舌头或喉咙肿胀。
如果您有以下情况,请立即致电您的医生:
出血事件增加;
不会停止的任何出血;
胸痛;要么
一种轻松的感觉,就像你可能昏倒了一样。
常见的副作用可能包括:
鼻子流血;
恶心,呕吐,腹泻;
头痛,头晕
肌肉或关节疼痛;
皮疹;
潮红(突然的温暖,发红或刺痛的感觉);
发烧,发冷;
咳嗽;
弱点;要么
注射时疼痛,肿胀,发痒或发红。
这不是副作用的完整列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响重组Adynovate?
其他药物可能会影响重组Adynovate,包括处方药和非处方药,维生素和草药产品。告诉您的医生您目前所有的药物以及您开始或停止使用的任何药物。
版权所有1996-2018 Cerner Multum,Inc.版本:8.01。
注意:本文档包含有关抗血友病因子的副作用信息。此页面上列出的某些剂型可能不适用于Adynovate品牌。
对于消费者
适用于抗血友病因子:溶液用静脉粉
需要立即就医的副作用
除其所需的作用外,抗血友病因子(Adynovate中包含的活性成分)可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用抗血友病因子时,如果有以下任何副作用,请立即咨询医生:
比较普遍;普遍上
- 发热
少见或罕见
- 面部肤色的变化
- 发冷
- 快速或不规则的呼吸
- 恶心
- 眼睑或眼睛周围浮肿或肿胀
- 灼热,发热,发热,麻木,紧绷或刺痛感
- 皮疹,荨麻疹或瘙痒
- 胸闷
- 呼吸困难
- 异常疲倦或虚弱
发病率未知
- 指甲,嘴唇,皮肤,手掌或指甲床的颜色发蓝
- 模糊的视野
- 胸痛或不适
- 混乱
- 咳嗽
- 深呼吸或头晕
- 呼吸困难或劳累
- 吞咽困难
- 从躺着或坐着的姿势突然起床时头晕,晕眩或头晕
- 快速,剧烈或不规则的心跳或脉搏
- 嘈杂的呼吸
- 脚,手和嘴巴的麻木
- 眼睑或眼睛,面部,嘴唇或舌头周围浮肿或肿胀
- 心律缓慢或不规则
- 出汗
- 面部,喉咙或舌头肿胀
- 异常疲倦或虚弱
不需要立即就医的副作用
抗血友病因子的某些副作用可能会发生,通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 头痛
不常见
- 注射部位灼伤,刺痛或肿胀
- 腹泻
- 头晕或头晕
- 口干或口臭
- 力量不足或丧失
- 鼻血
- 脸红
- 呕吐
罕见
- 口味变化
- 味觉丧失
发病率未知
- 腹部或胃痛
- 温暖的感觉
- 出汗增加
- 易怒
- 肌肉或骨骼疼痛
- 眼睛发红
- 脸部,脖子,手臂发红,偶尔上胸部发红
- 皮肤发红
- 麻烦看
对于医疗保健专业人员
适用于抗血友病因子:静脉注射试剂盒,静脉注射粉剂
血液学
上市后报告:VIII因子抑制,溶血性贫血,手术后出血[参考]
过敏症
上市后报告:过敏(包括过敏反应,皮疹,瘙痒) [参考]
神经系统
上市后报告:全身性强直-阵挛性癫痫发作[参考]
参考文献
1.“产品信息。Koate-HP(抗血友病因子)。”拜耳,康涅狄格州西黑文。
某些副作用可能没有报道。您可以将其报告给FDA。
常规预防
在儿童和成人(12岁及以上)中,每周两次每公斤体重40-50 IU。对儿童(<12岁),每周两次,每公斤体重55 IU,最高70 IU。根据患者的临床反应调整剂量。
准备和重建
制备
- 请勿从外壳上取出ADYNOVATE或稀释瓶。
- 检查装有ADYNOVATE的包装,以确保没有损坏或盖子明显脱落。如果盖子未完全密封在泡罩上,请勿使用。
- 重建过程中,请使用无菌技术(清洁且无菌)和平坦的工作表面。
重组
- 使用前,让ADYNOVATE包装达到室温。
- 剥去盖子打开包装。从包装中取出ADYNOVATE,并验证标签上的失效日期尚未过去,并且效价单位号与预期的相同。检查肠胃外药品是否变色和颗粒物。 ADYNOVATE粉末的颜色应为白色至灰白色,且稀释剂应无异物。如果不符合条件,请勿使用。
- 将ADYNOVATE放在平坦的表面上,将稀释瓶放在顶部(图A)。稀释瓶有蓝色条纹。除非随后有指示,否则请勿取下蓝盖。
图A 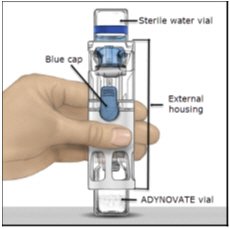
- 一只手握住ADYNOVATE外壳,另一只手用力向下按压稀释瓶,直到系统完全塌陷,稀释液向下流入ADYNOVATE瓶中(图B)。传输完成之前,请勿倾斜系统。
图B 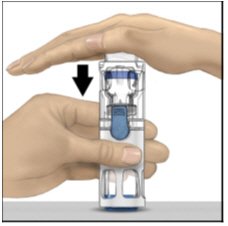
- 验证稀释剂转移是否完成。轻轻旋转直到粉末完全溶解(图C)。不要摇晃。复原后请勿冷藏。
图C 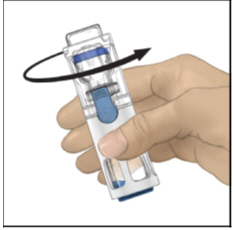
行政
- 在溶液和容器允许的情况下,目视检查重构的ADYNOVATE溶液中是否存在颗粒物和变色。最终的ADYNOVATE解决方案应该是透明无色的。如果发现有颗粒物或变色,请勿使用。
- 尽快管理ADYNOVATE,但不得晚于重建后3小时。
管理步骤:
- 从外壳上取下蓝盖。将注射器连接到系统(图D)。请勿将空气注入ADYNOVATE。
图D 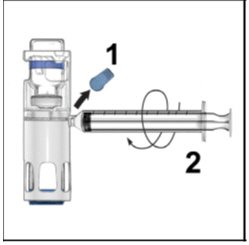
- 颠倒系统(ADYNOVATE样品瓶现在位于顶部)。缓慢向后拉柱塞,将ADYNOVATE溶液吸入注射器(图E)。
图E 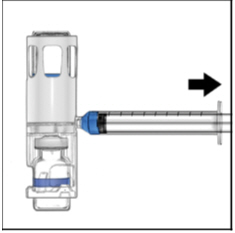
- 断开注射器的连接,连接合适的针头,然后按照说明进行静脉注射。如果患者要接受一个以上的ADYNOVATE -BAXJECT III系统或ADYNOVATE -BAXJECT II和ADYNOVATE -BAXJECT III系统的组合,则可以将内容物吸入同一注射器中。
- 在少于或等于5分钟的时间内静脉内注射ADYNOVATE(最大输注速率为每分钟10 mL)。
Adynovate的适应症和用法
Adynovate,抗血友病因子(重组),聚乙二醇化,是一种人类抗血友病因子,适用于患有A型血友病(先天性凝血因子VIII缺乏症)的儿童和成人,其针对:
- 按需治疗和控制出血发作
- 围手术期管理
- 常规预防以减少出血发作的频率
使用限制
Adynovate不适用于治疗von Willebrand病。
Adynovate剂量和给药
仅在重构后用于静脉使用。
剂量
- Adynovate的每个小瓶标签均以国际单位表示实际的VIII因子效价。这可能大于或小于标称的药瓶效价/含量。一个国际单位对应于一毫升正常人血浆中所含的因子的活性。
- 治疗的剂量和持续时间取决于VIII因子缺乏症的严重程度,出血的位置和程度以及患者的临床状况。如果发生严重或威胁生命的出血事件,则必须仔细监测替代疗法。
- 使用一阶段凝血测定法确定效价分配。血浆VIII因子水平可使用一阶段凝血测定法进行临床监测。
- 根据经验发现,每公斤体重1个国际单位的Adynovate可使血浆VIII因子水平增加2 IU / dL血浆,从而计算出Adynovate的剂量。使用以下公式估算以IU / dL(或正常值的百分比)IU表示的VIII因子水平预期的体内峰值增加,以及达到VIII因子水平所需的体内峰值增加的剂量:
因子VIII的估计增量(IU / dL或正常百分比)= [总剂量(IU)/体重(kg)]×2(IU / dL / IU / kg)
剂量(IU)=体重(kg)×所需的VIII因子升高(IU / dL或正常值的%)×0.5(IU / kg / IU / dL)
- 患者的药代动力学(例如清除率,半衰期,体内恢复)和临床反应各不相同。 Adynovate的剂量和频率取决于个体的临床反应。
按需治疗和控制出血发作
表1中提供了按需治疗和控制出血发作的Adynovate剂量指导。将血浆VIII因子活性水平维持在或高于所述血浆水平(单位为IU / dL或正常值的%)。
| 出血类型 | 目标因子VIII水平 (IU / dL或正常百分比) | 剂量* (IU /公斤) | 给药频率 (小时) | 治疗时间 |
|---|---|---|---|---|
| ||||
| 次要 早期出血,轻度肌肉出血或轻度口腔出血发作。 | 20-40 | 10-20 | 12-24 | 直到出血消失 |
| 中等 肌肉出血,口腔中度出血,明确的hemththroses和已知的创伤。 | 30-60 | 15-30 | 12-24 | 直到出血消失 |
| 重大的 重大胃肠道出血,颅内,腹内或胸腔内出血,中枢神经系统出血,咽后或腹膜后腔或or腰鞘出血,骨折,头部外伤。 | 60-100 | 30-50 | 8-24 | 直到出血解决。 |
围手术期管理
表2中提供了手术中Adynovate剂量的指南(围手术期管理)。应考虑将VIII因子的活性维持在目标范围或以上。
| 手术类型 | 所需的VIII因子水平 (正常或IU / dL的百分比) | 剂量 (IU /公斤) | 剂量频率 (小时) | 治疗时间 |
|---|---|---|---|---|
| 次要 包括拔牙 | 60-100 | 30-50 | 手术前一小时内。 必要时在24小时后重复 | 单剂或根据需要重复直至出血消失。 |
| 重大的 颅内,腹内或胸腔内手术,关节置换手术 | 80-120 (手术前后) | 40-60 | 手术前一小时内达到100%活性。 每8至24小时重复一次(<12岁的患者为6至24小时),以将FVIII活性维持在目标范围内 | 直到伤口充分愈合 |
常规预防
在儿童和成人(12岁及以上)中,每周两次每公斤体重40-50 IU。对儿童(<12岁),每周两次,每公斤体重55 IU,最高70 IU。根据患者的临床反应调整剂量。
准备和重建
制备
- 请勿从外壳上取出Adynovate或稀释瓶。
- 检查装有Adynovate的包装,以确保没有损坏或盖子明显脱落。如果盖子未完全密封在泡罩上,请勿使用。
- 重建过程中,请使用无菌技术(清洁且无菌)和平坦的工作表面。
重组
- 使用前,让Adynovate包装达到室温。
- 剥去盖子打开包装。从包装中取出Adynovate,并确认标签上的有效期限未过,且效价单位号与预期的相同。检查肠胃外药品是否变色和颗粒物。 Adynovate粉末的颜色应为白色至灰白色,且稀释剂应无异物。如果不符合条件,请勿使用。
- 将Adynovate放在一个平面上,将稀释瓶放在顶部(图A)。稀释瓶有蓝色条纹。除非随后有指示,否则请勿取下蓝盖。
图A 
- 一只手握住Adynovate外壳,另一只手用力向下按压稀释瓶,直到系统完全塌陷,稀释液向下流入Adynovate瓶中(图B)。传输完成之前,请勿倾斜系统。
图B 
- 验证稀释剂转移是否完成。轻轻旋转直到粉末完全溶解(图C)。不要摇晃。复原后请勿冷藏。
图C 
行政
- 在溶液和容器允许的情况下,目视检查重构的Adynovate溶液中是否存在颗粒物和变色。最终的Adynovate解决方案应该是透明无色的。如果发现有颗粒物或变色,请勿使用。
- 尽快管理Adynovate,但不得晚于重组后3小时。
管理步骤:
- 从外壳上取下蓝盖。将注射器连接到系统(图D)。不要将空气注入Adynovate。
图D 
- 颠倒系统(Adynovate样品瓶现在位于顶部)。缓慢向后拉柱塞,将Adynovate溶液吸入注射器(图E)。
图E 
- 断开注射器的连接,连接合适的针头,然后按照说明进行静脉注射。如果患者要接受多个Adynovate -BAXJECT III系统或Adynovate -BAXJECT II和Adynovate -BAXJECT III系统的组合,则可以将内容物吸入同一注射器中。
- 在少于或等于5分钟的时间内静脉内施用Adynovate(最大输注速率为每分钟10 mL)。
剂型和优势
Adynovate是一种单次使用小瓶中的冻干粉,其名义上(大约)包含250、500、750、1000、1500、2000和3000国际单位(IU,单位)。 250-1500 IU的强度带有2 mL注射用无菌水(sWFI); 2000和3000 IU的强度附带5 mL的sWFI。实际的VIII因子效价/含量标在每个Adynovate小瓶上。
效能分配采用的因子VIII浓缩物标准参照WHO(世界卫生组织)因子VIII浓缩物国际标准,并通过适当的方法进行评估以确保结果的准确性。
禁忌症
Adynovate禁忌于对Adynovate,母体分子(ADVATE),小鼠或仓鼠蛋白或Adynovate赋形剂(例如Tris,甘露醇,海藻糖,谷胱甘肽和/或聚山梨酯80)有过敏性反应的患者。
警告和注意事项
过敏反应
Adynovate可能会引起超敏反应。已经报道了其他重组抗血友病因子VIII产品(包括母体分子ADVATE)的过敏型超敏反应,包括过敏反应。可能发展为过敏反应的超敏反应的早期迹象可能包括血管性水肿,胸闷,呼吸困难,喘息,荨麻疹和瘙痒。如果发生超敏反应,请立即中止给药并开始适当的治疗。
中和抗体
给予Adynovate后可能会形成针对因子VIII的中和抗体(抑制剂)。通过适当的临床观察和实验室测试,定期监测患者的VIII因子抑制剂的发展。如果血浆VIII因子水平未能如预期那样增加,或者如果出血没有用预期的剂量控制,则进行测量VIII因子抑制剂浓度的测定。
监控实验室测试
- 通过执行经过验证的一阶段凝血测定法来监测血浆VIII因子的活性,以确认已经达到并维持了足够的VIII因子水平[参见剂量和用法(2) ]。
- 监测因子VIII抑制剂的发展。进行Bethesda抑制剂测定,以确定是否存在VIII因子抑制剂。如果未达到预期的VIII因子活性血浆水平,或如果使用预期剂量的Adynovate无法控制出血,则使用Bethesda单位(BU)确定抑制剂水平。
不良反应
临床研究中报告的最常见的不良反应(≥1%的受试者)是头痛和恶心。
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此不能将在一种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
在237例先前治疗过的严重P型血友病患者(PTP)和6例先前未治疗过的患者(PUP)中评估了Adynovate的安全性,这些患者在3个完整的多剂量治疗中接受了至少一剂Adynovate。中心,前瞻性,开放标签临床研究和4项正在进行的临床研究。每个受试者的中位持续时间为401天(最小-最大值:3-1034)天,每个受试者与Adynovate接触的天数中位数为111个(最小-最大值:1-322)。表3列出了临床研究期间报告的不良反应。
| MedDRA系统器官分类 | MedDRA首选术语 | 学科数 n(%) (N = 243) | 每100输液的AE发生率 (N = 30865) |
|---|---|---|---|
| |||
| 胃肠道疾病 | 腹泻 | 1(0.4%) | 0.003 |
| 恶心 | 2(0.8%) | 0.006 | |
| 免疫系统疾病 | 过敏* | 1(0.4%) | 0.003 |
| 神经系统疾病 | 头痛 | 5(2.1%) | 0.026 |
| 皮肤和皮下组织疾病 | 皮疹 | 1(0.4%) | 0.003 |
| 血管疾病 | 冲洗 | 1(0.4%) | 0.003 |
在一项对137名受试者进行评估的临床试验扩展研究中,成人报告了2例急性胰腺炎,其中1例未发现病因。继续进行Adynovate的管理,两个案件均得到解决。
免疫原性
在3个完成的和4个正在进行的临床试验中,评估了使用Adynovate引起VIII因子抑制剂发展的风险。受试者包括青春期和成人(n = 148≥150 ed EDs)和儿科PTP [(<6岁,≥50 ed eds(n = 32),≥6岁,≥150 ed eds(n = 57)]和小儿PUP(n = 6)。在接受Adynovate治疗至少50天暴露的191名成年和小儿PTP中,因子VIII抑制剂的频率为0(95%CI为0至0.019)。正在进行的一项研究(至少接受一次Adynovate输注)的研究对象开发了针对VIII因子的中和抗体。
免疫原性也通过使用验证的ELISA分析测量针对因子VIII,聚乙二醇化(PEG)因子VIII,PEG和中国仓鼠卵巢(CHO)蛋白的结合IgG和IgM抗体的发育来评估。至少注射一次Adynovate的大多数受试者(238/243)对这些抗原均未产生持续的结合抗体应答。在首次暴露于Adynovate之前,共有28名受试者显示了针对因子VIII(n = 3),PEG因子VIII(n = 25)和/或PEG(n = 3)的预先存在的抗体。在筛选中测试为阴性的13名受试者在进行一两次连续的研究访问时产生了针对因子VIII(n = 6),PEG-FVIII(n = 8)的瞬时抗体。抗体是暂时性的,在随后的访问中无法检测到。五名受试者在研究完成时或数据截止时显示出结合抗体的阳性结果。在暴露于Adynovate之前检测到的结合抗体,在试验过程中短暂形成的结合抗体或在研究完成或数据截止时仍可检测到的结合抗体,均不能与治疗功效受损或PK参数改变相关。观察到的不良事件与结合抗体之间没有因果关系,除非一位受试者无法根据现有数据排除因果关系。没有受试者具有针对CHO蛋白的既存抗体或治疗前抗体。
对因子VIII具有反应性的抗体的检测高度依赖于许多因素,包括:测定的敏感性和特异性,样品处理,样品收集的时间,伴随用药和潜在疾病。由于这些原因,将Adynovate抗体的发生率与其他产品的抗体发生率进行比较可能会产生误导。
在特定人群中的使用
怀孕
风险摘要
没有有关孕妇使用Adynovate的资料可告知与药物相关的风险。 Adynovate尚未进行动物繁殖研究。尚不清楚Adynovate对孕妇服用是否会造成胎儿伤害或会影响生殖能力。仅在明确需要时,才应将Adynovate用于孕妇。
在美国普通人群中,临床公认的怀孕中估计的主要先天缺陷和流产的背景风险分别为2-4%和15-20%。
哺乳期
风险摘要
没有关于人乳中Adynovate的存在,对母乳喂养婴儿的影响或对牛奶生产的影响的信息。应当考虑母乳喂养对发育和健康的益处,以及母亲对Adynovate的临床需求以及Adynovate或潜在母体状况对母乳喂养婴儿的任何潜在不利影响。
儿科用
已对91例先前接受治疗的1岁至18岁以下小儿患者进行了安全性和有效性研究,这些患者至少接受一剂Adynovate作为常规预防措施,按需治疗出血发作或围手术期处理的一部分。成人和青少年安全性和有效性试验纳入了12至<18岁的青少年受试者(n = 25),儿科试验纳入了小于12岁的受试者(n = 66)。在儿童和成人中,Adynovate在常规预防和出血发作治疗中的安全性和有效性相当。 [请参阅临床研究(14) ]
在儿童(<12岁)中进行的药代动力学研究表明,与成人相比,因子VIII的清除率更高,半衰期更短且增量恢复率更低。由于已证明儿童(<12岁)的清除率(基于每千克体重)较高,因此该人群可能需要基于每千克体重调整剂量或更频繁地给药。 [见临床药理学(12.3) ]
老人用
Adynovate的临床研究未包括65岁及以上的受试者。
Adynovate说明
聚乙二醇化的Adynovate抗血友病因子(重组)配制成无菌,无热原,白色至灰白色的冻干粉剂,用于静脉注射用。该产品以一次性使用的小瓶形式提供,其标称(近似)效价为250、500、750、1000、1500、2000或3000国际单位(IU)。每瓶Adynovate均以IU的实际VIII因子活性标记,该活性是使用针对世界卫生组织(WHO)国际标准的VIII因子浓缩物校准的参考物质,通过一步凝固测定法测定的。根据WHO WHO凝血因子VIII标准,人类定义的1 IU大约等于1 mL新鲜合并人血浆中发现的VIII因子活性水平。
当用2 mL或5 mL无菌注射用水复溶时,最终溶液每毫升复溶产品含有目标量的以下赋形剂和稳定剂:
| 稳定剂和辅料 | 2毫升 重组 (对于250、500、750、1000、1500 IU)目标 (每毫升) | 5毫升 重组 (对于2000,3000 IU)目标 (每毫升) |
|---|---|---|
| 三羟甲基氨基甲烷 | 3.05毫克 | 1.22毫克 |
| 氯化钙 | 0.60毫克 | 0.24毫克 |
| 甘露醇 | 80毫克 | 32毫克 |
| 氯化钠 | 13.15毫克 | 5.26毫克 |
| 海藻糖二水合物 | 20毫克 | 8毫克 |
| 谷胱甘肽 | 0.2毫克 | 0.08毫克 |
| 组氨酸 | 3.90毫克 | 1.56毫克 |
| 聚山梨酯80 | 0.25毫克 | 0.10毫克 |
Adynovate不包含防腐剂。 Adynovate的比活为2700-8000 IU / mg蛋白。
Adynovate是一种重组全长人凝血因子VIII(2,332个氨基酸,分子量(MW)为280 kDa)与一个或多个聚乙二醇分子(MW 20 kDa)共价缀合[请参见临床药理学(12.1) ]。 Adynovate的治疗活性源自其母体药物ADVATE [抗血友病因子(重组)],它是通过重组DNA技术从CHO细胞系产生的。使用一系列色谱柱从培养基中纯化ADVATE。纯化过程包括免疫亲和层析步骤,其中使用针对因子VIII的单克隆抗体从培养基中选择性分离因子VIII。生产过程包括专用的病毒灭活溶剂洗涤剂处理步骤。然后将ADVATE分子与主要靶向赖氨酸残基的聚乙二醇共价缀合。
用于生产Adynovate的细胞培养,聚乙二醇化,纯化工艺和配方均不使用人类或动物来源的添加剂。
Adynovate-临床药理学
作用机理
Adynovate是一种重组抗血友病因子(ADVATE)的聚乙二醇化形式,[参见说明(11) ]暂时替代了先天性血友病A患者有效止血所需的缺失凝血因子VIII。 Adynovate通过母体分子ADVATE的聚乙二醇化具有延长的末端半衰期,从而降低了与生理因子VIII清除受体(LRP1)的结合。
药效学
A型血友病是一种以功能性凝血因子VIII缺乏为特征的疾病,导致患者血浆凝血时间延长(通过活化的部分凝血活酶时间(aPTT)来衡量)。用Adynovate治疗可在有效给药期间使aPTT正常化。 Adynovate的使用可增加血浆VIII因子的水平,并可暂时纠正A型血友病患者的凝血功能障碍。
药代动力学
在一项多中心,前瞻性,开放标签的临床试验中对Adynovate的药代动力学(PK)进行了评估,并在开始进行Adynovate预防性治疗之前的26位受试者中和在Adynovate治疗6个月后的22位受试者中与ADVATE进行了比较。两种产品均使用45 IU / kg的单剂量。如表4所示,PK参数基于通过一级凝血测定法测量的血浆凝血因子VIII活性,并按年龄组列出。
两种产品的增量回收率相当。 Adynovate预防治疗6个月后确定的PK参数与初始参数估计值一致。
小儿药代动力学
由14位儿童(2至<6岁),17位年龄较大的儿童(6至<12岁)和8位青春期受试者(12至<12岁)提供了由39位<18岁的受试者(意图治疗分析)计算出的药代动力学参数。 18岁),如表4所示。与成人相比,Adynovate的平均清除率(基于体重)更高,而12岁以下儿童的平均半衰期则更低。 <12岁的儿童可能需要调整剂量。
| PK参数 | 小儿科 | 成人和青少年 | ||
|---|---|---|---|---|
| <6年 N = 14 | 6至<12岁 N = 17 | 12至<18岁 N = 8 | ≥18岁 N = 18 | |
| 缩写:MRT:平均停留时间; CL:间隙; CI:置信区间; AUC:曲线下的面积; V ss :体重调整后的稳态分布量; C max :观察到的最大活性; T max :达到最大浓度的时间。 | ||||
| ||||
| 终末半衰期[h] | 11.8±2.43 | 12.4±1.67 | 13.43±4.05 | 14.69±3.79 |
| 捷运[h] | 17.0±3.51 | 17.8±2.40 | 17.96±5.49 | 20.27±5.23 |
| CL [mL /(kg·h)] | 3.53±1.29 | 3.11±0.76 | 3.87±3.31 (2.73±0.93) * | 2.27±0.84 |
| 增量恢复[(IU / dL)/(IU / kg)] | NA † (1.88±0.49) | NA † (1.93±0.48) | 2.12±0.60 | 2.66±0.68 |
| AUC 0-Inf [IU∙h / dL] | 1950±758 | 2010±493 | 1642±752 | 2264±729 |
| Vss [dL / kg] | 0.97±0.23 | 1.59±0.34 | 0.56±0.18 | 0.43±0.11 |
| C max [IU / dL] | NA † (115±30) | NA † (115±33) | 95±25 | 122±29 |
| 最高温度[h] | -- | -- | 0.26±0.10 | 0.46±0.29 |
非临床毒理学
致癌,诱变,生育力受损
尚未在动物中进行长期研究以评估Adynovate的致癌潜力或确定Adynovate对遗传毒性或生殖力的影响的研究。
临床研究
原始安全性和有效性临床试验
在一项多中心,开放标签,前瞻性,非随机,两臂临床试验中评估了Adynovate的安全性,疗效和PK,该试验比较了每周两次预防性治疗方案与按需治疗方案的疗效,并确定了止血效果在治疗出血发作中。共有137例严重A型血友病的男性PTP(12至65岁)接受了至少1次Adynovate输注。 137名受试者中有25名是青少年(12岁至18岁以下)。
受试者每周两次接受40-50 IU / kg剂量的Adynovate预防性治疗(n = 120),或接受10-IU / kg剂量的Adynovate按需治疗(n = 17)6-一个月期间。预防性输注的平均(SD)剂量为每公斤44.4(3.9)IU,中位给药间隔为3.6天。 98名受试者中有91名(93%)在入组前接受了预防性治疗,在该例行常规预防期间,给药频率有所降低,中位数降低了33.7%(两次给药之间大约间隔了一天)。 120名(98%)预防受试者中有18名仍在开始推荐方案中进行剂量调整,而2名受试者由于靶关节出血而在预防期间将剂量增加至60 IU / kg。
按需治疗和控制出血发作
在每个协议人群中,总共使用Adynovate治疗了518次出血事件,即根据方案的具体剂量要求进行给药。其中,按需组发生361次出血事件(n = 17名受试者),预防组发生157次(n = 61名受试者)。在每协议人群中,用于治疗所有出血事件的每次输注中值剂量为每千克29 IU(Q1:20.0; Q3:39.2)IU。在每协议人群中,用于治疗轻度,中度或重度/重度出血事件的每次输注中值剂量为25.5(Q1:16.9; Q3:37.6)IU / kg,30.9(Q1:23.0; Q3:43.1)IU / kg或36.4(Q1:29.0; Q3:44.5)IU / kg。
在已治疗的人群中,总共用Adynovate治疗了591次出血事件,这与安全性分析组相同,这些受试者被分配了常规预防或按需用Adynovate治疗并且接受了至少一剂该产品的安全性分析。其中,按需组发生361次出血事件(n = 17名受试者),常规预防组发生230次出血事件(n = 75名受试者)。表5总结了控制出血发作的疗效。
| 出血情节病因 | 所有 | 联合 | 非联合 | |
|---|---|---|---|---|
| ||||
| 处理出血的数量 | 591 | 455 | 136 | |
| 治疗出血发作的输液次数 | 1次输液: | 85.4% | 85.9% | 83.8% |
| 2次输液: | 10.8% | 10.8% | 11.0% | |
| 总计(1或2次输注): | 96.2% | 96.7% | 94.8% | |
| 治疗出血发作的成功率* | 优秀或好 | 95.3% | 95.8% | 93.4% |
常规预防
共有120名受试者(治疗的人群)在预防组接受了每周两次的治疗,另有17名受试者在按需组接受了流行性治疗。在接受治疗的人群中,按需治疗组中的[平均]年平均流血率(ABR)为41.5 [40.8],而每周两次预防方案的患者中值为[1.9] [4.7](表6)。在按协议人群中,按需每周两次预防方案中,按需治疗组中的[平均]年平均出血率(ABR)为41.5 [40.8],而同期的为[1.9] [3.7]。使用负二项式模型来估计ABR,与按需组相比,预防组的受试者的ABR显着降低(p <0.0001)。
| 出血情节病因 | 按需治疗 | 常规预防治疗 | ||
|---|---|---|---|---|
| 中位数 | 均值(SD) | 中位数 | 均值(SD) | |
| 总体 | 41.5 | 40.8(16.3) | 1.9 | 4.7(8.6) |
| 联合 | 38.1 | 34.7(15.1) | 0.0 | 2.9(8.0) |
| 非联合 | 3.7 | 6.1(6.7) | 0.0 | 1.8(3.0) |
| 自发 | 21.6 | 26.0(19.6) | 0.0 | 2.9(7.1) |
| 创伤性的 | 9.3 | 14.9(15.3) | 0.0 | 1.8(3.1) |
在接受治疗的人群中,接受常规预防的年龄在12岁至<18岁之间的23名青少年受试者的平均[ABR]为2.1 [5.2],而97名受试者的平均[ABR]为1.9 [4.6] 18岁以上。不论所检查的基线亚组如何,治疗组之间的ABR均降低,包括年龄,目标关节是否存在以及预治疗方案。预防期间的大多数出血发作(95%)为轻度/中度。 120名受试者中有45名(38%)未发生出血事件,而120名受试者中有68名(57%)在预防组中未发生关节出血事件。在那些符合方案的受试者(按方案人群)中,在101名受试者中有40名(40%)没有出血事件。按需手臂中的所有受试者都经历了一次出血事件,包括关节出血事件。
儿科受试者(<12岁)的常规预防性临床试验
在总共73例严重A型血友病的儿科PTP中评估了Adynovate的安全性和有效性,其中在单独的儿科临床试验中,对66名受试者(32名年龄<6岁的受试者和34名年龄在6至<12岁的受试者)进行了评估。每周两次Adynovate的预防方案为40至60 IU / kg,平均(SD)剂量为51.1 IU / kg(5.5)。治疗人群中66名受试者的总[平均] ABR中位数为2.0 [3.61],自发性和关节出血发作的平均[ABR]中位数均为0 [分别为1.18和1.12]。在接受预防性治疗的66位受试者中,有25位(38%)没有出血事件,有44位(67%)没有自发出血事件,有48位(73%)没有关节出血。
在儿科试验期间观察到的70次出血事件中,1输注控制了82.9%的病情,而1或2输注控制了91.4%的病情。在70次(90%)出血发作中,有63例出血控制被评为优秀或良好。与先前在青少年和成人受试者中进行的预防性临床试验相比,儿科临床试验中“优”或“良”的定义没有变化。
围手术期管理临床试验
11大手术(3个膝关节置换,2个关节镜滑膜切除术,1个囊肿切除,1个端口放置,1个胃带放置以及3个多齿拔除术,包括1个根除囊肿)和4个附加的小手术(1个滑膜置换术,1个放射性滑膜切除术,1个在15位受试者中进行了拔牙,1次皮肤科手术。术前负荷剂量为36 IU / kg至99 IU / kg(中位数:65 IU / kg),术后总剂量为177 IU / kg至769 IU / kg(中位数:305 IU / kg)。大手术的中位总剂量为362 IU / kg(范围:237-863 IU / kg),小手术的中位总剂量为97 IU / kg(范围:73-119 IU / kg)。
围手术期止血效果被评为极好(失血量小于或等于非血友病患者所进行的同一类型手术所预期的出血量,输血所需的血液成分小于或等于非血友病人群所预期的血液成分)适用于所有15个(11个主要,4个次要)程序。观察到的术中失血(n = 10)的中位数(QR)为10.0(Q1:5.0,Q3:50.0)mL,而预测的平均失血(n = 11)为50.0(Q1:6.0,Q3:150.0)mL用于大手术。
供应/存储和处理方式
供应方式
BAXJECT III系统中的Adynovate装有2 mL或5 mL注射用无菌水,一套Terumo微孔输液器(仅2 mL),一份完整的医生处方和一份患者说明书。非天然橡胶胶乳制成的组件。
Adynovate可用于包含以下标称产品强度的一次性小瓶中:
| 标称强度 | 效力颜色代码 | 纸箱NDC (包括2 mL sWFI稀释剂) | 纸箱NDC (包括5 mL sWFI稀释剂) |
|---|---|---|---|
| 250 IU | 浅蓝 | 0944-4622-01 | |
| 500 IU | 粉 | 0944-4623-01 | |
| 750 IU | 红 | 0944-4626-01 | |
| 1000 IU | 浅绿色 | 0944-4624-01 | |
| 1500 IU | 紫色 | 0944-4627-01 | |
| 2000 IU | 橙子 | 0944-4625-01 | |
| 3000 IU | 银 | 0944-4628-01 |
IU中实际的VIII因子活性在每个Adynovate纸箱和外壳的标签上都有说明。
储存和处理
- 以2°C至8°C(36°F至46°F)的粉末形式储存Adynovate。
- 不要冻结。
- Adynovate可以在不超过30°C(86°F)的室温下保存最多3个月,不超过失效日期。如果在室温下保存,则将Adynovate从冰箱中取出的日期写在纸箱上。
- 在室温下存放后,请勿将产品退回冰箱。
- 请勿在纸箱或外壳上印刷的失效日期后使用。
- 将Adynovate存放在原包装盒中,并避免强光照射。
病人咨询信息
建议患者:
- 阅读FDA批准的患者标签(患者信息和使用说明)。
- 如果发生超敏反应,请致电其医疗保健提供者或立即去急诊室。过敏反应的早期迹象可能包括皮疹,荨麻疹,瘙痒,面部肿胀,胸闷和喘息。如果出现这些症状,建议患者停止使用该产品,并立即寻求紧急治疗。
- 如果他们缺乏对VIII因子疗法的临床反应,请联系其医疗保健提供者或治疗机构进行进一步治疗和/或评估,因为这可能是抑制剂发展的迹象。
- 建议患者出行前咨询其医生或保健提供者。在旅行时,建议患者根据他们目前的治疗方案携带充足的Adynovate。
要注册整个行业范围内的机密患者通知系统,请致电1-888-873-2838。
BAXALTA®,ADVATE®,Adynovate®和BAXJECT®是Baxalta股份有限公司,郡plc的全资间接附属公司的注册商标。
SHIRE和Shire徽标是Shire Pharmaceutical Holdings Ireland Limited或其附属公司的商标或注册商标。
已申请专利:请参见https://www.shire.com/legal-notice/product-patents
Baxalta US Inc.
列克星敦,MA 02421美国
美国牌照编号2020
FDA批准的患者标签
患者信息
Adynovate
[抗血友病因子(重组),聚乙二醇化]。
本传单总结了有关Adynovate的重要信息。在使用这种药物之前,请仔细阅读。此信息不会代替您与医疗保健提供者进行交流,并且不包括有关Adynovate的所有重要信息。如果在阅读本文后有任何疑问,请咨询您的医疗保健提供者。
我需要了解有关Adynovate的最重要信息是什么?
除非您的医疗保健提供者或血友病中心已教您如何操作,否则请勿尝试对自己进行输液。
您必须认真按照医疗保健提供者的说明进行有关Adynovate的剂量和时间表的注射,以使您的治疗最适合您。
什么是Adynovate?
Adynovate是一种可注射药物,用于帮助治疗和控制A型血友病(先天性凝血因子VIII缺乏症)的儿童和成人的出血。进行手术时,您的医疗保健提供者可能会给您Adynovate。
定期使用Adynovate可以减少出血次数(预防)。
Adynovate不用于治疗von Willebrand病。
谁不应该使用Adynovate?
如果您满足以下条件,则不应使用Adynovate:
- 对小鼠或仓鼠蛋白过敏
- 对Adynovate或ADVATE中的任何成分过敏
如果您是孕妇或母乳喂养,请告诉您的医疗保健提供者,因为Adynovate可能不适合您。
我应该如何使用Adynovate?
Adynovate直接进入血液。
您可以在血友病治疗中心,医疗服务提供者的办公室或家中给Adynovate输液。您的医疗保健提供者或血友病治疗中心应就如何进行输液对您进行培训。 Many people with hemophilia A learn to infuse their Adynovate by themselves or with the help of a family member.
Your healthcare provider will tell you how much Adynovate to use based on your individual weight, level of physical activity, the severity of your hemophilia A, and where you are bleeding.
Reconstituted product (after mixing dry product with wet diluent) must be used within 3 hours and cannot be stored or refrigerated. Discard any Adynovate left in the vial at the end of your infusion as directed by your healthcare professional.
You may have to have blood tests done after getting Adynovate to be sure that your blood level of factor VIII is high enough to clot your blood.
Call your healthcare provider right away if your bleeding does not stop after taking Adynovate.
What should I tell my healthcare provider before I use Adynovate?
You should tell your healthcare provider if you:
- Have or have had any medical problems.
- Take any medicines, including prescription and non-prescription medicines, such as over-the-counter medicines, supplements or herbal remedies.
- Have any allergies, including allergies to mice or hamsters.
- Are breastfeeding. It is not known if Adynovate passes into your milk and if it can harm your baby.
- Are pregnant or planning to become pregnant. It is not known if Adynovate may harm your unborn baby.
- Have been told that you have inhibitors to factor VIII (because Adynovate may not work for you).
What are the possible side effects of Adynovate?
You can have an allergic reaction to Adynovate.
Call your healthcare provider right away and stop treatment if you get a rash or hives, itching, tightness of the throat, chest pain or tightness, difficulty breathing, lightheadedness, dizziness, nausea or fainting.
The common side effects of Adynovate are headache and nausea. Tell your healthcare provider about any side effects that bother you or do not go away.
These are not all the possible side effects with Adynovate. You can ask your healthcare provider for information that is written for healthcare professionals.
What are the Adynovate dosage strengths?
Adynovate with 2 mL or 5 mL Sterile Water for Injection in a BAXJECT III system comes in seven different dosage strengths: 250 International Units (IU), 500 IU, 750 IU, 1000 IU, 1500 IU, 2000 IU, and 3000 IU. The actual strength will be imprinted on the label and on the box. The seven different strengths are color coded, as follows:
| Dosage strength of approximately 250 International Units per vial (with 2 mL sWFI) | |||||||
| Dosage strength of approximately 500 International Units per vial (with 2 mL sWFI) | |||||||
| Dosage strength of approximately 750 International Units per vial (with 2 mL sWFI) | |||||||
| Dosage strength of approximately 1000 International Units per vial (with 2 mL sWFI) | |||||||
| Dosage strength of approximately 1500 International Units per vial (with 2 mL sWFI) | |||||||
| Dosage strength of approximately 2000 International Units per vial (with 5 mL sterile Water For Injection) | |||||||
已知共有3种药物与Adynovate(抗血友病因子)相互作用。
检查互动已知与Adynovate(抗血友病因子)相互作用的药物注意:仅显示通用名称。
Adynovate(抗血友病因子)疾病相互作用与Adynovate(抗血友病因子)有5种疾病相互作用,包括:
药物相互作用分类
药物状态
美国日本医生 Gregory Aaen MD经验:11-20年  Brian Aalbers DO经验:11-20年  Glen Scott DO经验:21年以上  Cecile Becker MD经验:11-20年  Shruti Badhwar DO经验:11-20年  渡邊剛经验:21年以上  村上和成 教授经验:21年以上  中山秀章 教授经验:21年以上  村田朗经验:21年以上  溝上裕士 医院教授经验:21年以上 |















