获取国外修订(静脉内)药品价格,使用等信息,最快 24 小时回馈
修订(静脉内)
常用品牌名称
在美国
- 修改率
可用的剂型:
- 解
治疗类别:血管舒张药
药理类别:磷酸二酯酶5型抑制剂
修改用途
西地那非注射液用于治疗肺动脉高压的症状。这是在心脏和肺之间发生的一种高血压。当肺部发生高血压时,心脏必须更加努力地通过肺部抽出足够的血液。
西地那非属于称为磷酸二酯酶5(PDE5)抑制剂的一组药物。它作用于肺中的PDE5酶以放松血管。这将增加肺部的血液供应并减少心脏的工作量。
这种药物只能在医生的处方下使用。
使用修订版之前
在决定使用药物时,必须权衡服用药物的风险和所能带来的好处。这是您和您的医生会做出的决定。对于这种药物,应考虑以下几点:
过敏症
告诉您的医生您是否曾经对此药物或任何其他药物有任何异常或过敏反应。如果您还有其他类型的过敏症,例如食物,染料,防腐剂或动物,也请告知您的医疗保健专业人员。对于非处方产品,请仔细阅读标签或包装成分。
小儿科
西地那非不宜用于儿童的肺动脉高压,尤其是用于慢性用途。
老年医学
迄今为止进行的适当研究尚未显示出老年人特异性问题,这些问题会限制西地那非注射液在老年人中的使用。但是,老年患者更容易出现与年龄有关的肝脏,肾脏或心脏问题,这可能需要谨慎并接受西地那非注射剂的患者调整剂量。
哺乳
妇女没有足够的研究来确定在母乳喂养期间使用这种药物的婴儿风险。在母乳喂养期间服用这种药物之前,要权衡潜在收益与潜在风险。
与药物的相互作用
尽管某些药物根本不能一起使用,但在其他情况下,即使可能发生相互作用,也可以同时使用两种不同的药物。在这些情况下,您的医生可能希望更改剂量,或者可能需要其他预防措施。当您接收这种药物时,让您的医疗保健专业人员知道您是否在服用以下列出的任何药物尤为重要。已根据其潜在重要性选择了以下相互作用,并且不一定是包罗万象的。
不建议将本药与以下任何药物一起使用。您的医生可能会决定不使用这种药物治疗您,或更改您服用的其他一些药物。
- 安普那韦
- 亚硝酸戊酯
- 阿扎那韦
- 博西泼韦
- 考比司他
- 达鲁纳韦
- 四氢菊酯
- 福沙那韦
- 茚地那韦
- 异山梨醇酯
- 一硝酸异山梨酯
- 罗匹那韦
- 莫西多明
- 奈非那韦
- 硝酸甘油
- 硝普钠
- 季戊四醇四反酸酯
- 硝酸丙酯
- 里奥瓜瓜
- 利托那韦
- 沙奎那韦
- 特拉普韦
- 提普那韦
通常不建议将此药物与以下任何药物一起使用,但在某些情况下可能需要使用。如果两种药物一起开处方,您的医生可能会更改剂量或使用一种或两种药物的频率。
- 大麻
- 色瑞替尼
- 克拉霉素
- 康尼伐坦
- 二氢可待因
- 杜韦利西布
- 氟康唑
- 扶正剂
- 伊达利西布
- 伊曲康唑
- 依夫西尼布
- 拉罗替尼
- 利福米林
- 罗拉替尼
- Lumacaftor
- 奈法唑酮
- 网友
- 西美普韦
- 泰利霉素
- 伏立康唑
将此药物与以下任何药物合用可能会增加某些副作用的风险,但同时使用这两种药物可能是您的最佳治疗方法。如果两种药物一起开处方,您的医生可能会更改剂量或使用一种或两种药物的频率。
- 阿夫唑嗪
- 波森坦
- 布纳唑嗪
- 环丙沙星
- 德拉维定
- 多沙唑嗪
- 红霉素
- 依他韦
- 酮康唑
- 莫西氏液
- 奈比洛尔
- 吡唑嗪
- 利福喷丁
- 西洛多辛
- 坦索罗辛
- 特拉唑嗪
- 曲马索
与食物/烟草/酒精的相互作用
在进食食物或进食某些类型的食物时或前后,不应使用某些药物,因为可能会发生相互作用。在某些药物上使用烟酒也可能引起相互作用。已根据其潜在重要性选择了以下相互作用,并且不一定是包罗万象的。
将此药物与以下任何一种物质同时使用,可能会增加某些副作用的风险,但在某些情况下是不可避免的。如果一起使用,您的医生可能会更改剂量或使用这种药物的频率,或者给您有关使用食物,酒精或烟草的特别说明。
- 葡萄柚汁
其他医疗问题
其他医疗问题的存在可能会影响该药的使用。确保您告诉医生是否还有其他医疗问题,尤其是:
- 阴茎异常,包括弯曲的阴茎或阴茎的先天缺陷-发生问题的机会可能会增加,在这些患者中应谨慎使用该药。
- 心绞痛(胸痛)或
- 心律不齐(心律不规则)或
- 心脏病发作或
- 心脏病或
- 高血压(高血压)或
- 低血压(低血压)或
- 独裁者,或的历史
- 色素性视网膜炎(遗传性眼疾)或
- 中风—请谨慎使用。可能导致副作用加重。
- 年龄大于50岁或
- 冠状动脉疾病或
- 眼睛中的椎间盘拥挤或杯比低(眼疾)或
- 糖尿病或
- 心脏病或
- 高脂血症(血液中的高脂肪)或
- 高血压(高血压)或
- 非动脉性前部缺血性视神经病变或NAION(严重眼病),
- 吸烟-可能会增加被称为NAION的眼睛出现严重副作用的机会。
- 出血性疾病,历史或
- 胃溃疡或病史或—发生问题的机会可能增加;目前尚不知道这种药物对这些患者是否安全。
- 白血病(与血液有关的癌症)或
- 多发性骨髓瘤(血液相关癌)或
- 镰状细胞性贫血(血液病)—在这些患者中应谨慎使用西地那非,因为可能会出现阴茎延长勃起的问题。
- 肺静脉闭塞性疾病或PVOD(一种肺部疾病)可能会使这种情况恶化。
正确使用修订
护士或其他受过训练的保健专业人员将在医院为您提供这种药物。这种药物是通过一根静脉内的针头给药的。
您的医生会给您一些这种药物的剂量,直到您的病情好转为止,然后将您切换至以相同方式起作用的口服药物。如果对此有任何疑问,请咨询您的医生。
使用修订版时的注意事项
在您接受这种药物时,医生检查您的病情非常重要。这将使您的医生查看药物是否正常工作,并决定是否应继续服用。
请勿服用伟哥®或其他PDE5抑制剂,例如他达拉非(Cialis®)或伐地那非(Levitra®)。伟哥®还含有西地那非。如果您服用过多的西地那非或与这些药物一起服用,产生副作用的机会会更高。
如果您还使用硝酸盐治疗胸痛(心绞痛),请不要使用此药。硝酸盐药物的一些示例是:异山梨醇,硝酸甘油,Imdur®,Nitro-Bid®,Nitro-Dur®,Nitrol®软膏,Nitrolingual®喷雾剂,Nitrostat®和TransdermNitro®。一些非法(“街头”)药物或“ poppers”也包含硝酸盐,例如硝酸戊酯,硝酸丁酯或亚硝酸盐。如果您还使用riociguat(Adempas®),请勿使用这种药物。
重要的是要告诉您的医生您现在或过去曾经有过任何心脏疾病。这种药物可对患有心脏疾病的患者造成严重的副作用。
西地那非注射液可能会使您的血压过低。如果您有以下症状中的一种,请立即告诉医生:视力模糊,意识混乱,头昏眼花,晕眩或头昏眼花,突然从卧位或坐姿起床,出汗或异常疲倦或虚弱。
如果您的一只或两只眼睛突然失去视力,请立即联系您的医生。
如果您的听力突然下降或失聪,可能伴有头晕和耳鸣,请立即咨询医生。
如果您勃起时间延长或痛苦超过4小时,请立即与医生联系。这种情况可能需要及时的医疗,以防止严重和永久性损害您的阴茎。
除非与您的医生讨论过,否则请勿服用其他药物。这包括处方药或非处方药(非处方药[OTC])以及草药或维生素补充剂。
修正副作用
除了所需的作用外,药物还可能引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
如果出现以下任何副作用,请立即与您的医生或护士联系:
比较普遍;普遍上
- 脸,手臂,手,小腿或脚肿胀或肿胀
- 鼻子流血
- 呼吸困难或劳累
- 发热
- 体重快速增加
- 气促
- 胸闷
- 手或脚刺痛
- 体重异常增加或减少
不常见
- 灼痛,爬行,瘙痒,麻木,刺,“针刺”或刺痛感
发病率未知
- 失明
- 模糊的视野
- 听力下降
- 视力下降
- 听力下降
- 癫痫发作
可能会发生一些通常不需要医疗的副作用。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 胃酸或酸
- ching
- 腹泻
- 移动困难
- 温暖的感觉
- 皮肤潮红或发红
- 头痛
- 胃灼热
- 消化不良
- 关节痛
- 肌肉酸痛或抽筋
- 肌肉疼痛或僵硬
- 恶心
- 手臂或腿部疼痛
- 脸部,脖子,手臂发红,偶尔上胸部发红
- 失眠
- 胃部不适,不适或疼痛
- 关节肿胀
- 睡眠困难
- 无法入睡
- 异常温暖的皮肤
不常见
- 胸部或腹部有灼热感
- 咳嗽
- 眼睛和che骨周围疼痛或压痛
- 流鼻涕
- 打喷嚏
- 鼻塞或流鼻涕
- 胃部压痛
未列出的其他副作用也可能在某些患者中发生。如果您发现任何其他影响,请咨询您的医疗保健专业人员。
打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
注意:本文档包含有关昔多芬的副作用信息。此页面上列出的某些剂型可能不适用于品牌名称Revatio。
综上所述
较常见的副作用包括:鼻出血,失眠和鼻炎。有关不良影响的完整列表,请参见下文。
对于消费者
适用于西地那非:口服散剂,口服片剂
其他剂型:
- 静脉内溶液
需要立即就医的副作用
除需要的效果外,西地那非(Revatio中包含的有效成分)可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用西地那非时,如果有下列任何副作用,请立即咨询医生:
不常见
- 膀胱疼痛
- 胸部或腹部有灼热感
- 灼烧,爬行,发痒,麻木,刺,“针刺”或刺痛感
- 尿液混浊或流血
- 头晕
- 排尿次数增加
- 消化不良
- 小便疼痛
- 肚子不舒服
- 胃部压痛
罕见
- 视力异常
- 焦虑
- 行为改变类似于醉酒
- 眼出血
- 模糊的视野
- 骨痛
- 乳房增大
- 胸痛
- 发冷
- 冷汗
- 混乱
- 抽搐(癫痫发作)
- 皮肤白皙凉爽
- 耳聋或听力下降
- 尿量或排尿次数减少
- 视力下降
- 难以集中
- 头昏眼花或头昏眼花,尤其是从躺着或坐着的姿势突然起床时
- 双重视野
- 睡意
- 眼睛干涩
- 口干
- 皮肤干燥,发红,脱屑或脱皮
- 过度饥饿
- 眼痛
- 晕厥或晕厥
- 快速,不规则或剧烈的心跳
- 眼中的东西的感觉
- 发烧或发冷
- 头痛(严重或持续)
- 瞳孔增大
- 出汗增加
- 口渴
- 下背部或侧面疼痛
- 偏头痛
- 恶心(严重或持续)
- 紧张
- 噩梦
- 手麻木
- 关节疼痛,肿胀
- 阴茎长时间痛苦地勃起
- 眼睛发红,灼热或肿胀
- 眼睛发红,发痒或流泪
- 不安的睡眠
- 看到与以前不同的颜色阴影
- 对光的敏感性
- 颤抖
- 皮肤肿胀
- 皮肤苍白
- 皮疹,荨麻疹或瘙痒
- 皮肤溃疡
- 言语不清
- 咽喉痛
- 突然的虚弱
- 脸,手,脚或小腿肿胀
- 呼吸困难
- 肌肉抽搐
- 皮肤异常灼痛或刺痛感
- 异常疲倦或虚弱
- 视力改变
- 暂时失明
发病率未知
- 失明
不需要立即就医的副作用
西地那非的某些副作用可能会发生,通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 肌肉疼痛或疼痛
- 鼻子流血
- 腹泻
- 呼吸困难或劳累
- 潮红
- 头痛
- 眼睛和che骨周围疼痛或压痛
- 皮肤发红
- 打喷嚏
- 饭后胃部不适
- 鼻塞或流鼻涕
- 睡眠困难
- 异常温暖的皮肤
罕见
- 腹部或胃痛
- 异梦
- 焦虑
- 笨拙或不稳定
- 咳嗽
- 腹泻或胃痉挛(严重或持续)
- 吞咽困难
- 耳痛
- 唾液增加
- 增加皮肤敏感性
- 缺乏协调
- 失去膀胱控制
- 精神抑郁
- 恶心
- 手,腿或脚的麻木或刺痛感
- 直肠出血
- 舌头发红或发炎
- 牙龈发红,酸痛,肿胀或出血
- 耳鸣或嗡嗡作响
- 自身或周围环境的运动感觉,通常是旋转的
- 男性性问题(续),包括未经历性高潮
- 嗜睡
- 口腔和嘴唇上的疮
- 紧张的肌肉
- 颤抖和颤抖
- 呕吐
- 晚上醒来小便
- 哮喘恶化
对于医疗保健专业人员
适用于西地那非:静脉注射液,口服粉剂,口服片剂
一般
临床试验中报告的最常见不良反应是头痛,潮红,消化不良,视力异常,鼻充血,背痛,肌痛,恶心,头晕和皮疹。 [参考]
心血管的
很常见(10%或更多):冲洗(10%)
罕见(0.1%至1%):心率增加,心pal,心动过速,高血压,低血压
罕见(少于0.1%):心肌梗塞,房颤,心源性猝死,室性心律不齐,不稳定型心绞痛
未报告频率:室性心律失常,猝死,心绞痛,AV阻滞,心动过速,心lp,低血压,体位性低血压,心肌缺血,脑血栓形成,心脏骤停,心力衰竭,心电图异常,心肌病,休克
售后报告:严重的心血管,脑血管和血管事件,包括心肌梗塞;心源性猝死;心律失常脑血管出血;短暂性脑缺血发作高血压;蛛网膜下腔,脑和肺出血的报道与使用该药物在时间上有关。 [参考]
胃肠道
非常常见(10%或更多):消化不良(高达17%),腹泻
常见(1%至10%):恶心,呕吐,口干,胃炎,胃食管反流病,痔疮,腹胀
罕见(小于0.1%):口腔感觉不足
未报告频率:舌炎,结肠炎,吞咽困难,肠胃炎,食道炎,口腔炎,牙龈炎[参考]
肌肉骨骼
很常见(10%或更多):四肢疼痛
常见(1%至10%):背痛,肌痛
未报告的频率:关节炎,关节炎,肌痛,肌腱破裂,腱鞘炎,骨痛,肌无力,滑膜炎[参考]
神经系统
很常见(10%或更多):头痛(高达28%)
常见(1%至10%):头晕,偏头痛,震颤,感觉异常,灼热感
罕见(0.1%至1%):嗜睡,感觉不足
罕见(少于0.1%):脑血管意外,晕厥
未报告频率:短暂性脑缺血发作,癫痫发作,癫痫发作复发,共济失调,高渗,神经痛,神经病变,感觉异常,嗜睡,嗜睡,反射降低
上市后报告:全球暂时性失忆症[参考]
眼科
该药物对同功酶PDE6(在视网膜中发现的一种酶)的亲和力较小。较低的选择性被认为是与以较高剂量或血浆水平观察到的色觉有关的异常的基础。
服用西地那非(Revatio中的有效成分)后几分钟到几小时内,一只眼睛出现了非动脉性前部缺血性视神经病变。五名患者中有四名没有血管性缺血性视神经病变的危险因素。
-视力异常:轻度至中度和短暂性,主要是视觉色泽,但对光线的敏感性或视力模糊。
-视觉颜色失真:色盲,色盲,蓝眼,红血球和黄腐病
-泪流失调:干眼症,泪流失调和流泪增加[参考]
非常常见(10%或更高):视力异常(高达11%)
常见(1%到10%):视觉色彩失真,视网膜出血,视力障碍,视力模糊,畏光,色盲,蓝眼,眼刺激,充血
罕见(0.1%至1%):结膜疾病,眼部疾病,眼痛,流泪障碍,视力下降,复视,眼部异常感觉,光检查,视力亮度,结膜炎
罕见(少于0.1%):视网膜出血,动脉硬化性视网膜病变,视网膜疾病,青光眼,视野缺损,近视,弱视,玻璃体漂浮物,虹膜疾病,瞳孔散大,晕眼,眼水肿,眼肿胀,眼睑水肿,巩膜变色
未报告频率:非动脉前缺血性视神经病变(NAION),视网膜血管阻塞,视野缺损,白内障[参考]
呼吸道
非常常见(10%或更多):咽炎(18%),鼻炎
常见(1%至10%):鼻塞,鼻epi,咳嗽
罕见(0.1%至1%):鼻窦充血
罕见(小于0.1%):喉咙紧绷,鼻水肿,鼻干燥
未报告频率:哮喘,呼吸困难,喉炎,咽炎,鼻窦炎,支气管炎,痰液增加,咳嗽增加[参考]
皮肤科
常见(1%至10%):皮疹,脱发,红斑,盗汗
未报告的频率:史蒂文·约翰逊综合征(SJS),中毒性表皮坏死溶解症(TEN),荨麻疹,单纯疱疹,瘙痒,出汗,皮肤溃疡,接触性皮炎,剥脱性皮炎[参考]
血液学
常见(1%至10%):贫血
未报告频率:白细胞减少
上市后报告:在接受Revatio(R)治疗的肺动脉高压(继发于镰状细胞病)患者中,较常报道需要住院的血管闭塞性危机。该发现在接受西地那非(Revatio中包含的有效成分)治疗的男性患者中对于勃起功能障碍的临床意义尚不清楚。 [参考]
新陈代谢
常见(1%至10%):液体滞留
未报告频率:口渴,水肿,痛风,不稳定的糖尿病,高血糖,高尿酸血症,降糖反应,高钠血症[参考]
其他
常见(1%至10%):蜂窝织炎,流感,支气管炎,鼻窦炎,鼻炎,肠胃炎,眩晕,发热
罕见(0.1%至1%):耳鸣,胸痛,疲劳,女性乳房发育
稀有(小于0.1%):耳聋,易怒
未报告频率:突然听力下降,浮肿,面部浮肿,周围水肿,疼痛,发冷,意外跌倒,意外伤害[参考]
精神科
常见(1%至10%):失眠,焦虑
未报告频率:异常的梦想,沮丧[参考]
泌尿生殖
罕见(0.1%至1%):阴茎出血,血精症
未报告频率:精神异常,勃起时间延长,勃起增加,膀胱炎,夜尿症,尿频,尿失禁,射精异常,生殖器水肿,性欲减退[参考]
肾的
罕见(0.1%至1%):血尿[参考]
过敏症
罕见(少于0.1%):过敏反应,包括皮疹和荨麻疹[参考]
肝的
未报告频率:肝功能检查异常[参考]
参考文献
1. Cerner Multum,Inc.“英国产品特性摘要”。 00
2. Cerner Multum,Inc.“澳大利亚产品信息”。 00
3.“产品信息。修订版(sildenafil)。”辉瑞美国制药集团,纽约,纽约。
4.“产品信息。伟哥(西地那非)。”辉瑞美国制药公司,纽约,纽约。
5. Conti CR,Pepine CJ,Sweeney M“柠檬酸西地那非治疗缺血性心脏病患者勃起功能障碍的疗效和安全性。” Am J Cardiol 83(1999):c29-34
6. Israilov S,Baniel J,Shmueli J等。 “心血管疾病患者勃起功能障碍的治疗方案。” Am J Cardiol 93(2004):689-93
7. Goldenberg MM“柠檬酸西地那非在治疗男性勃起功能障碍中的安全性和有效性”。临床疗法20(1998):1033-48
8.宾夕法尼亚州Pellikka的Arruda-Olson AM,“在服用药物治疗勃起功能障碍之前适当使用运动测试。”赫兹28(2003):291-7
9. Malozowski S,Sahlroot JT,“西地那非的血流动力学效应”。英格兰医学杂志343(2000):967-8
10. Dunn N“西地那非使用者的心血管事件-纸张不能提供任何保证。” Br Med J 323(2001):50-1
11. Kloner RA“心血管风险和西地那非”。 Am J Cardiol 86(2000):F57-61
12. Stanopoulos I,Hatzichristou D,Tryfon S,Tzortzis V,Apostolidis A,Argyropoulou P“西地那非对压力期间心肺反应的影响。”乌克兰杂志169(2003):1417-21
13. Howes LG的Tran D,“西地那非的心血管安全性”。药物安全杂志26(2003):453-60
14. Webster LJ,Michelakis ED,Davis T,Archer SL“使用西地那非可安全改善纽约心脏协会II级和III级充血性心力衰竭男性的勃起功能和生活质量:前瞻性,安慰剂对照,双重盲交叉测试。” Arch Intern Med 164(2004):514-20
15. Feenstra J,vanDriePierik RJHM,Lacle CF,Stricker BHC“与西地那非相关的急性心肌梗死”。柳叶刀352(1998):957-8
16. McLeod AL,McKenna CJ,Northridge DB“娱乐性地使用了伟哥和大麻后,发生了心肌梗塞”。临床乙二醇25(2002):133-4
17. Arruda-Olson AM,Mahoney DW,Nehra A,Leckel M,Pellikka PA“西地那非对已知或可能患有冠心病的男性在运动过程中的心血管作用:一项随机交叉试验。”牙买加287(2002):719-25
18. Kloner RA,Zusman RM,“枸den酸西地那非的心血管作用及其使用建议”。 Am J Cardiol 84(1999):n11-7
19. Khandheria BK“勃起,勃起功能障碍:心脏与它有什么关系?”赫兹28(2003):275-6
20. Montorsi F,McDermott TED,Morgan R,Olsson A,Schultz A,Kirkeby HJ,Osterloh IH“固定剂量口服西地那非治疗各种病因的勃起功能障碍的疗效和安全性”。泌尿外科53(1999):1011-8
21. Egan RA,Pomeranz H“短暂性脑缺血发作与西地那非(Viagra)使用相关的中风。”神经学59(2002):293-4
22. Awan GM,Calderon E,Dawood G,Alpert MA“柠檬酸西地那非治疗后肥厚型梗阻性心肌病患者的急性,有症状心房颤动。”美国医学科学杂志320(2000):69-71
23. Zusman RM,Morales A,Glasser DB,Osterloh IH“枸den酸西地那非的总体心血管特征”。 Am J Cardiol 83(1999):c35-44
24. Bocchi EA,Guimaraes G,Mocelin A,Bacal F,Bellotte G和Ramires JF“西地那非对充血性心力衰竭的运动,神经激素激活和勃起功能障碍的影响:一项双盲,安慰剂对照,随机研究,然后进行勃起功能障碍的前瞻性治疗。”循环106(2002):1097-103
25. Zusman RM“枸sil酸西地那非的心血管数据-简介”。 Am J Cardiol 83(1999):c1-2
26. Jackson G“治疗心血管疾病患者的勃起功能障碍:药物选择指南。”毒品64(2004):1533-45
27. Moreira SG,Brannigan RE,Spitz A,Orejuela FJ,Lipshultz LI,Kim ED,“枸den酸西地那非(Viagra)在临床实践中的副作用”。泌尿科56(2000):474-6
28. McMahon CG,Smali R,Johnson H“柠檬酸西地那非作为勃起功能障碍的治疗的疗效,安全性和患者接受度。” Urol 164(2000):1192-6
29. Brindis RG,Kloner RA,“西地那非用于心血管疾病患者”。 Am J Cardiol 92(9增刊)(2003):26-36
30.博世X“西地那非的作用扩展到其他器官。”柳叶刀355(2000):631
31. Bortolotti M,Mari C,Lopilato C,Porrazzo G,Miglioli M“西地那非对特发性ach门失弛缓症患者食道运动的影响。”胃肠病学118(2000):253-7
32. Goldstein I,Lue TF,Padma-Nathan H,Rosen RC,Steers WD,Wicker PA“口服西地那非治疗勃起功能障碍”。英格兰医学杂志338(1998):1397-404
33. Boolell M,Gepi-Attee S,Gingell JC,Allen MJ,“西地那非,一种用于男性勃起功能障碍的新型有效口服疗法。” Br Urol 78(1996):257-61
34. PadmaNathan H,Steers WD,Wicker PA,“口服西地那非治疗勃起功能障碍的功效和安全性:一项对329名患者进行的双盲,安慰剂对照研究”。国际临床杂志52(1998):375-9
35. Gilad R,Lampl Y,Eshel Y,Sadeh M“服用西地那非的患者的强直性阵挛性癫痫发作。” BMJ 325(2002):869
36. Savitz SA,Caplan LR“西地那非(伟哥)使用后的暂时性全球失忆症”。神经学59(2002):778
37. Vobig MA,Klotz T,Staak M,BartzSchmidt KU,Engelmann U,Walter P“西地那非的视网膜副作用”。柳叶刀353(1999):375
38. Marmor MF“西地那非(伟哥)和眼科”。眼科拱门117(1999):518-9
39. Egan R,Pomeranz H“西地那非(伟哥)相关的前部缺血性视神经病变。”眼科杂志118(2000):291-2
40. Gandhi JS“与西地那非有关的NAION”。眼科杂志110(2003):1860-1。作者回复1861
41. Boshier A,Pambakian N,Shakir SA“一名服用西地那非的男性患者发生非动脉缺血性视神经病变(NAION)的病例。” Int J临床Pharmacol Ther 40(2002):422-3
42. Vobig MA,“西地那非的视网膜副作用”。柳叶刀353(1999):1442
43.“伟哥和视力丧失。” Med Lett Drugs Ther 47(2005):49
44. Jagle H,Jagle C,Serey L等。 “伟哥的视觉短期影响:健康年轻受试者的双盲研究。”美国眼科杂志137(2004):842-9
45. Pomeranz HD,Smith KH,Hart WM Jr,Egan RA“与西地那非相关的非动脉性前部缺血性视神经病变”。眼科学109(2002):584-7
46. Zrenner E“没有必要对西地那非的视网膜副作用引起警觉。”柳叶刀353(1999):340-1
47. Milman HA,Arnold SB“西地那非的神经,心理和攻击性疾病。” Ann Pharmacother 36(2002):1129-34
48. Goldmeier D,Lamba H“由二氢可待因和西地那非产生的长时间勃起。” BMJ 324(2002):1555
49. Kassim AA,Fabry ME,Nagel RL“与镰状细胞性状患者使用西地那非有关的急性阴茎异常勃勃”。血液95(2000):1878-9
某些副作用可能没有报道。您可以将其报告给FDA。
口服混悬粉的重建
注意:重新配制瓶中的内容物,总体积为90 mL(60 mL,然后是30 mL) 。请参阅下面的详细说明。
- 点击瓶子以释放粉末。
- 取下盖子。
- 准确地量出60毫升水,然后将水倒入瓶中。 (图1)
图1
- 盖上盖子并剧烈摇晃瓶子至少30秒钟。 (图2)
图2
- 取下盖子。
- 准确地再量出30毫升水,并将其添加到瓶中。不论处方剂量如何,您都应始终添加总计90毫升的水。 (图3)
图3
- 盖上盖子并剧烈摇晃瓶子至少30秒钟。 (图4)
图4
- 取下盖子。
- 将瓶子适配器按入瓶子的颈部(如下图5所示)。提供适配器,以便您可以用瓶中的药物填充口服注射器。盖上瓶盖。
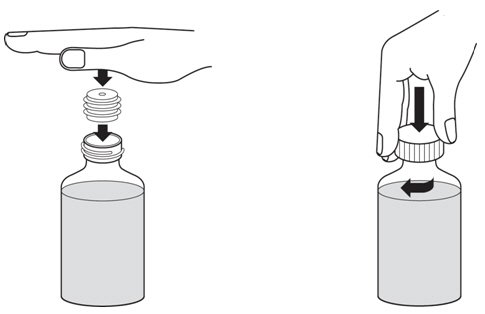
图5
- 在瓶标签上写上重新配制的口服混悬剂的失效日期(重新配制的口服混悬剂的失效日期为自重新配制之日起60天)。
不兼容
请勿与任何其他药物或其他调味剂混合使用。
修订的适应症和用法
适应症适用于成人肺动脉高压的治疗(WHO I组),以提高运动能力并延缓临床恶化。当将Revatio加入背景依泊汀治疗中时,证明了临床恶化的延迟[见临床研究(14) ] 。
建立有效性的研究是短期的(12到16周),主要包括患有纽约心脏协会(NYHA)功能性II–III级症状和特发性病因(71%)或与结缔组织病(CTD)相关的患者(25 %)。
使用限制:在波生坦疗法中加入西地那非不会对运动能力产生任何有益影响[参见临床研究(14) ] 。
剂量和管理
Revatio片剂和口服悬浮液
建议的Revatio剂量为每天3次5 mg或20 mg。间隔4到6个小时服用Revatio剂量。
在临床试验中,使用更大剂量无法获得更大的疗效。不建议每天服用3次高于20 mg的剂量。
修正注射
Revatio注射剂用于继续治疗目前被处方口服Revatio且暂时无法口服药物的PAH患者。
推荐剂量为2.5毫克或10毫克,每天3次静脉推注。 Revatio注射的剂量无需针对体重进行调整。
预计10毫克剂量的Revatio注射剂将提供西地那非及其N-去甲基代谢产物的药理作用,相当于20毫克口服剂量。
口服混悬粉的重建
注意:重新配制瓶中的内容物,总体积为90 mL(60 mL,然后是30 mL) 。请参阅下面的详细说明。
- 点击瓶子以释放粉末。
- 取下盖子。
- 准确地量出60毫升水,然后将水倒入瓶中。 (图1)

图1
- 盖上盖子并剧烈摇晃瓶子至少30秒钟。 (图2)

图2
- 取下盖子。
- 准确地再量出30毫升水,并将其添加到瓶中。不论处方剂量如何,您都应始终添加总计90毫升的水。 (图3)

图3
- 盖上盖子并剧烈摇晃瓶子至少30秒钟。 (图4)

图4
- 取下盖子。
- 将瓶子适配器按入瓶子的颈部(如下图5所示)。提供适配器,以便您可以用瓶中的药物填充口服注射器。盖上瓶盖。

图5
- 在瓶标签上写上重新配制的口服混悬剂的失效日期(重新配制的口服混悬剂的失效日期为自重新配制之日起60天)。
不兼容
请勿与任何其他药物或其他调味剂混合使用。
剂型和优势
平板电脑
白色,薄膜包衣的圆形片剂,刻有“ RVT20”,其中含有枸sil酸西地那非,相当于20 mg西地那非。
修正注射
包含10 mg / 12.5 mL西地那非的一次性瓶。
口服悬浮液的修订
白色至灰白色粉末,装在瓶子中,其中含有1.57 g枸sil酸西地那非(相当于1.12 g西地那非)。用90 mL水复溶后,口服混悬液的体积为112 mL,口服混悬液中含有西地那非10 mg / mL。还提供2 mL口服注射器(带有0.5 mL和2 mL剂量标记)和压入式瓶适配器。
禁忌症
患有以下情况的患者禁止进行修订:
- 由于低血压的风险较大,因此有规律地或间歇性地同时使用任何形式的有机硝酸盐[参见警告和注意事项(5.2) ] 。
- 并用鸟苷酸环化酶刺激剂riociguat。 PDE-5抑制剂(包括西地那非)可能会增强riociguat的降压作用。
- 已知对西地那非或片剂,注射剂或口服混悬剂的任何成分过敏。与西地那非的使用相关的过敏反应包括过敏反应,过敏性休克和类过敏反应。
警告和注意事项
儿科死亡率
在儿科PAH患者的一项长期试验中,观察到死亡率随着Revatio剂量的增加而增加。大约1年后首次观察到死亡,并且死因是PAH患者的典型病因。不建议在儿童中使用Revatio,尤其是长期使用[请参阅在特定人群中使用(8.4) ]。
低血压
Revatio具有血管舒张特性,可导致血压轻度和短暂降低。在开具Revatio处方之前,请仔细考虑是否存在某些潜在疾病的患者会受到此类血管舒张作用的不利影响(例如,接受抗高血压治疗或静息性低血压[BP低于90/50],体液耗竭,严重左心室流出道阻塞或自主神经功能障碍)。与Revatio并用降压药物时,请监测血压。
恶化的肺血管阻塞性疾病
肺血管扩张剂可能会使肺静脉闭塞性疾病(PVOD)患者的心血管状况显着恶化。由于尚无关于静脉闭塞性疾病患者服用Revatio的临床数据,因此不建议将此类药物给予Revatio。进行Revatio时,如果出现肺水肿的迹象,请考虑是否伴有PVOD。
鼻出血
接受CTD继发PAH修订版的患者,鼻epi发生率为13%。在特发性PAH(Revatio 3%,安慰剂2%)患者中未观察到这种作用。接受口服维生素K拮抗剂同时接受Revatio治疗的患者,鼻epi的发生率也更高(9%vs未接受维生素K拮抗剂治疗的患者为2%)。
对于有出血性疾病或活动性消化性溃疡的患者,Revatio的安全性尚不清楚。
视觉损失
据报道,当用于治疗勃起功能障碍时,非动脉性前部缺血性视神经病变(NAION)是导致视力下降(包括永久性视力下降)的原因,其上市后与磷酸二酯酶5型(PDE-5)抑制剂的使用在时间上相关,包括西地那非。这些患者中的大多数(但不是全部)具有形成NAION的潜在解剖或血管危险因素,包括但不限于:杯盘比低(“拥挤的盘”),50岁以上的人群,糖尿病,高血压,冠心病,高脂血症和吸烟。根据已发表的文献,在一般人群中,NAION的年发病率为每10万名≥50岁的男性,每年2.5-11.8例。
一项观察性病例交叉研究评估了与之前一段时间内使用PDE-5抑制剂相比,当将PDE-5抑制剂作为一类使用发生在NAION发作之前(5个半衰期内)时发生NAION的风险。结果表明,NAION的风险大约增加了2倍,风险估计为2.15(95%CI 1.06,4.34)。一项类似的研究报告了一致的结果,风险估计为2.27(95%CI 0.99,5.20)。在这些研究中,其他有关NAION的危险因素,例如“拥挤的”视盘的存在,也可能导致了NAION的发生。
无论是罕见的售后报道,还是观察性研究中PDE-5抑制剂的使用与NAION的关联都不能证实PDE-5抑制剂的使用与NAION之间的因果关系[参见不良反应(6.2 ) 。
建议患者在服用包括Revatio在内的PDE-5抑制剂时,如果一只或两只眼睛突然失去视力,应立即寻求医疗护理。医师还应与一只眼睛已经经历NAION的患者讨论NAION增加的风险,包括使用血管扩张药(例如PDE-5抑制剂)是否会对此类个体产生不利影响。
对于患有视网膜色素磷酸二酯酶遗传疾病的少数色素性视网膜炎患者,Revatio的安全性或有效性尚无可控制的临床数据。在这些患者中谨慎开处方。
听力损失
据报道,与PDE-5抑制剂(包括Revatio)的使用在时间上相关的病例,可能伴有耳鸣和头昏眼花的突然下降或听力下降。在某些情况下,据报道医疗状况和其他因素可能起到了作用。在许多情况下,医疗随访信息有限。无法确定这些报告的事件是否与Revatio的使用,患者听力下降的潜在危险因素,这些因素的组合或其他因素直接相关。
建议服用PDE-5抑制剂(包括Revatio)的患者突然下降或听力丧失时,应立即寻求医疗护理。
与其他PDE-5抑制剂组合
西地那非也以VIAGRA®销售。还没有研究Revatio与VIAGRA或其他PDE-5抑制剂联合使用的安全性和有效性。通知服用Revatio的患者不要服用VIAGRA或其他PDE-5抑制剂。
独裁者
对于阴茎解剖结构变形(例如,成角度,海绵体纤维化或Peyronie病)的患者或患有可能易患易感症(例如,镰状细胞性贫血,多发性骨髓瘤或白血病)的患者,请谨慎使用Revatio 。如果勃起持续超过4小时,患者应立即寻求医疗救助。如果阴茎勃起症(持续勃起时间超过6小时)没有得到立即治疗,可能会导致阴茎组织损伤和永久性丧失效能。
镰状细胞性贫血继发于肺动脉高压的血管闭塞性危机
在一项针对镰状细胞病继发性肺动脉高压(PH)患者的过早终止的小型研究中,接受Revatio的患者比接受随机安慰剂的患者更常报告需要住院的血管闭塞性危机。还没有确定Revatio在镰状细胞性贫血继发性PAH的治疗中的有效性和安全性。
不良反应
标签中其他地方讨论了以下严重不良事件:
- 儿科使用死亡率[请参阅警告和注意事项(5.1)和特定人群的使用(8.4) ]
- 低血压[请参阅警告和注意事项(5.2) ]
- 视力丧失[请参阅警告和注意事项(5.5) ]
- 听力损失[请参阅警告和注意事项(5.6) ]
- 暴虐[请参阅警告和注意事项(5.8) ]
- 血管阻塞性危机[请参阅警告和注意事项(5.9) ]
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
成人的Revatio的安全性数据来自于WHO第I组对277例接受Revatio治疗的PAH患者进行的为期12周的安慰剂对照临床研究(研究1)和开放标签扩展研究[参见临床研究(14) ]。 。
每天3次接受Revatio治疗的患者,停药的总频率为3%,与安慰剂组相同。
在研究1中,表1显示了至少3%的接受Revatio治疗的患者(每天3次,每天20 mg)报告的不良反应,并且在Revatio治疗的患者中发生的不良反应比安慰剂治疗的患者更为频繁。反应一般是短暂的,性质上是轻度至中度。
| 安慰剂, % (n = 70) | 每天三次,每次20 mg,% (n = 69) | 安慰剂- 减去,% | |
|---|---|---|---|
| 鼻出血 | 1个 | 9 | 8 |
| 头痛 | 39 | 46 | 7 |
| 消化不良 | 7 | 13 | 6 |
| 冲洗 | 4 | 10 | 6 |
| 失眠 | 1个 | 7 | 6 |
| 红斑 | 1个 | 6 | 5 |
| 呼吸困难加重 | 3 | 7 | 4 |
| 鼻炎 | 0 | 4 | 4 |
| 腹泻 | 6 | 9 | 3 |
| 肌痛 | 4 | 7 | 3 |
| 发热 | 3 | 6 | 3 |
| 胃炎 | 0 | 3 | 3 |
| 鼻窦炎 | 0 | 3 | 3 |
| 感觉异常 | 0 | 3 | 3 |
剂量高于建议的20毫克,一天3次,出现一些不良反应的可能性更高,包括潮红,腹泻,肌痛和视觉障碍。视力障碍被确定为轻度和短暂性,主要是视觉色泽,但对光或视力模糊的敏感性增加。
每天3次Revatio 20 mg视网膜出血的发生率分别为1.4%和0%安慰剂,研究的所有Revatio剂量为1.9%vs 0%安慰剂。每天两次20毫克和所有研究剂量的眼出血的发生率,Revatio为1.4%,安慰剂为1.4%。发生这些反应的患者有出血风险因素,包括同时进行抗凝治疗。
在安慰剂对照的固定剂量滴定研究(研究2)中(建议剂量为20 mg,开始每天增加3次,分别增加到40 mg,然后每天80 mg)作为PAH患者静脉内依泊汀的辅助治疗,表2显示了Revatio + epoprostenol组比epoprostenol组更常见的不良反应(差异大于6%) [见临床研究(14) ] 。
| 修订版+松香醇 (n = 134) | 松香醇 (n = 131) | (Revatio + Epoprostenol)减去Epoprostenol | |
|---|---|---|---|
| |||
| 头痛 | 57 | 34 | 23 |
| 水肿* | 25 | 13 | 14 |
| 消化不良 | 16 | 2 | 14 |
| 四肢疼痛 | 17 | 6 | 11 |
| 腹泻 | 25 | 18岁 | 7 |
| 恶心 | 25 | 18岁 | 7 |
| 鼻塞 | 9 | 2 | 7 |
修正注射
在66位患者的安慰剂对照研究中,以血浆浓度为10至500 ng / mL(最高推荐剂量的8倍)的剂量对PAH患者进行了Revatio注射研究。 Revatio注射液的不良反应与口服片剂相似。
上市后经验
在批准西地那非(市售PAH和勃起功能障碍)的批准后使用期间,已确认存在以下不良反应。由于这些反应是从不确定大小的人群中自愿报告的,因此并非总是能够可靠地估计其发生频率或建立与药物暴露的因果关系。
心血管事件
在西地那非的上市后经验中,指示剂量的勃起功能障碍,严重的心血管,脑血管和血管事件,包括心肌梗塞,猝死,室性心律失常,脑血管出血,短暂性缺血发作,高血压,肺出血以及蛛网膜下腔和脑内出血据报道与药物的使用有关。这些患者中的大多数(但不是全部)都已存在心血管危险因素。据报道,这些事件中有许多是在性活动期间或之后发生的,还有一些事件是在不使用西地那非的情况下不久发生的。据报道其他人在使用后数小时至数天发生性行为。无法确定这些事件是否与西地那非,性活动,患者的潜在心血管疾病或这些因素或其他因素的组合直接相关。
神经系统
癫痫发作,癫痫复发
眼科的
NAION [请参阅警告和注意事项(5.5)和患者咨询信息(17) ] 。
药物相互作用
硝酸盐
禁止将Revatio与任何形式的硝酸盐同时使用[请参阅禁忌症(4) ] 。
利托那韦和其他强效CYP3A抑制剂
不建议将Revatio与利托那韦和其他有效的CYP3A抑制剂同时使用[见临床药理学(12.3) ] 。
其他降低血压的药物
阿尔法阻滞剂。在药物相互作用研究中,将西地那非(25 mg,50 mg或100 mg)和α受体阻滞剂多沙唑嗪(4 mg或8 mg)同时给予经多沙唑嗪治疗稳定的良性前列腺增生(BPH)患者。在这些研究人群中,观察到仰卧收缩压和舒张压分别平均降低了7/7 mmHg,9/5 mmHg和8/4 mmHg。还观察到平均站立血压分别进一步降低了6/6 mmHg,11/4 mmHg和4/5 mmHg。很少有症状性体位性低血压的患者报告。这些报告包括头晕和头昏眼花,但不包括晕厥。
氨氯地平。当将100毫克西地那非与5毫克或10毫克氨氯地平共同给予高血压患者时,仰卧位血压的平均额外降低幅度为收缩压8 mmHg和舒张压7 mmHg。
与Revatio并用降压药物时监测血压[参见警告和注意事项(5.2) ] 。
在特定人群中的使用
怀孕
风险摘要
在妊娠期间使用西地那非时,来自随机对照试验,病例对照试验和病例系列的有限的公开数据未报告与西地那非和主要的出生缺陷,流产或母体或胎儿不良结局有明确的关联。未经治疗的肺动脉高压对母亲和胎儿都有风险(请参阅临床注意事项)。用西地那非进行的动物繁殖研究显示,没有证据表明在大鼠和兔子中,分别以每日建议剂量20 mg的人剂量(RHD)分别达到32倍和65倍时,胚胎-胎儿毒性或致畸性[见数据] 。
对于指定人群,估计的主要先天缺陷和流产的背景风险尚不清楚。所有怀孕都有出生缺陷,流产或其他不良后果的背景风险。在美国普通人群中,临床公认的怀孕中主要出生缺陷和流产的估计背景风险分别为2–4%和15–20%。
临床注意事项
与疾病相关的孕产妇和/或胚胎/胎儿风险
患有未经治疗的肺动脉高压的孕妇有发生心力衰竭,中风,早产以及母婴死亡的风险。
数据
动物资料
在器官发生过程中,未给予西地那非200 mg / kg /天的孕鼠或兔子,未观察到致畸,胚胎毒性或胎儿毒性的证据,以mg / m 2为基础,该水平分别为32倍和65倍,建议的人类剂量(RHD)为20毫克,每天3次。在大鼠产前和产后发育研究中,未观察到的不良反应剂量为30 mg / kg /天(相当于以mg / m 2为基础的RHD的5倍)。
哺乳期
风险摘要
病例报告中有限的公开数据描述了西地那非及其活性代谢产物在母乳中的存在。没有关于西地那非对母乳喂养婴儿的影响的信息,也没有关于西地那非对乳汁生产的影响的信息。哺乳期间有限的临床数据无法明确确定哺乳期间婴儿患Revatio的风险。
儿科用
在一项随机,双盲,多中心,安慰剂对照,平行组,剂量范围研究中,将234例1-17岁,体重大于或等于8 kg的PAH患者随机分组,以体重为基础,以三种剂量水平的Revatio或安慰剂治疗16周。大多数患者在基线时出现轻度至中度症状:WHO功能I级(32%),II级(51%),III级(15%)或IV级(0.4%)。三分之一的患者患有原发性PAH;三分之二的患者患有继发性PAH(全身肺分流为37%;外科手术修复为30%)。 62%的患者是女性。药物或安慰剂每天给药3次。
这项研究的主要目的是评估Revatio对运动能力的影响,该能力通过心肺运动测试对有能力进行该测试的小儿患者进行了评估(n = 115)。服用Revatio并未导致这些患者的运动能力有统计学上的显着改善。在16周的对照研究中,没有患者死亡。
在完成为期16周的对照研究后,最初随机分配给Revatio的患者仍保持其Revatio剂量,或者如果最初随机分配给安慰剂,则随机分配至低,中或高剂量Revatio。在对照研究中所有患者完成了16周的随访后,盲人被打破,并根据临床指示调整剂量。接受西地那非治疗的患者的中位随访时间为4.6年(范围为2天至8.6年)。通过最初分配的剂量进行的长期研究中的死亡率如图6所示:
 |
在研究期间,有42例死亡报告,其中37例死亡是在决定将受试者滴定至较低剂量之前报告的,因为发现随Revatio剂量增加死亡率增加。对于包括37例死亡的生存分析,高剂量与低剂量相比,危险比为3.9,p = 0.007。死亡原因是PAH患者的典型病因。不建议在儿童中使用Revatio,尤其是长期使用。
老人用
Revatio的临床研究没有包括足够多的65岁及以上的受试者,以确定他们是否与年轻受试者反应不同。其他报告的临床经验尚未发现老年患者和年轻患者在反应方面的差异。一般而言,老年患者的剂量选择应谨慎,以反映肝,肾或心脏功能下降以及伴随疾病或其他药物治疗的频率更高[见临床药理学(12.3) ] 。
肝功能不全患者
对于轻度至中度损伤,无需调整剂量。尚未研究严重损伤[见临床药理学(12.3) ] 。
肾功能不全的患者
无需调整剂量(包括严重损伤CLcr <30 mL / min) [请参见临床药理学(12.3) ] 。
过量
在单剂量至多800 mg的健康志愿者的研究中,不良事件与低剂量时的不良事件相似,但发生率和严重程度有所提高。
如果用药过量,应根据需要采取标准的支持措施。由于西地那非与血浆蛋白高度结合,并且不能在尿液中清除,因此肾脏透析不会加速清除过程。
版本说明
修订版,磷酸二酯酶5(PDE-5)抑制剂,是西地那非的柠檬酸盐,西地那非是环状鸟苷单磷酸(cGMP)特异性5型磷酸二酯酶(PDE-5)的选择性抑制剂。西地那非也销售伟哥®勃起功能障碍。
柠檬酸西地那非在化学上被称为1-[[3-(6,7-二氢-1-甲基-7-氧代-3-丙基-1 H-吡唑并[4,3- d ]嘧啶-5-基)-4 -乙氧基苯基]磺酰基] -4-甲基哌嗪柠檬酸酯,具有以下结构式:

柠檬酸西地那非是白色至类白色结晶性粉末,在水中的溶解度为3.5 mg / mL,分子量为666.7。
Revatio(西地那非)片剂:Revatio配制为白色,薄膜包衣的圆形片剂,用于口服。每片含有枸sil酸西地那非,相当于20毫克西地那非。除活性成分柠檬酸西地那非外,每片均包含以下非活性成分:微晶纤维素,无水磷酸氢钙,交联羧甲基纤维素钠,硬脂酸镁,羟丙甲纤维素,二氧化钛,乳糖一水合物和三醋精。
Revatio(西地那非)注射剂:Revatio是一种透明,无色,无菌,即用型溶液,装在一次性使用的小瓶中,该小瓶中含有10 mg / 12.5 mL的西地那非。每毫升溶液包含1.124 mg柠檬酸西地那非(相当于0.8 mg西地那非),50.5 mg葡萄糖和注射用水。
口服混悬剂(西地那非):白色至灰白色粉末形式的Revatio含有1.57克枸sil酸西地那非(相当于1.12克西地那非),用于重新配制。用90 mL水复溶后,口服混悬液的体积为112 mL,口服混悬液中含有西地那非10 mg / mL。非活性成分包括山梨糖醇,无水柠檬酸,三氯蔗糖,柠檬酸钠二水合物,黄原胶,二氧化钛,苯甲酸钠,无水胶体二氧化硅和葡萄风味。除瓶子外,还提供压入式瓶子适配器和口服剂量注射器(带有0.5 mL和2 mL剂量标记)。
修订-临床药理学
作用机理
西地那非是肺血管平滑肌中cGMP特异性磷酸二酯酶5型(PDE-5)的抑制剂,其中PDE-5负责cGMP的降解。因此,西地那非可增加肺血管平滑肌细胞内的cGMP,从而导致松弛。在PAH患者中,这可能导致肺血管床的血管舒张,并在较小程度上导致全身循环中的血管舒张。
体外研究表明西地那非对PDE-5具有选择性。它对PDE-5的作用比对其他已知磷酸二酯酶的作用更强(PDE6的作用是10倍,PDE1的作用是80倍以上,PDE2,PDE3,PDE4,PDE7,PDE8,PDE9,PDE10和PDE2的作用是700倍以上) PDE11)。 PDE-5对PDE3的选择性约为4,000倍,这很重要,因为PDE3参与心脏收缩力的控制。西地那非对PDE-5的效力仅是PDE6的10倍,PDE6是一种在视网膜中发现的酶,参与视网膜的光转导途径。较低的选择性被认为是与以较高剂量或血浆水平观察到的色觉相关的异常的基础[参见临床药理学(12.2) ] 。
除了肺血管平滑肌和海绵体外,PDE-5还存在于其他组织中,包括血管和内脏平滑肌以及血小板。西地那非对这些组织中PDE-5的抑制作用可能是体外观察到的一氧化氮增强的血小板抗聚集活性以及体内轻度的外周动脉-静脉扩张的基础。
药效学
修正对血流动力学指标的影响
与无背景血管舒张剂的研究相比,使用所有Revatio剂量的患者与安慰剂组相比,平均肺动脉压(mPAP)均有统计学显着性降低[临床研究1 (14) ] 。表3显示了每天3次Revatio 20 mg的其他血液动力学测量数据和安慰剂给药方案。这些作用与6分钟步行距离改善之间的关系尚不清楚。
| 安慰剂 (n = 65) * | 比例20毫克 一天三次 (n = 65) * | |
|---|---|---|
| mPAP =平均肺动脉压; PVR =肺血管阻力; SVR =全身血管阻力; RAP =右房压; CO =心输出量; HR =心率 | ||
| ||
| mPAP(毫米汞柱) | 0.6(-0.8,2.0) | -2.1(-4.3,0.0) |
| PVR(dyn∙s / cm 5 ) | 49(-54,153) | -122(-217,-27) |
| SVR(dyn∙s / cm 5 ) | -78(-197,41) | -167(-307,-26) |
| RAP(毫米汞柱) | 0.3(-0.9,1.5) | -0.8(-1.9,0.3) |
| CO(升/分钟) | -0.1(-0.4,0.2) | 0.4(0.1,0.7) |
| 心率(次/分) | -1.3(-4.1,1.4) | -3.7(-5.9,-1.4) |
在另一项评估西地那非1 mg,5 mg和20 mg较低剂量的研究中[临床研究3 (14) ] ,各剂量之间对血流动力学变量的影响没有显着差异。
修正对血压的影响
向健康志愿者单次口服西地那非100 mg可使仰卧位血压降低(平均收缩压/舒张压最大降低8/5 mmHg)。给药后约1-2小时,血压下降最为明显,并且在8小时后与安慰剂无差异。西地那非的剂量分别为25 mg,50 mg和100 mg,对血压有相似的影响,因此,该作用与该剂量范围内的剂量或血浆水平无关。在同时接受硝酸盐治疗的患者中记录到更大的效果[见禁忌症(4) ] 。
在健康志愿者中单次口服西地那非至多100 mg,对心电图没有临床相关影响。每天对PAH患者每天3次慢性给药80 mg后,尚无关于ECG的临床相关影响的报道。
每天向健康志愿者每天三次给予80 mg西地那非的慢性剂量后,仰卧位收缩压和仰卧位舒张压相对于基线的最大平均变化分别为降低9.0 mmHg和8.4 mmHg。
每天向全身性高血压患者每天三次给予80 mg西地那非的慢性剂量后,收缩压和舒张压相对于基线的平均变化分别降低了9.4 mmHg和9.1 mmHg。
每天向丙型肝炎患者每天三次给予80毫克西地那非的慢性剂量后,观察到收缩压和舒张压的下降幅度均小于上述幅度(两者均下降2 mmHg)。
修订对视觉的影响
在100 mg和200 mg的单次口服剂量下,使用Farnsworth-Munsell 100色相测试检测到短暂的剂量相关的颜色歧视(蓝/绿),峰值血浆水平接近峰值。该发现与PDE6的抑制相一致,PDE6的抑制与视网膜的光转导有关。最高200 mg剂量的视觉功能评估显示,Revatio对视力,眼压或瞳孔测定法没有影响。
药代动力学
吸收与分布
口服给药后,速动迅速吸收,平均绝对生物利用度为41%(25–63%)。在禁食状态下口服给药的30至120分钟(中值60分钟)内可达到观察到的最大血浆浓度。当以高脂餐食服用Revatio时,吸收率降低,T max的平均延迟为60分钟,C max的平均降低为29%。西地那非的平均稳态分布体积(Vss)为105 L,表明已分布到组织中。西地那非及其主要循环N-去甲基代谢产物均与血浆蛋白结合约96%。蛋白结合与总药物浓度无关。
当以20 mg单次口服西地那非(柠檬酸盐)给药时,在20 mg片剂和10 mg / mL口服混悬液之间建立了生物等效性。
代谢与排泄
西地那非主要由CYP3A(主要途径)和细胞色素P450 2C9(CYP2C9,次要途径)肝微粒体同工酶清除。西地那非的N-去甲基化作用是主要的循环代谢产物,其本身被进一步代谢。该代谢产物具有与西地那非相似的磷酸二酯酶选择性,并且对PDE-5的体外效力约为母体药物的50%。在健康志愿者中,这种代谢产物的血浆浓度约为西地那非的40%,因此该代谢产物约占西地那非药理作用的20%。然而,在PAH患者中,代谢产物与西地那非的比例更高。西地那非和活性代谢物均具有约4小时的终末半衰期。
口服或静脉内给药后,西地那非主要以代谢产物的形式排泄在粪便中(约占口服剂量的80%),在尿液中的代谢程度较小(约占口服剂量的13%)。
Revatio注射:Revatio的药代动力学特征已在静脉内给药后表征。预计10 mg的Revatio Injection剂量将提供sildenafil及其N-去甲基代谢产物的药理作用,相当于20 mg口服剂量。
人群药代动力学
在人群药代动力学模型中评估了年龄,性别,种族以及肾和肝功能,作为评估PAH患者西地那非药代动力学的因素。可用于人群药代动力学评估的数据集包含广泛的人口统计学数据和与肝,肾功能相关的实验室参数。这些因素均未对PAH患者的西地那非药代动力学产生重大影响。
与健康志愿者相比,PAH患者的平均稳态浓度高20-50%。与健康志愿者相比,C min水平也加倍。两项发现均表明,与健康志愿者相比,PAH患者西地那非的清除率较低和/或口服生物利用度较高。
老年患者
健康的老年志愿者(65岁或以上)的西地那非清除率降低,与健康的年轻志愿者相比,西地那非及其活性N-去甲基代谢产物的血浆浓度分别升高约84%和107%。 45年)。由于血浆蛋白结合的年龄差异,游离(未结合)西地那非及其活性N-去甲基代谢产物的AUC相应增加分别为45%和57%。
肾功能不全
在轻度(CLcr = 50–80 mL / min)和中度(CLcr = 30–49 mL / min)肾功能不全的志愿者中,单次口服西地那非(50 mg)的药代动力学没有改变。 In volunteers with severe (CLcr less than 30 mL/min) renal impairment, sildenafil clearance was reduced, resulting in approximately doubling of AUC and C max compared to age-matched volunteers with no renal impairment. In addition, N-desmethyl metabolite AUC and C max values were significantly increased 200 % and 79 %, respectively, in subjects with severe renal impairment compared to subjects with normal renal function.
肝功能不全
In volunteers with mild to moderate hepatic cirrhosis (Child-Pugh class A and B), sildenafil clearance was reduced, resulting in increases in AUC (84%) and C max (47%) compared to age-matched volunteers with no hepatic impairment. Patients with severe hepatic impairment (Child-Pugh class C) have not been studied.
药物相互作用研究
In vitro studies
Sildenafil metabolism is principally mediated by the CYP3A (major route) and CYP2C9 (minor route) cytochrome P450 isoforms. Therefore, inhibitors of these isoenzymes may reduce sildenafil clearance and inducers of these isoenzymes may increase sildenafil clearance.
Sildenafil is a weak inhibitor of the cytochrome P450 isoforms 1A2, 2C9, 2C19, 2D6, 2E1 and 3A (IC50 greater than150 µM).
Sildenafil is not expected to affect the pharmacokinetics of compounds which are substrates of these CYP enzymes at clinically relevant concentrations.
In vivo studies
The effects of other drugs on sildenafil pharmacokinetics and the effects of sildenafil on the exposure to other drugs are shown in Figure 7 and Figure 8, respectively.
| Figure 7. Effects of Other Drugs on Sildenafil Pharmacokinetics |
|
| Figure 8 Effects of Sildenafil on Other Drugs |
|
CYP3A Inhibitors and Beta Blockers
Population pharmacokinetic analysis of data from patients in clinical trials indicated an approximately 30% reduction in sildenafil clearance when it was co-administered with mild/moderate CYP3A inhibitors and an approximately 34% reductions in sildenafil clearance when co-administered with beta-blockers. Sildenafil exposure at a dose of 80 mg three times a day without concomitant medication is shown to be 5-fold the exposure at a dose of 20 mg three times a day. This concentration range covers the same increased sildenafil exposure observed in specifically-designed drug interaction studies with CYP3A inhibitors (except for potent inhibitors such as ketoconazole, itraconazole, and ritonavir).
Revatio Injection: Predictions based on a pharmacokinetic model suggest that drug-drug interactions with CYP3A inhibitors will be less than those observed after oral sildenafil administration.
CYP3A4 inducers including bosentan
Concomitant administration of potent CYP3A inducers is expected to cause substantial decreases in plasma levels of sildenafil.
Population pharmacokinetic analysis of data from patients in clinical trials indicated approximately 3-fold the sildenafil clearance when it was co-administered with mild CYP3A inducers.
Epoprostenol
The mean reduction of sildenafil (80 mg three times a day) bioavailability when co-administered with epoprostenol was 28%, resulting in about 22% lower mean average steady state concentrations. Therefore, the slight decrease of sildenafil exposure in the presence of epoprostenol is not considered clinically relevant. The effect of sildenafil on epoprostenol pharmacokinetics is not known.
No significant interactions were shown with tolbutamide (250 mg) or warfarin (40 mg), both of which are metabolized by CYP2C9.
醇
Sildenafil (50 mg) did not potentiate the hypotensive effect of alcohol in healthy volunteers with mean maximum blood alcohol levels of 0.08%.
非临床毒理学
致癌,诱变,生育力受损
Sildenafil was not carcinogenic when administered to rats for up to 24 months at 60 mg/kg/day, a dose resulting in total systemic exposure (AUC) to unbound sildenafil and its major metabolite 33- and 37-times, for male and female rats respectively, the human exposure at the RHD of 20 mg three times a day. Sildenafil was not carcinogenic when administered to male and female mice for up to 21 and 18 months, respectively, at doses up to a maximally tolerated level of 10 mg/kg/day, a dose equivalent to the RHD on a mg/m 2 basis.
Sildenafil was negative in in vitro bacterial and Chinese hamster ovary cell assays to detect mutagenicity, and in vitro human lymphocytes and in vivo mouse micronucleus assays to detect clastogenicity.
There was no impairment of fertility in male or female rats given up to 60 mg sildenafil/kg/day, a dose producing a total systemic exposure (AUC) to unbound sildenafil and its major metabolite of 19- and 38- times for males and females, respectively, the human exposure at the RHD of 20 mg three times a day.
临床研究
Studies of Adults with Pulmonary Arterial Hypertension
Study 1 (Revatio monotherapy (20 mg, 40 mg, and 80 mg three times a day))
A randomized, double-blind, placebo-controlled study of Revatio (Study 1) was conducted in 277 patients with PAH (defined as a mean pulmonary artery pressure of greater than or equal to 25 mmHg at rest with a pulmonary capillary wedge pressure less than 15 mmHg). Patients were predominantly World Health Organization (WHO) functional classes II–III. Allowed background therapy included a combination of anticoagulants, digoxin, calcium channel blockers, diuretics, and oxygen. The use of prostacyclin analogues, endothelin receptor antagonists, and arginine supplementation were not permitted. Subjects who had failed to respond to bosentan were also excluded. Patients with left ventricular ejection fraction less than 45% or left ventricular shortening fraction less than 0.2 also were not studied.
Patients were randomized to receive placebo (n=70) or Revatio 20 mg (n = 69), 40 mg (n = 67) or 80 mg (n = 71) three times a day for a period of 12 weeks. They had either primary pulmonary hypertension (PPH) (63%), PAH associated with CTD (30%), or PAH following surgical repair of left-to-right congenital heart lesions (7%). The study population consisted of 25% men and 75% women with a mean age of 49 years (range: 18–81 years) and baseline 6-minute walk distance between 100 and 450 meters (mean 343).
The primary efficacy endpoint was the change from baseline at week 12 (at least 4 hours after the last dose) in the 6-minute walk distance. Placebo-corrected mean increases in walk distance of 45–50 meters were observed with all doses of Revatio. These increases were significantly different from placebo, but the Revatio dose groups were not different from each other (see Figure 9 ), indicating no additional clinical benefit from doses higher than 20 mg three times a day. The improvement in walk distance was apparent after 4 weeks of treatment and was maintained at week 8 and week 12.
| Figure 9. Change from Baseline in 6-Minute Walk Distance (meters) at Weeks 4, 8, and 12 in Study 1: Mean (95% Confidence Interval) |
|
Figure 10 displays subgroup efficacy analyses in Study 1 for the change from baseline in 6-Minute Walk Distance at Week 12 including baseline walk distance, disease etiology, functional class, gender, age, and hemodynamic parameters.
| Key: PAH = pulmonary arterial hypertension; CTD = connective tissue disease; PH = pulmonary hypertension; PAP = pulmonary arterial pressure; PVRI = pulmonary vascular resistance index; TID = three times daily. |
| Figure 10. Placebo-Corrected Change From Baseline in 6-Minute Walk Distance (meters) at Week 12 by study subpopulation in Study 1: Mean (95% Confidence Interval) |
|
Of the 277 treated patients, 259 entered a long-term, uncontrolled extension study. At the end of 1 year, 94% of these patients were still alive. Additionally, walk distance and functional class status appeared to be stable in patients taking Revatio. Without a control group, these data must be interpreted cautiously.
Study 2 (Revatio co-administered with epoprostenol)
A randomized, double-blind, placebo controlled study (Study 2) was conducted in 267 patients with PAH who were taking stable doses of intravenous epoprostenol. Patients had to have a mean pulmonary artery pressure (mPAP) greater than or equal to 25 mmHg and a pulmonary capillary wedge pressure (PCWP) less than or equal to 15 mmHg at rest via right heart catheterization within 21 days before randomization, and a baseline 6-minute walk test distance greater than or equal to 100 meters and less than or equal to 450 meters (mean 349 meters). Patients were randomized to placebo or Revatio (in a fixed titration starting from 20 mg, to 40 mg and then 80 mg, three times a day) and all patients continued intravenous epoprostenol therapy.
At baseline patients had PPH (80%) or PAH secondary to CTD (20%);WHO functional class I (1%), II (26%), III (67%), or IV (6%); and the mean age was 48 years, 80% were female, and 79% were Caucasian.
There was a statistically significant greater increase from baseline in 6-minute walk distance at Week 16 (primary endpoint) for the Revatio group compared with the placebo group. The mean change from baseline at Week 16 (last observation carried forward) was 30 meters for the Revatio group compared with 4 meters for the placebo group giving an adjusted treatment difference of 26 meters (95% CI: 10.8, 41.2) (p = 0.0009).
Patients on Revatio achieved a statistically significant reduction in mPAP compared to those on placebo. A mean placebo-corrected treatment effect of -3.9 mmHg was observed in favor of Revatio (95% CI: -5.7, -2.1) (p = 0.00003).
Time to clinical worsening of PAH was defined as the time from randomization to the first occurrence of a clinical worsening event (death, lung transplantation, initiation of bosentan therapy, or clinical deterioration requiring a change in epoprostenol therapy). Table 4 displays the number of patients with clinical worsening events in Study 2. Kaplan-Meier estimates and a stratified log-rank test demonstrated that placebo-treated patients were 3 times more likely to experience a clinical worsening event than Revatio-treated patients and that Revatio-treated patients experienced a significant delay in time to clinical worsening versus placebo-treated patients (p = 0.0074). Kaplan-Meier plot of time to clinical worsening is presented in Figure 11.
| 安慰剂 (N = 131) | 修改率 (N = 134) | |||||||
|---|---|---|---|---|---|---|---|---|
| Number of subjects with clinical worsening first event | 23 | 8 | ||||||
| First Event | All Events | First Event | All Events | |||||
| Death, n | 3 | 4 | 0 | 0 | ||||
| Lung Transplantation, n | 1个 | 1个 | 0 | 0 | ||||
| Hospitalization due to PAH, n | 9 | 11 | 8 | 8 | ||||
| Clinical deterioration resulting in: | ||||||||
| Change of Epoprostenol Dose, n | 9 | 16 | 0 | 2 | ||||
| Initiation of Bosentan, n | ||||||||
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义最小。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
- 审批历史 FDA的药物史
美国日本医生

Heather Benjamin MD

Heather Benjamin MD

Suzanne Reitz MD

Heather Miske DO

Heather Miske DO

渡邊剛

渡邊剛

宮崎総一郎 中部大学特聘教授

百村伸一 教授

百村伸一 教授
临床试验
- 急性髓样白血病中的PHF19基因表达和EZH2基因缺失
- R-CHOP与漫纳替麦胺在一线治疗中结合了弥漫性大B细胞淋巴瘤患者的一线治疗
- 对患有晚期血液学或实体瘤患者的AZD0466的研究
- 多发性骨髓瘤中锌指蛋白217基因的扩增
- 多发性骨髓瘤患者的Loratadine减少G-CSF诱导的骨痛
- AL淀粉样变性患者的自体干细胞移植
- 对血液系统恶性肿瘤患者的嵌合抗原受体(CAR)-T细胞治疗的反应,具体取决于肿瘤特征(Biocart-HM)
- 血液学恶性肿瘤患者的嵌合抗原受体T细胞治疗后复发,难治或可检测的疾病的Nivolumab
- 减少强度调节供体干细胞移植以治疗复发多发性骨髓瘤
- 使用daratumumab(dardar)在肾脏同种异体移植中脱敏













