获取国外RhoGAM超滤增强版药品价格,使用等信息,最快 24 小时回馈
RhoGAM超滤增强版
RhoGAM超滤增强版
什么是RhoGAM Ultra-Filtered Plus?
RhoGAM Ultra-Filtered Plus是一种由人血制成的无菌溶液。 Rh是大多数人血液中的一种物质(Rh阳性),但有些人则没有(Rh阴性)。 Rh阴性的人可以通过不匹配的输血或在怀孕期间婴儿的血型相反而暴露于Rh阳性血液。当发生这种暴露时,Rh阴性血液将通过产生抗体来试图破坏Rh阳性血细胞作出反应。这可能会导致医疗问题,例如贫血(红细胞低下),肾衰竭或休克。
RhoGAM Ultra-Filtered Plus用于防止Rh阴性血型患者对Rh阳性血的免疫反应。该药也可用于治疗免疫性血小板减少性紫癜(ITP)。
RhoGAM超滤增强版还可用于本用药指南中未列出的目的。
重要信息
如果您的免疫球蛋白A(IgA)缺乏抗IgA抗体,或者您患有溶血性贫血(缺乏红细胞),则不应接受RhoGAM Ultra-Filtered Plus。
RHo(D)免疫球蛋白可引起红细胞异常分解。这种作用会导致致命的血栓或器官衰竭。
如果您有以下任何症状,请立即致电医生:发烧,发冷,背部疼痛,异常虚弱,尿液呈红色或粉红色,皮肤苍白,呼吸急促,排尿少或无尿,体重迅速增加,突然发麻或虚弱,言语不清,视力或平衡问题,咳血或腿部肿胀或发热。
在服药之前
如果您曾经对免疫球蛋白有过敏反应,或者您患有以下疾病,则不应服用该药:
具有IgA抗体的免疫球蛋白A(IgA)缺乏症;要么
溶血性贫血(缺乏红细胞)。
为确保RhoGAM Ultra-Filtered Plus对您安全,请告知您的医生是否患有:
贫血病史;
心脏病或冠状动脉疾病史(动脉硬化);
出血性疾病(例如血友病);
高甘油三酸酯(血液中的一种脂肪);
肾脏疾病;要么
糖尿病。
RhoGAM Ultra-Filtered Plus经常在怀孕期间和之后使用。尚不知道这种药物在怀孕期间或哺乳期间对婴儿有害。
如果您正在接受这种药物以治疗不匹配的输血,请告知您的医生您是否怀孕或计划怀孕。
如果您是Rh阴性妇女并且怀孕,则必须告诉您的医生,您一生中是否曾接触过Rh阳性血液。这包括输血不匹配或第一次怀孕期间的暴露。您的接触和治疗史对您的每一次怀孕都至关重要。
RhoGAM Ultra-Filtered Plus是由人血浆(血液的一部分)制成的,血浆中可能含有病毒和其他传染因子。对捐赠的血浆进行了测试和处理,以降低其含有传染病的风险,但仍可能传播疾病。与您的医生讨论使用这种药物的风险和益处。
RhoGAM Ultra-Filtered Plus如何使用?
RhoGAM Ultra-Filtered Plus被注入肌肉或静脉。您将在诊所或医院接受注射。
接受免疫球蛋白后,将密切注意您的呼吸,血压,氧气水平和其他生命体征。您的尿液可能还需要每2至4小时至少检查8小时。
为了在怀孕期间进行治疗,通常在怀孕的后半段和婴儿出生后定期给予RhoGAM Ultra-Filtered Plus。
为了治疗不匹配的输血,当出现免疫反应症状时(当人体开始制造Rh抗体时)就可以服用该药物。
为确保此药对您的病情有所帮助,您可能需要经常进行血液检查。您可能没有注意到症状的任何变化,但是您的血液检查将帮助您的医生确定RhoGAM Ultra-Filtered Plus对您的治疗时间。
在某些实验室测试中,RhoGAM Ultra-Filtered Plus可能会对血液中的葡萄糖(糖)产生错误的结果。告诉任何治疗您的医生您正在使用这种药物。
如果我错过剂量怎么办?
如果您错过RhoGAM Ultra-Filtered Plus的预约,请致电医生。
如果我服药过量怎么办?
寻求紧急医疗护理或致电1-800-222-1222,拨打毒药帮助热线。
收到RhoGAM Ultra-Filtered Plus时应该避免什么?
用RhoGAM Ultra-Filtered Plus治疗后至少三个月不要接受“活”疫苗。在这段时间内,疫苗可能效果不佳,并且可能无法完全保护您免受疾病侵害。活疫苗包括麻疹,腮腺炎,风疹(MMR),轮状病毒,伤寒,黄热病,水痘(水痘),带状疱疹(带状疱疹)和鼻流感(流感)疫苗。
RhoGAM Ultra-Filtered Plus副作用
如果您有以下任何过敏反应迹象,请寻求紧急医疗救助:皮疹或荨麻疹;头晕,胸闷,呼吸困难;脸,嘴唇,舌头或喉咙肿胀。
如果您有以下情况,请立即致电您的医生:
发烧,发冷,发抖,背部疼痛,异常虚弱,尿液呈红色或粉红色;
皮肤浅黄或发黄,尿色深;
呼吸急促,心律加快,精神错乱,呼吸困难;
肾衰竭的迹象-小便或无小便,肿胀,体重迅速增加;要么
血块的迹象-突然的麻木或虚弱,言语不清,视力或平衡问题,胸痛,咳嗽的血液,一只或两只腿发红肿胀和发热。
常见的副作用可能包括:
恶心,腹泻,呕吐,胃痛;
头痛,头晕
嗜睡,虚弱,全身不适;
关节或肌肉疼痛;
潮红(温暖,发红或刺痛的感觉);
轻度瘙痒或皮疹;
出汗增加;要么
注射药物的疼痛或压痛。
这不是完整的副作用列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响RhoGAM Ultra-Filtered Plus?
其他药物可能会与RHo(D)免疫球蛋白相互作用,包括处方药和非处方药,维生素和草药产品。向您的每个医疗保健提供者告知您现在使用的所有药物以及您开始或停止使用的任何药物。
版权所有1996-2018 Cerner Multum,Inc.版本:5.01。
注意:本文档包含有关rho(d)免疫球蛋白的副作用信息。此页面上列出的某些剂型可能不适用于商标名称RhoGAM Ultra-Filtered Plus。
对于消费者
适用于rho(d)免疫球蛋白:溶液
警告
静脉途径(粉剂;溶液)
据报道,用Rho(D)免疫球蛋白治疗免疫性血小板减少性紫癜(ITP)的患者发生血管内溶血(IVH),导致死亡。 IVH可导致临床上危及贫血和多系统器官衰竭,包括急性呼吸窘迫综合征(ARDS),急性肾功能不全,肾衰竭和弥散性血管内凝血(DIC)。在ITP给药后至少8小时内,应在医疗机构中提醒患者并密切监测IVH的体征和症状。在基线,给药后2小时,4小时以及监测期结束之前进行试纸尿液分析。如果存在或怀疑有IVH的体征和/或症状,应进行治疗后实验室检查。
需要立即就医的副作用
rho(d)免疫球蛋白(RhoGAM Ultra-Filtered Plus中包含的活性成分)及其所需的作用可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用rh(d)免疫球蛋白时,如果出现以下任何副作用,请立即与医生或护士联系:
罕见
- 尿血
- 排尿次数减少或尿量减少
- 发热
- 血压升高
- 口渴
- 食欲不振
- 下腰痛
- 恶心或呕吐
- 皮肤苍白
- 面部,手指或小腿肿胀
- 呼吸困难
- 异常出血或瘀伤
- 异常疲倦或虚弱
- 体重增加
不需要立即就医的副作用
rho(d)免疫球蛋白可能会出现一些副作用,通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
不常见
- 注射处酸痛
对于医疗保健专业人员
适用于rho(d)免疫球蛋白:注射粉剂,注射液,肌肉注射粉剂,肌肉注射液
其他
非常常见(10%或更高):寒冷(34.7%),发烧/体温升高(32.6%)
罕见(0.1%至1%):不适
非常罕见(少于0.01%):死亡
未报告频率:发抖,虚弱
上市后报告:胸痛,疲劳,浮肿[参考]
血液学
溶血反应包括低血压,恶心,发冷,头痛以及触珠蛋白和血红蛋白减少。 [参考]
非常罕见(小于0.01%):弥散性血管内凝血
未报告频率:血管内溶血,导致死亡的溶血,临床上影响贫血的贫血,血管外溶血,溶血反应
上市后报道:血红蛋白血症,弥散性血管内凝血[参考]
本地
罕见(0.1%至1%):注射部位肿胀,注射部位疼痛
稀有(小于0.1%):注射部位红斑,注射部位硬结,注射部位发热,注射部位瘙痒,注射部位皮疹[参考]
神经系统
非常常见(10%或更多):头痛(14.3%)
罕见(0.1%至1%):头晕,眩晕[Ref]
胃肠道
罕见(0.1%至1%):恶心,呕吐
稀有(小于0.1%):腹泻[参考]
心血管的
罕见(少于0.1%):心动过速,低血压
未报告频率:血压升高
上市后报告:心脏骤停,心力衰竭,心肌梗塞[参考]
皮肤科
罕见(0.1%至1%):皮肤反应,红斑,瘙痒,苍白,皮疹
上市后报告:多汗症[参考]
肌肉骨骼
罕见(少于0.1%):关节痛,背痛
上市后报道:肌痛,肌肉痉挛,四肢疼痛[参考]
肝的
非常常见(10%或更多):血液胆红素升高(21.4%)
上市后报告:黄疸[参考]
过敏症
稀有(小于0.1%):过敏,过敏性休克,过敏反应[参考]
一般
最常见的不良反应是畏寒,发热,胆红素升高和头痛。 [参考]
呼吸道
罕见(小于0.1%):呼吸困难
上市后报告:急性呼吸窘迫综合征,与输血有关的急性肺损伤[参考]
肾的
未报告频率:急性肾功能不全
上市后报告:肾衰竭,肾功能不全[参考]
免疫学的
罕见(0.1%至1%):瞬时抗C抗体阳性测试
未报告频率:反复注射人球蛋白会引起过敏[参考]
泌尿生殖
上市后报告:血红蛋白尿,无尿,色尿,血尿[参考]
参考文献
1.“产品信息。RhoGAM超滤增强版(RHo(D)免疫球蛋白)。”马萨诸塞州剑桥市的Kedrion Biopharma Inc.
2. Cerner Multum,Inc.“英国产品特性摘要”。 00
3. Cerner Multum,Inc.“澳大利亚产品信息”。 00
4.“产品信息。WinRho SDF(RHo(D)免疫球蛋白)。”纳比,佛罗里达州博卡拉顿。
5.“产品信息。Rhophylac(RHo(D)免疫球蛋白)。” ZLB Bioplasma Inc,加利福尼亚州格伦代尔。
6.“产品信息。HyperRHO S / D全剂量(RHo(D)免疫球蛋白)。”北卡罗莱纳州三角研究园的Talecris生物治疗学。
7.“产品信息。BayRHo-D(RHo(D)免疫球蛋白)。”拜耳,康涅狄格州西黑文。
某些副作用可能没有报道。您可以将其报告给FDA。
MICRhoGAM剂量
每个预装的MICRhoGAM单剂量注射器均包含50 µg(250 IU)的Rho(D)免疫球蛋白(人类)。该剂量将抑制对多达2.5 mL Rh阳性红细胞的免疫反应。 MICRhoGAM适用于终止妊娠后72小时内,包括妊娠12周。在妊娠13周或以后,应使用RhoGAM代替MICRhoGAM。
多剂量
如果FMH超过15毫升,则需要多剂量的RhoGAM,这是可能的,但在妊娠中期之前不太可能发生,最有可能在分娩时发生。已知或怀疑FMH风险增加的患者,应通过定性或定量方法进行FMH检测。 3在功效研究中,当以每毫升Rh阳性红细胞> 20 µg的剂量给予RhoGAM时,可抑制所有受试者的Rh免疫。因此,单剂量的RhoGAM暴露于<15 mL Rh阳性红细胞后,将抑制免疫反应。然而,在临床实践中,用于确定Rh阳性红细胞的暴露量(输血量或FMH量)的实验室方法并不精确。因此,每当怀疑或记录大量FMH或红细胞暴露时,应考虑每毫升Rh阳性红细胞施用超过20 µg RhoGAM。只要在暴露后三天内施用总剂量,就可以同时或以一定间隔施用多次剂量。 1个
不兼容Rh的血液或血液制品的输血
在怀疑或证明暴露于Rh阳性红细胞的72小时内进行给药。
| 剂量 | 适应症 | 笔记 |
|---|---|---|
| 微型计算机 (50微克) (250 IU) | <2.5 mL Rh阳性红细胞 | 如果无法使用MICRhoGAM,则可以使用RhoGAM。 |
| RhoGAM (300微克) (1500 IU) | 2.5-15.0 mL Rh阳性红细胞 | |
| RhoGAM (300微克) (1500 IU) (多个注射器) | > 15.0 mL Rh阳性红细胞 | 当患者已暴露于> 15 mL Rh阳性红细胞时,需要额外剂量的RhoGAM。 每毫升Rh阳性红细胞暴露量管理20 µg RhoGAM,取整至下一个完整的注射器。 只要在暴露后三天内施用总剂量,即可同时或以一定间隔施用多次剂量。 |
行政
- 使用前,目视检查RhoGAM和MicRhoGAM是否存在颗粒物,变色和注射器损坏。
- 如果发现有颗粒物,请勿使用。
- RhoGAM和MicRhoGAM透明或微乳白色。如果变色,请勿使用。
- 按照标准方案管理注射。
| 注意:肌肉内注射RhoGAM时,将手指穿过防护罩中的窗口与玻璃注射器针筒接触,以防安全护罩过早启动。 | 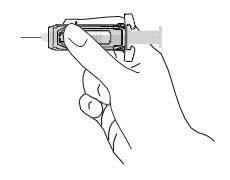 |
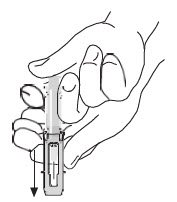 | 注射后,要接合安全防护装置,请用另一只手将安全防护装置滑过针头。可听见的“喀哒”声表示已正确激活。始终将双手放在针头后面。根据当地法规处理注射器。 |
与所有血液制品一样,在施用RhoGAM或MICRhoGAM后,应至少观察患者20分钟。
RhoGAM超滤PLUS的适应症和用法
怀孕和其他产科疾病
RhoGAM和MICRhoGAM适用于以前未对Rho(D)因子敏感的Rh阴性女性,除非父亲或婴儿最终都为Rh阴性,在以下情况下:
- 不论母亲和婴儿的ABO组如何,Rh阳性婴儿的分娩
- 妊娠26至28周时的产前预防
- 前置胎盘,羊膜穿刺术,绒毛膜取样,经皮脐血取样,其他产科操作程序(例如,版本)或腹部创伤导致的产前胎儿-母亲出血(怀疑或证实)
- 在妊娠的任何阶段出现实际或威胁怀孕的情况
- 异位妊娠
不兼容Rh的血液或血液制品的输血
RhoGAM和MICRhoGAM用于预防不合规输注Rh阳性血液或血液制品(例如红细胞,血小板浓缩液,粒细胞浓缩液)后,在任何Rh阴性人士中预防Rh免疫。
使用限制
怀孕和其他产科疾病
对于产后使用,RhoGAM和MICRhoGAM用于孕妇。不要注射新生婴儿。
RhoGAM超滤PLUS剂量和管理
仅用于肌肉内。
剂量
怀孕和其他产科疾病
| 剂量 | 适应症 | 注意事项* |
|---|---|---|
| ||
| RhoGAM (300微克) (1500 IU) | 产后(如果新生儿是Rh阳性) 交货后72小时内进行管理。 | 当患者已暴露于> 15 mL Rh阳性红细胞时,需要额外剂量的RhoGAM。这可以通过使用定性或定量的胎儿-母亲出血检查来确定。 |
产前:
| 如果需要进行产前预防,如果婴儿的Rh阳性,母亲必须接受产后剂量。 如果在怀孕早期(26至28周之前)施用RhoGAM,则有义务通过每隔12周施用RhoGAM来维持被动获得的抗D水平。 | |
| 微型计算机 (50微克) (250 IU) | 妊娠直至12周(包括12周)的实际或威胁终止妊娠(自然或自然终止) 在72小时内执行 | 如果无法使用MICRhoGAM,则可以使用RhoGAM。 |
- 从首次注射开始,每12周管理一次RhoGAM,以维持被动获得的抗D水平。
- 如果分娩的最后一次产后三周内分娩,则可以停止产后剂量,但应进行胎儿-母亲出血检查以确定是否发生了> 15 mL的红细胞暴露。
- 如果在标准产前剂量给药后12周(26至28周)没有分娩婴儿,则建议第二剂以最大程度地保护产前。
RhoGAM剂量
每个RhoGAM单剂量预装注射器均包含300 µg(1500 IU)的Rh o (D)免疫球蛋白(人类)。除非有临床或实验室证据表明胎儿-母亲出血(FMH)超过15 mL Rh阳性红细胞,否则这是与13周或13周以上妊娠相关的适应症剂量。
MICRhoGAM剂量
每个预装的MICRhoGAM单剂量注射器均包含50 µg(250 IU)的Rho(D)免疫球蛋白(人类)。该剂量将抑制对多达2.5 mL Rh阳性红细胞的免疫反应。 MICRhoGAM适用于终止妊娠后72小时内,包括妊娠12周。在妊娠13周或以后,应使用RhoGAM代替MICRhoGAM。
多剂量
如果FMH超过15毫升,则需要多剂量的RhoGAM,这是可能的,但在妊娠中期之前不太可能发生,最有可能在分娩时发生。已知或怀疑FMH风险增加的患者,应通过定性或定量方法进行FMH检测。 3在功效研究中,当以每毫升Rh阳性红细胞> 20 µg的剂量给予RhoGAM时,可抑制所有受试者的Rh免疫。因此,单剂量的RhoGAM暴露于<15 mL Rh阳性红细胞后,将抑制免疫反应。然而,在临床实践中,用于确定Rh阳性红细胞的暴露量(输血量或FMH量)的实验室方法并不精确。因此,每当怀疑或记录大量FMH或红细胞暴露时,应考虑每毫升Rh阳性红细胞施用超过20 µg RhoGAM。只要在暴露后三天内施用总剂量,即可同时或以一定间隔施用多次剂量。 1个
不兼容Rh的血液或血液制品的输血
在怀疑或证明暴露于Rh阳性红细胞的72小时内进行给药。
| 剂量 | 适应症 | 笔记 |
|---|---|---|
| 微型计算机 (50微克) (250 IU) | <2.5 mL Rh阳性红细胞 | 如果无法使用MICRhoGAM,则可以使用RhoGAM。 |
| RhoGAM (300微克) (1500 IU) | 2.5-15.0 mL Rh阳性红细胞 | |
| RhoGAM (300微克) (1500 IU) (多个注射器) | > 15.0 mL Rh阳性红细胞 | 当患者已暴露于> 15 mL Rh阳性红细胞时,需要额外剂量的RhoGAM。 每毫升Rh阳性红细胞暴露量管理20 µg RhoGAM,取整至下一个完整的注射器。 只要在暴露后三天内施用总剂量,即可同时或以一定间隔施用多次剂量。 |
行政
- 使用前,目视检查RhoGAM和MicRhoGAM是否存在颗粒物,变色和注射器损坏。
- 如果发现有颗粒物,请勿使用。
- RhoGAM和MicRhoGAM透明或微乳白色。如果变色,请勿使用。
- 按照标准方案管理注射。
| 注意:肌肉内注射RhoGAM时,将手指穿过防护罩中的窗口与玻璃注射器针筒接触,以防安全护罩过早启动。 |  |
 | 注射后,要接合安全防护装置,请用另一只手将安全防护装置滑过针头。可听见的“喀哒”声表示已正确激活。始终将双手放在针头后面。根据当地法规处理注射器。 |
与所有血液制品一样,在施用RhoGAM或MICRhoGAM后,应至少观察患者20分钟。
剂型和优势
- RhoGAM®超过滤PLUS - 300微克(1500 IU) 1 -预充式注射器
- MICRhoGAM®超过滤PLUS - 50微克(250 IU) 1 -预充式注射器
- 1个
- RhoGAM / MICRhoGAM的抗D含量以每剂量µg或每剂量国际单位(IU)表示。转换系数为1 µg = 5 IU。 2
禁忌症
禁止在以下情况下使用RhoGAM和MICRhoGAM:
- Rh阳性个体
- 已知有人类免疫球蛋白产品过敏性或严重全身反应史的患者。
警告和注意事项
过敏症
使用RhoGAM / MICRhoGAM可能会发生严重的超敏反应,即使是在先前已耐受的患者中也是如此。
RhoGAM / MICRhoGAM包含少量IgA 3 。在IgA缺乏的个体中存在超敏反应的潜在风险。尽管在治疗具有高滴度的IgA 4抗体的患者期间未发生大剂量的含270-720μg/ mL IgA的静脉免疫球蛋白的情况,但主治医师必须权衡该益处与超敏反应的潜在风险。
RhoGAM / MICRhoGAM应该在可以使用适当设备,药物如肾上腺素以及接受过超敏反应,过敏反应和休克管理培训的人员的环境中进行管理。
传染性传染病
由于RhoGAM和MICRhoGAM是由人类血液制成的,因此它们可能具有传播传染原的风险,例如病毒,克雅氏病(vCJD)变种以及理论上是CJD病原体。
医生认为或可能由这些产品传播的所有感染,应由美国医生或其他医疗保健提供者以1-855-3KDRION(1-855-353-7466)报告给Kedrion Biopharma Inc.。在美国境外,应联系分销这些产品的公司。医生应与患者讨论这些产品的风险和益处。
干扰实验室测试
服用Rho(D)免疫球蛋白后,患者血液中各种被动转移抗体的短暂增加可能会产生积极的血清学检测结果,并可能引起误解。针对红细胞抗原(例如,A,B,C和E)的抗体和其他血型抗体的被动传递可能会导致直接或间接抗球蛋白(Coombs')检测阳性。
注射RhoGAM或其他Rho(D)免疫球蛋白(人类)产品后,血浆或血清中抗D的恢复在个体之间差异很大。患者血浆中的抗D检测取决于检测灵敏度和注射后样品收集的时间。目前,尚无要求或实践标准来测试抗D的存在,以确定注射RhoGAM后剂量的充分性或有效性。
孕妇血清中被动获得的抗D抗体的存在可能会导致抗体筛查试验阳性。这不排除进一步的产前或产后预防。
妊娠后期或分娩后大的胎儿母亲出血可能会导致混合视野Du测试结果呈弱势。评估此类患者是否患有大量的胎儿母体出血,并相应地调整Rho(D)免疫球蛋白的剂量。母体或胎儿血液中被动施用的抗Rho(D)的存在可导致直接抗球蛋白(Coombs')检测呈阳性。如果不确定父亲的Rh组或免疫状态,请向母亲服用Rho(D)免疫球蛋白。
溶血
不兼容的输血
向Rh阳性或已接受Rh阳性红细胞的患者服用RhoGAM / MICRhoGAM可能导致溶血反应的体征和症状,包括发烧,背痛,恶心和呕吐,低血压或高血压,血红蛋白尿/血,胆红素和肌酐升高,触珠蛋白降低。因此,应通过临床和实验室手段监测接受Rh不相容性输血治疗的患者的溶血反应的体征和症状。提醒患者注意并监测血管内溶血的体征和症状,包括背痛,发冷,发烧,尿液或血尿变色。在8小时内没有这些迹象和/或血管内溶血的症状并不表示随后不会发生血管内溶血。
不良反应
接受Rh o (D)免疫球蛋白(人类)产品的患者中最常报告的不良反应是注射部位反应,例如肿胀,硬结,发红,轻度疼痛或发热。可能的全身反应是皮疹,身体疼痛或体温升高。严重的全身反应包括过敏反应和溶血反应(见警告和注意事项[5.2] )。
没有因过敏反应或与RhoGAM或MICRhoGAM施用相关的任何其他原因而导致死亡的报道。
临床研究经验
由于临床研究是在不同的方案和广泛不同的条件下进行的,因此观察到的不良反应发生率无法直接与其他临床试验中的发生率进行比较,也可能无法反映实际中观察到的发生率。
根据现行的《良好临床规范》(GCP)准则,尚未进行RhoGAM和MICRhoGAM的临床研究。
上市后经验
由于这些反应是从不确定大小的人群中自愿报告的,因此始终无法可靠地估计其频率或建立与Rho(D)免疫球蛋白(人类)产品的因果关系。
在RhoGAM / MICRhoGAM的批准后使用期间,已报告了以下不良反应:超敏反应,包括过敏性休克或类过敏反应,皮疹,红斑,瘙痒,发冷,发热,发热,不适和背痛。肌肉注射后已有短暂注射部位刺激和疼痛的报道。
药物相互作用
活病毒疫苗
包括Rho(D)免疫球蛋白(人类)在内的免疫球蛋白制剂可能会削弱活疫苗(例如麻疹,腮腺炎和水痘)的功效。活疫苗的接种通常应延迟至免疫球蛋白最终剂量后12周。如果在施用活疫苗后的14天内施用了免疫球蛋白,则可能会抑制对疫苗的免疫反应。 5
由于在育龄妇女中风疹免疫很重要,因此不应因为在妊娠最后三个月接受Rho(D)免疫球蛋白(人)而推迟风疹易感妇女的风疹或MMR疫苗产后接种或交货时。分娩后应立即接种疫苗,如有可能,应在3个月或更长时间后进行测试,以确保对风疹和麻疹的免疫力。 5
在特定人群中的使用
怀孕
风险摘要
RhoGAM和/或MICRhoGAM用于孕妇以抑制或Rh进行同种免疫。现有证据表明,将Rh o (D)免疫球蛋白(人类)用于怀孕的Rh0(D)阴性的女性,以抑制Rh的同种免疫,不会损害胎儿或影响胎儿的怀孕或繁殖能力。 6
RhoGAM或MICRhoGAM尚未进行动物繁殖研究。
哺乳期
风险摘要
RhoGAM或MICRhoGAM可以在母乳喂养期间使用。免疫球蛋白从人乳中排出。
儿科用
儿科患者的安全性和有效性尚未确定。
老人用
在老年受试者中尚未进行临床研究。
过量
没有关于使用RhoGAM或MICRhoGAM治疗的患者中已知过量的报道。
RhoGAM超滤PLUS描述
RhoGAM和MICRhoGAM Rho(D)免疫球蛋白(人类)是无菌溶液,含有免疫球蛋白G(IgG)抗D(抗Rh),可用于预防Rh免疫。它们由含有抗D的人血浆制成,抗D来自用Rh阳性红细胞免疫的Rh阴性供体。单剂量的RhoGAM包含足够的抗D(300 µg或1500 IU),以抑制对多达15 mL Rh阳性红细胞的免疫反应。 7单剂量的MICRhoGAM包含足够的抗D(50 µg或250 IU),以抑制对多达2.5 mL Rh阳性红细胞的免疫反应。通过与RhoGAM内部参考标准进行比较来测量抗D剂量,该参考标准相对于美国/世界卫生组织/欧洲药典标准的抗D免疫球蛋白Rho(D)免疫球蛋白(人类)CBER来确定批次4:NIBSC批次01/572(285 IU /安瓿)。 8
RhoGAM的血浆通常来自美国里克KEDPlasma LLC。拥有和运营的捐助中心。 No.1876。历史和实验室测试对所有供体进行了仔细筛选,以降低从受感染的供体传播血源性病原体的风险。每次血浆捐赠都经过测试,发现对乙型肝炎表面抗原(HBsAg)和丙型肝炎(HCV)抗体以及人类免疫缺陷病毒(HIV)1和2的反应无反应。此外,血浆还需获得FDA许可进行测试乙肝病毒(HBV),HCV和HIV-1的核酸检测(NAT)。在所有测试中,每个血浆单位必须为负(非反应性)。通过过程NAT程序对血浆进行minipool格式的甲型肝炎病毒(HAV)和细小病毒B19(B19)测试。只有通过病毒筛选的血浆才能用于生产。 B19的NAT程序基于已知病毒分离株的序列比对来检测所有三种基因型。生产池中B19 DNA的限制设置为不超过10 4 IU / mL。
血浆的分级分离是通过改良的冷酒精程序进行的,该程序已显示可显着降低病毒滴度。 3血浆分离后,进行专利的病毒清除过滤步骤和专利的病毒灭活步骤。病毒过滤步骤通过使用专利的Viresolve 180超滤膜(具有定义的12-18纳米的孔径分布)通过尺寸排阻机制去除病毒,以去除包膜的和非包膜的病毒。
病毒过滤后,对Viresolve 180超滤膜进行质量控制测试(CorrTest和扩散测试),以确保过滤器的完整性。 8病毒灭活步骤利用Triton X-100和磷酸三正丁酯(TNBP)灭活包膜病毒,例如HCV,HIV和西尼罗河病毒(WNV)。 3,9
供体选择过程,分离过程,病毒过滤步骤和病毒灭活过程通过降低包膜和非包膜病毒的传播风险来提高产品安全性。用于肌肉注射的Rho(D)免疫球蛋白(人类),是通过冷酒精分馏制备的,尚未显示可传播肝炎或其他传染病。 10没有RhoGAM或MICRhoGAM传播传染病的案例。
实验室峰值研究3,11表明,RhoGAM / MICRhoGAM制造过程的累积病毒去除和灭活能力如下:
| 病毒 | 艾滋病病毒 | BVDV | PRV | PPV | 电磁兼容 | 西尼 | 甲肝病毒 |
|---|---|---|---|---|---|---|---|
| 单位=减少10的对数 HIV人类免疫缺陷病毒,HIV-1和2以及人类T细胞淋巴病毒(HTLV)1和2的模型 BVDV牛病毒性腹泻病毒,丙型肝炎病毒模型 PRV伪狂犬病病毒,疱疹病毒模型 PPV猪细小病毒,细小病毒B19的模型 EMC脑心肌炎病毒,甲型肝炎病毒模型 WNV西尼罗河病毒 HAV甲型肝炎病毒 ND未确定 不适用 | |||||||
| 脂质包裹 | 是 | 是 | 是 | 没有 | 没有 | 是 | 没有 |
| 尺寸(纳米) | 80-120 | 40-70 | 120-200 | 18-24 | 25-30 | 40-60 | 27-32 |
| 基因组 | 核糖核酸 | 核糖核酸 | 双链DNA | 脱氧核糖核酸 | 核糖核酸 | 核糖核酸 | 核糖核酸 |
| 分馏 | ≥7.98 | 7.29 | ≥11.74 | 8.30 | ND | ND | ND |
| 病毒过滤 | ≥5.60 | 5.40 | ≥6.20 | 3.30 | 4.16 | ND | ≥5.07 |
| 病毒灭活 | ≥4.28 | ≥4.90 | ≥5.58 | 不适用 | 不适用 | ≥7.05 | 不适用 |
| 总病毒减少 | ≥17.86 | ≥17.59 | ≥23.52 | 11.60 | 4.16 | ≥7.05 | ≥5.07 |
铑O(d)免疫球蛋白(人)的安全性已在美国女性献血者病毒标记率的实证研究进一步显示。 13该研究表明,估计有55-60%的Rh阴性供体已接受Rho(D)免疫球蛋白(人)作为妊娠相关指征,其患病率和发生率与Rh阳性女性相似。尚未收到Rho(D)免疫球蛋白(人类)的捐赠者。
最终产物包含5±1%IgG,2.9 mg / mL氯化钠,0.01%Polysorbate 80(非动物来源)和15 mg / mL甘氨酸。存在少量的IgA,通常每剂量少于15 µg。 3 pH范围是6.20-7.00,IgG纯度> 98%。该产品不含添加的人血清白蛋白(HSA),硫柳汞或其他防腐剂,并使用无乳胶的输送系统。
RhoGAM超滤PLUS和MICRhoGAM超滤PLUS是由Ortho-Clinical Diagnostics,Inc.为美国纽约州梅尔维尔市Duryea Road 155号Kedrion Biopharma Inc.制造的。
RhoGAM超滤PLUS-临床药理学
作用机理
RhoGAM和MICRhoGAM通过抑制Rh阴性个体对Rh阳性红细胞的免疫反应来发挥作用。作用机理未知。 RhoGAM,MICRhoGAM和其他Rho(D)免疫球蛋白(人类)产品在改变Rh免疫接种的过程或后果方面无效。
药效学
Rh不相容输血后使用
输注了一个单位Rh阳性红细胞的Rh阴性个体产生抗D的可能性约为80%。但是,暴露于<1 mL Rh阳性红细胞后,可能会发生Rh免疫。在输注不相容的红细胞后72小时内,每毫升Rh阳性红细胞要施用大于20 µg的RhoGAM或MICRhoGAM,以防止Rh免疫。 14,15,16
药代动力学
肌肉注射后的药代动力学研究是对16名接受单剂量(368 µg或1840 IU)RhoGAM的Rh阴性受试者进行的。使用经过验证的自动定量血凝法监测3次血浆抗D水平,持续13周,灵敏度约为1 ng / mL。从十三周研究的前十周收集的数据中获得以下平均药代动力学参数:
| 参数 | 意思 | 标清 | 单位 |
|---|---|---|---|
| 获得的最大血浆浓度(Cmax) | 54.0 | 13.0 | ng / mL |
| 达到Cmax(Tmax)的时间 | 4 | 天 | |
| 消除半衰期(T1 / 2) | 30.9 | 13.8 | 天 |
| 分配量(Vd) | 7.3 | 1.5 | 升 |
| 间隙(CL) | 150.4 | 53.3 | 毫升/天 |
临床研究
Rho(D)免疫球蛋白(人)在第28周以及分娩后72小时内给药,已显示可将Rh免疫率降低至约0.1-0.2%。 15,16临床研究表明,终止妊娠后三小时内给予MICRhoGAM可以100%有效地预防Rh免疫。 17
已经进行了多项研究,证明了RhoGAM在产科和输血后环境中的安全性和有效性。
Freda,Gorman及其同事18在1967年完成的一项随机对照研究中研究了RhoGAM在产后环境中的功效。对照组在分娩后未接受免疫球蛋白治疗,而测试组在分娩后72小时内肌肉内接受了300μgRhoGAM Rh阳性婴儿。分娩后六个月,对照组的Rh免疫发生率为6.4%(32/499),而RhoGAM组为0.13%(1/781)(p <0.001)。
Pollack等。在输血后环境中进行了两项随机,安慰剂对照研究,旨在建立RhoGAM的剂量反应关系。在第一个研究中, 7 178名(176名男性,2名女性)Rh阴性志愿者接受了不同数量的Rh阳性红细胞。然后有92名受试者接受了RhoGAM。已显示单剂量的RhoGAM(1.1 mL @ 267 µg / mL)在注射多达15.1 mL Rh阳性红细胞后可抑制抗D的形成。在一项伴随研究中,Pollack向44位Rh阴性男性志愿者提供了500 mL Rh阳性全血。 22(22)名受试者每毫升Rh阳性红细胞接受20 µg RhoGAM,22名受试者未接受RhoGAM。 RhoGAM治疗的受试者均未开发出抗D抗体。 18/22对照组的受试者发展为抗D(p <0.0001)。
随后进行了人类临床研究3 ,以证明MICRhoGAM和低蛋白(5%)制剂的功效。在MICRhoGAM研究中,有81名Rh阴性男性志愿者接受了最初注射的2.5 mL Rh阳性红细胞,然后在26周时进行了加强注射(0.1 mL)的红细胞。最初的红细胞注射后,有40名受试者接受了MICRhoGAM注射。在加强红细胞注射之前和之后,接受MICRhoGAM治疗的受试者均未产生抗D。 1985年使用RhoGAM的低蛋白制剂进行了类似的研究。在注射15 mL Rh阳性红细胞后接受RhoGAM的30名Rh阴性男性志愿者中没有一个产生抗D抗体。
参考资料
- 1个
- AABB技术手册。第19版。马里兰州贝塞斯达:AABB,2017年10月。
- 2
- Gunson HH,Bowell PJ,Kirkwood TBL。重新校准抗D免疫球蛋白国际参考制剂的合作研究。 J Clin Pathol 1980; 33:249-53。
- 3
- 数据在Kedrion Biopharma Inc.
- 4
- Cunningham-Rundles C,Zhuo Z,Mankarious S,Courter S.在具有抗IgA抗体的免疫缺陷受试者中长期使用IgA耗尽的静脉免疫球蛋白。免疫学杂志1993; 13:272-78。
- 5
- 疾病预防与控制中心。关于免疫的一般建议:免疫实践咨询委员会和美国家庭医师学会的建议。 MMWR 2002; 51(No.RR-2):6-7。
- 6
- 桑顿JG,第C页,富特G,亚瑟GR,托维·拉德,斯科特·JS。抗D免疫球蛋白对产前丙基轴的疗效和长期影响。 Br Med J.1989; 298:1671-1673
- 7
- Pollack W,Ascari WQ,Kochesky RJ,O'Connor RR,Ho TY,Tripodi D.Rh预防研究。 I.抗Rh的剂量与抗原刺激的大小之间的关系。输血1971; 11:333-39。
- 8
- Thorpe SJ,Sands D,Fox B,Behr-Gross ME,Schaffner G,Yu MW。抗D免疫球蛋白的全球标准:评估候选制剂的国际合作研究。 Vox Sang 2003; 85:313-21。
- 9
- Phillips MW,DiLeo AJ。一种用于验证病毒保留膜完整性的有效孔隙率技术。 Biologicals 1996; 24:243-53。
- 10
- Horowitz B,Wiebe ME,Lippin A,Stryker MH。不稳定血液衍生物中病毒的灭活。 I.通过磷酸三(正丁酯)洗涤剂组合破坏包膜脂质的病毒。输血1985; 25(6):516-22。
- 11
- Tabor E.血浆衍生物传播病毒的流行病学:临床研究证实缺乏乙型和丙型肝炎病毒以及1型HIV的传播。输血1999; 39:1160-68。
- 12
- Van Holten RW,Ciavarella D,Oulundsen G,Harmon F,RiesterS。将额外的病毒清除步骤纳入人免疫球蛋白的生产过程。 Vox Sang 2002; 83:227-33。
- 13
- Watanabe KK,Busch MP,Schreiber GB,Zuck TF。通过监测Rh阴性女性献血者中的病毒标志物评估Rh免疫球蛋白的安全性。 Vox Sang 2000; 8:1-6。
- 14
- Zipursky A,以色列的LG。 Rh免疫的发病机理和预防。 Can Med Assoc J 1967; 97:1245-56。
- 15
- de Haas M,Finning K,Massey E,Roberts DJ。预防D的预防:过去,现在和将来。 Transfus Med 2014; 24:1–7。 (例如22-24)
- 16
- Bowman J. Rh预防三十五年。输血2003; 43:1661-6。 (例如22-24)
- 17
- Stewart FH,Burnhill MS,Bozorgi N.妊娠早期终止后降低Rh免疫球蛋白剂量。 Obstet Gynecol 1978; 51:318-22。
- 18岁
- McBain RD,Crowther CA,Middleton P.妊娠期抗D给药可预防恒河猴同种免疫。 Cochrane数据库系统版本2015年9月
供应/存储和处理方式
提供以下RhoGAM演示:
| 介绍 | 产品描述/包装尺寸 | 纸箱NDC编号 | 主容器 NDC号码 |
|---|---|---|---|
| RhoGAM®超过滤PLUS(300微克)(1500 IU) - 1个注射器的纸箱 | 1个装在小袋中的预填充单剂量注射器,1个包装说明书,1个对照表,1个患者身份证 | NDC 0562-7805-01 | 预装单剂量注射器 NDC 0562-7805-00 |
| RhoGAM®超过滤PLUS(300微克)(1500 IU) - 5周的注射器的纸箱 | 5个装在小袋中的预填充单剂量注射器,5个包装说明书,5个对照表,5个患者身份证 | NDC 0562-7805-05 | |
| RhoGAM®超过滤PLUS(300微克)(1500 IU) - 25周的注射器外箱 | 25个装在小袋中的预填充单剂量注射器,25个包装说明书,25个对照表,25个患者身份证 | NDC 0562-7805-25 |
提供以下MICRhoGAM演示:
| 介绍 | 产品描述/包装尺寸 | 纸箱NDC编号 | 主容器 NDC号码 |
|---|---|---|---|
| MICRhoGAM超滤PLUS(50 µg)(250 IU)– 1盒注射器 | 1个装在小袋中的预填充单剂量注射器,1个包装说明书,1个对照表,1个患者身份证 | NDC 0562-7806-01 | 预装单剂量注射器 NDC 0562-7806-00 |
| MICRhoGAM超滤PLUS(50 µg)(250 IU)–五个注射器 | 5个装在小袋中的预填充单剂量注射器,5个包装说明书,5个对照表,5个患者身份证 | NDC 0562-7806-05 | |
| MICRhoGAM超滤PLUS(50 µg)(250 IU)–纸箱装25个注射器 | 25个装在小袋中的预填充单剂量注射器,25个包装说明书,25个对照表,25个患者身份证 | NDC 0562-7806-25 |
储存在2至8°C。不要存放冷冻的。
请勿在注射器上打印的失效日期之后使用。
病人咨询信息
请告知患者以下内容:
- RhoGAM和MicRhoGAM的风险和收益。
- 最常见的不良反应是局部反应,包括注射部位的肿胀,硬结,发红和轻度疼痛,少数患者注意到体温略有升高。
- 可能对RhoGAM和MICRhoGAM发生过敏反应。给药后至少应观察患者20分钟。过敏反应的迹象包括荨麻疹,全身性荨麻疹,胸闷,喘息,低血压和过敏反应。
- RhoGAM和MICRhoGAM可能会干扰对活病毒疫苗(例如麻疹,腮腺炎,风疹和水痘)的反应。指导患者在接受疫苗接种时将这种潜在的相互作用告知其医疗保健专业人员。
- RhoGAM和MICRhoGAM是从人血浆中制备的,可能含有会引起疾病的传染原。在血浆收集过程中已经进行了许多测试,并且在生产过程中添加了特定的病毒灭活步骤,以最大程度地降低疾病传播的风险,但是不能消除所有风险。
- 保留RhoGAM患者识别卡,并建议患者保留该卡,并在适当时将其提供给其他医疗保健提供者。
| 修订摘要 用Kedrion Biopharma Inc.替换了Kedrion Melville Inc.的所有实例。 用美国里德的KEDPlasma LLC。取代了Kedrion Group。第11段说明中的编号1876。 |
美国许可1906
Kedrion Biopharma Inc., 155 Duryea Road,Melville,NY 11747美国制造:Ortho-Clinical Diagnostics,Inc.生产的Kedrion Biopharma Inc.。
©Kedrion Biopharma Inc.2018年
美国印刷
用以下方法制成
美国专利6,096,872
美国专利7,655,233



| 患者识别卡 | |
| 名称 | |
| 地址 | |
| 我是负面的。我已经收到RhoGAM®或MICRhoGAM®Rho(D)免疫球蛋白(人类)超滤PLUS的保护性注射。重要说明:注射后数周内,我的血液中将存在抗Rh抗体(也称为抗D),并且可以通过实验室检测发现。此被动抗Rh抗体的存在并不使我失去接受我的医生指示和处方的其他RhoGAM或MICRhoGAM注射的资格。 | |
| ©Kedrion Biopharma Inc.2018年 | |
Rh o (D)免疫球蛋白(人类)
RhoGAM®和MICRhoGAM®
超滤PLUS
此三部分表格包含:
- 使用指南
- 患者控制表
- 患者身份证
美国许可1906
Kedrion Biopharma Inc., 155 Duryea Road,Melville,NY 11747美国制造:Ortho-Clinical Diagnostics,Inc.生产的Kedrion Biopharma Inc.。
待定
| RhoGAM或MICRhoGAM的注射日期 | ||
| (圈出产品) | ||
| 批号 | 经验日期 | |
| 注射剂为: | ❏终止妊娠时 | |
| ❏怀孕期间 | ||
| ❏交货后 | ||
| 主治医师 | ||
| 医师的电话号码 | ||
主显示屏-300μg注射器标签
美国
查看使用方向
的Rh O(d)免疫
格洛布林(人类)
RhoGAM®超过滤PLUS
300μg(1500 IU)剂量
KEDRION BIOPHARMA INC。
梅尔维尔,NY 11747美国
美国许可1906
NDC 0562-7805-00

主要显示屏-300μg注射器袋标签
在这里撕
Rh o (D)免疫球蛋白(人类)
RhoGAM®
超滤PLUS
300μg剂量(1500 IU *)
*国际单位
仅接收
无硫柳汞
无乳胶输送系统
名称 ______________________
房间号。 ___________________
请参阅使用说明
美国许可1906
Kedrion Biopharma Inc.,155 Duryea Road,Melville,NY 11747美国
用以下方法制成
拍。 6,096,872
凯迪恩
生物制药
NDC 0562-7805-00
©Kedrion Biopharma Inc.2018年
美国
在这里撕
防篡改:
密封袋
为了安全
使用方法:将柱塞拧入
注射器筒中的塞子。
病人和医师
应该讨论风险并
该产品的好处。

主要显示屏-300μg注射器袋标签(返修)
在这里撕
Rh o (D)免疫球蛋白(人类)
RhoGAM®
超滤PLUS
300μg剂量(1500 IU *)
*国际单位
仅接收
无硫柳汞
无乳胶输送系统
名称 ______________________
房间号。 ___________________
请参阅使用说明
美国许可1906
Kedrion Biopharma Inc.,155 Duryea Road,Melville,NY 11747美国
用以下方法制成
拍。 6,096,872
凯迪恩
生物制药
NDC 0562-7805-00
©Kedrion Biopharma Inc.2018年
美国
在这里撕
防篡改:
密封袋
为了安全
使用方法:将柱塞拧入
注射器筒中的塞子。
病人和医师
应该讨论风险并
该产品的好处。

主要显示屏-300μg注射器袋纸箱-01
Rh o (D)免疫球蛋白(人类)
RhoGAM®
超滤PLUS – 300μg剂量(1500 IU *)
无硫柳汞
*国际单位
不要冷冻存放
请参阅使用说明
包装内含:
- 1个装有单剂量RhoGAM的预填充注射器
- 1控制表格
- 1个包装说明书
- 1张患者身份证
1单剂
有效成分:
抗D Rho免疫球蛋白(300μg),
相对于US / WHO / EP标准确定
抗D免疫球蛋白Rho(D)免疫球蛋白(人类)
CBER批次4:NIBSC批次01/572(285 IU /安瓿)
非活性成分:
2.9 mg / mL氯化钠
0.01%聚山梨酯80
15 mg / mL甘氨酸
美国许可1906
Kedrion Biopharma Inc.,155 Duryea Road,Melville,NY 11747美国
凯迪恩
生物制药
参考
780501

主要显示屏-300μg注射器袋纸箱-05
Rh o (D)免疫球蛋白(人类)
RhoGAM®
超滤PLUS – 300μg剂量(1500 IU *)
无硫柳汞
*国际单位
注意:RhoGAM应该对未致敏的Rh阴性女性服用
Rh阳性婴儿流产或分娩后三天内。请勿注射婴儿。
仅接收
仅用于肌肉注射-请勿静脉注射
患者和医师应讨论该产品的风险和益处。
参考
780505

主要显示屏-300μg注射器袋纸箱-25
Rh o (D)免疫球蛋白(人类)
RhoGAM®
超滤PLUS – 300μg剂量(1500 IU *)
无硫柳汞
*国际单位
注意:RhoGAM应该对未致敏的Rh阴性者使用
女人最好在流产或分娩后三天内
Rh阳性婴儿。请勿注射婴儿。
仅接收
仅用于肌肉注射-请勿静脉注射
患者和医师应讨论该产品的风险和益处。
参考
780525

主要显示面板-50μg注射器标签
S780601美国
查看使用方向
的Rh O(d)免疫
格洛布林(人类)
MICRhoGAM®超过滤PLUS
50μg(250 IU)剂量
KEDRION BIOPHARMA INC。
梅尔维尔,NY 11747美国
美国许可1906
NDC 0562-7806-00

PRINCIPAL DISPLAY PANEL - 50 μg Syringe Pouch Label
TEAR HERE
Rh o (D) Immune Globulin (Human)
MICRhoGAM ®
Ultra-Filtered PLUS
50 μg Dose (250 IU*)
*International Units
仅接收
Thimerosal-Free
Latex-Free Delivery System
Name ______________________
Room No. ___________________
See Directions for Use
US LICENSE 1906
Kedrion Biopharma Inc., 155 Duryea Road, Melville, NY 11747 USA
Made by methods of
Pat. 6,096,872
KEDRION
BIOPHARMA
NDC 0562-7806-00
©Kedrion Biopharma Inc. 2018
P780601USA
TEAR HERE
TAMPER RESISTANT:
POUCH SEALED
FOR SAFETY
TO USE: Screw plunger into
stopper in syringe barrel.
The patient and physician
should discuss the risks and
benefits of this product.

PRINCIPAL DISPLAY PANEL - 50 μg Syringe Pouch Label (Rework)
TEAR HERE
Rh o (D) Immune Globulin (Human)
MICRhoGAM ®
Ultra-Filtered PLUS
50 μg Dose (1500 IU*)
*International Units
仅接收
Thimerosal-Free
Latex-Free Delivery System
Name ______________________
Room No. ___________________
See Directions for Use
US LICENSE 1906
Kedrion Biopharma Inc., 155 Duryea Road, Melville, NY 11747 USA
Made by methods of
Pat. 6,096,872
KEDRION
BIOPHARMA
NDC 0562-7806-00
©Kedrion Biopharma Inc. 2018
R780601USA
TEAR HERE
TAMPER RESISTANT:
POUCH SEALED
FOR SAFETY
TO USE: Screw plunger into
stopper in syringe barrel.
The patient and physician
should discuss the risks and
benefits of this product.

PRINCIPAL DISPLAY PANEL - 50 μg Syringe Pouch Carton - 01
Rh o (D) Immune Globulin (Human)
MICRhoGAM ®
Ultra-Filtered PLUS – 50 μg Dose (250 IU*)
Thimerosal-Free
*International Units
Do not store frozen
See Directions for Use
Package Contains:
- 1 prefilled syringe containing a single dose of MICRhoGAM
- 1 control form
- 1 package insert
- 1 patient identification card
Active ingredient:
Anti-D Rho Immune Globulin (50 μg), the potency of
which is determined relative to the US/WHO/EP Standard
Anti-D Immunoglobulin Rho(D) Immune Globulin (Human)
CBER Lot 4: NIBSC Lot 01/572 (285 IU/ampoule)
Inactive ingredients:
2.9 mg/mL sodium chloride
0.01% polysorbate 80
15 mg/mL glycine
Rho(D) Immune Globulin (Human)
US LICENSE 1906
Kedrion Biopharma Inc., 155 Duryea Road, Melville, NY 11747 USA
KEDRION
BIOPHARMA
REF
780601

PRINCIPAL DISPLAY PANEL - 50 μg Syringe Pouch Carton - 05
Rh o (D) Immune Globulin (Human)
MICRhoGAM ®
Ultra-Filtered PLUS – 50 μg Dose (250 IU*)
Thimerosal-Free
*International Units
Micro-dose for use only after spontaneous or induced abortion or termination
of ectopic pregnancy up to and including 12 weeks' gestation. DO NOT INJECT INFANT.
仅接收
For Intramuscular Use Only—Do Not Inject Intravenously
REF
780605

PRINCIPAL DISPLAY PANEL - 50 μg Syringe Pouch Carton - 25
Rh o (D) Immune Globulin (Human)
MICRhoGAM ®
Ultra-Filtered PLUS – 50 μg Dose (1500 IU*)
Thimerosal-Free
*International Units
Micro-dose for use only after spontaneous or induced abortion or
termination of ectopic pregnancy up to and including 12 weeks'
gestation. DO NOT INJECT INFANT.
仅接收
For Intramuscular Use Only—Do Not Inject Intravenously
The patient and physician should discuss the risks and benefits of this product.
REF
780625

| RhoGAM Ultra-Filtered PLUS human rho(d) immune globulin injection, solution | ||||||||||||||||||
| ||||||||||||||||||
| ||||||||||||||||||
| ||||||||||||||||||
药物状态
美国日本医生 Heather Benjamin MD经验:11-20年  Heather Benjamin MD经验:11-20年  Suzanne Reitz MD经验:11-20年  Heather Miske DO经验:11-20年  Heather Miske DO经验:11-20年  渡邊剛经验:21年以上  村上和成 教授经验:21年以上  中山秀章 教授经验:21年以上  村田朗经验:21年以上  溝上裕士 医院教授经验:21年以上 临床试验
| ||||||||||||||||||