获取国外Afstyla(重组)药品价格,使用等信息,最快 24 小时回馈
Afstyla(重组)
Afstyla(重组)
什么是重组Afstyla?
Afstyla(凝血因子)是血液中的天然蛋白质。患有A型血友病的人凝血因子VIII缺乏。重组该药可替代血液中的凝血因子VIII。
重组Afstyla用于治疗或预防A型血友病成人和儿童的出血事件。Afstyla有时在手术前服用。
重组Afstyla可以帮助预防A型血友病且以前没有关节损伤的儿童的关节损伤。
重组Afstyla不适用于治疗von Willebrand病。
Jivi不被12岁以下的任何人使用。
重组Afstyla也可用于本药物指南中未列出的目的。
重要信息
如果您过去曾经对Afstyla发生过严重的过敏反应,则不应使用这种药物。
仔细遵循有关如何混合和储存这种药物的所有说明。不同品牌的重组Afstyla可能具有不同的存储说明。
您的身体可能会产生针对Afstyla的抗体,从而使其效力降低。如果这种药物似乎无法有效控制出血,请致电您的医生。
在服药之前
如果您曾经对Afstyla发生过严重的过敏反应,或者对鼠标或仓鼠蛋白过敏,则不应使用Afstyla。如果您对牛肉蛋白过敏,则不应使用“重组” 。
告诉医生您是否曾经:
心脏病;
乳胶过敏;要么
如果曾经被告知您有因子VIII抑制剂。
告诉医生您是孕妇还是母乳喂养。
我应该如何使用重组Afstyla?
您的医生将进行血液检查,以确保重组Afstyla是治疗凝血因子缺乏症的正确治疗方法。
遵循处方标签上的所有说明,并阅读所有用药指南或说明表。完全按照指示使用药物。
您的医生可能偶尔会改变您的剂量。务必检查标签上的药物强度,以确保使用正确的药效。
重组Afstyla是通过静脉输注给予的。医护人员会给您第一剂,并可能会教您如何正确使用药物。
阅读并认真遵循您的药物随附的所有使用说明。重组Afstyla在使用前必须与液体(稀释剂)混合。如果您不了解如何正确混合和储存药物,请咨询您的医生或药剂师。
在准备和注射之前,一定要洗手。
仅在准备好注射时才准备注射。如果药物改变了颜色或有微粒,不要使用。致电您的药剂师购买新药。
重组Afstyla剂量基于体重。如果体重增加或减少,您的剂量需求可能会改变。
您将需要频繁的医学检查。
您的身体可能会产生针对Afstyla的抗体,从而使其效力降低。如果这种药物似乎无法有效控制出血,请致电医生。
在完全用完药物之前,请先补充您的处方。出门旅行时,请确保您有足够的药品和注射用品。
将未混合的重组Afstyla以原始包装存放在冰箱中。不要冻结。在准备剂量之前,将药物从冰箱中取出,使其达到室温。
您也可以在室温下保存未混合的重组Afstyla,但切勿将其返回冰箱。有些品牌的这种药物只能在室温下保存数月,或者直到有效期(以先到者为准)保存。
仔细遵循有关如何储存这种药物的所有说明。不同品牌的重组Afstyla可能具有不同的存储说明。
请勿存放在强光下。不要使用标签上的过期日期。
混合药物和稀释剂后,将混合物保持在室温下(不要放在冰箱中),并在3小时内使用。
每个小瓶(瓶)仅可使用一次。一次使用后将其扔掉,即使里面仍然有药物。
只能使用针头和注射器一次,然后将其放在防刺穿的“尖头”容器中。遵循州或当地有关如何处置此容器的法律。请将其放在儿童和宠物接触不到的地方。
万一发生紧急情况,佩戴或携带医疗证明以使他人知道您有出血或凝血障碍。
如果我错过剂量怎么办?
由于在需要时会使用重组Afstyla,因此您可能不在常规的给药时间表上。但是,您可能需要连续几天使用药物来控制出血发作。继续按照指示使用药物,并告诉医生您的出血是否继续。
记住时,请使用任何错过的剂量。不要一次使用两次。
如果我服药过量怎么办?
寻求紧急医疗护理或致电1-800-222-1222,拨打毒药帮助热线。
使用重组Afstyla时应避免什么?
关于食物,饮料或活动的任何限制,请遵循医生的指示。
重组Afstyla副作用
如果您有过敏反应迹象,请寻求紧急医疗救助:荨麻疹,瘙痒,皮疹,麻木,刺痛;发烧,头晕,恶心;心跳加快,胸闷,喘息,呼吸困难;皮肤苍白,冷汗,头晕目眩,晕倒;脸,嘴唇,舌头或喉咙肿胀。
如果您有以下情况,请立即致电您的医生:
出血事件增加;
不会停止的任何出血;
胸痛;要么
一种轻松的感觉,就像你可能昏倒了一样。
常见的副作用可能包括:
鼻子流血;
恶心,呕吐,腹泻;
头痛,头晕
肌肉或关节疼痛;
皮疹;
潮红(突然的温暖,发红或刺痛的感觉);
发烧,发冷;
咳嗽;
弱点;要么
注射时疼痛,肿胀,发痒或发红。
这不是副作用的完整列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响重组Afstyla?
其他药物可能会影响重组Afstyla,包括处方药和非处方药,维生素和草药产品。告诉您的医生您目前所有的药物以及您开始或停止使用的任何药物。
版权所有1996-2018 Cerner Multum,Inc.版本:8.01。
注意:本文档包含有关抗血友病因子的副作用信息。此页面上列出的某些剂型可能不适用于Afstyla品牌。
对于消费者
适用于抗血友病因子:溶液用静脉粉
需要立即就医的副作用
除其所需的作用外,抗血友病因子(Afstyla中包含的活性成分)可能会导致某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用抗血友病因子时,如果有以下任何副作用,请立即咨询医生:
比较普遍;普遍上
- 发热
少见或罕见
- 面部肤色的变化
- 发冷
- 快速或不规则的呼吸
- 恶心
- 眼睑或眼睛周围浮肿或肿胀
- 灼热,发热,发热,麻木,紧绷或刺痛感
- 皮疹,荨麻疹或瘙痒
- 胸闷
- 呼吸困难
- 异常疲倦或虚弱
发病率未知
- 指甲,嘴唇,皮肤,手掌或指甲床的颜色发蓝
- 模糊的视野
- 胸痛或不适
- 混乱
- 咳嗽
- 深呼吸或头晕
- 呼吸困难或劳累
- 吞咽困难
- 从躺着或坐着的姿势突然起床时头晕,晕眩或头晕
- 快速,剧烈或不规则的心跳或脉搏
- 嘈杂的呼吸
- 脚,手和嘴巴的麻木
- 眼睑或眼睛,面部,嘴唇或舌头周围浮肿或肿胀
- 心律缓慢或不规则
- 出汗
- 面部,喉咙或舌头肿胀
- 异常疲倦或虚弱
不需要立即就医的副作用
抗血友病因子的某些副作用可能会发生,通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 头痛
不常见
- 注射部位灼伤,刺痛或肿胀
- 腹泻
- 头晕或头晕
- 口干或口臭
- 力量不足或丧失
- 鼻血
- 脸红
- 呕吐
罕见
- 口味变化
- 味觉丧失
发病率未知
- 腹部或胃痛
- 温暖的感觉
- 出汗增加
- 易怒
- 肌肉或骨骼疼痛
- 眼睛发红
- 脸部,脖子,手臂发红,偶尔上胸部发红
- 皮肤发红
- 麻烦看
对于医疗保健专业人员
适用于抗血友病因子:静脉注射试剂盒,静脉注射粉剂
血液学
上市后报告:VIII因子抑制,溶血性贫血,手术后出血[参考]
过敏症
上市后报告:过敏(包括过敏反应,皮疹,瘙痒) [参考]
神经系统
上市后报告:全身性强直-阵挛性癫痫发作[参考]
参考文献
1.“产品信息。Koate-HP(抗血友病因子)。”拜耳,康涅狄格州西黑文。
某些副作用可能没有报道。您可以将其报告给FDA。
常规预防
- 成人和青少年(≥12岁):建议的起始治疗方案为每公斤AFSTYLA每周20至50 IU,每周2至3次。
- 儿童(<12岁):推荐的起始治疗方案是每公斤AFSTYLA每周30至50 IU,每周2至3次。 <12岁的儿童可能需要更频繁或更高剂量,以说明该年龄组的更高清除率[见临床药理学(12.3)]。
- 可以基于患者反应来调整方案。
围手术期出血
表2提供了手术期间AFSTYLA的剂量指南(围手术期出血管理)。应考虑将VIII因子的活性维持在目标范围或以上。
| 手术类型 | 所需的因子VIII活性水平 (%或IU / dL) | 剂量频率(小时)/治疗时间(天) |
|---|---|---|
| 次要 (包括拔牙) | 30-60 | 每24小时重复注射至少1天,直到达到治愈为止。 |
| 重大的 (颅内,腹腔内,胸腔内或关节置换) | 80-100 | 每8-24小时重复注射一次,直到伤口充分愈合,然后再继续治疗至少7天,以使VIII因子活性保持30-60%(IU / dL)。 |
准备和重建
- 使用无菌技术和试剂盒中提供的稀释剂重建AFSTYLA。
- 给药前肉眼检查重构溶液中是否有颗粒物。溶液应无可见颗粒。如果发现有颗粒物,请勿使用。
以下提供的程序是AFSTYLA制备和重组的一般指南。
AFSTYLA重组说明
- 确保AFSTYLA小瓶和稀释瓶在室温下。使用无菌技术进行准备和管理。
- 放置AFSTYLA小瓶中,稀释剂的小瓶中,并在平坦表面上推出Mix2Vial®转移集。
- 取下AFSTYLA和稀释瓶盖。用提供的无菌酒精棉签擦拭塞子,并在打开Mix2Vial传输套件包装之前使塞子变干。
- 剥去盖子,打开Mix2Vial传输套件包装(图1)。将Mix2Vial传输设备保留在透明包装中。
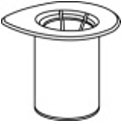
图。1
- 将稀释瓶放在平坦的表面上,并紧紧握住该瓶。抓住Mix2Vial传输装置和透明包装,将Mix2Vial传输装置蓝色端的塑料钉牢牢推入稀释瓶的塞子中心(图2)。
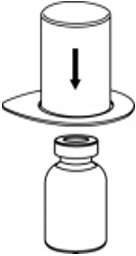
图2
- 小心地从Mix2Vial传输套件中取出透明包装。确保只拉起透明包装,而不拉Mix2Vial传送装置(图3)。
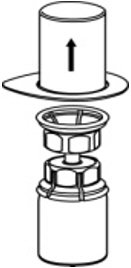
图3
- 将AFSTYLA小瓶牢固地放置在平坦的表面上,将稀释的小瓶倒置,并连接Mix2Vial传输套件,然后将透明适配器的塑料钉牢固地推入AFSTYLA小瓶的塞子中心(图4)。稀释剂将自动转移到AFSTYLA小瓶中。
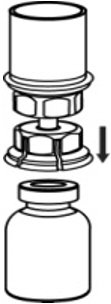
图4
- 将稀释剂和AFSTYLA小瓶仍连接到Mix2Vial传输装置上,轻轻旋转AFSTYLA小瓶以确保AFSTYLA完全溶解(图5)。不要摇动小瓶。
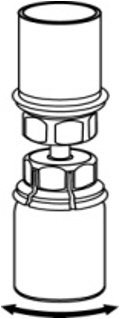
图5
- 一只手握住Mix2Vial转移套件的AFSTYLA一侧,另一只手握住Mix2Vial转移套件的蓝色稀释剂一侧,然后将其拧松成两部分。 (图6)。
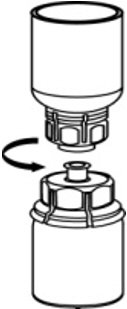
图6
- 将空气吸入空的无菌注射器中。将AFSTYLA小瓶直立时,将注射器拧到Mix2Vial传输套件上。将空气注入AFSTYLA小瓶中。按住注射器柱塞的同时,将系统上下颠倒,然后通过缓慢向后拉柱塞将浓缩液吸入注射器。 (图7)。
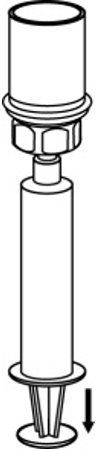
图7
- 现在将浓缩物转移到注射器中,牢牢抓住注射器的枪管(保持柱塞朝下),然后从Mix2Vial转移装置上拧下注射器(图8)。

图8
- 复溶后,立即或在4小时内注入。重构的AFSTYLA可以在室温(不超过25°C(77°F))下保存最多4小时。不要冻结。避免阳光直射。
- 记录治疗–从使用的每个药瓶上取下标签的剥离部分,并将其粘贴到患者的治疗日记/日志上,或者以电子方式记录输液时扫描药瓶。
- 如果剂量需要多于一个小瓶,使用一个单独的,未使用的推出Mix2Vial®转印每个产品小瓶集。重复步骤10,将小瓶中的内容物合并到一个注射器中。
行政
- 给予AFSTYLA时要使用无菌技术。
- 请勿将AFSTYLA与其他药品混合使用。
- 通过静脉注射给药。给药速率应由患者的舒适度决定。不要超过每分钟10 mL的输注速度。
- 复溶后4小时内在室温下管理AFSTYLA。
- AFSTYLA仅用于单次使用。管理后,请按照当地要求以适当的方式丢弃所有未使用的溶液和所有管理设备。
- 如果需要中央静脉通路设备(CVAD),则应考虑与CVAD相关的并发症的风险,包括局部感染,菌血症和导管部位血栓形成。
Afstyla的适应症和用法
Afstyla,抗血友病因子(重组),单链是一种重组抗血友病因子,适用于成人和患有甲型血友病(先天性凝血因子VIII缺乏症)的儿童,用于:
- 按需治疗和控制出血发作,
- 常规预防以减少出血发作的频率,
- 围手术期处理出血。
使用限制
Afstyla未指定用于治疗von Willebrand病。
Afstyla剂量和用法
仅在重构后用于静脉使用。
剂量指导
- 治疗的剂量和持续时间取决于VIII因子缺乏症的严重程度,出血的部位和程度以及患者的临床状况。
- Afstyla的每个小瓶均以生色测定法确定的国际单位(IU)中因子VIII活性的实际含量。 1 IU对应于1毫升(mL)正常人血浆中所含的VIII因子活性。
- 可以使用生色测定法或一阶段凝血测定法(美国临床实验室中常规使用)监测血浆VIII因子水平。如果使用一阶段凝血测定,则将结果乘以转换系数2来确定患者的VIII因子活性水平[请参阅警告和注意事项(5.3) ] 。
计算所需剂量
- 因子VIII所需剂量的计算基于以下经验发现:每千克体重1 IU因子VIII可将血浆因子VIII水平提高2 IU / dL。
使用IU / dL(或正常值的百分比)表示的因子VIII水平的预期体内峰值增加是使用以下公式估算的:
因子VIII的估计增量(IU / dL或正常值的%)= [总剂量(IU)/体重(kg)]×2(IU / dL / IU / kg)
可以使用以下公式计算出达到所需的凝血因子VIII体内峰值峰值的剂量:
剂量(IU)=体重(kg)×所需的VIII因子升高(IU / dL或正常百分比)×0.5(IU / kg / IU / dL)
- Afstyla的给药量和给药频率应始终视具体病例的临床有效性而定。
按需治疗和控制出血发作
表1提供了治疗和控制出血发作的Afstyla剂量指南。应考虑将VIII因子的活性维持在目标范围或以上。
| 出血类型 | 所需的因子VIII活性水平 (%或IU / dL) | 剂量频率(小时) |
|---|---|---|
| 次要 单纯性出血,轻微肌肉出血或口腔出血 | 20-40 | 每隔12-24小时重复注射一次,直到出血消失。 |
| 中等 肌肉出血(肌除外),血栓形成或轻度创伤 | 30-60 | 每隔12-24小时重复注射一次,直到出血消失。 |
| 重大/危及生命 四肢威胁性出血,深部肌肉出血(包括including肌),颅内和咽后部出血,骨折或头部外伤 | 60-100 | 每8-24小时重复注射一次,直到出血解决。 |
常规预防
- 成人和青少年(≥12岁):建议的起始治疗方案为每公斤Afstyla每周20至50 IU,每周2至3次。
- 儿童(<12岁):推荐的起始治疗方案是每公斤Afstyla每周服用2-3次,每次30至50 IU。 <12岁的儿童可能需要更频繁或更高剂量,以说明该年龄组的更高清除率[见临床药理学(12.3) ]。
- 可以基于患者反应来调整方案。
围手术期出血
表2中提供了手术期间Afstyla的剂量指南(围手术期出血管理)。应考虑将VIII因子活性维持在目标范围或以上。
| 手术类型 | 所需的因子VIII活性水平 (%或IU / dL) | 剂量频率(小时)/治疗时间(天) |
|---|---|---|
| 次要 (包括拔牙) | 30-60 | 每24小时重复注射至少1天,直到达到治愈为止。 |
| 重大的 (颅内,腹腔内,胸腔内或关节置换) | 80-100 | 每8-24小时重复注射一次,直到伤口充分愈合,然后再继续治疗至少7天,以使VIII因子活性保持30-60%(IU / dL)。 |
准备和重建
- 使用无菌技术和试剂盒中提供的稀释剂重建Afstyla。
- 给药前肉眼检查重构溶液中是否有颗粒物。溶液应无可见颗粒。如果发现有颗粒物,请勿使用。
以下提供的程序是Afstyla制备和重组的一般指南。
Afstyla重组说明
- 确保Afstyla小瓶和稀释瓶在室温下。使用无菌技术进行准备和管理。
- 放置Afstyla小瓶中,稀释剂的小瓶中,并在平坦表面上推出Mix2Vial®转移集。
- 取下Afstyla和稀释瓶盖。用提供的无菌酒精棉签擦拭塞子,并在打开Mix2Vial传输套件包装之前使塞子变干。
- 剥去盖子,打开Mix2Vial传输套件包装(图1)。将Mix2Vial传输设备保留在透明包装中。

图。1
- 将稀释瓶放在平坦的表面上,并紧紧握住该瓶。抓住Mix2Vial传输装置和透明包装,将Mix2Vial传输装置蓝色端的塑料钉牢牢推入稀释瓶的塞子中心(图2)。

图2
- 小心地从Mix2Vial传输套件中取出透明包装。确保只拉起透明包装,而不拉Mix2Vial传送装置(图3)。

图3
- 将Afstyla小瓶牢固地放置在平坦的表面上,将稀释的小瓶倒置,并连接Mix2Vial传输套件,然后将透明适配器的塑料钉牢固地推入Afstyla小瓶的塞子中心(图4)。稀释剂将自动转移到Afstyla小瓶中。

图4
- 在仍然将稀释剂和Afstyla小瓶连接到Mix2Vial传输装置上的同时,轻轻旋转Afstyla小瓶以确保Afstyla完全溶解(图5)。不要摇动小瓶。

图5
- 一只手握住Mix2Vial转移装置的Afstyla侧,另一只手握住Mix2Vial转移装置的蓝色稀释剂侧,然后将其拧松成两部分。 (图6)。

图6
- 将空气吸入空的无菌注射器中。当Afstyla小瓶直立时,将注射器拧到Mix2Vial传输套件上。将空气注入Afstyla小瓶。按住注射器柱塞的同时,将系统上下颠倒,然后通过缓慢向后拉柱塞将浓缩液吸入注射器。 (图7)。

图7
- 现在将浓缩物转移到注射器中,牢牢抓住注射器的枪管(保持柱塞朝下),然后从Mix2Vial转移装置上拧下注射器(图8)。

图8
- 复溶后,立即或在4小时内注入。重构的Afstyla可以在室温(不超过25°C(77°F))下保存最多4小时。不要冻结。避免阳光直射。
- 记录治疗–从使用的每个药瓶上取下标签的剥离部分,并将其粘贴到患者的治疗日记/日志上,或者以电子方式记录输液时扫描药瓶。
- 如果剂量需要多于一个小瓶,使用一个单独的,未使用的推出Mix2Vial®转印每个产品小瓶集。重复步骤10,将小瓶中的内容物合并到一个注射器中。
行政
- 给予Afstyla时要使用无菌技术。
- 请勿将Afstyla与其他药品混合使用。
- 通过静脉注射给药。给药速率应由患者的舒适度决定。不要超过每分钟10 mL的输注速度。
- 复原后4小时内,于室温下管理Afstyla。
- Afstyla仅可单次使用。管理后,请按照当地要求以适当的方式丢弃所有未使用的溶液和所有管理设备。
- 如果需要中央静脉通路设备(CVAD),则应考虑与CVAD相关的并发症的风险,包括局部感染,菌血症和导管部位血栓形成。
剂型和优势
Afstyla是白色或浅黄色冻干粉末,可在一次性小瓶中提供,标称容量为250、500、1000、1500、2000、2500或3000 IU。实际效力标在每个Afstyla小瓶和纸箱上。
禁忌症
Afstyla是禁忌在病人谁曾威胁生命的过敏反应,包括过敏到Afstyla或其赋形剂(例如,聚山梨醇酯80)[见说明(11) ],或仓鼠蛋白[见警告和注意事项(5.1) ]。
警告和注意事项
过敏反应
Afstyla可能引起过敏型超敏反应,包括过敏反应。告知患者可能会发展为过敏反应的超敏反应的早期迹象(包括荨麻疹,全身性荨麻疹,胸闷,喘息,低血压和瘙痒)。如果发生超敏反应,请立即中止给药并开始适当的治疗。
对于先前有超敏反应的患者,请考虑使用抗组胺药进行预用药。
中和抗体
据报道,给予Afstyla后会形成针对因子VIII的中和抗体(抑制剂);先前未接受治疗的患者(PUPs)的风险最高[见不良反应(6.2) ] 。通过适当的临床观察和实验室测试监测患者中和抗体(抑制剂)的发展。如果未达到预期的血浆VIII因子活性水平,或者在Afstyla给药后未控制出血,则应怀疑存在抑制剂(中和抗体) [参见警告和注意事项(5.3) ] 。
如果患者产生抑制剂,请联系专门的血友病治疗中心。
监控实验室测试
- 使用生色测定法或一阶段凝血测定法(通常在美国临床实验室中使用)监测接受Afstyla的患者的血浆VIII因子活性。生色测定结果最准确地反映了Afstyla的临床止血潜力,因此是首选。与生色测定结果相比,一阶段凝血测定结果低估了因子VIII的活性水平。如果使用一阶段凝血测定,则将结果乘以转换系数2,以确定患者的VIII因子活性水平。通过一级凝血试验获得的因子VIII活性的错误解释可能会导致不必要的额外剂量,更高的长期剂量或研究抑制剂。
- 监测因子VIII抑制剂的发展。如果未达到预期的血浆凝血因子VIII活性水平,或者如果使用预期剂量的Afstyla无法控制出血,请执行Bethesda抑制剂测定。使用贝塞斯达单位(BU)报告抑制剂水平。
不良反应
临床试验中报告的最常见不良反应(> 0.5%的受试者)为头昏和超敏反应。
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将一种药物的临床试验中观察到的不良反应率直接与另一种药物的临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
已对258名接受过重度A型血友病(<1%内源性VIII因子活性)的先前治疗过的患者(PTP)进行了Afstyla的安全性,疗效和药代动力学的评估,这些患者至少接受了一剂Afstyla作为常规预防措施的一部分在两项完整的临床试验(成人/青少年研究[≥12至65岁]和儿科研究[<12岁]中进行出血发作或围手术期治疗)和一项正在进行的扩展研究(0至≤65)岁)。有FVIII抑制剂病史或已有FVIII抑制剂史或任何一级FVIII抑制剂家族史的患者,已知对任何FVIII产品或仓鼠蛋白过敏(过敏反应或过敏反应)的患者以及有血栓形成证据(包括深静脉血栓形成)的患者研究第1天前3个月内的中风,中风,肺栓塞,心肌梗塞和动脉栓塞被排除在研究之外。
八十四(32.6%)名受试者为12岁以下的儿童(35名[13.6%] 0至<6岁,49名[19.0%]≥6至<12岁),青少年(≥12岁)为14名(5.4%)至18岁以下(<18岁),成人(≥18至≤65岁)为160(62.0%)。总共有28,418天的暴露天数(ED),至少注射了28,492针Afstyla。在完成的研究中,共有185名受试者获得了至少50 EDs,其中60名受试者获得了≥100 EDs。
在所有研究中,报告了258位受试者中的14位(5.4%)的不良反应(ARs)(总结于表3中)。超敏反应的不良反应导致一名受试者退出。没有受试者开发针对因子VIII的中和抗体(抑制剂)或针对宿主细胞蛋白的抗体。没有过敏反应或血栓形成的报道。
| MedDRA系统器官分类 | 不良反应 | 学科数 n(%) |
|---|---|---|
| 免疫系统疾病 | 过敏症 | 4(1.6) |
| 神经系统疾病 | 头晕 | 2(0.8) |
| 感觉异常 | 1(0.4) | |
| 皮肤和皮下组织疾病 | 皮疹 | 1(0.4) |
| 红斑 | 1(0.4) | |
| 瘙痒 | 1(0.4) | |
| 一般疾病和给药部位情况 | 发热 | 1(0.4) |
| 注射部位疼痛 | 1(0.4) | |
| 寒意 | 1(0.4) | |
| 感觉好热 | 1(0.4) |
免疫原性
在首次注入Afstyla之前,应在研究期间和研究结束时,以一定的间隔对所有受试者的Afstyla抑制抗体和结合抗体以及与中国仓鼠卵巢(CHO)宿主细胞蛋白的结合抗体进行监测。
来自正在进行中的≤5岁未接受治疗的患者(PUP)的临床试验的初步数据表明,在23位接受治疗的受试者中,有12位(52%,其95%置信区间为31%,73%)开发了一种抑制剂。其中,6名受试者(26%)的峰值抑制物值在高滴度范围内,6名受试者(26%)的峰值抑制物在低滴度范围内。在抑制剂测试呈阳性的12位受试者中,有11位受试者仍在试验中。成功清除了8种抑制剂;具有高滴度抑制剂的三名受试者保持抑制剂阳性并继续用Afstyla治疗。
在完成的临床研究中,任何时候都没有PTP产生针对因子VIII的中和抗体(抑制剂)或针对CHO宿主细胞蛋白的抗体。成人/青少年研究中的四名受试者和儿科研究中的十名受试者在筛选时非中和性抗药物抗体(ADAs)阴性,并在临床研究中转为阳性。在研究访问结束时,有2名成人/青少年受试者和3名患ADA的儿科受试者为阴性。没有不良事件与ADAs的发生有关。抗体形成的检测高度依赖于测定的灵敏度和特异性。另外,在测定中观察到的抗体阳性的发生率可能受到多种因素的影响,包括测定方法,样品处理,样品采集时间,伴随用药和潜在疾病。由于这些原因,将Afstyla抗体的发生率与其他产品的抗体发生率进行比较可能会产生误导。
上市后经验
在Afstyla的批准后使用过程中,发现了以下不良反应。由于这些反应是从不确定大小的人群中自愿报告的,因此并非总是能够可靠地估计其发生频率或建立与药物暴露的因果关系。
血液和淋巴系统疾病:因子VIII抑制剂的发展
在特定人群中的使用
怀孕
风险摘要
目前尚无孕妇使用Afstyla的数据来告知与药物相关的风险。 Afstyla没有进行发育或动物生殖毒性研究。因此,尚不知道发育毒性的风险,包括结构异常,胚胎胎儿和/或婴儿死亡率,功能障碍和生长改变。在美国普通人群中,主要出生缺陷的估计背景风险发生在普通人群的2-4%中,流产发生在15%至20%的临床公认的孕妇中。
哺乳期
风险摘要
没有关于Afstyla在人乳中的排泄,对母乳喂养婴儿的影响或对牛奶产量的影响的信息。应考虑母乳喂养对发育和健康的益处,以及母亲对Afstyla的临床需求以及Afstyla或潜在母体状况对母乳喂养婴儿的任何潜在不利影响。
儿科用
Afstyla的安全性和有效性研究已在98位18岁以下的先前接受过治疗的儿科患者中进行。 14名≥12至<18岁的青少年受试者参加了成人/青少年安全性和有效性研究。 35名0至<6岁的受试者和49位≥6至<12岁的受试者参加了儿科安全性和有效性研究[参见不良反应(6.1) ,临床药理学(12.3)和临床研究(14) ] 。由于在0至<12岁的儿童人群中,清除率(基于每千克体重)已显示较高,因此可能需要根据体重更频繁或更频繁地服用Afstyla [请参阅临床药理学(12.3) ]。
老人用
Afstyla的临床研究未纳入65岁以上的受试者,以确定他们与年轻受试者的反应是否不同。
Afstyla说明
Afstyla是在中国仓鼠卵巢(CHO)细胞中产生的单链重组VIII因子。它是一种构建体,其中野生型全长因子VIII中出现的B结构域已被截断,相邻酸性a3域的4个氨基酸被去除(全长因子VIII的765至1652位氨基酸)。 Afstyla表示为在重链和轻链之间具有共价键的单链因子VIII分子;从而使分子保持单链形式,从而提高了稳定性并提高了von Willebrand Factor(VWF)亲和力。除了在重链和轻链之间的连接处有新的N-糖基化位点外,翻译后修饰与内源性VIII因子相当。
Afstyla是通过受控的多步骤过程纯化的,该过程包括两个病毒减少步骤,这些步骤在其作用方式上相互补充。纯化或配制过程中不使用人类或动物衍生的蛋白质。
Afstyla是一种不含防腐剂,无菌,无热原的冻干粉,将用无菌注射用水(sWFI)进行复溶以进行静脉注射。 Afstyla可在一次性小瓶中使用,该小瓶包含以IU表示的标记数量的因子VIII活性。每个小瓶标称包含250、500、1000、1500、2000、2500或3000 IU的Afstyla。实际效力标在每个Afstyla小瓶和纸箱上。冻干粉复溶后,所有剂量强度均可产生几乎无色至微乳白色的溶液。下表4中提供了基于小瓶大小的赋形剂浓度以及用于重构的sWFI量。
| 成分 | 250 IU小瓶 | 500 IU小瓶 | 1000 IU小瓶 | 1500 IU小瓶 | 2000 IU小瓶 | 2500 IU小瓶 | 3000 IU小瓶 |
|---|---|---|---|---|---|---|---|
| rVIII-单链 | 100 IU /毫升 | 200 IU /毫升 | 400 IU /毫升 | 300 IU /毫升 | 400 IU /毫升 | 500 IU /毫升 | 600 IU /毫升 |
| L-组氨酸 | 3.1毫克/毫升 | 3.1毫克/毫升 | 3.1毫克/毫升 | 3.1毫克/毫升 | 3.1毫克/毫升 | 3.1毫克/毫升 | 3.1毫克/毫升 |
| 聚山梨酯80 | 0.2毫克/毫升 | 0.2毫克/毫升 | 0.2毫克/毫升 | 0.2毫克/毫升 | 0.2毫克/毫升 | 0.2毫克/毫升 | 0.2毫克/毫升 |
| 氯化钙 | 0.4毫克/毫升 | 0.4毫克/毫升 | 0.4毫克/毫升 | 0.4毫克/毫升 | 0.4毫克/毫升 | 0.4毫克/毫升 | 0.4毫克/毫升 |
| 氯化钠 | 16.4毫克/毫升 | 16.4毫克/毫升 | 16.4毫克/毫升 | 16.4毫克/毫升 | 16.4毫克/毫升 | 16.4毫克/毫升 | 16.4毫克/毫升 |
| 蔗糖 | 6毫克/毫升 | 6毫克/毫升 | 6毫克/毫升 | 6毫克/毫升 | 6毫克/毫升 | 6毫克/毫升 | 6毫克/毫升 |
| 注射用水 | 2.5毫升 | 2.5毫升 | 2.5毫升 | 5毫升 | 5毫升 | 5毫升 | 5毫升 |
施用的因子VIII的单位数以IU表示,与现行的WHO因子VIII产品标准有关。血浆中1 IU因子VIII活性相当于1 mL正常血浆中VIII因子的量。血浆中的VIII因子活性以百分比(相对于正常人血浆)或IU(相对于血浆中VIII因子的国际标准)表示。
Afstyla-临床药理学
作用机理
Afstyla是一种重组蛋白,可替代有效止血所需的缺失凝血因子VIII。 Afstyla是具有截短的B结构域的单条多肽链,其允许共价桥连接因子VIII重链和轻链。 Afstyla已证明相对于全长rFVIII具有更高的VWF亲和力。 1 VWF可稳定因子VIII并保护其免于降解。活化的Afstyla具有与内源性FVIIIa相同的氨基酸序列。
药效学
A型血友病是一种X连锁遗传性血液病,由于凝血因子VIII的水平降低而导致,自然地或由于意外或手术创伤而渗入关节,肌肉或内部器官。替代疗法可增加因子VIII的血浆水平,从而能够暂时纠正因子缺乏症并纠正出血倾向。
药代动力学
≥12岁
在单次静脉注射50 IU / kg剂量的91名先前治疗的受试者(81位≥18岁的成年人和10位≥12至<18岁的青少年)中评估了Afstyla的药代动力学(PK)。
PK参数(表5)基于首次给药后通过显色测定法测得的血浆VIII因子活性(初始PK评估)。初始PK评估后3至6个月获得的PK曲线与首次给药后获得的PK曲线相当。
| PK参数 | ≥18岁 (N = 81) | ≥12至<18岁 (N = 10) |
|---|---|---|
| IR =注射后30分钟记录的增量恢复; C max =观察到的最大血浆浓度; AUC 0-inf =因子VIII活动时间曲线下的面积外推至无穷大; t 1/2 =半衰期; MRT =平均停留时间; CL =体重调整后的间隙; V ss =体重调整后的稳态分布量。 | ||
| 红外(IU / dL)/(IU / kg) | 2.00(20.8) | 1.69(24.8) |
| 最大C(IU / dL) | 106(18.1) | 89.7(24.8) |
| AUC 0-inf (IU * h / dL) | 1960(33.1) | 1540(36.5) |
| t 1/2 (小时) | 14.2(26.0) | 14.3(33.3) |
| 捷运(h) | 20.4(25.8) | 20.0(32.2) |
| CL(mL / h / kg) | 2.90(34.4) | 3.80(46.9) |
| V ss (毫升/千克) | 55.2(20.8) | 68.5(29.9) |
<12岁的儿童
在开放标签,多中心研究中,在以50 IU / kg静脉注射Afstyla之后,对39名先前接受治疗的儿童(0至<12岁)评估Afstyla的药代动力学参数。
表6总结了根据儿科数据计算出的PK参数。这些参数是根据血浆VIII因子随时间变化的活性估算的。
| PK参数 | 0至<6年 (N = 20) | ≥6至<12岁 (N = 19) |
|---|---|---|
| IR =对于12至<18岁的受试者在注射后30分钟和1至<12岁的受试者在注射后60分钟记录的增量恢复; C max =观察到的最大血浆浓度; AUC =因子VIII活动时间曲线下的面积外推至无穷大; t 1/2 =半衰期; MRT =平均停留时间; CL =体重调整后的间隙; V ss =体重调整后的稳态分布量。 | ||
| 红外(IU / dL)/(IU / kg) | 1.60(21.1) | 1.66(19.7) |
| 最大C(IU / dL) | 80.2(20.6) | 83.5(19.5) |
| AUC 0-inf (IU * h / dL) | 1080(31.0) | 1170(26.3) |
| t 1/2 (小时) | 10.4(28.7) | 10.2(19.4) |
| 捷运(h) | 12.4(25.0) | 12.3(16.8) |
| CL(mL / h / kg) | 5.07(29.6) | 4.63(29.5) |
| V ss (毫升/千克) | 71.0(11.8) | 67.1(22.3) |
非临床毒理学
致癌,诱变,生育力受损
尚未进行调查Afstyla致癌作用的长期动物研究。未进行Afstyla的诱变或对生育力影响的体外和体内测试。
临床研究
在两项研究中评估了Afstyla的安全性和有效性:成人/青少年的开放标签,多中心,交叉安全性,功效和药代动力学研究,以及儿童开放标签的药代动力学,功效和安全性研究。这些研究表征了Afstyla的PK并确定了在控制出血事件,预防出血事件的预防中的止血功效,并且在成人/青少年研究中,确定了在接受外科手术的患者围手术期处理出血期间的止血功效。
这项成人/青少年研究共纳入175名先前接受过治疗的患有严重血友病A(<1%内源性VIII因子活性)的男性受试者。受试者的年龄范围为12至65岁,包括14名青春期受试者(≥12至<18岁)。在175名受试者中,有174名接受了至少一剂Afstyla的治疗,其中173名(99%)的疗效可评估。共有161位受试者(92.5%)完成了研究。总共对120位(69.0%)的受试者进行了至少50次ED的治疗,其中52位(29.9%)的受试者接受了至少100次ED的治疗。受试者总共进行了14592次注射,每位受试者的中位注射次数为67.0(范围为1至395)。
儿科研究招募了84名先前治疗过的严重A型血友病男性受试者(35名0至<6岁的受试者和49位≥6至<12岁的受试者)。在84名入选受试者中,所有受试者均接受了至少一剂Afstyla,其中83名(99%)的疗效可评估。共有65名(77.4%)的受试者接受了至少50次ED的治疗,其中8名(9.5%)的受试者接受了至少100次ED的治疗。受试者总共接受了5,313次注射,每位受试者的中位数为59次注射(范围从4到145)。
按需治疗和控制出血发作
在成人/青少年研究中,Afstyla治疗了848例出血事件,研究人员对835例患者进行了疗效评估。大部分出血事件发生在关节。用于治疗出血发作的每次注射的中位剂量为31.7 IU / kg(范围6至84 IU / kg)。在848次出血事件中,一次Afstyla注射控制了686次(81%),两次注射控制了107次(13%)。 848次出血发作中有55次(6%)需要注射3次或以上。对于94%的出血事件,研究者的止血功效评级为优异或良好。
在儿科研究中,Afstyla共治疗了347次出血事件,所有这些事件均得到了研究者的疗效评估。大部分出血事件发生在关节。用于治疗出血发作的每次注射的中位剂量为27.3 IU / kg(16至76 IU / kg)。在347次出血事件中,单次Afstyla注射可控制298次(86%),而两次注射可控制34次(10%)。 347次出血事件中有15次(4%)需要注射3次或更多。对于96%的出血事件,研究者的止血功效评级为优异或良好。
研究者对出血的治疗反应评估如下:
极好:第一次输注后约8小时内,疼痛缓解和/或出血迹象(即,肌肉骨骼出血时肿胀,压痛和/或运动范围增加)得到改善
良好:第一次输注后约8小时,疼痛缓解和/或出血迹象有所改善,但需要两次输注才能完全解决
中度:第一次输注后约8小时内可能产生或轻微的有益作用;需要两次以上的输注才能完全解决
无反应:第一次输注后完全没有改善或病情恶化(即出血迹象),并且需要另一种FVIII产品,冷沉淀或血浆进行额外的止血干预以完全解决。
表7总结了这两项研究在控制出血发作中的疗效。
| 治疗出血事件 | 成人和青少年 (≥12至65岁) (N = 848) | 小儿科 (0至<12岁) (N = 347) |
|---|---|---|
| 注射次数 | ||
| 1次进样n(%) | 686(81%) | 298(85.9%) |
| 2次进样n(%) | 107(13%) | 34(9.8%) |
| 3次进样n(%) | 29(3%) | 8(2.3%) |
| > 3次进样,n(%) | 26(3%) | 7(2.0%) |
| 研究者的疗效评估 | (N = 835) | (N = 347) |
| 优秀或好,n(%) | 783(94%) | 334(96.3%) |
| 中度n(%) | 52(6%) | 12(3.5%) |
| 无反应,n(%) | 0 | 1(0.3%) |
常规预防
成人和青少年研究
在成人/青少年和儿科研究中,考虑到受试者在入组前使用的VIII因子治疗方案和受试者的出血表型,受试者接受了研究者确定的方案的预防。
在成人/青少年研究中,进行预防的146名受试者中有54%每周接受Afstyla 3次。 32%的受试者每周两次接受Afstyla;每隔一天有6%的人接受Afstyla治疗,而有8%的受试者接受了其他治疗。
每周3次(中位数ABR为1.53)与每周2次(中位数ABR为0.00)的受试者之间的年化出血率(ABR)相当。每周3次(中位AsBR为0.0)和每周2次(中位ASBR为0.0)的受试者之间的年发性自发出血率(AsBR)也相当。两组中需要调整剂量的受试者人数相当(每周3次为34.2%[27名受试者],每周两次为27.7%[13名受试者])。
每周3次预防方案的受试者的中位处方剂量为30 IU / kg(12至50 IU / kg)。每周2次治疗的受试者中位处方剂量为35 IU / kg(17至50 IU / kg)。
预防中的ABR(中位数为1.14)显着低于按需接受治疗的受试者中位数(19.64)(p <0.0001)。 146名受试者中的63名(43%)在进行预防时未发生出血事件。接受预防的受试者没有严重或威胁生命的出血(例如颅内出血)。
儿科研究
在儿科研究中,接受预防的80名受试者中有54%每周接受Afstyla 2次; 30%的受试者每周接受3次Afstyla;每隔一天有4%的人收到Afstyla; 12%的受试者接受了其他治疗。
80名受试者中有21名(26%)在进行预防时未发生出血事件。儿科研究中有1例严重出血(髋关节出血)得到了成功治疗。
对于接受预防的受试者,总体ABR为3.69,接受每周3次治疗的受试者的中位ABR为2.30,接受每周2次治疗的受试者的平均ABR为4.37。在受试者之间,每周3次和每周2次,AsBR的中位数(0.00)相同。
每周3次治疗的受试者的中位处方剂量为32 IU / kg(19至50 IU / kg),每周2次治疗的受试者的中位处方剂量为35 IU / kg(20至57 IU / kg)。
表8总结了这两项研究中用于预防和按需使用的ABR。
| I / III期成人/青少年研究 | 三期儿科研究 | |||
|---|---|---|---|---|
| 预防 (N = 146) | 一经请求 (N = 27) | 预防 (N = 80) | 一经请求 (N = 3) | |
| ||||
| 整体ABR 中位数(IQR * ) | 1.14(0–4.2) | 19.64(6.2–46.5) | 3.69(0–7.2) | 78.56(35.1–86.6) |
| 年度自然出血率(AsBR) 中位数(IQR * ) | 0(0–2.4) | 11.73(2.8–36.5) | 0(0–2.2) | 31.76(0–42.7) |
| 零出血事件的受试者人数 | 63(43.2%) | 1(3.7%) | 21(26.3%) | 0 |
围手术期出血
在成人/青少年研究中的13位受试者总共接受了16项外科手术。总体而言,研究人员评估了Afstyla在围手术期出血管理中的止血效果,在16例外科手术中有15例出色,在16例外科手术中有1例良好(参见表9 )。术前和术中消耗的中位数因子为89.4 IU / kg(范围40.5至108.6 IU / kg)。
研究者在手术过程中对止血的评估如下:
优秀:在没有其他止血干预的情况下,临床上的止血在临床上与正常情况无显着差异(例如,止血效果与非手术缺陷患者中类似手术所预期的止血相当),并且手术期间的失血量估计不超过正常情况的20%预期手术的预期失血量
好:就数量和/或质量而言,正常或轻度异常止血(例如,在没有其他止血干预的情况下,与非因素缺乏患者相比,轻微渗血,止血时间延长,出血量有所增加)或估计失血量是比预期手术的预计失血量高> 20%,但≤30%
中度:就数量和/或质量而言为中度异常止血(例如,难以控制的中度出血),估计失血量大于定义为良好的止血量
不良/无反应:就数量和/或质量而言,严重止血(例如,难以控制的严重出血)和/或另一种FVIII产品,冷沉淀或血浆需要额外的止血干预才能完全解决。
| 程序 | 效能评估 | 要素消耗(IU / kg) (术前和术中) |
|---|---|---|
| 拔智齿 | 优秀的 | 51.09 |
| 腹部疝气修补 | 优秀的 | 47.89 |
| 肘部置换 | 优秀的 | 108.58 |
| 踝关节置换术 | 优秀的 | 76.83 |
| 护膝替换(5) | 优良(4),优良(1) | 92.49 100.9 67.26 105.79 86.09 |
| 胆囊切除术 和 跟腱拉长结合在一起:伸直右脚趾 | 优秀的 优秀的 | 105.95 |
| 包皮环切术(3) | 优良(3) | 99.04 92.74 81.5 |
| 切开复位内固定(ORIF)右脚踝 | 优秀的 | 89.36 |
| 硬件拆卸,右脚踝 | 优秀的 | 40.45 |
参考资料
1. Zollner S,Raquet E,Claar Ph,Müller-CohrsJ,Metzner HJ,Weimer Th,Pragst I,Dickneite G,SchulteS。 ,《血栓形成研究》(2014年); 134:125-131。
供应/存储和处理方式
Afstyla在试剂盒中提供,该试剂盒在单次使用的小瓶中包含冻干粉,并以国际单位(IU)表示的因子VIII活性量标记。在Afstyla纸箱和小瓶标签上注明了国际单位(IU)中实际的VIII因子活性。
Afstyla装有无菌注射用水,USP(2.5 mL用于重构250、500或1000 IU或5 mL用于重构1500、2000、2500或3000 IU Afstyla),一套Mix2Vial过滤器转移套件和一套无菌酒精拭子。组件不是由天然橡胶胶乳制成。
| 标称强度 | 填充尺寸颜色指示器 | 套件NDC |
|---|---|---|
| 250 IU | 橙子 | 69911-474-02 |
| 500 IU | 蓝色 | 69911-475-02 |
| 1000 IU | 绿色 | 69911-476-02 |
| 1500 IU | 绿松石 | 69911-480-02 |
| 2000 IU | 紫色 | 69911-477-02 |
| 2500 IU | 酷灰色 | 69911-481-02 |
| 3000 IU | 黄色 | 69911-478-02 |
储存和处理
- Store Afstyla in the original package to protect the Afstyla vials from light.
- Store Afstyla in powder form at 2°C to 8°C (36°F to 46°F). Do not freeze to avoid damage to the diluent vial. Afstyla can be stored at room temperature, not to exceed 25°C (77°F), for a single period of up to 3 months, within the expiration date printed on the carton and vial labels.
- Record the starting date of room temperature on the unopened product carton. Once stored at room temperature, do not return the product to the refrigerator. The shelf-life then expires after storage at room temperature for 3 months, or after the expiration date on the product vial, whichever is earlier.
- Do not use Afstyla after the expiration date indicated on the vial.
- The reconstituted product (after mixing dry product with diluent) can be stored at 2°C to 8°C (36°F to 46°F), or at room temperature, not to exceed 25°C (77°F), for up to 4 hours.
- 避免阳光直射。
- After reconstitution, if the product is not used within 4 hours, it must be discarded.
- Do not use Afstyla if the reconstituted solution is cloudy or has particulate matter.
- Discard any unused Afstyla.
病人咨询信息
建议患者:
- Read the FDA-approved Patient Labeling (Patient Product Information and Instructions for Use).
- Discontinue use of Afstyla in case of a hypersensitivity reaction and contact their healthcare provider and/or seek emergency care, depending on the severity of the reaction. Early signs of hypersensitivity reactions may include hives, itching, facial swelling, tightness of the chest, and wheezing [see Warnings and Precautions (5.1) ] .
- Contact their healthcare provider or hemophilia treatment facility for further treatment and/or assessment if they experience a lack of a clinical response to Fact
已知总共有3种药物与Afstyla(抗血友病因子)相互作用。
- 1主要药物相互作用
- 2中度药物相互作用
检查互动
已知与Afstyla(抗血友病因子)相互作用的药物
注意:仅显示通用名称。
- 卡非佐米
- 艾米单抗
- 聚戊二酸酶
Afstyla(抗血友病因子)疾病相互作用
与Afstyla(抗血友病因子)有5种疾病相互作用,包括:
- 心血管并发症
- 抑制性抗体
- 血液异凝集素
- 免疫缺陷
- 血栓栓塞事件
药物相互作用分类
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
美国日本医生

Gregory Aaen MD

Brian Aalbers DO

Glen Scott DO

Cecile Becker MD

Shruti Badhwar DO

渡邊剛

村上和成 教授

中山秀章 教授

村田朗
















