获取国外Stelara(Ustekinumab皮下注射)药品价格,使用等信息,最快 24 小时回馈
Stelara(Ustekinumab皮下注射)
斯泰拉拉的用途:
- 它用于治疗斑块状牛皮癣。
- 它用于治疗牛皮癣关节炎。
- 它用于治疗克罗恩氏病。
- 它用于治疗溃疡性结肠炎。
在服用Stelara之前,我需要告诉我的医生什么?
- 如果您对Stelara过敏(ustekinumab皮下注射); Stelara的任何部位(ustekinumab皮下注射);或任何其他药物,食物或物质。告诉您的医生有关过敏以及您有什么症状。
- 如果您在过去的一年中曾接种过BCG疫苗。
- 如果您有感染。
- 如果您患有活动性结核病(结核病)。
这不是与Stelara(ustekinumab皮下注射)相互作用的所有药物或健康问题的列表。
告诉您的医生和药剂师所有药物(处方药或非处方药,天然产品,维生素)和健康问题。您必须检查以确保服用Stelara(ustekinumab皮下注射剂)对您所有的药物和健康问题都是安全的。未经医生许可,请勿开始,停止或更改任何药物的剂量。
乘坐Stelara时,我需要了解或做什么?
- 告诉所有医疗保健提供者您服用Stelara(ustekinumab皮下注射)。这包括您的医生,护士,药剂师和牙医。
- 如果您对乳胶过敏,请咨询您的医生。
- 按照医生的指示检查血液。与医生交谈。
- 使用Stelara(ustekinumab皮下注射)后患癌的机会更高。与医生交谈。
- 检查皮肤。告诉医生您是否有皮肤变化,例如新的疣,皮肤疼痛或微红的斑点出血或无法愈合,或者痣的颜色或大小发生变化。
- 您可能有更多机会受到感染。经常洗手。远离感染,感冒或流感的人。有些感染非常严重,甚至致命。
- 在服用Stelara(ustekinumab皮下注射)期间以及在停止服用任何疫苗之前,应先咨询医生。与Stelara一起使用疫苗(ustekinumab皮下注射)可能会增加感染机会或使疫苗无法正常工作。与您的医生交谈。
- 开始Stelara(ustekinumab皮下注射)之前,您需要进行TB(结核病)检查。
- 如果您的体重有变化,请咨询您的医生。 Stelara(ustekinumab皮下注射)的剂量可能需要更改。
- 如果您年满60岁,请小心使用Stelara(ustekinumab皮下注射)。您可能会有更多的副作用。
- 告诉医生您是否怀孕,计划怀孕或正在哺乳。您将需要谈论对您和婴儿的好处和风险。
如何最好地服用这种药物(斯泰拉拉)?
按照医生的指示使用Stelara(ustekinumab皮下注射)。阅读提供给您的所有信息。请严格按照所有说明进行操作。
- 可以注射到上臂,大腿,臀部或胃部皮肤的脂肪部分。
- 如果您要给自己打针,您的医生或护士会教您如何打针。
- 使用前后请洗手。
- 每次拍摄时,将拍摄地点移动到该位置。
- 该产品可能含有白色小颗粒。如果溶液混浊,泄漏或有大块,薄片或其他颗粒,请勿使用。
- 这种药是无色至微黄色。如果溶液变色,请勿使用。
- 不要让皮肤受到刺激,擦伤,变红,被感染或有疤痕。
- 不要摇晃。
- 每个预填充的注射器或小瓶仅用于一种用途。给予剂量后,将剩余的任何部分扔掉。
- 将针头丢入针头/锋利的处理盒中。请勿重复使用针头或其他物品。盒子装满后,请遵守所有当地规定以摆脱它。如有任何疑问,请与医生或药剂师联系。
如果我错过了剂量怎么办?
- 致电您的医生以了解如何处理。
我需要马上打电话给我的医生什么副作用?
警告/警告:尽管这种情况很少见,但有些人在服药时可能会有非常严重的副作用,有时甚至是致命的副作用。如果您有以下任何与严重不良副作用相关的症状或体征,请立即告诉医生或寻求医疗帮助:
- 过敏反应的迹象,如皮疹;麻疹;瘙痒;发红或发烧的皮肤发红,肿胀,起泡或脱皮;喘息胸部或喉咙发紧;呼吸,吞咽或说话困难;异常嘶哑或嘴,脸,嘴唇,舌头或喉咙肿胀。
- 感染的迹象包括发烧,发冷,非常严重的喉咙痛,耳朵或鼻窦疼痛,咳嗽,痰多或痰液颜色改变,尿液通过疼痛,口疮或伤口无法治愈。
- 尿路感染(UTI)的征兆,如尿中带血,排尿时灼痛或疼痛,感觉需要经常或马上排尿,发烧,下胃痛或骨盆痛。
- 皮肤上有温暖,发红或疼痛的皮肤或疮。
- 气促。
- 冲洗。
- 头晕或昏倒非常严重。
- 皮肤肿块或生长。
- 阴道瘙痒或分泌物。
- Stelara(ustekinumab皮下注射)发生了一个非常严重的,有时甚至是致命的大脑问题,称为后可逆性脑病综合征(PRES)。如果您有感到困惑,警觉性降低,视力改变,视力丧失,癫痫发作或非常头痛的迹象,请立即致电医生。
- 使用Stelara(ustekinumab皮下注射)期间发生了肺炎。有时这很严重,人们需要去医院。如果您有咳嗽,发烧,胸痛,呼吸急促或呼吸困难,请告诉医生。
Stelara还有哪些其他副作用?
所有药物都可能引起副作用。但是,许多人没有副作用,或者只有很小的副作用。如果这些副作用或任何其他副作用困扰您或不消失,请致电您的医生或获得医疗帮助:
- 感到疲倦或虚弱。
- 头痛。
- 胃部不适或呕吐。
- 胃痛或腹泻。
- 鼻子或喉咙发炎。
- 感冒的迹象。
- 给予射击的刺激。
这些并非所有可能发生的副作用。如果您对副作用有疑问,请致电您的医生。打电话给您的医生,征求有关副作用的医疗建议。
您可以致电1-800-332-1088向FDA报告副作用。您也可以在https://www.fda.gov/medwatch报告副作用。
如果怀疑OVERDOSE:
如果您认为服药过量,请致电毒物控制中心或立即就医。准备好告诉或显示采取了什么,采取了多少,何时发生。
如何存储和/或丢弃Stelara?
- 存放在冰箱中。不要冻结。
- 存放在原始容器中以避光。
- 将所有药物放在安全的地方。将所有毒品放在儿童和宠物够不到的地方。
- 扔掉未使用或过期的药物。除非被告知,否则不要冲厕所或倒水。如果您对扔出药物的最佳方法有疑问,请咨询您的药剂师。您所在地区可能有毒品回收计划。
消费者信息使用
- 如果症状或健康问题没有好转或恶化,请致电医生。
- 不要与他人共享您的药物,也不要服用他人的药物。
- 该药还带有一个称为《用药指南》的额外患者情况说明书。仔细阅读。每次重新装满Stelara(ustekinumab皮下注射)时,请再次阅读。如果您对Stelara(ustekinumab皮下注射)有任何疑问,请与医生,药剂师或其他医疗服务提供者联系。
- 如果您认为服药过量,请致电毒物控制中心或立即就医。准备好告诉或显示采取了什么,采取了多少,何时发生。
注意:本文档包含有关ustekinumab的副作用信息。此页面上列出的某些剂型可能不适用于Stelara品牌。
综上所述
更常见的副作用包括:头痛。有关不良影响的完整列表,请参见下文。
对于消费者
适用于ustekinumab:肠胃外注射,肠胃外注射浓缩
副作用包括:
牛皮癣患者:鼻咽炎,上呼吸道感染,头痛,疲劳。
银屑病关节炎患者:不良反应与牛皮癣患者相似。
克罗恩病患者:诱导治疗期间呕吐;鼻咽炎,注射部位红斑,外阴阴道念珠菌病/真菌感染,支气管炎,瘙痒,泌尿道感染,维持治疗期间的鼻窦炎。
溃疡性结肠炎患者:诱导治疗期间的鼻咽炎;鼻咽炎,头痛,腹痛,流行性感冒,发烧,腹泻,鼻窦炎,疲劳,恶心,维持治疗。
对于医疗保健专业人员
适用于ustekinumab:静脉内溶液,皮下溶液
呼吸道
常见(1%至10%):鼻咽炎,上呼吸道感染,口咽痛
罕见(0.1%至1%):鼻塞[参考]
神经系统
常见(1%至10%):头痛,头晕
罕见(0.1%至1%):面神经麻痹[参考]
其他
普通(1%至10%):疲劳[参考]
胃肠道
常见(1%至10%):腹泻,恶心[参考]
肌肉骨骼
常见(1%至10%):背痛,肌痛,关节痛[Ref]
本地
常见(1%至10%):注射部位红斑,疼痛,瘀伤,刺激
罕见(0.1%至1%):注射部位反应(包括出血,血肿,硬结,肿胀和瘙痒) [Ref]
皮肤科
常见(1%至10%):瘙痒
罕见(0.1%至1%):脓疱型牛皮癣,皮肤脱落
罕见(少于0.1%):剥脱性皮炎
上市后报告:红皮性牛皮癣[参考]
精神科
常见(1%至10%):抑郁[参考]
肿瘤的
常见(1%至10%):恶性肿瘤(1.7%)
上市后报告:迅速出现的多发性皮肤鳞状细胞癌[参考]
过敏症
罕见(0.1%至1%):过敏反应(包括皮疹,荨麻疹)
稀有(小于0.1%):严重的超敏反应(包括过敏反应和血管性水肿) [参考]
免疫学的
非常常见(10%或更多):感染(高达27%)
常见(1%至10%):大约6%的患者对此药物产生了抗体,牙齿感染
罕见(0.1%至1%):蜂窝织炎,带状疱疹,病毒性上呼吸道感染[参考]
参考文献
1. Cerner Multum,Inc.“澳大利亚产品信息”。 00
2. Cerner Multum,Inc.“英国产品特性摘要”。 00
3.“产品信息。Stelara(ustekinumab)。” Centocor Inc,宾夕法尼亚州马尔文。
某些副作用可能没有报道。您可以将其报告给FDA。
银屑病关节炎
皮下成人剂量方案
- 建议的剂量是最初和之后4周分别为45 mg,然后每12周45 mg。
- 对于并存重度超过100公斤的中度至重度斑块状牛皮癣患者,推荐剂量为最初90毫克和4周后,然后每12周90毫克。
克罗恩病和溃疡性结肠炎
静脉感应成人给药方案
STELARA的使用表3中指定的基于体重的剂量方案中单次静脉内输注剂量®[见说明STELARA®130毫克小瓶的稀释用于静脉内输注(2.6)]。
| 给药时患者的体重 | 剂量 | 的130毫克/毫升26(5毫克/毫升)STELARA®小瓶数 |
|---|---|---|
| 55公斤以下 | 260毫克 | 2 |
| 超过55公斤至85公斤 | 390毫克 | 3 |
| 超过85公斤 | 520毫克 | 4 |
皮下维护成人剂量方案
推荐的维持剂量是在初始静脉内剂量后8周皮下注射90 mg皮下剂量,然后每8周一次。
一般管理注意事项
- STELARA®是用于在医生的指导和监督下使用。 STELARA®只应给予谁将会密切监测,并与医师定期随访的患者。合适的剂量应由医疗服务提供者根据给药时患者的当前体重来确定。在儿童患者,建议STELARA®由医疗服务提供者进行管理。如果一个医生确定是适当,患者可自行注射或护理人员可在皮下注射技术适当的训练后注射STELARA®。应指导患者遵循《用药指南》 [参见《用药指南》》中提供的指导。
- 预填充注射器上的针头套包含干燥的天然橡胶(乳胶的衍生物)。对乳胶敏感的人员请勿操作针套。
- 建议每次注射都应与之前的注射在不同的解剖位置(例如上臂,臀区,大腿或腹部任何象限)进行,并且不要进入皮肤嫩,青肿,红斑或硬结。使用单剂量小瓶时,建议使用带有27号1/2英寸针头的1 mL注射器。
- 在给药前,目视检查STELARA®颗粒物质和变色。 STELARA®是无色至浅黄色的溶液,并且可以含有一些小的半透明或白色颗粒。不要使用STELARA®如果变色或浑浊,或者其他存在微粒物质。 STELARA®不含防腐剂;因此,请丢弃小瓶和/或注射器中残留的所有未使用产品。
说明STELARA®预充式注射器的管理配备针安全防护
有关提供的说明,请参见下图。
为防止过早激活针头安全防护装置,在使用过程中请勿随时触摸NEEDLE GUARD ACTIVATION CLIPS。
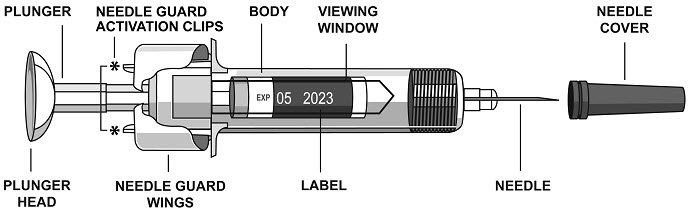
- 握住身体并取下针头盖。卸下针头盖时,请勿握住柱塞或柱塞头,否则柱塞可能会移动。如果未装入针头盖的情况下将其倒下,请勿使用预填充的注射器。
- 注入STELARA®皮下建议[见剂量和给药(2.1,2.2,2.3)]。
- 推入柱塞,直至柱塞头完全位于护针器翼之间,以注入所有药物。必须注射全部预填充的注射器内容物才能激活护针器。
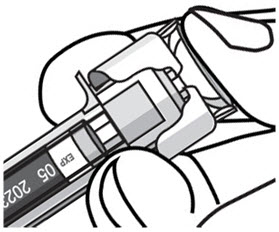
- 注射后,保持柱塞头上的压力并从皮肤上拔下针头。慢慢地将拇指从柱塞头上移开,以使空的注射器向上移动,直到整个针头都被针头保护罩盖住,如下图所示:
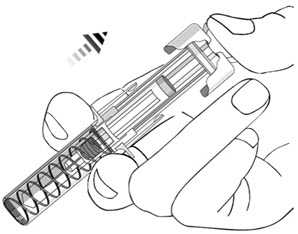
- 用过的注射器应放在防刺穿的容器中。
制备和STELARA的管理®130毫克/毫升26(5毫克/毫升)小瓶用于静脉内输注(克罗恩病和溃疡性结肠炎)
STELARA®用于静脉内输注溶液必须稀释,通过使用无菌技术专业医护人员制备和注入。
- 计算剂量和基于患者体重所需STELARA®小瓶的(表3)的数目。 STELARA®的各26毫升小瓶含有130毫克优特克单抗的。
- 退出,并然后丢弃0.9%氯化钠注射液的体积,USP从250mL的输液袋等于STELARA的®体积被添加(丢弃26毫升氯化钠STELARA的每个小瓶®需要的,2瓶-丢弃52 mL,用于3瓶-丢弃78 mL,4瓶-丢弃104 mL)。或者,可以使用装有0.45%氯化钠注射液USP的250 mL输液袋。
- 从需要每个小瓶撤回26毫升STELARA®的,并将其添加到250mL的输液袋。输液袋中的最终体积应为250 mL。轻轻混合。
- 输液前目视检查稀释后的溶液。如果发现明显不透明的颗粒,变色或异物,请勿使用。
- 注入在一段至少一小时的稀释溶液。稀释后,应在稀释后的八小时内完全输注到输液袋中。
- 仅使用带有在线,无菌,无热原,低蛋白结合过滤器(孔径为0.2微米)的输液器。
- 不要注入了STELARA®伴随与其他药物在同一静脉线。
- STELARA®不含防腐剂。每个小瓶仅供一次性使用。丢弃所有剩余的溶液。根据当地要求处置任何未使用的药品。
存储
如果必要,稀释的输注液可以在室温下保持高达25℃(77°F)达7小时。一旦制备了稀释溶液,便开始在室温下保存。输注应在输液袋中稀释后的8小时内完成(准备后的累积时间,包括储存和输注时间)。不要冻结。丢弃输液中任何未使用的部分。
斯泰拉拉的适应症和用法
牛皮癣(Ps)
Stelara的®表示用于治疗患者6年或以上的中度至重度牛皮癣谁是光疗或全身治疗的候选者。
银屑病关节炎(PsA)
Stelara的®的适应症为治疗成人患者的活动性银屑病关节炎。 Stelara的®可以单独使用或与氨甲蝶呤(MTX)组合使用。
克罗恩病(CD)
Stelara的®表示用于治疗成年患者的中度至重度活动性克罗恩病。
溃疡性结肠炎
Stelara的®表示用于治疗成年患者的中度至重度活动性溃疡性结肠炎。
Stelara剂量和管理
银屑病
皮下成人剂量方案
- 对于体重不超过100 kg的患者,建议的剂量最初为45 mg,之后为4周,随后为每12周45 mg。
- 对于体重超过100千克的患者,建议的剂量最初为90毫克,之后为4周,然后每12周90毫克。
在体重超过100公斤的受试者中,也显示45毫克有效。然而,90 mg在这些受试者中产生了更高的疗效[见临床研究(14) ] 。
皮下儿科剂量方案
辖Stelara的®皮下0和4周,然后每12周之后。
下面示出的Stelara的®基于体重儿科患者(6-17岁)的推荐剂量(表1)。
| 给药时患者的体重 | 推荐剂量 |
|---|---|
| 少于60公斤 | 0.75毫克/千克 |
| 60至100公斤 | 45毫克 |
| 超过100公斤 | 90毫克 |
对于体重不足60 kg的儿科患者,推荐剂量(0.75 mg / kg)的给药量见表2;从单剂量小瓶中取出适当的体积。
| 给药时体重(kg) | 剂量(毫克) | 进样量(mL) |
|---|---|---|
| 15 | 11.3 | 0.12 |
| 16 | 12.0 | 0.13 |
| 17 | 12.8 | 0.14 |
| 18 | 13.5 | 0.15 |
| 19 | 14.3 | 0.16 |
| 20 | 15.0 | 0.17 |
| 21 | 15.8 | 0.17 |
| 22 | 16.5 | 0.18 |
| 23 | 17.3 | 0.19 |
| 24 | 18.0 | 0.20 |
| 25 | 18.8 | 0.21 |
| 26 | 19.5 | 0.22 |
| 27 | 20.3 | 0.22 |
| 28 | 21.0 | 0.23 |
| 29 | 21.8 | 0.24 |
| 30 | 22.5 | 0.25 |
| 31 | 23.3 | 0.26 |
| 32 | 24 | 0.27 |
| 33 | 24.8 | 0.27 |
| 34 | 25.5 | 0.28 |
| 35 | 26.3 | 0.29 |
| 36 | 27 | 0.3 |
| 37 | 27.8 | 0.31 |
| 38 | 28.5 | 0.32 |
| 39 | 29.3 | 0.32 |
| 40 | 30 | 0.33 |
| 41 | 30.8 | 0.34 |
| 42 | 31.5 | 0.35 |
| 43 | 32.3 | 0.36 |
| 44 | 33 | 0.37 |
| 45 | 33.8 | 0.37 |
| 46 | 34.5 | 0.38 |
| 47 | 35.3 | 0.39 |
| 48 | 36 | 0.4 |
| 49 | 36.8 | 0.41 |
| 50 | 37.5 | 0.42 |
| 51 | 38.3 | 0.42 |
| 52 | 39 | 0.43 |
| 53 | 39.8 | 0.44 |
| 54 | 40.5 | 0.45 |
| 55 | 41.3 | 0.46 |
| 56 | 42 | 0.46 |
| 57 | 42.8 | 0.47 |
| 58 | 43.5 | 0.48 |
| 59 | 44.3 | 0.49 |
银屑病关节炎
皮下成人剂量方案
- 建议的剂量是最初和之后4周分别为45 mg,然后每12周45 mg。
- 对于并存重度超过100公斤的中度至重度斑块状牛皮癣患者,推荐剂量为最初90毫克和4周后,然后每12周90毫克。
克罗恩病和溃疡性结肠炎
静脉内成人剂量方案
Stelara的的使用表3中指定的基于体重的剂量方案中单次静脉内输注剂量®[见说明Stelara®130毫克小瓶的稀释用于静脉内输注(2.6) ]。
| 给药时患者的体重 | 剂量 | 130毫克/ 26毫升的数(5毫克/毫升)Stelara的®小瓶 |
|---|---|---|
| 55公斤以下 | 260毫克 | 2 |
| 超过55公斤至85公斤 | 390毫克 | 3 |
| 超过85公斤 | 520毫克 | 4 |
皮下维护成人剂量方案
推荐的维持剂量是在初始静脉内剂量后8周皮下注射90 mg皮下剂量,然后每8周一次。
一般管理注意事项
- Stelara的®是为医生的指导和监督下使用。 Stelara的®只应给予谁将会密切监测,并与医师定期随访的患者。合适的剂量应由医疗服务提供者根据给药时患者的当前体重来确定。在儿童患者,建议Stelara的®由医疗服务提供者进行管理。如果一个医生确定是适当,患者可自行注射或护理人员可在皮下注射技术适当的训练后注射Stelara的®。应指导患者遵循《用药指南》 [参见《用药指南》 》中提供的指导。
- 预填充注射器上的针头套包含干燥的天然橡胶(乳胶的衍生物)。对乳胶敏感的人员请勿操作针套。
- 建议每次注射都应与之前的注射在不同的解剖位置(例如上臂,臀区,大腿或腹部任何象限)进行,并且不要进入皮肤嫩,青肿,红斑或硬结。使用单剂量小瓶时,建议使用带有27号1/2英寸针头的1 mL注射器。
- 在给药前,目视检查Stelara的®颗粒物质和变色。 Stelara的®是一种无色至浅黄色的溶液,并且可以含有一些小的半透明或白色颗粒。不要使用Stelara的®如果变色或浑浊,或者其他存在微粒物质。 Stelara的®不含防腐剂;因此,请丢弃小瓶和/或注射器中残留的所有未使用产品。
配备针头安全防护装置的Stelara®预填充注射器的管理说明
有关提供的说明,请参见下图。
为防止过早激活针头安全防护装置,在使用过程中请勿随时触摸NEEDLE GUARD ACTIVATION CLIPS。

- 握住身体并取下针头盖。卸下针头盖时,请勿握住柱塞或柱塞头,否则柱塞可能会移动。如果未装入针头盖的情况下将其倒下,请勿使用预填充的注射器。
- 注入Stelara的®皮下建议[见剂量和给药(2.1 , 2.2 , 2.3) ]。
- 推入柱塞,直至柱塞头完全位于护针器翼之间,以注入所有药物。必须注射全部预填充的注射器内容物才能激活护针器。

- 注射后,保持柱塞头上的压力并从皮肤上拔下针头。慢慢地将拇指从柱塞头上移开,以使空的注射器向上移动,直到整个针头都被针头保护罩盖住,如下图所示:

- 用过的注射器应放在防刺穿的容器中。
用于静脉输注(克罗恩病和溃疡性结肠炎)的Stelara®130 mg / 26 mL(5 mg / mL)小瓶的制备和给药
Stelara的®用于静脉内输注溶液必须稀释,通过使用无菌技术专业医护人员制备和注入。
- 计算剂量和基于患者体重所需Stelara的®小瓶的(表3)的数目。 Stelara的®的各26毫升小瓶含有130毫克优特克单抗的。
- 退出,并然后丢弃0.9%氯化钠注射液的体积,USP从250mL的输液袋等于Stelara的的®体积被添加(丢弃26毫升氯化钠Stelara的的每个小瓶®需要的,2 vials-弃置52 mL,对于3个小瓶-弃去78 mL,4个小瓶-弃置104 mL)。或者,可以使用装有0.45%氯化钠注射液USP的250 mL输液袋。
- 从需要每个小瓶撤回26毫升Stelara的®的和将其添加到250mL的输液袋。输液袋中的最终体积应为250 mL。轻轻混合。
- 输液前目视检查稀释后的溶液。如果发现明显不透明的颗粒,变色或异物,请勿使用。
- 在至少一个小时的时间内注入稀释的溶液。稀释后,应在稀释后的八小时内完全输注到输液袋中。
- 仅使用带有在线,无菌,无热原,低蛋白结合过滤器(孔径为0.2微米)的输液器。
- 不要与其他药物在同一静脉输注线Stelara的®相伴。
- Stelara的®不含防腐剂。每个小瓶仅供一次性使用。丢弃所有剩余的溶液。根据当地要求处置任何未使用的药品。
存储
如有必要,可将稀释的输注溶液在室温(最高25°C(77°F))下保存7小时。一旦制备了稀释溶液,便开始在室温下保存。输注应在输液袋中稀释后的8小时内完成(准备后的累积时间,包括储存和输注时间)。不要冻结。丢弃输液中任何未使用的部分。
剂型和优势
Stelara的®(优特克单抗)是一种无色至浅黄色的溶液,并且可以含有一些小的半透明或白色颗粒。
皮下注射
- 注射:在单剂量预装注射器中为45 mg / 0.5 mL或90 mg / mL溶液
- 注射剂:单剂量小瓶中的45 mg / 0.5 mL溶液
静脉输液
- 注射剂:单剂量小瓶中的130 mg / 26 mL(5 mg / mL)溶液
禁忌症
Stelara的®是禁忌在病人临床显著过敏优特克单抗或任何赋形剂的[见警告和注意事项(5.5) ]。
警告和注意事项
传染病
Stelara的®可能会增加感染和潜伏感染激活的危险。在接收Stelara的®[见患者中观察到严重的细菌,分枝杆菌,真菌和病毒感染不良反应(6.1 , 6.3) ]。
临床研究中报告的需要住院的严重感染或其他具有临床意义的感染包括:
- 牛皮癣:憩室炎,蜂窝组织炎,肺炎,阑尾炎,胆囊炎,败血症,骨髓炎,病毒感染,肠胃炎和尿路感染。
- 银屑病关节炎:胆囊炎。
- 克罗恩氏病:肛门脓肿,肠胃炎,眼带状疱疹,肺炎和李斯特菌性脑膜炎。
- 溃疡性结肠炎:肠胃炎,眼带状疱疹,肺炎和李斯特菌病。
与Stelara的治疗®不应在患者发起任何临床意义的活动性感染,直到感染痊愈或适当治疗。考虑风险和治疗的好处开始使用Stelara的®患者有慢性感染或复发感染史之前。
指导患者就医,如果症状或体征提示感染的发生,同时用Stelara的治疗®并考虑停止Stelara的®严重或临床显著感染直到感染痊愈或适当治疗。
特定感染易感性的理论风险
遗传上缺乏IL-12 / IL-23的个体尤其容易受到分枝杆菌(包括非结核性,环境分枝杆菌),沙门氏菌(包括非伤寒菌株)和卡介苗-芽孢杆菌(BCG)疫苗的传播感染的影响。在这些患者中已经报道了严重的感染和致命的后果。
目前还不知道是否患者IL-12药理学阻断/ IL-23从与Stelara的®治疗可能易受这些类型的感染。根据临床情况,应考虑进行适当的诊断测试,例如组织培养,粪便培养。
结核病的治疗前评估
评估患者对结核感染Stelara的®开始治疗之前。
不要给予Stelara的®使患者活动性结核感染。 Stelara的给药之前®开始治疗潜伏性结核病。考虑之前Stelara的开始®患者潜在的或活动性肺结核病史的人在治疗的过程中充分无法确认抗结核治疗。密切监测患者治疗期间和治疗后,接受Stelara的®迹象和活动性肺结核的症状。
恶性肿瘤
Stelara的®是一种免疫抑制剂,并可能增加恶性肿瘤的风险。恶性肿瘤报告谁在临床研究中接受Stelara的®科目中[见不良反应(6.1) ]。在啮齿动物模型中,抑制IL-12 / IL-23p40会增加恶性肿瘤的风险[请参见非临床毒理学(13) ] 。
Stelara的®的安全性还没有在谁有恶性肿瘤病史或谁拥有已知恶性肿瘤的患者进行了评估。
已经有多种皮肤鳞状细胞癌在接受Stelara的®谁了发展非黑色素瘤皮肤癌的预先存在的风险因素的患者迅速出现的上市后报告。所有接受Stelara的®患者应非黑色素瘤皮肤癌的外观进行监控。年龄大于60岁的患者,具有长期免疫抑制剂治疗病史的患者和具有PUVA治疗史的患者应密切随访[见不良反应(6.1) ] 。
过敏反应
超敏反应,包括过敏性反应和血管性水肿,已经报道了与Stelara的®[见不良反应(6.1 , 6.3) ]。如果发生过敏或其他临床显著过敏反应,制定适当的治疗,并停止Stelara的®。
可逆性后脑白质脑病综合征
在牛皮癣和牛皮癣性关节炎的临床研究中观察到1例可逆性后脑白质脑病综合征(RPLS)。主题,谁收到了12剂Stelara的的®在大约两年,带有头痛,癫痫发作和混乱。无需额外的Stelara的®注射给药和对象与适当的治疗完全康复。在克罗恩氏病或溃疡性结肠炎的临床研究中未观察到RPLS病例。
RPLS是一种神经系统疾病,它不是由脱髓鞘或已知的传染原引起的。 RPLS可出现头痛,癫痫发作,精神错乱和视觉障碍。与之相关的疾病包括先兆子痫,子痫,急性高血压,细胞毒性药物和免疫抑制疗法。致命结果已有报道。
如果RPLS怀疑,管理适当的治疗,并停止Stelara的®。
免疫接种
在此之前开始治疗与Stelara的®,患者应接受所有年龄的免疫接种所推荐的当前免疫接种指导方针。患者被Stelara的治疗®应该不会收到活疫苗。 BCG疫苗不应该在治疗期间前一年开始治疗或一年以下停药给出Stelara的®或。施用活疫苗,以接受Stelara的®,因为从家庭接触并传输给病人脱落的潜在风险患者的家庭接触的注意事项建议。
Stelara的®的过程中收到的非活疫苗接种可能不会引发足以预防疾病的免疫反应。
伴随疗法
在牛皮癣的临床研究Stelara的®的与其他生物免疫抑制剂或彩光组合的安全性没有评价。紫外线诱发的皮肤癌在经过基因处理的小鼠中更早,更频繁地发展为仅缺乏IL-12和IL-23或IL-12的小鼠[见伴随疗法(7.1) ,非临床毒理学(13.1) ] 。
非传染性肺炎
间质性肺炎,嗜酸细胞性肺炎和隐源性机化性肺炎病例后批准使用Stelara的®期间的报道。一到三剂后,临床表现包括咳嗽,呼吸困难和间质浸润。严重的后果包括呼吸衰竭和长期住院。停止治疗并在某些情况下使用皮质类固醇可改善患者的病情。如果诊断被确认,停止Stelara的®和研究所适当的治疗[见上市后经验(6.3) ]。
不良反应
标签上其他地方讨论了以下严重不良反应:
- 感染[请参阅警告和注意事项(5.1) ]
- 恶性肿瘤[请参阅警告和注意事项(5.4) ]
- 过敏反应[请参阅警告和注意事项(5.5) ]
- 可逆性后脑白质脑病综合征[见警告和注意事项(5.6) ]
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
斑块状牛皮癣的成人受试者
安全数据反映了3117个成人牛皮癣主题,包括2414暴露至少6个月,1855年暴露至少一年,1653暴露至少两年,1569暴露至少三年暴露Stelara的®,1482曝光至少四年,838至少暴露五年。
表4总结了发生在至少1%的速度,并在过程中诗研究1和P研究2的安慰剂对照期间在Stelara的®组比安慰剂组更高的速率[参见不良反应临床研究(14 ) ] 。
| 斯泰拉拉® | |||
|---|---|---|---|
| 安慰剂 | 45毫克 | 90毫克 | |
| 治疗对象 | 665 | 664 | 666 |
| 鼻咽炎 | 51(8%) | 56(8%) | 49(7%) |
| 上呼吸道感染 | 30(5%) | 36(5%) | 28(4%) |
| 头痛 | 23(3%) | 33(5%) | 32(5%) |
| 疲劳 | 14(2%) | 18(3%) | 17(3%) |
| 腹泻 | 12(2%) | 13(2%) | 13(2%) |
| 背疼 | 8(1%) | 9(1%) | 14(2%) |
| 头晕 | 8(1%) | 8(1%) | 14(2%) |
| 咽喉痛 | 7(1%) | 9(1%) | 12(2%) |
| 瘙痒 | 9(1%) | 10(2%) | 9(1%) |
| 注射部位红斑 | 3(<1%) | 6(1%) | 13(2%) |
| 肌痛 | 4(1%) | 7(1%) | 8(1%) |
| 萧条 | 3(<1%) | 8(1%) | 4(1%) |
在Ps RESEARCH 1和2的控制期内至第12周期间发生的不良反应发生率低于1%,包括:蜂窝织炎,带状疱疹,憩室炎和某些注射部位反应(疼痛,肿胀,瘙痒,硬结,硬结,出血,瘀伤和刺激)。
在临床研究期间发生了1例RPLS [请参阅警告和注意事项(5.6) ] 。
传染病
在银屑病受试者的临床研究的安慰剂对照期间(平均随访同比增长12.6周,安慰剂治疗的患者和13.4周Stelara的治疗过的®科目),Stelara的27%®治疗过的受试者报告感染(1.39每科-随访年),与之相比,安慰剂治疗的受试者为24%(随访的每个受试者年为1.21)。严重感染发生在Stelara的治疗过的®科目(0.01每后续的主题年)的0.3%,而在安慰剂治疗的受试者(0.02每后续的主题年)的0.4%[见警告和注意事项(5.1 ) ] 。
在银屑病的临床研究的受控的和非受控的部分(中位随访3.2岁),相当于8998受试者暴露年,Stelara的® -处理的受试者的72.3%报告感染(0.87每个受试者年随访)。在2.8%的受试者中报告了严重感染(随访的每受试者年0.01)。
恶性肿瘤
在牛皮癣临床研究的受控和非受控的部分(中位随访3.2年,较8998主题年曝光的),Stelara的1.7%®治疗过的受试者报告不包括非黑色素瘤皮肤癌(0.60百恶性肿瘤随访的主题年)。非黑色素瘤皮肤癌的报道中Stelara的治疗过的®科目(0.52百主题年的随访)的1.5%[见警告和注意事项(5.4) ]。在临床研究期间,除非黑色素瘤皮肤癌以外,最常观察到的恶性肿瘤是:前列腺癌,黑色素瘤,结直肠癌和乳腺癌。在研究的控制和不受控制的部分比非黑色素瘤皮肤癌等恶性肿瘤的Stelara的治疗过的®患者的类型和数量,以什么在美国一般人群根据SEER数据库所预期的相似(调整了年龄,性别和种族)。 1个
斑块状牛皮癣的儿科受试者
Stelara的®的安全性在儿科患者的两项研究进行评估的中度至重度牛皮癣。 Ps Study 3评估了110名青少年(12至17岁)长达60周的安全性。 PS研究4评估了44名儿童(6至11岁)长达56周的安全性。小儿科目的安全性与成人斑块状牛皮癣的研究相似。
银屑病关节炎
Stelara的®的安全性在927个科目两项随机,双盲,安慰剂对照研究与活动性银屑病关节炎(PSA)的成年人进行评估。在PsA的受试者Stelara的®的总体安全性与成人银屑病的临床研究中观察其安全性是一致的。在Stelara的® -处理的受试者中观察到的关节痛,恶心和牙齿感染的发生率较高时,与安慰剂治疗的受试者中(3%对1%关节痛和3%对恶心1%变为1%对0.6 PsA临床研究中安慰剂对照部分的百分比)。
克罗恩病
Stelara的®的安全性在1407名受试者患有中度至重度活动克罗恩病评估(克罗恩氏病活性指数[CDAI]大于或等于220且小于或等于450)在三个随机,双盲,安慰剂对照,平行小组,多中心研究。这1407名受试者包括40名接受过预先研究的静脉使用乌斯妥单抗制剂但未纳入疗效分析的受试者。在研究CD-1和CD-2有谁收到470名受试者Stelara的®6毫克/公斤为基于重量的单次静脉内诱导剂量和466谁接受安慰剂[见剂量和给药方法(2.3) ]。谁在任一研究CD-1或CD-2应答的受试者随机接受的任一90毫克Stelara的®每8周,或安慰剂皮下维持方案44周研究CD-3。这3项研究的受试者可能还接受了其他伴随疗法,包括氨基水杨酸酯,免疫调节剂[硫唑嘌呤(AZA),6-巯基嘌呤(6-MP),MTX],口服皮质类固醇(泼尼松或布地奈德)和/或克罗恩氏病抗生素[参见临床研究(14.4) ] 。
Stelara的®的总体安全性与成人银屑病和银屑病关节炎的临床研究中观察到的安全性是一致的。表5和表6分别列出了研究CD-1和CD-2和研究CD-3中的常见不良反应。
| 安慰剂 | 斯泰拉拉® 6 mg / kg单次静脉内诱导剂量 | |
|---|---|---|
| N = 466 | N = 470 | |
| 呕吐 | 3% | 4% |
研究CD-1和CD-2中受试者报告的其他较不常见的不良反应包括乏力(1%vs 0.4%),痤疮(1%vs 0.4%)和瘙痒(2%vs 0.4%)。
| 安慰剂 | 斯泰拉拉® 每8周90毫克皮下维持剂量 | |
|---|---|---|
| N = 133 | N = 131 | |
| 鼻咽炎 | 8% | 11% |
| 注射部位红斑 | 0 | 5% |
| 外阴念珠菌病/霉菌感染 | 1% | 5% |
| 支气管炎 | 3% | 5% |
| 瘙痒 | 2% | 4% |
| 尿路感染 | 2% | 4% |
| 鼻窦炎 | 2% | 3% |
传染病
在克罗恩氏病患者中,严重或其他临床上重要的感染包括肛门脓肿,肠胃炎和肺炎。此外,每例患者中均报告了李斯特菌性脑膜炎和带状疱疹[见警告和注意事项(5.1) ] 。
恶性肿瘤
凭借高达一年的治疗在克罗恩病的临床研究,Stelara的®的0.2%治疗过的受试者(每百病人年0.36事件)和安慰剂治疗的患者的0.2%(0.58百事件病人年)开发的非-黑色素瘤皮肤癌。比非黑色素瘤皮肤癌等恶性肿瘤发生在Stelara的治疗过的®科目(每百病人年0.27事件)的0.2%,并且在没有安慰剂治疗的受试者。
过敏反应,包括过敏反应
在CD研究中,两名病人报道过敏反应以下Stelara的®管理。一名患者经历了一个皮下给药(接受皮下Stelara的®患者0.1%)后的症状和体征与过敏反应(喉咙的胸闷,气短,和冲洗)一致。此外,一个患者经历的症状和体征的初始静脉Stelara的®剂量(接收静脉内Stelara的®患者0.08%)之后具有一致的或相关的超敏反应(胸部不适,潮红,荨麻疹,和增加的体温)。这些患者接受了口服抗组胺药或皮质类固醇激素的治疗,在两种情况下,症状均在一小时内消失。
溃疡性结肠炎
Stelara的®的安全性两个随机,双盲,安慰剂对照的临床研究(UC-1 [IV感应]和UC-2 [SC维护])在960名成年受试者有中度至重度活动性溃疡性结肠炎进行评价[参见[临床研究(14.5) 。在溃疡性结肠炎患者Stelara的®的总体安全性与所有批准的适应症看到的安全性是一致的。不良反应报道Stelara的® -处理的受试者的至少3%,并以较高的速率比安慰剂分别为:
- 诱导(UC-1):鼻咽炎(7%对4%)。
- 维持(UC-2):鼻咽炎(24%vs 20%),头痛(10%vs 4%),腹痛(7%vs 3%),流行性感冒(6%vs 5%),发烧(5%vs.5%)。 4%),腹泻(4%比1%),鼻窦炎(4%比1%),疲劳(4%比2%)和恶心(3%比2%)。
传染病
在溃疡性结肠炎患者中,严重或其他具有临床意义的感染包括肠胃炎和肺炎。此外,每例患者中均报告了李斯特菌病和带状疱疹[见警告和注意事项(5.1) ] 。
恶性肿瘤
凭借高达一年的治疗在溃疡性结肠炎的临床研究,Stelara的治疗过的®科目的0.4%(每百病人年0.48事件)和安慰剂治疗的患者的0.0%发展非(每百病人年0.00事件) -黑色素瘤皮肤癌。比非黑色素瘤皮肤癌等恶性肿瘤发生在Stelara的治疗过的®科目的0.5%(0.64百事件病人年)和安慰剂治疗的患者的0.2%(每百病人年0.40事件)。
免疫原性
与所有治疗性蛋白质一样,具有免疫原性的潜力。抗体形成的检测高度依赖于测定的灵敏度和特异性。另外,在测定中观察到的抗体(包括中和抗体)阳性的发生率可能受到几个因素的影响,包括测定方法,样品处理,样品收集的时间,伴随药物和基础疾病。由于这些原因,在下面描述的研究中将乌斯他单抗抗体的发生率与其他产品的抗体发生率进行比较可能会产生误导。
与Stelara的®在银屑病和银屑病性关节炎的临床研究治疗的受试者约6至12.4%开发抗体优特克单抗,其一般都低滴度。在牛皮癣临床研究中,抗ustekinumab的抗体与血清ustekinumab浓度降低或不可检测以及功效降低相关。在牛皮癣研究中,对ustekinumab抗体呈阳性的大多数受试者均具有中和抗体。
在克罗恩病和溃疡性结肠炎的临床研究中,2.9%和4.6科目%,分别产生抗体时Stelara的®大约一年处理,以优斯。没有发现抗ustekinumab的抗体的发展与注射部位反应的发展之间的明显联系。
上市后经验
Stelara的®的批准后在接下来的不良反应的报道。因为这些反应是从不确定大小的人群自愿报告,并不总是能够可靠地估计其发生率或建立Stelara的®暴露的因果关系。
免疫系统疾病:严重的超敏反应(包括过敏反应和血管性水肿),其他超敏反应(包括皮疹和荨麻疹) [请参阅警告和注意事项(5.5) ] 。
感染和感染:下呼吸道感染(包括机会性真菌感染和结核病) [请参阅警告和注意事项(5.1)] 。
呼吸,胸和纵隔疾病:间质性肺炎,嗜酸性粒细胞性肺炎和隐源性组织性肺炎[见警告和注意事项(5.9) ]。
皮肤反应:脓疱型牛皮癣,红皮性牛皮癣。
药物相互作用
伴随疗法
在牛皮癣研究Stelara的®的与免疫抑制剂或彩光组合的安全性尚未评估[见警告和注意事项(5.8) ]。在银屑病关节炎研究,同时使用MTX似乎没有影响Stelara的®的安全性或有效性。在克罗恩氏病和溃疡性结肠炎诱导研究中,分别在约30%的受试者中同时使用免疫调节剂(6-MP,AZA,MTX),在约40%和50%的克罗恩氏病和溃疡性结肠炎受试者中同时使用皮质类固醇。这些伴随治疗的使用似乎没有影响Stelara的®的整体安全性或有效性。
CYP450底物
CYP450酶的形成可以通过在慢性炎症过程中某些细胞因子(例如IL-1,IL-6,IL-10,TNFα,IFN)的水平升高来改变。因此,Stelara的®,IL-12和IL-23的拮抗剂,可正常化的CYP450酶的形成。当在谁正在接受伴随CYP450基板的患者,特别是那些具有窄的治疗指数,监测治疗效果(例如,华法林),或药物浓度(例如,用于环孢菌素)Stelara的®的起始应考虑和的单个剂量根据需要调整药物[参见临床药理学(12.3) ] 。
过敏原免疫疗法
Stelara的®已没有谁经历了过敏免疫治疗的患者进行了评估。 Stelara的®可能降低过敏原免疫疗法(减少公差),其可以增加过敏反应的风险剂量的变应原免疫疗法的的保护作用。因此,在接受或已接受过敏原免疫疗法的患者中应格外小心,尤其是在过敏反应方面。
在特定人群中的使用
怀孕
风险摘要
在孕妇中使用Stelara的的®有限的数据不足以告知药物相关的风险[见的数据。在动物生殖和发育毒性研究中,对怀孕的猴子给予乌斯他单抗的暴露量大于最大推荐人皮下剂量(MRHD)的人暴露量的100倍后,未观察到不利的发育影响。
对于指定人群而言,重大出生缺陷和流产的背景风险尚不清楚。所有怀孕都有出生缺陷,流产或其他不良后果的背景风险。在美国普通人群中,主要出生缺陷和临床认可的流产的估计背景风险分别为2%至4%和15%至20%。
数据
人数据
对孕妇使用Stelara的的®观察性研究,已发表的病例报告和上市后监测数据十分有限不足以告知药物相关的风险。
动物资料
Ustekinumab在食蟹猴的两项胚胎-胎儿发育毒性研究中进行了测试。在器官发生期间,每周两次皮下或每周静脉内注射ustekinumab的怀孕猴子的胎儿中未观察到致畸或其他不利的发育影响。在怀孕的猴子中,ustekinumab的血清浓度是每周皮下注射90 mg ustekinumab治疗4周的患者血清浓度的100倍以上。
在一项结合胚胎-胎儿发育以及出生前和产后发育毒性研究中,从器官发生开始到分娩后第33天,每周两次对怀孕的食蟹猴进行皮下剂量的ustekinumab暴露,其暴露量是人皮下暴露的100倍以上。一只猴子以22.5 mg / kg的剂量给予ustekinumab和一只猴子以45 mg / kg的剂量发生新生婴儿的新生儿死亡。从出生到六个月大的婴儿均未观察到乌斯替单抗对功能,形态或免疫学发育的影响。
哺乳期
风险摘要
没有关于人乳中ustekinumab的存在,对母乳喂养婴儿的影响或对牛奶产量的影响的数据。乌斯库单抗存在于服用乌斯库单抗的哺乳期猴子的乳汁中。由于泌乳生理的物种特异性差异,动物数据可能无法可靠地预测人乳中的药物水平。已知母乳中存在母体IgG。公开的数据表明,由于ustekinumab是一种大分子并且在胃肠道中降解,因此对母乳喂养婴儿的全身暴露预计较低。但是,如果将乌斯库单抗转移至人乳中,则胃肠道局部暴露的影响尚不清楚。
母乳喂养的发育和健康的好处应该与母亲的临床需要Stelara的®和Stelara的®或从底层母亲的状况对母乳喂养的孩子的任何潜在的不利影响一起考虑。
儿科用
Stelara的的安全性和有效性®已经建立了儿童患者6岁到17岁的中度至重度牛皮癣。 Stelara的®青少年由证据从一个多中心的支持,使用随机化,60周的试验(诗研究3),其中包括一个12周的,双盲,安慰剂对照,平行组部,在110个儿科对象12岁及以上[见不良反应(6.1) ,临床研究(14.2) ] 。
中度至重度牛皮癣使用Stelara的6至11岁的®在儿童证据在44个科目的开放标签,单臂,有效性,安全性和药代动力学研究(诗研究4)支持[见不良反应(6.1 ) ,药代动力学(12.3) ] 。
Stelara的®的儿科患者小于6岁的银屑病患者的安全性和有效性尚未确立。
Stelara的的安全性和有效性®尚未建立儿童患者银屑病关节炎,克罗恩病或溃疡性结肠炎。
老人用
暴露于Stelara的所述6709名患者中®,共有340是65岁以上(183名牛皮癣患者,65例银屑病关节炎,58例克罗恩病和34例溃疡性结肠炎),以及40例为75年或年长一些。尽管在老年和年轻患者之间未观察到安全性或疗效的总体差异,但65岁及65岁以上的患者人数不足以确定他们对年轻患者的反应是否不同。
过量
在临床研究中,静脉注射剂量最高为6 mg / kg,没有剂量限制的毒性。如果过量,建议对患者进行任何不良反应或影响的体征或症状的监测,并立即采取适当的对症治疗。
Stelara说明
Ustekinumab是人IgG1κ单克隆抗体,是人白介素12和-23拮抗剂。使用DNA重组技术,ustekinumab在鼠细胞系(Sp2 / 0)中产生。制造过程包含清除病毒的步骤。 Ustekinumab由1326个氨基酸组成,分子量估计为148,079至149,690道尔顿。
Stelara ® (ustekinumab) injection is a sterile, preservative-free, colorless to light yellow solution and may contain a few small translucent or white particles with pH of 5.7– 6.3.
Stelara ® for Subcutaneous Use
Available as 45 mg of ustekinumab in 0.5 mL and 90 mg of ustekinumab in 1 mL, supplied as a sterile solution in a single-dose prefilled syringe with a 27 gauge fixed ½ inch needle and as 45 mg of ustekinumab in 0.5 mL in a single-dose 2 mL Type I glass vial with a coated stopper. The syringe is fitted with a passive needle guard and a needle cover that contains dry natural rubber (a derivative of latex).
Each 0.5 mL prefilled syringe or vial delivers 45 mg ustekinumab, L-histidine and L-histidine monohydrochloride monohydrate (0.5 mg), Polysorbate 80 (0.02 mg), and sucrose (38 mg).
Each 1 mL prefilled syringe delivers 90 mg ustekinumab, L-histidine and L-histidine monohydrochloride monohydrate (1 mg), Polysorbate 80 (0.04 mg), and sucrose (76 mg).
Stelara ® for Intravenous Infusion
Available as 130 mg of ustekinumab in 26 mL, supplied as a single-dose 30 mL Type I glass vial with a coated stopper.
Each 26 mL vial delivers 130 mg ustekinumab, EDTA disodium salt dihydrate (0.52 mg), L-histidine (20 mg), L-histidine hydrochloride monohydrate (27 mg), L-methionine (10.4 mg), Polysorbate 80 (10.4 mg) and sucrose (2210 mg).
Stelara - Clinical Pharmacology
作用机理
Ustekinumab is a human IgG1қ monoclonal antibody that binds with specificity to the p40 protein subunit used by both the IL-12 and IL-23 cytokines. IL-12 and IL-23 are naturally occurring cytokines that are involved in inflammatory and immune responses, such as natural killer cell activation and CD4+ T-cell differentiation and activation. In in vitro models, ustekinumab was shown to disrupt IL-12 and IL-23 mediated signaling and cytokine cascades by disrupting the interaction of these cytokines with a shared cell-surface receptor chain, IL-12Rβ1. The cytokines IL-12 and IL-23 have been implicated as important contributors to the chronic inflammation that is a hallmark of Crohn's disease and ulcerative colitis. In animal models of colitis, genetic absence or antibody blockade of the p40 subunit of IL-12 and IL-23, the target of ustekinumab, was shown to be protective.
药效学
银屑病
In a small exploratory study, a decrease was observed in the expression of mRNA of its molecular targets IL-12 and IL-23 in lesional skin biopsies measured at baseline and up to two weeks post-treatment in subjects with psoriasis.
溃疡性结肠炎
In both study UC-1 (induction) and study UC-2 (maintenance), a positive relationship was observed between exposure and rates of clinical remission, clinical response, and endoscopic improvement. The response rate approached a plateau at the ustekinumab exposures associated with the recommended dosing regimen for maintenance treatment [see Clinical Studies (14.5) ] .
药代动力学
吸收性
In adult subjects with psoriasis, the median time to reach the maximum serum concentration (T max ) was 13.5 days and 7 days, respectively, after a single subcutaneous administration of 45 mg (N=22) and 90 mg (N=24) of ustekinumab. In healthy subjects (N=30), the median T max value (8.5 days) following a single subcutaneous administration of 90 mg of ustekinumab was comparable to that observed in subjects with psoriasis.
Following multiple subcutaneous doses of Stelara ® in adult subjects with psoriasis, steady-state serum concentrations of ustekinumab were achieved by Week 28. The mean (±SD) steady-state trough serum ustekinumab concentrations were 0.69 ± 0.69 mcg/mL for patients less than or equal to 100 kg receiving a 45 mg dose and 0.74 ± 0.78 mcg/mL for patients greater than 100 kg receiving a 90 mg dose. There was no apparent accumulation in serum ustekinumab concentration over time when given subcutaneously every 12 weeks.
Following the recommended intravenous induction dose, mean ±SD peak serum ustekinumab concentration was 125.2 ± 33.6 mcg/mL in patients with Crohn's disease, and 129.1 ± 27.6 mcg/mL in patients with ulcerative colitis. Starting at Week 8, the recommended subcutaneous maintenance dosing of 90 mg ustekinumab was administered every 8 weeks. Steady state ustekinumab concentration was achieved by the start of the second maintenance dose. There was no apparent accumulation in ustekinumab concentration over time when given subcutaneously every 8 weeks. Mean ±SD steady-state trough concentration was 2.5 ± 2.1 mcg/mL in patients with Crohn's disease, and 3.3 ± 2.3 mcg/mL in patients with ulcerative colitis for 90 mg ustekinumab administered every 8 weeks.
分配
Population pharmacokinetic analyses showed that the volume of distribution of ustekinumab in the central compartment was 2.7 L (95% CI: 2.69, 2.78) in patients with Crohn's disease and 3.0 L (95% CI: 2.96, 3.07) in patients wit
已知共有360种药物与Stelara(ustekinumab)相互作用。
- 33种主要药物相互作用
- 320种中等程度的药物相互作用
- 7种次要药物相互作用
检查互动
最常检查的互动
查看Stelara(ustekinumab)与下列药物的相互作用报告。
- 阿米替林
- 阿托伐他汀
- 外用氯倍他索
- 环苯扎林
- 叶酸
- 加巴喷丁
- Humira(阿达木单抗)
- 左甲状腺素
- 赖诺普利
- 抒情诗(普瑞巴林)
- 二甲双胍
- 甲氨蝶呤
- 甲氨蝶呤
- Norco(对乙酰氨基酚/氢可酮)
- 奥美拉唑
- 奥特兹拉(Apremilast)
- top托拉唑
- 强的松
- 强的松
- 曲马多
- 曲唑酮
- 维生素B12(氰钴胺)
- 维生素D3(胆钙化固醇)
Stelara(ustekinumab)酒精/食物相互作用
Stelara(ustekinumab)与酒精/食物有1种相互作用
斯泰拉拉(ustekinumab)疾病相互作用
与Stelara(ustekinumab)有5种疾病相互作用,包括:
- 恶性肿瘤
- 后白质脑病综合征
- 感染
- 结核
- 免疫接种
药物相互作用分类
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
- 审批历史 FDA的药物史
美国日本医生

Heather Benjamin MD

Heather Benjamin MD

Suzanne Reitz MD

Heather Miske DO

Heather Miske DO

渡邊剛

村上和成 教授

中山秀章 教授

村田朗




