获取国外绳索药品价格,使用等信息,最快 24 小时回馈
绳索
陶维德
在本页面
- 适应症和用法
- 剂量和给药
- 剂型和优势
- 禁忌症
- 警告和注意事项
- 不良反应/副作用
- 在特定人群中使用
- 描述
- 临床药理学
- 非临床毒理学
- 临床研究
- 供应/存储和处理方式
- 病人咨询信息
Tauvid的适应症和用法
Tauvid适用于大脑的正电子发射断层扫描(PET)成像,以评估正在评估阿尔茨海默氏病(AD)的成年认知障碍患者中聚集的tau神经原纤维缠结(NFT)的密度和分布。
使用限制
Tauvid未指定用于评估慢性创伤性脑病(CTE)的患者[参见警告和注意事项(5.2)] 。
牛磺酸剂量和给药
辐射安全-药物处理
牛磺酸是一种放射性药物。只有经过培训和经验丰富的授权人员才可以接收,使用和管理Tauvid。用适当的安全措施处理Tauvid,以最大程度地减少给药过程中的辐射暴露[请参阅警告和注意事项(5.3)] 。准备和处理Tauvid时,请使用防水手套和有效的防护罩,包括注射器防护罩。
推荐剂量和给药指导
推荐剂量
用于PET成像的建议放射活性建议为370 MBq(10 mCi),以静脉推注方式给药,总体积不超过10 mL。
准备和管理
- 建议在服用Tauvid之前对有生殖能力的女性进行妊娠状况评估。
- 在Tauvid的制备和给药过程中使用无菌技术和辐射屏蔽[请参阅剂量和给药方法(2.1)] 。
- 给药前目视检查放射性药物溶液。如果它包含颗粒物或已变色(Tauvid是一种透明,无色的溶液),请勿使用它。
- 最终用户可以用0.9%氯化钠注射液将Tauvid无菌稀释至最大稀释度为1:5。稀释后的产品应在稀释后的3小时内和产品到期前使用。
- 给药前在合适的剂量校准器中测定剂量。
给药后说明
- 在Tauvid注射液后,用0.9%氯化钠注射液(USP)进行静脉冲洗。
- 遵照适用法规处理任何未使用的Tauvid。
图像采集
在Tauvid静脉注射后约80分钟开始,患者仰卧获取20分钟的PET图像。将头放在PET扫描仪视野中,使大脑(包括小脑)居中。可以使用胶带或其他柔软的头部保护装置来减少头部的移动。
影像显示
读取的目的是识别和定位新皮层中氟罗西吡活性的区域,该区域大于背景活性(背景活性定义为所测小脑平均值的1.65倍)。为了获得最佳显示效果,请选择一种在两种不同颜色之间具有快速过渡的色标,并调整该色标,以使过渡发生在1.65倍阈值处。两侧检查颞外侧颞(PLT),枕骨,顶叶和额叶区域。两个半球的新皮质活动均有助于图像解释。脑白质或大脑外部区域的活动不会有助于图像解释。为了帮助识别PLT,请考虑按照以下说明将颞叶细分为四个象限。前颞叶和颞颞叶的活动不有助于正Tauvid模式的图像解释。
图像显示和方向
在横断面,矢状面和冠状面显示图像。重新调整图像方向以消除头部在横向和冠状面上的倾斜。在正好位于中线附近的位置使用矢状切面,以在水平面中对齐额下和枕下极。
选择并调整色阶
要创建阳性的视觉阈值:
- 在横断面上在小脑周围绘制一个感兴趣的区域。
- 选择要在小脑的最大横截面积处穿过小脑的平面。
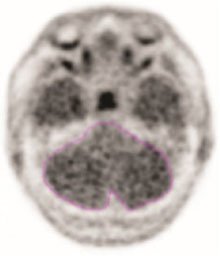
- 记录平均活动或小脑计数(MCC)。如图1的示例所示,应在灰度扫描和横向平面中绘制感兴趣的区域。
图1:小脑感兴趣区域的示例

- 选择用于图像显示的色阶,该色阶在最大强度的25%到60%的一般范围内的两种不同的颜色之间快速转换。
- 设置色标的上对比度(UCV)。使用以下公式将视觉阈值设置为1.65 x MCC,以匹配色阶的快速过渡:
| UCV =(MCC x 1.65)x(100%/%颜色过渡级别) |
如果需要有关图像显示的其他指导,请参考制造商的要求提供的Tauvid PET图像显示用户指南。
准备图像解释
- 在解释图像之前,请检查大脑以确定大叶解剖结构。首先评估颞叶,然后评估双侧枕叶,顶叶和额叶,以解释图像。
- 要评估颞叶,可将水平十字准线细分为四个象限,方法是将水平十字准线紧紧放在脑干核的后方,然后向下滚动以将垂直十字准线穿过颞极的最宽部分,从而获得前额颞侧(ALT)颞内侧肌(AMT),后外侧颞肌(PLT)和后内侧颞肌(PMT)象限。参见图2的示例(左右图像面板以两种不同的色标显示相同的扫描)。
图2:颞叶象限

影像解析
解释Tauvid成像独立于患者的临床特征和其他成像。
根据新皮层灰质内(而不是白质内或大脑外部区域中)放射性信号的模式和密度解释PET Tauvid图像。只有在新皮层灰质区域摄取示踪剂才有助于扫描解释。
脱靶结合可以在脉络丛,纹状体和脑干核中看到。不连续的示踪剂摄取的小焦点可能导致假阳性解释。谨慎解释在任何区域中具有孤立或不连续的小焦点的扫描。由于图像噪声或运动伪影,某些扫描可能难以解释。对于新皮层摄取位置不确定的情况,请使用共同注册的解剖学影像来改善摄取的局部性。
阳性Tauvid扫描
阳性扫描显示后外侧颞部(PLT),枕部或顶叶/胎前区的新皮层活动增加,有或没有额叶活动。任何一个半球的新皮层活动均可有助于确定阳性模式。阳性扫描支持广泛分布的tau神经病理学(B3 tau病理学)的存在。有关示例,请参见图3(左图像面板和右图像面板以两种不同的色标显示相同的扫描) [请参见警告和注意事项(5.1)] 。
负牛磺酸扫描
阴性扫描未显示出新的皮质活性增加,或显示出新的皮质活性分离到颞叶内侧,前外侧颞叶和/或额叶区域。有关示例,请参见图4(左右图像面板以两种不同的色标显示相同的扫描) [请参见警告和注意事项(5.1)] 。
图3:正扫描示例

答:在纹状体中脱靶结合。
第1行:PLT摄取增加的患者示例。
第2行:PLT和枕骨区域摄取增加的患者示例。
第3行和第4行:患者的PLT,枕叶(实心箭头)和早突(虚线箭头)的新皮层活动增强的示例(第3行:颞叶水平,第4行:顶叶/早突水平)。
第5行:在内侧前额叶/扣带状,外侧额叶前,PLT,顶叶,枕叶和前枕骨区域中新皮质活动增强的患者的示例。
图4:负扫描示例

B:在脉络丛或脑干核中脱靶结合。
第1行:没有增加新皮层活动的患者(活动强度与小脑参考区域相似)。
第2行:孤立于MTL的活动增加的患者示例。
第3行:孤立于额叶的新皮质活动增强的患者的示例。
第4行:在PLT中具有小的非连续且可变吸收灶的孤立病灶的患者的示例(实线箭头); ALT中的活性增加(虚线箭头)。在枕骨或顶叶区域也可以看到这种模式。
辐射剂量法
表1显示了Tauvid静脉内给药对成年人器官和组织的辐射吸收剂量估计。向体重70公斤的成年人施用370 MBq(10 mCi)的Tauvid产生的有效辐射剂量估计为8.7 mSv。关键器官包括大肠壁上部,小肠和肝脏。进行PET / CT时,放射线的照射量会增加,具体取决于CT采集中使用的设置。
a将F 18的吸收剂量(灰色或rads)转换为等效剂量(Sieverts或rem)的假定辐射权重因子wr(以前定义为质量因子Q)为1。获得以rad / mCi为单位的辐射吸收剂量从上表中,将以μGy/ MBq为单位的剂量乘以0.0037(例如14μGy/ MBq x 0.0037 = 0.0518 rad / mCi)。 | |
| 器官/组织 | 单位平均吸收剂量 管理活动(μGy/ MBq) |
| 肾上腺 | 14 |
| 脑 | 8 |
| 乳房 | 7 |
| 胆囊壁 | 38 |
| 下大肠壁 | 35 |
| 小肠壁 | 85 |
| 胃壁 | 13 |
| 上大肠壁 | 96 |
| 心墙 | 30 |
| 肾脏 | 40 |
| 肝 | 57 |
| 肺 | 34 |
| 肌肉 | 9 |
| 卵巢 | 21 |
| 胰腺 | 14 |
| 红骨髓 | 10 |
| 成骨细胞 | 12 |
| 皮肤 | 6 |
| 脾 | 10 |
| 睾丸 | 7 |
| 胸腺 | 9 |
| 甲状腺 | 7 |
| 膀胱壁 | 38 |
| 子宫 | 18岁 |
| 全身 | 12 |
| 有效剂量(μSv/ MBq) a | 24 |
剂型和优势
进样:在合成结束时,在含有300 MBq / mL至1,900 MBq / mL(8.1 mCi / mL至51 mCi / mL)的氟尿嘧啶F 18注射液的30 mL或50 mL多剂量小瓶中制成无色透明溶液。
禁忌症
没有。
警告和注意事项
评估阿尔茨海默氏病的患者发生误诊的风险
Tauvid不会靶向β-淀粉样蛋白,后者是AD神经病理学诊断的两个必需成分之一。
在绝症患者中评估了tauvid检测tau病理的能力,其中大多数患者患有AD痴呆且B3级NFT病理。在病理频谱较早阶段的患者中,tauvid检测tau病理的性能可能较低[参见临床研究(14)] 。
负牛磺酸扫描
在Tauvid扫描阴性的患者中,NFTs的存在水平可能符合AD的神经病理学诊断水平(在至少中等水平的皮质淀粉样蛋白病理状态下为B2 tau病理学)。考虑进行其他评估,以确认Tauvid扫描阴性的患者不存在AD病理。
假阳性Tauvid扫描
不连续的示踪剂摄取的小灶可能会导致假阳性Tauvid扫描阳性。只有在新皮层中摄取示踪剂才有助于Tauvid阳性扫描的解释[见剂量和给药方法(2.4)] 。
慢性创伤性脑病误诊的风险
对于接受CTE评估的患者,尚未确定Tauvid的安全性和有效性。初步的非临床和临床研究表明tau构象和分布的差异可能会限制氟罗西吡F 18的结合。因此,Tauvid未指示用于检测CTE。
辐射风险
诊断性放射性药物(包括Tauvid)使患者暴露于放射线下[见剂量和用法(2.7)] 。辐射暴露与癌症的剂量依赖性增加相关。确保安全的处理和准备程序,以保护患者和医护人员免受意外辐射的侵害[见剂量和用法(2.1,2.2)] 。
不良反应
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
在临床研究中,有1921名研究参与者暴露于Tauvid [请参阅临床研究(14)] 。在这些研究中,有1192名研究参与者接受了240 MBq的Tauvid(约65%推荐剂量),而729名研究参与者接受了370 MBq的Tauvid(建议剂量)。表2显示了研究中报告的大于0.5%的不良反应。
| 不良反应 | n(%) |
| 头痛 | 26(1.4%) |
| 注射部位疼痛 | 23(1.2%) |
| 血压升高 | 15(0.8%) |
在特定人群中的使用
怀孕
风险摘要
根据胎儿的发育阶段和辐射剂量的大小,所有放射性药物(包括Tauvid)都有可能造成胎儿伤害。建议孕妇服用Tauvid可能导致胎儿暴露于辐射剂量。 Tauvid不太可能用于育龄女性。
目前尚无有关孕妇使用Tauvid的数据。没有进行使用氟罗西吡F 18的动物繁殖研究来评估其对雌性繁殖和胚胎胎儿发育的影响。
对于指定人群,估计的主要先天缺陷和流产的背景风险尚不清楚。所有怀孕都有出生缺陷,流产或其他不良后果的背景风险。在美国普通人群中,临床公认的怀孕中主要先天缺陷和流产的估计背景风险分别为2%至4%和15%至20%。
哺乳期
风险摘要
没有关于人乳中存在氟罗西吡F 18或其对母乳喂养婴儿或产奶量的影响的数据。尚未在动物中进行泌乳研究。建议哺乳期妇女在Tauvid给药后4小时内避免母乳喂养,以最大程度地减少对母乳喂养婴儿的辐射暴露。
儿科用
尚无Tauvid在儿科患者中的安全性和有效性。
老人用
在完成Tauvid临床研究的1921名研究参与者中,有1544名(80%)接受Tauvid治疗的受试者年龄≥65岁,而839名(44%)受试者年龄≥75岁。在≥65岁的受试者和较年轻的成年人受试者之间未观察到Tauvid的安全性或有效性的总体差异。
Tauvid说明
化学特性
牛磺酸含有氟罗西弗氟18(F 18)。化学上,氟罗西吡F 18为7-(6- [F-18]氟吡啶-3-基)-5H-吡啶并[4,3-b]吲哚。分子量为262.27,分子式为C 16 H 10 [ 18 F] N 3,结构式为:

Tauvid是用于静脉注射的无菌,无热原的溶液。提供无色透明,无可见颗粒物的透明溶液,可立即使用,每毫升包含高达2微克的氟洛西吡和在合成结束时包含300至1,900 MBq(8.1至51 mCi)氟洛西吡F 18和0.1 mL脱水醇在0.9%氯化钠注射液USP中。溶液的pH在4.5至8.0之间。
物理特性
Tauvid被氟18(F 18)放射性标记,氟18是回旋加速器产生的放射性核素,通过正电子发射而衰减成稳定的氧18,其半衰期为109.8分钟。可用于诊断成像的主要光子是511 keV伽马光子的重合对,这是由发射的正电子与电子的相互作用所致(表3)。
| 辐射 | 能量水平(keV) | 丰度(%) |
| 正电子 | 249.8 | 96.9 |
| 伽玛 | 511 | 193.5 |
外部辐射
F18的点源空气比释动能系数为3.74E -17 Gy m 2 /(Bq s)。 F 18伽马射线的铅(Pb)的前半值厚度约为6毫米。表4显示了由F 18发射的相对降低的辐射,该降低是由不同厚度的铅屏蔽引起的。使用8 cm的Pb将使辐射的传输(即暴露)降低约10,000倍。
| 屏蔽层厚度 铅cm(Pb) | 衰减系数 |
| 0.6 | 0.5 |
| 2 | 0.1 |
| 4 | 0.01 |
| 6 | 0.001 |
| 8 | 0.0001 |
Tauvid-临床药理学
作用机理
Flortaucipir F 18与聚集的tau蛋白结合。在患有AD的患者的大脑中,tau聚集体结合形成NFT,这是AD神经病理学诊断所需的两个组件之一。在体外,氟罗西吡F 18结合成对的螺旋丝(PHF)tau,该螺旋tau从具有AD的供体的脑匀浆中纯化。氟罗西吡F 18与PHF结合的解离常数(Kd)为0.57 nM。在体内,氟罗西弗F 18在包含聚集tau的新皮质区域中有差异地保留。在体外,据报道tri化的氟罗西吡与单胺氧化酶-A和单胺氧化酶-B的纳摩尔亲和力较低,这可能会导致脱靶结合。
药效学
在临床试验中未探讨氟罗西吡F 18血浆浓度与图像解释之间的关系。
MAO抑制剂对AD患者花胶结合的影响
Tauvid PET信号在体内的低tau,高MAO-B脑区域(如伏伏核,壳状核和尾状)中被MAO-B抑制剂雷沙吉兰稍微降低了。但是,MAO结合几乎不会影响新皮层区域的Tauvid扫描解释。
药代动力学
静脉内注射Tauvid后,氟罗西吡F 18分布到全身,给药后5分钟内血液中注入的F 18放射性不足10%,给药后10分钟时血液中存在少于5%。在80分钟至100分钟的成像窗口中,循环中残留的F 18约为母体的28%至34%,其余为代谢产物。
清除主要通过肝胆和肾脏排泄发生。
非临床毒理学
致癌,诱变,生育力受损
尚未进行评估氟罗西吡F 18致癌性或生殖毒性潜力的动物研究。
在体外细菌回复突变试验(Ames试验)中,在5株暴露于flortaucipir˚F19.在染色体畸变在体外用中国仓鼠卵巢(CHO)细胞研究的4观察到回复突变菌落数增加,在有或没有S9代谢激活的情况下,经过3小时的暴露,氟洛西吡F 19增加了具有结构畸变的细胞百分比。在所有测试浓度下,未激活的二十小时曝光都会导致结构像差增加。
在大鼠微核研究中评估了Flortaucipir F 19,未显示出遗传毒性。在这项研究中,当连续服用两天后,氟罗西吡F 19在最高可达到的剂量水平1600μg/ kg / day时并未增加微核多色红细胞的数量。
临床研究
在两项临床研究中评估了Tauvid成像评估聚集的tau神经原纤维缠结(NFT)的密度和分布的性能:研究1(NCT02516046)和研究2(NCT03901092)。在每项研究中,Tauvid成像均由5位对临床信息不了解的独立读者进行解释。读者将Tauvid成像解释为阳性或阴性[请参阅剂量和用法(2.6)] 。
研究1招募了156位同意接受Tauvid成像并参加尸体捐赠计划的绝症患者。在这些患者中的64名患者中,根据独立病理学家提供的评分,将读者对Tauvid扫描的解释与tau病理学进行了比较,他们对死后大脑中NFT的密度和分布进行了评估(参见表5)。在这64例患者中,平均年龄为83岁(55至100岁)。 34位为女性;在Tauvid成像期间,临床评估中有49名痴呆,1名轻度认知障碍和14名无认知障碍。
| 头病理评分 | Tau NFT在大脑中的分布 |
| B0 | 没有NFT |
| B1 | NFT仅限于跨肠脑区 |
| B2 | B1 + NFT仅限于边缘脑区 |
| B3 | B2 + NFTs分布在整个新皮层 |
表6显示了区分B3(阳性)和B0-B2(阴性)tau病理的图像阅读器性能。
一个CI =置信区间。 | ||||||
| 读者 | 真肯定 | 真阴性 | 假阳性 | 假阴性 | 灵敏度%(95%CI a ) | 特异性%(95%CI) |
| 1个 | 38 | 17 | 8 | 1个 | 97 (87,100) | 68 (48,83) |
| 2 | 36 | 23 | 2 | 3 | 92 (80,97) | 92 (75,98) |
| 3 | 36 | 22 | 3 | 3 | 92 (80,97) | 88 (70,96) |
| 4 | 36 | 19 | 6 | 3 | 92 (80,97) | 76 (57,89) |
| 5 | 39 | 13 | 12 | 0 | 100 (91,100) | 52 (34,70) |
五个Tauvid读码器的灵敏度(95%CI)为92%(80,97)至100%(91,100),而特异性(95%CI)为52%(34、70)至92 %(75,98)。探索性分析评估了相同的Tauvid解释如何将B2-B3与B0-B1 tau病理学区分开,b0-B1 tau病理学是将tau和淀粉样蛋白病理学整合在一起用于AD神经病理学诊断的阈值。在此分析中,五种Tauvid读码器的灵敏度(95%CI)为68%(55,79)至86%(74,93),特异性(95%CI)为63%(31,31)。 86)到100%(68,100) [请参阅警告和注意事项(5.1)] 。
研究2包括与研究1相同的绝症患者(外加18名其他绝症患者)和159名接受AD评估的认知障碍患者(指定人群)。使用Fleiss的kappa统计量(95%CI)评估了五名新的Tauvid读者的阅读器间协议,在所有241名患者中,阅读器之间的协议值为0.87(0.83,0.91)。探索性分析评估了两个小组中的读者间协议。在此分析中,绝症患者的Fleissκ(95%CI)为0.82(0.75,0.88),指定人群为0.90(0.85,0.95)。
供应/存储和处理方式
供应方式
Tauvid注射液在30 mL或50 mL多剂量小瓶中提供,其中包含无色透明溶液,无可见颗粒物质,浓度为300 MBq / mL至1,900 MBq / mL(8.1 mCi / mL至51 mCi / mL)合成结束时使用氟罗西吡F 18。每个小瓶包含多个剂量,并封装在屏蔽容器中,以最大程度地减少外部辐射暴露。
| 30毫升 | NDC 0002-1210-30(IC1210) |
| 50毫升 | NDC 0002-1210-50(IC1210) |
储存和处理
存储
将Tauvid存放在25°C(77°F);允许在15°C到30°C(59°F到86°F)之间进行偏移[请参阅USP控制的室温] 。牛磺酸不包含防腐剂。将Tauvid立柱存放在屏蔽容器中[请参阅剂量和用法(2.1)] 。过期日期和时间在容器标签上提供。在标记的有效期内使用Tauvid。
处理方式
经核监管委员会或协议国相关监管机构许可,可将该制剂供个人使用。
病人咨询信息
辐射风险
告知患者Tauvid的放射风险[见警告和注意事项(5.3)] 。
怀孕
向孕妇建议使用Tauvid进行辐射剂量可导致胎儿暴露的潜在风险[请参见在特定人群中使用(8.1)] 。
哺乳期
劝告哺乳期妇女在服用Tauvid后4小时内避免母乳喂养,以最大程度地减少对母乳喂养婴儿的辐射暴露[见在特定人群中使用(8.2)] 。
为宾夕法尼亚州费城的礼来公司的全资子公司Avid Radiopharmaceuticals制造
礼来公司版权所有©2020。版权所有。
TAU-0001-USPI-20200528
PDP文字
Tauvid 50毫升盾牌
NDC 0002-1210-50
Tauvid™
Flortaucipir F 18注射剂
50 mL多剂量瓶
不育
仅接收
注意☢放射性物质
仅限静脉使用
合成结束时300 MBq / mL至1,900 MBq / mL(8.1 mCi / mL至51 mCi / mL)
______上的______:_____ ______mL中的_____MBq(_____mCi)
于_____到期_____:_____
批号。_____
剂量:参见处方信息。
每毫升溶液中最多含2微克的氟洛西吡和0.1 mL脱水醇USP,含0.9%氯化钠注射液USP。将小瓶直立放置在25°C(77°F)的屏蔽容器中;允许在15°C至30°C(59°F至86°F)的范围内移动。
由PETNET Solutions,Inc.在田纳西州诺克斯维尔37932制造,用于Avid Radiopharmaceuticals,这是礼来公司的全资子公司,宾夕法尼亚州费城19104

| 陶维德 氟妥普西F-18注射液 | |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| 贴标机-礼来公司(006421325) |
| 注册人-礼来公司(006421325) |
准备和管理
- 建议在服用TAUVID之前对有生殖能力的女性进行妊娠状况评估。
- 在TAUVID的制备和给药过程中使用无菌技术和辐射屏蔽[请参阅剂量和给药方法(2.1)] 。
- 给药前目视检查放射性药物溶液。如果它包含颗粒物或已褪色(TAUVID是透明,无色的溶液),请勿使用它。
- 最终用户可以用0.9%氯化钠注射液将TAUVID无菌稀释至最大1:5稀释度。稀释后的产品应在稀释后的3小时内和产品到期前使用。
- 给药前在合适的剂量校准器中测定剂量。
给药后说明
- 在TAUVID注射后,用0.9%氯化钠注射液(USP)进行静脉冲洗。
- 遵照适用法规处理任何未使用的TAUVID。
图像采集
在TAUVID静脉注射后约80分钟开始,仰卧患者获得20分钟的PET图像。将头放在PET扫描仪视野中,使大脑(包括小脑)居中。可以使用胶带或其他柔软的头部保护装置来减少头部的移动。
影像显示
读取的目的是识别和定位新皮层中氟罗西吡活性的区域,该区域大于背景活性(背景活性定义为所测小脑平均值的1.65倍)。为了获得最佳显示效果,请选择一种在两种不同颜色之间具有快速过渡的色标,并调整该色标,以使过渡发生在1.65倍阈值处。两侧检查颞外侧颞(PLT),枕骨,顶叶和额叶区域。两个半球的新皮质活动均有助于图像解释。脑白质或大脑外部区域的活动不会有助于图像解释。为了帮助识别PLT,请考虑按照以下说明将颞叶细分为四个象限。前颞叶和颞颞叶的活动不影响正TAUVID模式的图像解释。
图像显示和方向
在横断面,矢状面和冠状面显示图像。重新调整图像方向以消除头部在横向和冠状面上的倾斜。在正好位于中线附近的位置使用矢状切面,以在水平面中对齐额下和枕下极。
选择并调整色阶
要创建阳性的视觉阈值:
- 在横断面上在小脑周围绘制一个感兴趣的区域。
- 选择要在小脑的最大横截面积处穿过小脑的平面。
- 记录平均活动或小脑计数(MCC)。如图1的示例所示,应在灰度扫描和横向平面中绘制感兴趣的区域。
图1:小脑感兴趣区域的示例
- 选择用于图像显示的色阶,该色阶在最大强度的25%到60%的一般范围内的两种不同的颜色之间快速转换。
- 设置色标的上对比度(UCV)。使用以下公式将视觉阈值设置为1.65 x MCC,以匹配色阶的快速过渡:
| UCV =(MCC x 1.65)x(100%/%颜色过渡级别) |
如果需要有关图像显示的其他指导,请参考制造商的要求提供的《 TAUVID PET图像显示用户指南》。
准备图像解释
- 在解释图像之前,请检查大脑以确定大叶解剖结构。首先评估颞叶,然后评估双侧枕叶,顶叶和额叶,以解释图像。
- 要评估颞叶,可将水平十字准线细分为四个象限,方法是将水平十字准线紧紧放在脑干核的后方,然后向下滚动以将垂直十字准线穿过颞极的最宽部分,从而获得前额颞侧(ALT)颞内侧肌(AMT),后外侧颞肌(PLT)和后内侧颞肌(PMT)象限。参见图2的示例(左右图像面板以两种不同的色标显示相同的扫描)。
图2:颞叶象限

影像解析
解释TAUVID成像与患者的临床特征和其他成像无关。
根据新皮层灰质内(而不是白质内或大脑外部区域中)放射性信号的模式和密度来解释PET TAUVID图像。只有在新皮层灰质区域摄取示踪剂才有助于扫描解释。
脱靶结合可以在脉络丛,纹状体和脑干核中看到。不连续的示踪剂摄取的小焦点可能导致假阳性解释。谨慎解释在任何区域中具有孤立或不连续的小焦点的扫描。由于图像噪声或运动伪影,某些扫描可能难以解释。对于新皮层摄取位置不确定的情况,请使用共同注册的解剖学影像来改善摄取的局部性。
正TAUVID扫描
阳性扫描显示后外侧颞部(PLT),枕部或顶叶/胎前区的新皮层活动增加,有或没有额叶活动。任何一个半球的新皮层活动均可有助于确定阳性模式。阳性扫描支持广泛分布的tau神经病理学(B3 tau病理学)的存在。有关示例,请参见图3(左图像面板和右图像面板以两种不同的色标显示相同的扫描) [请参见警告和注意事项(5.1)] 。
负TAUVID扫描
阴性扫描未显示出新的皮质活性增加,或显示出新的皮质活性分离到颞叶内侧,前外侧颞叶和/或额叶区域。有关示例,请参见图4(左右图像面板以两种不同的色标显示相同的扫描) [请参见警告和注意事项(5.1)] 。
图3:正扫描示例
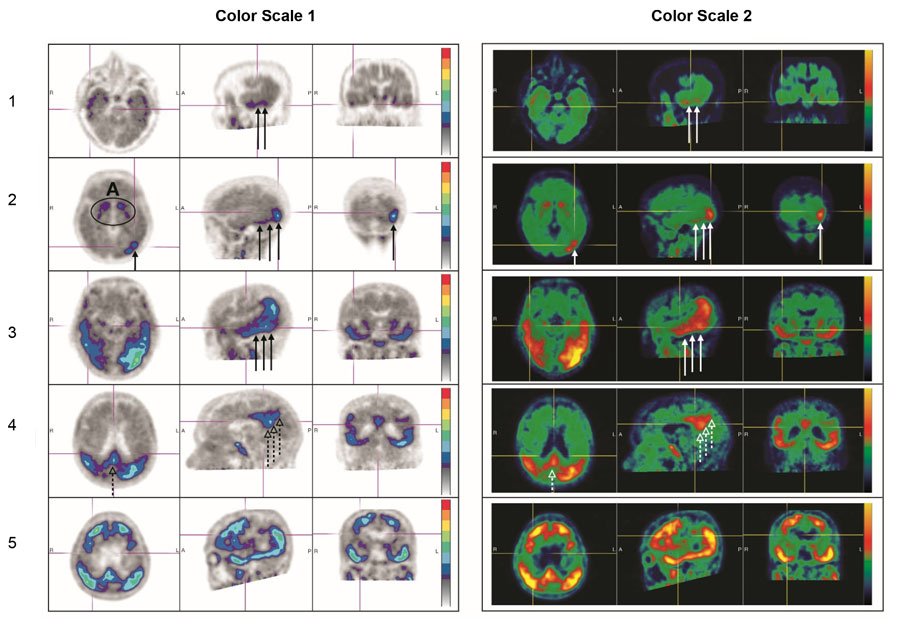
答:在纹状体中脱靶结合。
第1行:PLT摄取增加的患者示例。
第2行:PLT和枕骨区域摄取增加的患者示例。
第3行和第4行:患者的PLT,枕叶(实心箭头)和早突(虚线箭头)的新皮层活动增强的示例(第3行:颞叶水平,第4行:顶叶/早突水平)。
第5行:在内侧前额叶/扣带状,外侧额叶前,PLT,顶叶,枕叶和前枕骨区域中新皮质活动增强的患者的示例。
图4:负扫描示例
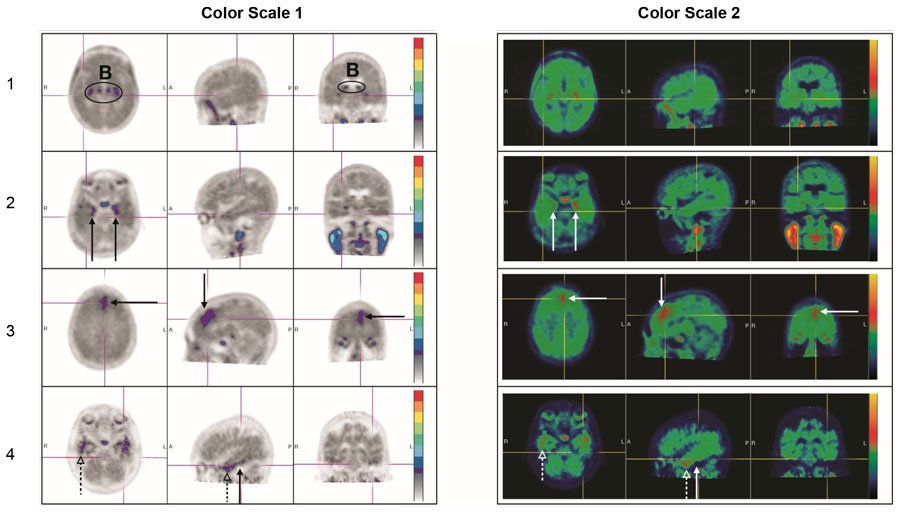
B:在脉络丛或脑干核中脱靶结合。
第1行:没有增加新皮层活动的患者(活动强度与小脑参考区域相似)。
第2行:孤立于MTL的活动增加的患者示例。
第3行:孤立于额叶的新皮质活动增强的患者的示例。
第4行:在PLT中具有小的非连续且可变吸收灶的孤立病灶的患者的示例(实线箭头); ALT中的活性增加(虚线箭头)。在枕骨或顶叶区域也可以看到这种模式。
辐射剂量法
表1中显示了TAUVID的静脉内给药对成年人器官和组织的辐射吸收剂量估计。向体重70公斤的成年人施用370 MBq(10 mCi)TAUVID所产生的有效辐射剂量估计为8.7 mSv。关键器官包括大肠壁上部,小肠和肝脏。进行PET / CT时,放射线的照射量会增加,具体取决于CT采集中使用的设置。
a将F 18的吸收剂量(灰色或rads)转换为等效剂量(Sieverts或rem)的假定辐射权重因子wr(以前定义为质量因子Q)为1。获得以rad / mCi为单位的辐射吸收剂量从上表中,将以μGy/ MBq为单位的剂量乘以0.0037(例如14μGy/ MBq x 0.0037 = 0.0518 rad / mCi)。 | |
| 器官/组织 | 单位平均吸收剂量 管理活动(μGy/ MBq) |
| 肾上腺 | 14 |
| 脑 | 8 |
| 乳房 | 7 |
| 胆囊壁 | 38 |
| 下大肠壁 | 35 |
| 小肠壁 | 85 |
| 胃壁 | 13 |
| 上大肠壁 | 96 |
| 心墙 | 30 |
| 肾脏 | 40 |
| 肝 | 57 |
| 肺 | 34 |
| 肌肉 | 9 |
| 卵巢 | 21 |
| 胰腺 | 14 |
| 红骨髓 | 10 |
| 成骨细胞 | 12 |
| 皮肤 | 6 |
| 脾 | 10 |
| 睾丸 | 7 |
| 胸腺 | 9 |
| 甲状腺 | 7 |
| 膀胱壁 | 38 |
| 子宫 | 18岁 |
| 全身 | 12 |
| 有效剂量(μSv/ MBq) a | 24 |
Tauvid的适应症和用法
Tauvid适用于大脑的正电子发射断层扫描(PET)成像,以评估正在评估阿尔茨海默氏病(AD)的成年认知障碍患者中聚集的tau神经原纤维缠结(NFT)的密度和分布。
使用限制
Tauvid未指定用于评估慢性创伤性脑病(CTE)的患者[参见警告和注意事项( 5.2 )] 。
牛磺酸剂量和给药
辐射安全-药物处理
牛磺酸是一种放射性药物。只有经过培训和经验丰富的授权人员才可以接收,使用和管理Tauvid。用适当的安全措施处理Tauvid,以最大程度地减少给药过程中的辐射暴露[请参阅警告和注意事项( 5.3 )] 。准备和处理Tauvid时,请使用防水手套和有效的防护罩,包括注射器防护罩。
推荐剂量和给药指导
推荐剂量
用于PET成像的建议放射活性建议为370 MBq(10 mCi),以静脉推注方式给药,总体积不超过10 mL。
准备和管理
- 建议在服用Tauvid之前对有生殖能力的女性进行妊娠状况评估。
- 在Tauvid的制备和给药过程中使用无菌技术和辐射屏蔽[请参阅剂量和给药方法( 2.1 )] 。
- 给药前目视检查放射性药物溶液。如果它包含颗粒物或已变色(Tauvid是一种透明,无色的溶液),请勿使用它。
- 最终用户可以用0.9%氯化钠注射液将Tauvid无菌稀释至最大稀释度为1:5。稀释后的产品应在稀释后的3小时内和产品到期前使用。
- 给药前在合适的剂量校准器中测定剂量。
给药后说明
- 在Tauvid注射液后,用0.9%氯化钠注射液(USP)进行静脉冲洗。
- 遵照适用法规处理任何未使用的Tauvid。
图像采集
在Tauvid静脉注射后约80分钟开始,患者仰卧获取20分钟的PET图像。将头放在PET扫描仪视野中,使大脑(包括小脑)居中。可以使用胶带或其他柔软的头部保护装置来减少头部的移动。
影像显示
读取的目的是识别和定位新皮层中氟罗西吡活性的区域,该区域大于背景活性(背景活性定义为所测小脑平均值的1.65倍)。为了获得最佳显示效果,请选择一种在两种不同颜色之间具有快速过渡的色标,并调整该色标,以使过渡发生在1.65倍阈值处。两侧检查颞外侧颞(PLT),枕骨,顶叶和额叶区域。两个半球的新皮质活动均有助于图像解释。脑白质或大脑外部区域的活动不会有助于图像解释。为了帮助识别PLT,请考虑按照以下说明将颞叶细分为四个象限。前颞叶和颞颞叶的活动不有助于正Tauvid模式的图像解释。
图像显示和方向
在横断面,矢状面和冠状面显示图像。重新调整图像方向以消除头部在横向和冠状面上的倾斜。在正好位于中线附近的位置使用矢状切面,以在水平面中对齐额下和枕下极。
选择并调整色阶
要创建阳性的视觉阈值:
- 在横断面上在小脑周围绘制一个感兴趣的区域。
- 选择要在小脑的最大横截面积处穿过小脑的平面。
- 记录平均活动或小脑计数(MCC)。如图1中的示例所示,应在灰度扫描和横向平面中绘制感兴趣的区域。
图1:小脑感兴趣区域的示例

- 选择用于图像显示的色阶,该色阶在最大强度的25%到60%的一般范围内的两种不同的颜色之间快速转换。
- 设置色标的上对比度(UCV)。使用以下公式将视觉阈值设置为1.65 x MCC,以匹配色阶的快速过渡:
| UCV =(MCC x 1.65)x(100%/%颜色过渡级别) |
如果需要有关图像显示的其他指导,请参考制造商的要求提供的Tauvid PET图像显示用户指南。
准备图像解释
- 在解释图像之前,请检查大脑以确定大叶解剖结构。首先评估颞叶,然后评估双侧枕叶,顶叶和额叶,以解释图像。
- 要评估颞叶,可将水平十字准线细分为四个象限,方法是将水平十字准线紧紧放在脑干核的后方,然后向下滚动以将垂直十字准线穿过颞极的最宽部分,从而获得前额颞侧(ALT)颞内侧肌(AMT),后外侧颞肌(PLT)和后内侧颞肌(PMT)象限。参见图2的示例(左右图像面板以两种不同的色标显示相同的扫描)。
图2:颞叶象限

影像解析
解释Tauvid成像独立于患者的临床特征和其他成像。
根据新皮层灰质内(而不是白质内或大脑外部区域中)放射性信号的模式和密度解释PET Tauvid图像。只有在新皮层灰质区域摄取示踪剂才有助于扫描解释。
脱靶结合可以在脉络丛,纹状体和脑干核中看到。不连续的示踪剂摄取的小焦点可能导致假阳性解释。谨慎解释在任何区域中具有孤立或不连续的小焦点的扫描。由于图像噪声或运动伪影,某些扫描可能难以解释。对于新皮层摄取位置不确定的情况,请使用共同注册的解剖学影像来改善摄取的局部性。
阳性Tauvid扫描
阳性扫描显示后外侧颞部(PLT),枕部或顶叶/胎前区的新皮层活动增加,有或没有额叶活动。任何一个半球的新皮层活动均可有助于确定阳性模式。阳性扫描支持广泛分布的tau神经病理学(B3 tau病理学)的存在。示例请参见图3 (左右图像面板以两种不同的色标显示相同的扫描) [请参见警告和注意事项( 5.1 )] 。
负牛磺酸扫描
阴性扫描未显示出新的皮质活性增加,或显示出新的皮质活性分离到颞叶内侧,前外侧颞叶和/或额叶区域。请参见图4的示例(左右图像面板以两种不同的色标显示相同的扫描) [请参见警告和注意事项( 5.1 )] 。
图3:正扫描示例

答:在纹状体中脱靶结合。
第1行:PLT摄取增加的患者示例。
第2行:PLT和枕骨区域摄取增加的患者示例。
第3行和第4行:患者的PLT,枕叶(实心箭头)和早突(虚线箭头)的新皮层活动增强的示例(第3行:颞叶水平,第4行:顶叶/早突水平)。
第5行:在内侧前额叶/扣带状,外侧额叶前,PLT,顶叶,枕叶和前枕骨区域中新皮质活动增强的患者的示例。
图4:负扫描示例

B:在脉络丛或脑干核中脱靶结合。
第1行:没有增加新皮层活动的患者(活动强度与小脑参考区域相似)。
第2行:孤立于MTL的活动增加的患者示例。
第3行:孤立于额叶的新皮质活动增强的患者的示例。
第4行:在PLT中具有小的非连续且可变吸收灶的孤立病灶的患者的示例(实线箭头); ALT中的活性增加(虚线箭头)。在枕骨或顶叶区域也可以看到这种模式。
辐射剂量法
表1显示了Tauvid静脉内给药对成年人器官和组织的辐射吸收剂量估计。向体重70公斤的成年人施用370 MBq(10 mCi)的Tauvid产生的有效辐射剂量估计为8.7 mSv。关键器官包括大肠壁上部,小肠和肝脏。进行PET / CT时,放射线的照射量会增加,具体取决于CT采集中使用的设置。
a将F 18的吸收剂量(灰色或rads)转换为等效剂量(Sieverts或rem)的假定辐射权重因子wr(以前定义为质量因子Q)为1。获得以rad / mCi为单位的辐射吸收剂量从上表中,将以μGy/ MBq为单位的剂量乘以0.0037(例如14μGy/ MBq x 0.0037 = 0.0518 rad / mCi)。 | |
| 器官/组织 | 单位平均吸收剂量 管理活动(μGy/ MBq) |
| 肾上腺 | 14 |
| 脑 | 8 |
| 乳房 | 7 |
| 胆囊壁 | 38 |
| 下大肠壁 | 35 |
| 小肠壁 | 85 |
| 胃壁 | 13 |
| 上大肠壁 | 96 |
| 心墙 | 30 |
| 肾脏 | 40 |
| 肝 | 57 |
| 肺 | 34 |
| 肌肉 | 9 |
| 卵巢 | 21 |
| 胰腺 | 14 |
| 红骨髓 | 10 |
| 成骨细胞 | 12 |
| 皮肤 | 6 |
| 脾 | 10 |
| 睾丸 | 7 |
| 胸腺 | 9 |
| 甲状腺 | 7 |
| 膀胱壁 | 38 |
| 子宫 | 18岁 |
| 全身 | 12 |
| 有效剂量(μSv/ MBq) a | 24 |
剂型和优势
进样:在合成结束时,在含有300 MBq / mL至1,900 MBq / mL(8.1 mCi / mL至51 mCi / mL)的氟尿嘧啶F 18注射液的30 mL或50 mL多剂量小瓶中制成无色透明溶液。
禁忌症
没有。
警告和注意事项
评估阿尔茨海默氏病的患者发生误诊的风险
Tauvid不会靶向β-淀粉样蛋白,后者是AD神经病理学诊断的两个必需成分之一。
在绝症患者中评估了tauvid检测tau病理的能力,其中大多数患者患有AD痴呆且B3级NFT病理。在病理频谱较早阶段的患者中,tauvid检测tau病理的性能可能较低[参见临床研究( 14 )] 。
负牛磺酸扫描
在Tauvid扫描阴性的患者中,NFTs的存在水平可能符合AD的神经病理学诊断水平(在至少中等水平的皮质淀粉样蛋白病理状态下为B2 tau病理学)。考虑进行其他评估,以确认Tauvid扫描阴性的患者不存在AD病理。
假阳性Tauvid扫描
不连续的示踪剂摄取的小灶可能会导致假阳性Tauvid扫描阳性。仅在新皮层中摄取示踪剂才有助于Tauvid阳性扫描的解释[见剂量和给药方法( 2.4 )] 。
慢性创伤性脑病误诊的风险
对于接受CTE评估的患者,尚未确定Tauvid的安全性和有效性。初步的非临床和临床研究表明tau构象和分布的差异可能会限制氟罗西吡F 18的结合。因此,Tauvid未指示用于检测CTE。
辐射风险
诊断性放射性药物(包括Tauvid)使患者暴露于放射线下[参见剂量和用法( 2.7 )] 。辐射暴露与癌症的剂量依赖性增加相关。确保安全处理和准备程序,以保护病人和医护人员无意辐射暴露[见剂量和给药方法( 2.1 , 2.2 )]。
不良反应
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
在临床研究中,有1921名研究参与者暴露于Tauvid [请参阅临床研究( 14 )] 。在这些研究中,有1192名研究参与者接受了240 MBq的Tauvid(约65%推荐剂量),而729名研究参与者接受了370 MBq的Tauvid(建议剂量)。表2显示了研究中报告的不良反应大于0.5%。
| 不良反应 | n(%) |
| 头痛 | 26(1.4%) |
| 注射部位疼痛 | 23(1.2%) |
| 血压升高 | 15(0.8%) |
在特定人群中的使用
怀孕
风险摘要
根据胎儿的发育阶段和辐射剂量的大小,所有放射性药物(包括Tauvid)都有可能造成胎儿伤害。建议孕妇服用Tauvid可能导致胎儿暴露于辐射剂量。 Tauvid不太可能用于育龄女性。
目前尚无有关孕妇使用Tauvid的数据。没有进行使用氟罗西吡F 18的动物繁殖研究来评估其对雌性繁殖和胚胎胎儿发育的影响。
对于指定人群,估计的主要先天缺陷和流产的背景风险尚不清楚。所有怀孕都有出生缺陷,流产或其他不良后果的背景风险。在美国普通人群中,临床公认的怀孕中主要先天缺陷和流产的估计背景风险分别为2%至4%和15%至20%。
哺乳期
风险摘要
没有关于人乳中存在氟罗西吡F 18或其对母乳喂养婴儿或产奶量的影响的数据。尚未在动物中进行泌乳研究。建议哺乳期妇女在Tauvid给药后4小时内避免母乳喂养,以最大程度地减少对母乳喂养婴儿的辐射暴露。
儿科用
尚无Tauvid在儿科患者中的安全性和有效性。
老人用
在完成Tauvid临床研究的1921名研究参与者中,有1544名(80%)接受Tauvid治疗的受试者年龄≥65岁,而839名(44%)受试者年龄≥75岁。在≥65岁的受试者和较年轻的成年人受试者之间未观察到Tauvid的安全性或有效性的总体差异。
Tauvid说明
化学特性
牛磺酸含有氟罗西弗氟18(F 18)。化学上,氟罗西吡F 18为7-(6- [F-18]氟吡啶-3-基)-5H-吡啶并[4,3-b]吲哚。分子量为262.27,分子式为C 16 H 10 [ 18 F] N 3,结构式为:

Tauvid是用于静脉注射的无菌,无热原的溶液。提供无色透明,无可见颗粒物的透明溶液,可立即使用,每毫升包含高达2微克的氟洛西吡和在合成结束时包含300至1,900 MBq(8.1至51 mCi)氟洛西吡F 18和0.1 mL脱水醇在0.9%氯化钠注射液USP中。溶液的pH在4.5至8.0之间。
物理特性
Tauvid被氟18(F 18)放射性标记,氟18是回旋加速器产生的放射性核素,通过正电子发射而衰减成稳定的氧18,其半衰期为109.8分钟。可用于诊断成像的主要光子是511 keV伽马光子的重合对,这是由发射的正电子与电子的相互作用所致(表3 )。
| 辐射 | 能量水平(keV) | 丰度(%) |
| 正电子 | 249.8 | 96.9 |
| 伽玛 | 511 | 193.5 |
外部辐射
F18的点源空气比释动能系数为3.74E -17 Gy m 2 /(Bq s)。 F 18伽马射线的铅(Pb)的前半值厚度约为6毫米。表4显示了由F 18发射的相对减少的辐射,该辐射是由不同厚度的铅屏蔽引起的。使用8 cm的Pb将使辐射传输(即暴露)降低约10,000倍。
| 屏蔽层厚度 铅cm(Pb) | 衰减系数 |
| 0.6 | 0.5 |
| 2 | 0.1 |
| 4 | 0.01 |
| 6 | 0.001 |
| 8 | 0.0001 |
Tauvid-临床药理学
作用机理
Flortaucipir F 18与聚集的tau蛋白结合。在患有AD的患者的大脑中,tau聚集体结合形成NFT,这是AD神经病理学诊断所需的两个组件之一。在体外,氟罗西吡F 18结合成对的螺旋丝(PHF)tau,该螺旋tau从具有AD的供体的脑匀浆中纯化。氟罗西吡F 18与PHF结合的解离常数(Kd)为0.57 nM。在体内,氟罗西弗F 18在包含聚集tau的新皮质区域中有差异地保留。在体外,据报道tri化的氟罗西吡与单胺氧化酶-A和单胺氧化酶-B的纳摩尔亲和力较低,这可能会导致脱靶结合。
药效学
在临床试验中未探讨氟罗西吡F 18血浆浓度与图像解释之间的关系。
MAO抑制剂对AD患者花胶结合的影响
Tauvid PET信号在体内的低tau,高MAO-B脑区域(如伏伏核,壳状核和尾状)中被MAO-B抑制剂雷沙吉兰稍微降低了。但是,MAO结合几乎不会影响新皮层区域的Tauvid扫描解释。
药代动力学
静脉内注射Tauvid后,氟罗西吡F 18分布到全身,给药后5分钟内血液中注入的F 18放射性不足10%,给药后10分钟时血液中存在少于5%。在80分钟至100分钟的成像窗口中,循环中残留的F 18约为母体的28%至34%,其余为代谢产物。
清除主要通过肝胆和肾脏排泄发生。
非临床毒理学
致癌,诱变,生育力受损
尚未进行评估氟罗西吡F 18致癌性或生殖毒性潜力的动物研究。
在体外细菌回复突变试验(Ames试验)中,在5株暴露于flortaucipir˚F19.在染色体畸变在体外用中国仓鼠卵巢(CHO)细胞研究的4观察到回复突变菌落数增加,在有或没有S9代谢激活的情况下,经过3小时的暴露,氟洛西吡F 19增加了具有结构畸变的细胞百分比。在所有测试浓度下,未激活的二十小时曝光都会导致结构像差增加。
在大鼠微核研究中评估了Flortaucipir F 19,未显示出遗传毒性。在这项研究中,当连续服用两天后,氟罗西吡F 19在最高可达到的剂量水平1600μg/ kg / day时并未增加微核多色红细胞的数量。
临床研究
在两项临床研究中评估了Tauvid成像评估聚集的tau神经原纤维缠结(NFT)的密度和分布的性能:研究1(NCT02516046)和研究2(NCT03901092)。在每项研究中,Tauvid成像均由5位对临床信息不了解的独立读者进行解释。读者将Tauvid成像解释为阳性或阴性[请参阅剂量和用法( 2.6 )] 。
研究1招募了156位同意接受Tauvid成像并参加尸体捐赠计划的绝症患者。在这些患者中的64名患者中,基于独立病理学家提供的评分,将读者对Tauvid扫描的解释与tau病理学进行了比较,他们对死后大脑中NFT的密度和分布进行了评估(参见表5 )。在这64例患者中,平均年龄为83岁(55至100岁)。 34位为女性;在Tauvid成像期间,临床评估中有49名痴呆,1名轻度认知障碍和14名无认知障碍。
| 头病理评分 | Tau NFT在大脑中的分布 |
| B0 | 没有NFT |
| B1 | NFT仅限于跨肠脑区 |
| B2 | B1 + NFT仅限于边缘脑区 |
| B3 | B2 + NFTs分布在整个新皮层 |
表6显示了区分B3(阳性)和B0-B2(阴性)tau病理的图像阅读器性能。
一个CI =置信区间。 | ||||||
| 读者 | 真肯定 | 真阴性 | 假阳性 | 假阴性 | 灵敏度%(95%CI a ) | 特异性%(95%CI) |
| 1个 | 38 | 17 | 8 | 1个 | 97 (87,100) | 68 (48,83) |
| 2 | 36 | 23 | 2 | 3 | 92 (80,97) | 92 (75,98) |
| 3 | 36 | 22 | 3 | 3 | 92 (80,97) | 88 (70,96) |
| 4 | 36 | 19 | 6 | 3 | 92 (80,97) | 76 (57,89) |
| 5 | 39 | 13 | 12 | 0 | 100 (91,100) | 52 (34,70) |
五个Tauvid读码器的灵敏度(95%CI)为92%(80,97)至100%(91,100),而特异性(95%CI)为52%(34、70)至92 %(75,98)。探索性分析评估了相同的Tauvid解释如何将B2-B3与B0-B1 tau病理学区分开,b0-B1 tau病理学是将tau和淀粉样蛋白病理学整合在一起用于AD神经病理学诊断的阈值。在此分析中,五种Tauvid读码器的灵敏度(95%CI)为68%(55,79)至86%(74,93),特异性(95%CI)为63%(31,31)。 86)到100%(68,100) [请参阅警告和注意事项( 5.1 )] 。
研究2包括与研究1相同的绝症患者(外加18名其他绝症患者)和159名接受AD评估的认知障碍患者(指定人群)。使用Fleiss的kappa统计量(95%CI)评估了五名新的Tauvid读者的阅读器间协议,在所有241名患者中,阅读器之间的协议值为0.87(0.83,0.91)。探索性分析评估了两个小组中的读者间协议。在此分析中,绝症患者的Fleissκ(95%CI)为0.82(0.75,0.88),指定人群为0.90(0.85,0.95)。
供应/存储和处理方式
供应方式
Tauvid注射液在30 mL或50 mL多剂量小瓶中提供,其中包含无色透明溶液,无可见颗粒物质,浓度为300 MBq / mL至1,900 MBq / mL(8.1 mCi / mL至51 mCi / mL)合成结束时使用氟罗西吡F 18。每个小瓶包含多个剂量,并封装在屏蔽容器中,以最大程度地减少外部辐射暴露。
| 30毫升 | NDC 0002-1210-30(IC1210) |
| 50毫升 | NDC 0002-1210-50(IC1210) |
储存和处理
存储
将Tauvid存放在25°C(77°F);允许在15°C到30°C(59°F到86°F)之间进行偏移[请参阅USP控制的室温] 。牛磺酸不包含防腐剂。将Tauvid立柱存放在屏蔽容器中[请参阅剂量和用法说明( 2.1 )] 。过期日期和时间在容器标签上提供。在标记的有效期内使用Tauvid。
处理方式
经核监管委员会或协议国相关监管机构许可,可将该制剂供个人使用。
病人咨询信息
辐射风险
告知患者Tauvid的放射风险[见警告和注意事项( 5.3 )] 。
怀孕
向孕妇建议使用Tauvid进行放射剂量的胎儿暴露的潜在风险[请参见在特定人群中使用( 8.1 )] 。
哺乳期
劝告哺乳期妇女在服用Tauvid后4小时内避免母乳喂养,以最大程度地减少对母乳喂养婴儿的辐射暴露[见在特定人群中使用( 8.2 )] 。
为宾夕法尼亚州费城的礼来公司的全资子公司Avid Radiopharmaceuticals制造
礼来公司版权所有©2020。版权所有。
TAU-0001-USPI-20200528
PDP文字
Tauvid 50毫升盾牌
NDC 0002-1210-50
Tauvid™
Flortaucipir F 18注射剂
50 mL多剂量瓶
不育
仅接收
注意☢放射性物质
仅限静脉使用
合成结束时300 MBq / mL至1,900 MBq / mL(8.1 mCi / mL至51 mCi / mL)
______上的______:_____ ______mL中的_____MBq(_____mCi)
于_____到期_____:_____
批号。_____
剂量:参见处方信息。
每毫升溶液中最多含2微克的氟洛西吡和0.1 mL脱水醇USP,含0.9%氯化钠注射液USP。将小瓶直立放置在25°C(77°F)的屏蔽容器中;允许在15°C至30°C(59°F至86°F)的范围内移动。
由PETNET Solutions,Inc.在田纳西州诺克斯维尔37932制造,用于Avid Radiopharmaceuticals,这是礼来公司的全资子公司,宾夕法尼亚州费城19104

| 陶维德 氟妥普西F-18注射液 | |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| 贴标机-礼来公司(006421325) |
| 注册人-礼来公司(006421325) |
药物状态
- 可用性 仅处方
- 审批历史 FDA批准2020
美国日本医生

Heather Benjamin MD

Suzanne Reitz MD

Heather Miske DO

Steven Paterno MD

Gregory Aaen MD

村上和成 教授

溝上裕士 医院教授

山内広平

吉井文均 东海大学名誉教授
