获取国外Amyvid药品价格,使用等信息,最快 24 小时回馈
Amyvid
Amyvid
什么是Amyvid?
Amyvid(florbetapir F 18)代表一组称为诊断放射性药物的药物(RAY dee oh far ma SOO tik als)。 Amyvid是一种放射性试剂,可通过PET(正电子发射断层扫描)扫描检测体内特定器官的图像。
Amyvid与PET扫描一起使用以检测大脑中的斑块量。斑块是某些蛋白质和患病神经细胞的积聚,通常在患有阿尔茨海默氏病或其他痴呆症迹象的人的大脑中发现。
Amyvid也可以用于本用药指南中未列出的目的。
重要信息
为确保您可以放心接受Amyvid,请告诉医生您的所有医疗状况。
接受Amyvid后24小时内请勿母乳喂养。如果您在这段时间使用吸奶器,请丢弃收集的所有牛奶。不要喂给宝宝。接受放射性药物(例如Amyvid)可能会增加您患癌症的长期风险。与您的医生讨论您的特定风险。
接收Amyvid之前
为确保您可以放心接受Amyvid,请告诉医生您的所有医疗状况。
接受放射性物质可能会增加您患癌症的长期风险。与您的医生讨论您的特定风险。 FDA怀孕类别C。尚不清楚Amyvid是否会伤害未出生的婴儿。在收到Amyvid之前,请告诉医生您是否怀孕。接受Amyvid后24小时内请勿母乳喂养。如果您在这段时间使用吸奶器,请丢弃收集的所有牛奶。不要喂给宝宝。
Amyvid如何服用?
Amyvid通过静脉注射入静脉。您将在诊所或医院接受注射。通常在放射学检查前30至50分钟内给予。
如果我错过剂量怎么办?
由于Amyvid用作单剂,因此没有每日给药时间表。
如果我服药过量怎么办?
由于Amyvid是由医疗专业人员在医疗环境中提供的,因此服用过量的可能性不大。
我应该避免什么?
关于食物,饮料或活动的任何限制,请遵循医生的指示。
Amyvid副作用
如果您对Amyvid有以下任何过敏反应迹象,请寻求紧急医疗救助:呼吸困难;脸,嘴唇,舌头或喉咙肿胀。
不太严重的Amyvid副作用可能包括:
头痛;
关节或肌肉疼痛;
恶心;要么
感觉累了。
这不是副作用的完整列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响Amyvid?
可能还有其他药物可以与Amyvid相互作用。告诉医生您使用的所有药物。这包括处方药,非处方药,维生素和草药产品。在不告知医生的情况下,请勿开始新药治疗。
版权所有1996-2020 Cerner Multum,Inc.版本:1.01。
注意:本文档包含有关florbetapir F 18的副作用信息。本页列出的某些剂型可能不适用于Amyvid品牌。
对于消费者
适用于florbetapir F 18:静脉内溶液
需要立即就医的副作用
florbetapir F 18(Amyvid中包含的活性成分)及其所需的作用可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用florbetapir F 18时,请立即与您的医生或护士联系,检查是否有以下任何副作用:
罕见
- 模糊的视野
- 头晕
- 头痛
- 紧张
- 敲打耳朵
- 缓慢或快速的心跳
不需要立即就医的副作用
可能会发生florbetapir F 18的某些副作用,这些副作用通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
罕见
- 背疼
- 注射部位出血,刺激或疼痛
- 发冷
- 恐惧
- 感觉冷
- 肌肉或骨骼疼痛
- 恶心
- 颈部疼痛
- 睡眠困难
- 异常疲倦或虚弱
发病率未知
- 口味变化
- 温暖的感觉
- 味觉丧失
- 皮疹,荨麻疹或伤口,瘙痒
- 脸部,脖子,手臂发红,偶尔上胸部发红
对于医疗保健专业人员
适用于florbetapir F 18:静脉内溶液
一般
最常见的副作用是头痛,肌肉骨骼疼痛,血压升高,疲劳,恶心和注射部位反应。 [参考]
心血管的
罕见(0.1%至1%):血压升高,高血压
未报告频率:冲洗[参考]
皮肤科
未报告频率:瘙痒,荨麻疹[参考]
胃肠道
罕见(0.1%至1%):恶心[参考]
肌肉骨骼
罕见(0.1%至1%):肌肉骨骼疼痛,背部疼痛,颈部疼痛[Ref]
神经系统
常见(1%至10%):头痛
罕见(0.1%至1%):头晕
未报告频率:味觉障碍[参考]
精神科
罕见(0.1%至1%):焦虑症,幽闭恐惧症,失眠[Ref]
本地
罕见(0.1%至1%):注射部位出血,注射部位刺激和注射部位疼痛
未报告频率:输液部位皮疹[参考]
其他
罕见(0.1%至1%):疲劳,感到寒冷,发冷[参考]
参考文献
1.“产品信息。Amyvid(florbetapir F 18)。”印第安纳州印第安纳波利斯的礼来公司和礼来公司。
某些副作用可能没有报道。您可以将其报告给FDA。
图像采集准则
在Amyvid静脉注射后30至50分钟开始,应获取10分钟的PET图像。患者应仰卧,头部应位于PET扫描仪视野内的大脑中心,包括小脑。可以采用胶带或其他柔性头枕来减少头部移动。图像重建应包括衰减校正,使得跨轴像素大小在2到3 mm之间。
图像显示和解释
只有成功完成特殊培训计划的读者才能解释Amyvid图像[请参阅警告和注意事项(5.1)] 。制造商使用现场教程或电子过程提供培训。
Amyvid图像解释的目的是提供脑β-淀粉样蛋白神经斑块密度的估计值,而不是进行临床诊断。图像解释独立于患者的临床特征执行,并且依赖于独特图像特征的识别。
影像显示
图像应以横轴方向显示,并可根据需要访问矢状和冠状面。在查看图像时,使用黑白标度包括大脑的所有跨轴切片,并且标度的最大强度设置为所有大脑像素的最大强度。最初定位图像对比度最高的大脑切片(对于Amyvid摄取最高的放射性信号),并适当调整对比度。通过从大脑底部到顶部顺序显示切片来开始图像解释。根据需要定期参考矢状和冠状平面图像显示,以更好地定义放射性吸收并确保显示整个大脑。
影像解析
图像解释是基于放射性信号在大脑中的分布。临床信息不是图像评估的组成部分[请参阅警告和注意事项(5.1)] 。通过将皮质灰质中的放射性与相邻白质中的放射性进行比较,可将图像指定为正或负。该确定仅在大脑皮层中进行;小脑中的信号吸收不会有助于扫描解释(例如,即使皮质灰白色对比度丢失,阳性扫描也可能显示保留的小脑灰白色对比度)。
- 负扫描显示白质比灰质具有更高的放射性,从而产生清晰的灰白色对比度。
- 阳性扫描显示皮质区域减少或丧失了通常明显的灰白色对比度。这些扫描的一个或多个区域的皮质灰质信号增加,导致灰白对比度降低(或不存在)。具体来说,正面扫描将具有以下任一情况:
- 一种)
- 两个或多个大脑区域(每个区域大于单个皮质回),其中灰白色对比度降低或不存在。这是阳性扫描的最常见外观。
要么 - b)
- 灰质放射性很强并且明显超过相邻白质放射性的一个或多个区域。
某些扫描可能由于图像噪声,皮层色带变薄而萎缩或图像模糊而难以解释。对于在PET扫描上不确定灰质的位置或边缘并且可以使用共同注册的计算机断层扫描(CT)图像(如在PET / CT扫描仪上进行研究的情况)的情况下,口译员应该检查CT图像以阐明PET放射性与灰质解剖结构之间的关系。
图1、2和3提供了负扫描和正扫描的示例。图1展示了不同程度的正常灰白色对比度(负)和示例,其中灰白色对比度已丢失(正)。图2显示了负扫描的典型特征,而图3显示了在正扫描的不同大脑区域中灰白色对比度的损失。
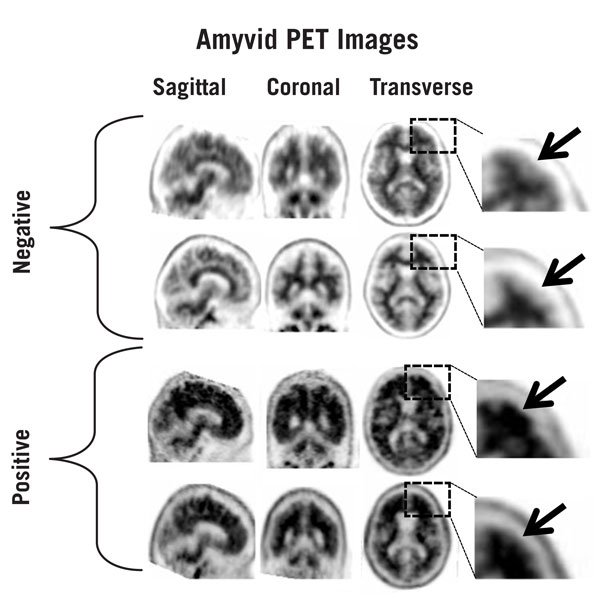
图1:Amyvid负扫描(上两行)和正扫描(下两行)的示例。左至右面板显示矢状,冠状和横向PET图像切片。右侧的最后一个面板显示了框下面的大脑区域的放大图片。上方的两个箭头指向正常保留的灰白色对比度,其皮质放射性小于相邻的白质。底部的两个箭头指示灰白色对比度降低的区域,而皮质放射性增加,这与相邻白质的放射性相当。
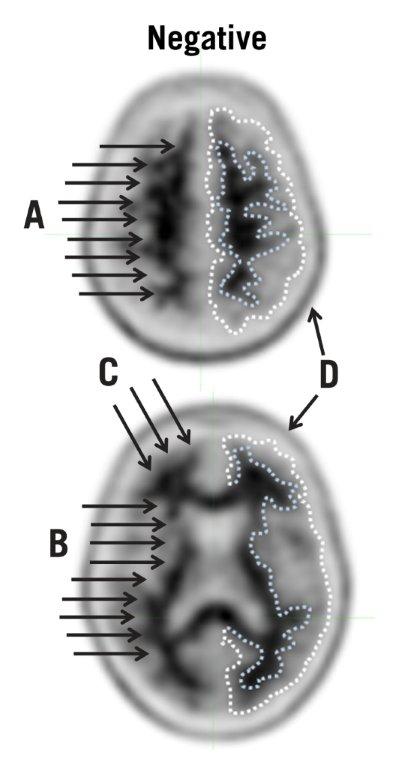 | 图2:典型的负扫描。通过负扫描显示图像,其中上部(顶部)和下部(底部)横切面均显示出良好的灰白色对比度。在每个切片的右侧,虚线已用于说明皮质灰质的边缘(外线)和灰白色边框(内线)。这些虚线突出显示了灰质吸收强度较低和白质吸收强度较高之间的吸收差异。此外,箭头说明了以下几点: |
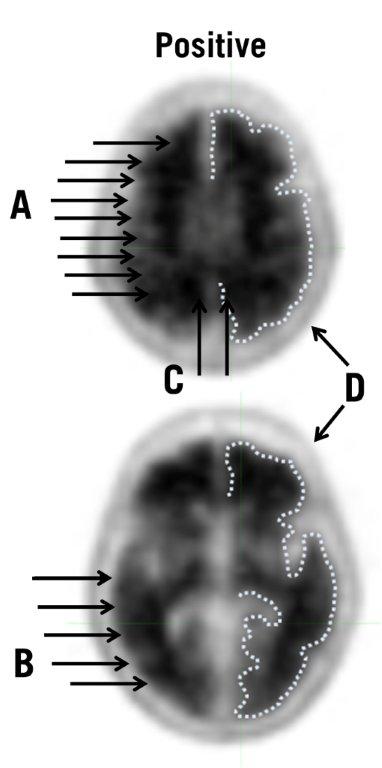 | 图3:典型的正向扫描:来自正向扫描的图像显示了上部(顶部)和下部(底部)横向切片,并且在多个大脑区域中灰白色物质的损失形成了对比。在每个切片的右侧,用虚线表示了皮质灰质的边缘。与图2中否定情况的图像相比,灰质的摄取与白质的摄取更为相似,而灰白质边界更难以辨别。此外,箭头表示以下几点: |
辐射剂量法
表1显示了静脉注射Amyvid对成人的估计辐射吸收剂量。
胃肠 | |
b假定将F 18的吸收剂量(灰色或rads)转换为等效剂量(Sieverts或rem)时的辐射加权因子w r (以前定义为质量因子Q)为1。要获得以rad /上表中的mCi,将以μGy/ MBq为单位的剂量乘以0.0037(例如14μGy/ MBq x 0.0037 = 0.0518 rad / mCi) | |
| 器官/组织 | 平均单位吸收剂量 活性(μGy/ MBq) |
| 肾上腺 | 14 |
| 骨-成骨细胞 | 28 |
| 骨-红骨髓 | 14 |
| 脑 | 10 |
| 乳房 | 6 |
| 胆囊壁 | 143 |
| GI一个-下大肠壁 | 28 |
| GI-小肠 | 66 |
| GI-胃壁 | 12 |
| GI-大肠上部壁 | 74 |
| 心墙 | 13 |
| 肾脏 | 14 |
| 肝 | 64 |
| 肺 | 9 |
| 肌肉 | 9 |
| 卵巢 | 18岁 |
| 胰腺 | 14 |
| 皮肤 | 6 |
| 脾 | 9 |
| 睾丸 | 7 |
| 胸腺 | 7 |
| 甲状腺 | 7 |
| 膀胱膀胱壁 | 27 |
| 子宫 | 16 |
| 全身 | 12 |
| 有效剂量(μSv/ MBq) b | 19 |
成年人的370 MBq(10 mCi)剂量的Amyvid产生的有效剂量为7.0 mSv(19 x 370 = 7030μSv= 7.030 mSv)。使用CT扫描来计算衰减校正以重建Amyvid图像(如在PET / CT成像中所做的那样)会增加辐射暴露。使用螺旋扫描仪进行的诊断性头部CT扫描平均可提供2.2±1.3 mSv的有效剂量(CRCPD出版物E-07-2,2007年)。实际辐射剂量取决于操作员和扫描仪。 Amyvid给药和随后在PET / CT扫描仪上进行扫描的总辐射暴露估计为9 mSv。
Amyvid注射剂的适应症和用法
Amyvid适用于大脑的正电子发射断层扫描(PET)成像,以评估正在评估阿尔茨海默氏病(AD)和其他认知功能下降原因的成年认知障碍患者的β-淀粉样蛋白神经病斑密度。阴性的Amyvid扫描表明没有稀疏的神经斑,并且在图像采集时与AD的神经病理学诊断不一致;阴性扫描结果可降低患者认知障碍归因于AD的可能性。 Amyvid扫描呈阳性表示中度至频繁的淀粉样蛋白神经斑。神经病理学检查表明,AD患者存在这种淀粉样神经病斑,但其他神经系统疾病患者以及认知正常的老年人也可能存在。 Amyvid是其他诊断评估的辅助工具。
使用限制:
- 阳性Amyvid扫描不能确定对AD或其他认知障碍的诊断。
- Amyvid的安全性和有效性尚未确定用于:
- 预测痴呆或其他神经系统疾病的发展;
- 监测对疗法的反应。
Amyvid注射剂量和给药
辐射安全-药物处理
Amyvid是一种放射性药物,应采取适当的安全措施进行处理,以最大程度减少给药过程中的辐射暴露[请参阅警告和注意事项( 5.1 )] 。处理Amyvid时,请使用防水手套和有效的防护罩,包括注射器防护罩。放射性药物(包括Amyvid)仅应由在安全使用和处理放射性物质方面经过特殊培训和经验并具有相应经验和培训资格并已得到相应政府授权机构许可的医师使用或受其控制。放射性药物的使用。
推荐剂量和给药指导
Amyvid的推荐剂量为370 MBq(10 mCi),最大剂量为50μg,以单次静脉推注的方式给药,总体积为10 mL或更少。注射后用0.9%无菌氯化钠进行静脉冲洗。
- 给药前检查放射性药物剂量溶液,如果含有颗粒物质或变色,请勿使用。
- 使用无菌技术和辐射屏蔽来抽取Amyvid溶液。
- 给药前在合适的剂量校准器中测定剂量。
- 通过短的静脉导管(约1.5英寸或更短)注射Amyvid,以最大程度地减少药物吸附到导管上的可能性。 Amyvid剂量的某些部分可能会粘附在更长的导管上。
图像采集准则
在Amyvid静脉注射后30至50分钟开始,应获取10分钟的PET图像。患者应仰卧,头部应位于PET扫描仪视野内的大脑中心,包括小脑。可以采用胶带或其他柔性头枕来减少头部移动。图像重建应包括衰减校正,使得跨轴像素大小在2到3 mm之间。
图像显示和解释
只有成功完成特殊培训计划的读者才能解释Amyvid图像[请参阅警告和注意事项( 5.1 )] 。制造商使用现场教程或电子过程提供培训。
Amyvid图像解释的目的是提供脑β-淀粉样蛋白神经斑块密度的估计值,而不是进行临床诊断。图像解释独立于患者的临床特征执行,并且依赖于独特图像特征的识别。
影像显示
图像应以横轴方向显示,并可根据需要访问矢状和冠状面。在查看图像时,使用黑白标度包括大脑的所有跨轴切片,并且标度的最大强度设置为所有大脑像素的最大强度。最初定位图像对比度最高的大脑切片(对于Amyvid摄取最高的放射性信号),并适当调整对比度。通过从大脑底部到顶部顺序显示切片来开始图像解释。根据需要定期参考矢状和冠状平面图像显示,以更好地定义放射性吸收并确保显示整个大脑。
影像解析
图像解释是基于放射性信号在大脑中的分布。临床信息不是图像评估的组成部分[请参阅警告和注意事项( 5.1 )] 。通过将皮质灰质中的放射性与相邻白质中的放射性进行比较,可将图像指定为正或负。该确定仅在大脑皮层中进行;小脑中的信号吸收不会有助于扫描解释(例如,即使皮质灰白色对比度丢失,阳性扫描也可能显示保留的小脑灰白色对比度)。
- 负扫描显示白质比灰质具有更高的放射性,从而产生清晰的灰白色对比度。
- 阳性扫描显示皮质区域减少或丧失了通常明显的灰白色对比度。这些扫描的一个或多个区域的皮质灰质信号增加,导致灰白对比度降低(或不存在)。具体来说,正面扫描将具有以下任一情况:
- 一种)
- 两个或多个大脑区域(每个区域大于单个皮质回),其中灰白色对比度降低或不存在。这是阳性扫描的最常见外观。
要么 - b)
- 灰质放射性很强并且明显超过相邻白质放射性的一个或多个区域。
某些扫描可能由于图像噪声,皮层色带变薄而萎缩或图像模糊而难以解释。对于在PET扫描上不确定灰质的位置或边缘并且可以使用共同注册的计算机断层扫描(CT)图像(如在PET / CT扫描仪上进行研究的情况)的情况下,口译员应该检查CT图像以阐明PET放射性与灰质解剖结构之间的关系。
图1 , 2 ,和3提供负和正扫描的例子。图1展示了不同程度的正常灰白色对比度(负)和示例,其中灰白色对比度已丢失(正)。图2显示了负扫描的典型特征,而图3显示了在正扫描的不同大脑区域中灰白色对比度的损失。

图1:Amyvid负扫描(上两行)和正扫描(下两行)的示例。左至右面板显示矢状,冠状和横向PET图像切片。右侧的最后一个面板显示了框下面的大脑区域的放大图片。上方的两个箭头指向正常保留的灰白色对比度,其皮质放射性小于相邻的白质。底部的两个箭头指示灰白色对比度降低的区域,而皮质放射性增加,这与相邻白质的放射性相当。
 | 图2:典型的负扫描。通过负扫描显示图像,其中上部(顶部)和下部(底部)横切面均显示出良好的灰白色对比度。在每个切片的右侧,虚线已用于说明皮质灰质的边缘(外线)和灰白色边框(内线)。这些虚线突出显示了灰质吸收强度较低和白质吸收强度较高之间的吸收差异。此外,箭头说明了以下几点: |
 | 图3:典型的正向扫描:来自正向扫描的图像显示了上部(顶部)和下部(底部)横向切片,并且在多个大脑区域中灰白色物质的损失形成了对比。在每个切片的右侧,用虚线表示了皮质灰质的边缘。与图2中否定情况的图像相比,灰质的摄取与白质的摄取更为相似,而灰白质边界更难以辨别。此外,箭头表示以下几点: |
辐射剂量法
表1显示了静脉注射Amyvid对成人的估计辐射吸收剂量。
胃肠 | |
b假定将F 18的吸收剂量(灰色或rads)转换为等效剂量(Sieverts或rem)时的辐射加权因子w r (以前定义为质量因子Q)为1。要获得以rad /上表中的mCi,将以μGy/ MBq为单位的剂量乘以0.0037(例如14μGy/ MBq x 0.0037 = 0.0518 rad / mCi) | |
| 器官/组织 | 平均单位吸收剂量 活性(μGy/ MBq) |
| 肾上腺 | 14 |
| 骨-成骨细胞 | 28 |
| 骨-红骨髓 | 14 |
| 脑 | 10 |
| 乳房 | 6 |
| 胆囊壁 | 143 |
| GI一个-下大肠壁 | 28 |
| GI-小肠 | 66 |
| GI-胃壁 | 12 |
| GI-大肠上部壁 | 74 |
| 心墙 | 13 |
| 肾脏 | 14 |
| 肝 | 64 |
| 肺 | 9 |
| 肌肉 | 9 |
| 卵巢 | 18岁 |
| 胰腺 | 14 |
| 皮肤 | 6 |
| 脾 | 9 |
| 睾丸 | 7 |
| 胸腺 | 7 |
| 甲状腺 | 7 |
| 膀胱膀胱壁 | 27 |
| 子宫 | 16 |
| 全身 | 12 |
| 有效剂量(μSv/ MBq) b | 19 |
成年人的370 MBq(10 mCi)剂量的Amyvid产生的有效剂量为7.0 mSv(19 x 370 = 7030μSv= 7.030 mSv)。使用CT扫描来计算衰减校正以重建Amyvid图像(如在PET / CT成像中所做的那样)会增加辐射暴露。使用螺旋扫描仪进行的诊断性头部CT扫描平均可提供2.2±1.3 mSv的有效剂量(CRCPD出版物E-07-2,2007年)。实际辐射剂量取决于操作员和扫描仪。 Amyvid给药和随后在PET / CT扫描仪上进行扫描的总辐射暴露估计为9 mSv。
剂型和优势
Amyvid(Florbetapir F 18注射液)装在30 mL和50 mL多剂量小瓶中,其中含有澄清无色溶液,合成结束时浓度为500-1900 MBq / mL(13.5-51 mCi / mL)florbetapir F 18( EOS)。
禁忌症
没有。
警告和注意事项
图像误解和其他错误的风险
在图像解释期间,Amyvid估计脑神经斑块密度可能会出现错误[请参见临床研究( 14 )] 。
图像解释应独立于患者的临床信息进行。在评估Amyvid图像时使用临床信息尚未得到评估,可能会导致错误。其他错误可能是由于广泛的脑萎缩限制了Amyvid扫描区分灰色和白色物质的能力,以及使图像变形的运动伪像。
Amyvid扫描结果仅在图像采集时才指示脑神经淀粉样斑块含量,而扫描结果为负并不排除将来脑淀粉样蛋白的发展。
辐射风险
与其他放射性药物类似,Amyvid会增加患者的整体长期累积辐射暴露量。长期累积辐射暴露会增加患癌症的风险。确保安全处理,以保护患者和医护人员免受意外辐射的侵害[见剂量和用法( 2.1 )] 。
不良反应
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此不能将在一种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映在临床实践中观察到的不良反应率。
在临床研究中,有555名患者暴露于Amyvid。 Amyvid在研究中未引起严重的不良反应,并且所报告的不良反应的严重程度主要为轻度至中度。表2显示了研究中多个受试者报告的不良反应。
a包括血压升高和高血压。 | |
b包括术语注射部位出血,注射部位刺激和注射部位疼痛。 | |
c包括感到寒冷和寒冷的术语。 | |
| 不良反应 | N(患者百分比) |
| 头痛 | 10(1.8%) |
| 肌肉骨骼疼痛 | 4(0.7%) |
| 血压升高一 | 4(0.7%) |
| 恶心 | 4(0.7%) |
| 疲劳 | 3(0.5%) |
| 注射部位反应b | 3(0.5%) |
| 焦虑 | 2(0.4%) |
| 背疼 | 2(0.4%) |
| 恐惧症 | 2(0.4%) |
| 头晕 | 2(0.4%) |
| 感冒c | 2(0.4%) |
| 失眠 | 2(0.4%) |
| 颈部疼痛 | 2(0.4%) |
其他不良反应发生的频率较低,包括输液部位皮疹,消化不良,瘙痒,荨麻疹和潮红。
药物相互作用
尚未在患者中进行药效动力学药物-药物相互作用研究来确定伴随药物可能改变Amyvid图像结果的程度(如果有)。
在一项针对一系列认知障碍患者的临床研究中,一些可能患有AD的患者正在接受以下药物:多奈哌齐,加兰他敏,美金刚。服用或未服用这些药物的患者之间的平均皮质标准化摄取值(SUV)比值没有差异。在体外试验中,包括乙酰胆碱酯酶抑制剂多奈哌齐,加兰他敏和他克林在内的所有药物均未改变florbetapir F 18与靶标的结合。
在特定人群中的使用
怀孕
风险摘要
目前尚无有关孕妇使用Amyvid来评估与药物相关的重大先天缺陷,流产或不良母婴后果的风险的数据。 Amyvid尚未进行动物繁殖研究,以评估其对雌性繁殖和胚胎胎儿发育的影响。根据胎儿发育阶段和放射性药物剂量的大小,所有放射性药物(包括Amyvid)都有可能造成胎儿伤害。如果考虑对孕妇使用Amyvid,请根据药物的放射剂量和暴露的孕育时间告知患者潜在的不良妊娠结果。
对于所指出的人群,主要出生缺陷和流产的背景风险尚不清楚。所有怀孕都有不良后果的背景风险。在美国一般人群中,主要的先天性缺陷的背景风险是临床公认的怀孕的2-4%,流产的是15-20%。
哺乳期
风险摘要
没有关于人乳中是否存在Florbetapir F 18注射液,对母乳喂养婴儿的影响或Florbetapir F 18注射液对牛奶生产的影响的数据。尚未在动物中进行泌乳研究。暂时停止母乳喂养可以最大程度地减少Amyvid对母乳喂养婴儿的暴露[请参见临床注意事项]。应当考虑母乳喂养的发育和健康益处,以及母亲对Amyvid的临床需求以及Amyvid或潜在母体状况对母乳喂养孩子的任何潜在不利影响。
临床注意事项
为了减少对母乳喂养婴儿的辐射暴露,建议哺乳期的妇女在服用Amyvid后泵吸并丢弃母乳24小时(对于F 18同位素,放射性衰变的半衰期> 10)。
生殖潜力的男性和女性
在将Amyvid应用于有生殖能力的女性之前,先评估妊娠状况。
儿科用
未将Amyvid指示用于儿科患者。
老人用
在完成Amyvid临床研究的496例患者中,≥65岁的患者为307例(75岁以上的患者为203例)。在这些受试者和较年轻的受试者之间未观察到安全性或有效性的总体差异。
Amyvid注射液说明
Amyvid含有florbetapir F 18(一种与β-淀粉样聚集体结合的分子成像剂),旨在与大脑的PET成像一起使用。化学上,氟倍他吡F 18被描述为(E)-4-(2-(6-(2-(2-(2-(2- [2 [ 18 F]氟乙氧基)乙氧基)乙氧基)吡啶-3-基)乙烯基)-N-甲基苯甲胺。分子量为359,结构式为:

Amyvid是用于静脉注射的无菌,无热原的放射性诊断剂。该澄清无色溶液可立即使用,每毫升包含EOS上的0.1至19微克florbetapir和500-1900 MBq(13.5-51 mCi)florbetapir F 18、4.5 mg抗坏血酸钠USP和0.1 mL脱水醇USP(0.9) %氯化钠注射液USP。溶液的pH在5.5至8.0之间。
物理特性
Amyvid用[ 18 F]氟(F 18)进行放射性标记,该氟通过正电子(β + )发射到O 18而衰减,半衰期为109.77分钟。可用于诊断成像的主要光子是511 keV伽马光子的重合对,这是由发射的正电子与电子的相互作用所致(表3 )。
| 辐射 | 能量水平(keV) | 丰度(%) |
| 正电子 | 249.8 | 96.9 |
| 伽玛 | 511 | 193.5 |
外部辐射
F-18的点源空气比释动能系数a为3.74E -17 Gy m 2 /(Bq s);该系数以前被定义为在1 cm处的5.7 R / hr / mCi的特定伽马射线常数。 F 18伽马射线的铅(Pb)的前半值厚度约为6 mm b 。表4显示了由F-18发射的辐射的相对减少,这是由不同厚度的铅屏蔽引起的。 〜8 cm的Pb的使用将使辐射传输(即,暴露)降低约10,000倍。
一个Eckerman KF和A远藤。 MIRD:《放射性核素数据和衰变方案》,第二版,2008年。 | |
b源自1998年NCRP报告第49号附录C中的数据 | |
| 屏蔽层厚度 铅cm(Pb) | 衰减系数 |
| 0.6 | 0.5 |
| 2 | 0.1 |
| 4 | 0.01 |
| 6 | 0.001 |
| 8 | 0.0001 |
Amyvid注射液-临床药理学
作用机理
Florbetapir F 18与β淀粉样蛋白斑块结合,F 18同位素产生正电子信号,该信号由PET扫描仪检测。在使用含有β-淀粉样蛋白斑块的死后人脑匀浆进行的体外结合研究中,florbetapir的解离常数(K d )为3.7±0.3 nM。使用放射自显影,硫黄素S和传统的银染相关性研究以及单克隆抗体β-淀粉样蛋白特异性相关性研究,在死后人脑切片中证明了florbetapir F 18与β淀粉样蛋白聚集体的结合。在体外研究中未检测到Florbetapir与tau蛋白和一系列神经受体的结合。
药效学
静脉注射后,florbetapir F 18扩散穿过人的血脑屏障,并产生可在整个大脑中检测到的放射性信号。随后,脑灌注降低了脑florbetapir F 18的含量,与缺乏β-淀粉样蛋白聚集体的区域相比,该药物在含有β-淀粉样聚集体的区域的保留差异。阳性扫描对象的大脑中florbetapir F 18的时间活动曲线显示,从给药后零时到30分钟,信号持续不断增加,此后直至注射后至少90分钟保持稳定值。专门保留florbetapir F 18的大脑部分与非特异性保留药物的大脑部分之间信号强度的差异形成了图像解释方法[见剂量和给药方法( 2.4 )] 。
临床研究评估了florbetapir F 18在21例受试者(11例可能患有AD和10例健康志愿者)的大脑中的再测分布,这些受试者接受了2次注射(PET扫描),间隔2至30天。当定性评估(由遮盖图像时间点的阅读器)以及使用预先确定的大脑区域中SUV的自动评估进行定量评估时,显示图像可保持信号分布的可重复性。 10分钟图像获取时间与20分钟图像获取时间的比较显示,所获得的平均皮质与小脑SUV比结果没有差异。
药代动力学
向健康志愿者静脉注射370 MBq(10 mCi)的florbetapir F 18后,该药物在人体中分布,到给药后20分钟时血液中注射的F 18放射性不足5%,并且少于给药后45分钟时2%存在。在30-90分钟成像窗口内循环中残留的F 18主要为极性F 18代谢物的形式。静脉内注射后的全身扫描显示,注射后四分钟内肝脏中放射性蓄积,随后主要通过胆/胃肠道消除放射性,而在膀胱中检测到的放射性低得多。尿液中收集的所有放射性基本上都以florbetapir F 18的极性代谢产物形式存在。
非临床毒理学
致癌,诱变,生育力受损
尚未进行评估Amyvid致癌性或生殖毒性潜力的动物研究。
在体外细菌反向突变试验(Ames试验)中,在暴露于19 F-AV-45(弗洛贝匹尔F 18的非放射性形式)的5株菌株中,有2株观察到了回复菌落数量的增加。用培养的人外周血淋巴细胞进行的体外畸变研究表明,在有或没有激活的情况下,暴露3小时后19 F-AV-45都不会增加具有结构畸变的细胞的百分比;但是,在所有测试浓度下,暴露22小时都会使结构像差在统计学上显着增加。在大鼠微核研究中评估了19 F-AV-45的潜在体内遗传毒性。在该试验中,当连续3天每天两次给药时,在最高可达到的剂量水平372μg/ kg /天, 19 F-AV-45不会增加微核多色红细胞的数量。
临床研究
在三项临床研究中对Amyvid进行了评估,该研究检查了健康成人受试者以及患有一系列认知障碍的受试者的图像,其中包括一些同意参加死后大脑捐赠计划的绝症患者。所有研究均为单臂研究,其中受试者进行Amyvid注射和扫描,然后由多个独立的读者解读图像,这些读者被所有临床信息所掩盖。在双PET-CT扫描仪上进行PET扫描时,图像解释会与CT扫描一起使用。
在研究一中,三位读者使用了一种不用于临床的半定量Amyvid图像解释方法,来解释152名绝症患者的图像,其中35名接受了尸检(初步分析中包括29名)。患者的中位年龄为85岁(55至103岁),其中14位为女性。 18位患者患有痴呆症,9位无认知障碍,2位患有轻度认知障碍(MCI)。主要研究结果是将死前Amyvid图像与死后脑部检查(真相标准)的发现进行比较。半定量测量由五点全脑Amyvid摄取图像评分结果组成,该结果与通过免疫组织化学显微镜法确定的含淀粉样蛋白的全脑百分比的整体评分相比较。死后皮质淀粉样蛋白负担的百分比范围为0%至9%,并且与中位Amyvid得分相关(Spearman的rho = 0.78; p <0.0001,95%CI,0.58至0.89)。
研究二和研究三使用临床适用的二进制图像解释方法(正/负)来评估来自参与早期研究的一系列患者的图像。研究评估了死后淀粉样蛋白神经病斑密度真值标准受试者的表现特征(敏感性和特异性)。此外,还对所有受试者(包括缺乏事后真实标准的受试者)进行了阅读器间和阅读器内图像解释的再现性评估。在进行图像解释之前,所有读者都要接受特殊培训:研究二使用了面对面的辅导类型的培训,研究三使用了基于电子媒体的培训方法。五位训练有素的读者在每个研究中独立地解释图像。两项研究中的脑神经斑块密度均使用一种算法确定,该算法将大脑区域内最高斑块密度的显微测量结果取平均值,以得出神经元对神经斑块密度的整体估计。以与对于区域(表5 )相同的方式对整体神经营养斑密度进行分类(表5 ),其中在具有修饰的Bielschowsky银染组织切片的载玻片上对噬斑进行计数。为了确定体内Amyvid图像结果和验尸后全脑淀粉样蛋白神经斑密度之间的一致性,基于对Amyvid的修改,预先指定Amyvid结果(阴性/阳性)与特定斑块密度得分相对应建立老年痴呆症注册机构(CERAD)标准的联盟,该联盟使用神经噬菌斑计数作为AD的必要病理特征。
神经病理学和实验1997年神经病为J; 56(10):1095。 | ||
| 中性斑块计数 | CERAD成绩 | Amyvid图像结果 |
| <1 | 没有 | 负 |
| 1-5 | 疏 | |
| 6-19 | 中等 | 正 |
| 20+ | 经常 | |
研究2仅检查了进行死前Amyvid扫描和死后脑部检查以确定真实标准的绝症患者的图像。在这59名患者中,其中35名也在研究一中,中位年龄为83岁(47至103岁),女性为一半,大多数为白人(93%)。 29例患有AD临床诊断,13例患有另一种痴呆症,12例无认知障碍史,5例患有MCI。 Amyvid扫描与死亡之间的时间间隔对于46例患者不到一年,而对于13例患者则在1-2年之间。在Amyvid扫描后一年内死亡的患者子集(预先确定的结局)中,使用多数阅读器解释的敏感性为96%(95%CI:80%至100%),特异性为100%(95%) CI:78%到100%)。在59位患者的整个数据集中,使用多数阅读器解释的敏感性为92%(95%CI:78%至98%),特异性为100%(95%CI:80%至100%)。尸检时,全球脑神经斑块密度类别(CERAD评分,如表5所示)为:经常性n = 30;中等n = 9;稀疏n = 5;没有n = 15。表6和7显示了所有患者中的Amyvid性能特征。在Amyvid扫描后一年内死亡的患者子集中(根据组织病理学,n = 46; 28例阳性和18例阴性),正确阅读结果,假阴性和假阳性的中位数(和范围)为44(37至45) ),1(0到7)和1(0到2)用于亲自训练(研究2);电子媒体培训(研究三)分别为43(38至44),3(0至7)和1(0至2)。
| 测试表现 | 亲自培训 (研究二) | 电子媒体培训 (研究三) | |
| 灵敏度 (%) | 中位数 | 92 | 82 |
| 在5位读者中排名 | (69 – 95) | (69 – 92) | |
| 特异性(%) | 中位数 | 95 | 95 |
| 在5位读者中排名 | (90 – 100) | (90 – 95) | |
一个39正和负20基于组织病理学 | |||||||||||
| 读取结果 | 亲自培训 (研究二) | 电子媒体培训 (研究三) | |||||||||
| 读者 | 读者 | ||||||||||
| 1个 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||
| 所有带有尸检的扫描(N = 59 a ) | 正确 | 55 | 56 | 53 | 56 | 45 | 49 | 54 | 46 | 53 | 51 |
| 假阴性 | 3 | 2 | 5 | 3 | 12 | 8 | 3 | 12 | 5 | 7 | |
| 假阳性 | 1个 | 1个 | 1个 | 0 | 2 | 2 | 2 | 1个 | 1个 | 1个 | |
研究三包括来自没有真相标准的受试者的图像(20名健康志愿者,52名轻度认知障碍患者,20名AD患者)以及所有进行尸检的59名患者(与研究二相同)并提供了真相标准。为了评估阅读器内图像的可重复性,将33位患者的重复图像包括在图像总库中。在151名受试者中,中位年龄为76岁(介于47至103岁之间),女性为一半,大多数为白人(93.4%)。上面显示了具有真相标准的患者的表现特征(表6和7 )。表8显示了各组受试者的主要再现性结果。所有图像的阅读器间可重复性分析显示,弗莱斯(Freiss)的总体kappa统计量为0.83(95%CI:0.78至0.88); 95%CI的下限超过了预先指定的成功标准(95%CI下限> 0.58)。读取器内再现性分析显示,在33位重复图像的患者中,每位的两次读数之间,五位阅读者中的一位对所有33位患者完全一致,两位阅读者对一位患者的读数不一致,一位阅读者的读数不一致。两名患者,另一名读者的三名患者的读值不一致。
a显示的是第一列中列出的每个患者亚组的5个阅读器上被解释为阳性的扫描中位数。 | |||||
| 主题组 按照认知和真理标准 (TS,尸检)状态 | 正扫描,n a | 河童 (95%CI) | 阅读器间协议的扫描百分比 | ||
| 5位读者中有3位同意 | 5位读者中有4位同意 | 5位读者中有5位同意 | |||
| 所有具有TS的科目,n = 59 | 33 | 0.75 (0.67,0.83) | 14 | 10 | 76 |
| 没有TS的所有主题,n = 92 | 33 | 0.88 (0.82,0.94) | 2 | 11 | 87 |
| AD,n = 49 (含TS的29个;不含TS的20个) | 38 | 0.67 (0.58,0.76) | 10 | 14 | 76 |
| MCI,n = 57 (5个带TS; 52个不带TS) | 17 | 0.91 (0.83,0.99) | 2 | 7 | 91 |
| 没有TS的认知正常,n = 20 | 4 | 0.83 (0.69,0.97) | 5 | 5 | 90 |
| TS认知正常, n = 12 | 1个 | 0.73 (0.55,0.87) | 0 | 8 | 92 |
| 患有TS的其他(非AD)痴呆症, n = 13 | 7 | 0.52 (0.35,0.69) | 23 | 23 | 54 |
供应/存储和处理方式
供应方式
将Amyvid分装在30 mL或50 mL的小瓶中,分别含有10-30 mL或10-50 mL的无色透明溶液,浓度为500-1900 MBq / mL(13.5-51 mCi / mL)florbetapir F 18在EOS。每个小瓶包含多个剂量,并装在屏蔽容器中,以最大程度地减少外部辐射暴露。
| 30毫升 | NDC 0002-1200-30(IC1200) |
| 50毫升 | NDC 0002-1200-50(IC1200) |
储存和处理
将Amyvid储存在25ºC(77°F);允许在15ºC到30ºC(59°F到86°F)之间进行偏移[请参阅USP控制的室温]。该产品不含防腐剂。将Amyvid存放在原始容器或等效的辐射屏蔽罩内。 Amyvid不得稀释。
经核监管委员会或协议国相关监管机构许可,可将该制剂供个人使用。
病人咨询信息
- 指导患者怀孕或哺乳时通知其医生或医护人员。
- 告知正在母乳喂养的患者在服用药物后要使用替代的婴儿营养源(例如,储存的母乳或婴儿配方奶粉)24小时(F 18同位素的放射性衰变半衰期大于10)或避免使用药物。
由美国印第安纳州印第安纳波利斯的礼来美国有限责任公司销售,美国46285
礼来公司版权所有©2012、2019。版权所有。
AMV-0001-USPI-20191220
包装标签
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
- 审批历史 FDA批准2012年
美国日本医生

Heather Benjamin MD

Heather Miske DO

Bert Hepner DO

Gregory Aaen MD

Kristopher Aalderink MD

村上和成 教授

中山秀章 教授

村田朗

溝上裕士 医院教授
