获取国外lea药品价格,使用等信息,最快 24 小时回馈
lea
什么是Eylea?
Eylea(aflibercept)由人抗体片段制成。它的作用是防止新血管在视网膜(眼内衬的感觉膜)下形成。在患有某种类型眼病的人中,新血管在视网膜下方生长,并在那里渗出血液和体液。这被称为黄斑变性的“湿形式”。
Eylea用于治疗与年龄相关的湿性黄斑变性。它也用于治疗因血管阻塞引起的视网膜肿胀。
Eylea还被用于治疗糖尿病性视网膜病,这是一种糖尿病性眼病,可导致视网膜中积聚液体并引起失明。
重要信息
如果您对阿柏西普过敏,或者眼睛内部有红肿,或者眼睛内部或周围存在任何类型的感染(细菌,真菌,病毒),则不应使用Eylea。如果在治疗期间任何时候眼部疼痛或发红,眼睛周围肿胀或浮肿或突然的视力问题,请立即致电医生。
使用Eylea之前
如果您对阿柏西普过敏,或者如果您有以下情况,则不应使用Eylea:
眼内肿胀;要么
眼睛内部或周围的任何类型的细菌,真菌或病毒感染。
为确保该药对您安全,请告知您的医生是否曾经:
血块或中风;要么
青光眼或其他会增加眼内压力的疾病。
告诉您的医生您是否怀孕或计划在使用Eylea时怀孕。在您第一次服用这种药物之前,请使用有效的节育措施防止怀孕。上次注射后请继续使用节育至少3个月。
除非得到医生的建议,否则在使用Eylea时请勿哺乳。
Eylea如何服用?
眼药水是作为注射剂注入您的眼睛。在给您注射之前,您的医生会使用一种药物使您的眼睛麻木。您将在医生的办公室或其他诊所接受注射。
注射后的短时间内,将定期检查眼睛,以确保注射未引起任何副作用。
通常,每4至12周给予一次Eylea,具体取决于该药物治疗的病情。请非常仔细地遵循医生的剂量说明。
如果我错过剂量怎么办?
如果您错过Eylea注射预约,请致电您的医生以获取指导。
如果我服药过量怎么办?
寻求紧急医疗护理或致电1-800-222-1222,拨打毒药帮助热线。
我应该避免什么?
眼油可能会导致视力模糊。如果您开车或做任何需要能够清晰看到的事情,请小心。
眼药副作用
如果您对Eylea有任何过敏反应,请寻求紧急医疗救助。呼吸困难;眼睛,脸,嘴唇,舌头或喉咙肿胀。
如果您有严重的副作用,请立即致电医生,例如:
眼睛疼痛或发红,眼睛周围肿胀;
突然的视力问题;
看到视线中闪烁的灯光或“漂浮物”,看到灯光周围的光晕;
增加眼睛对光的敏感度;
胸痛;
突然的麻木或虚弱,尤其是在身体的一侧;要么
突然剧烈头痛,精神错乱,言语或平衡问题。
不太严重的Eylea副作用可能包括:
红色或水汪汪的眼睛;
模糊的视野;
眼睑肿胀;要么
注射后轻度眼痛或不适。
这不是副作用的完整列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响Eylea?
您口服或注射的其他药物不太可能对眼睛中使用的Eylea产生影响。但是许多药物可以互相影响。告诉您的医生您使用的所有药物。这包括处方药,非处方药,维生素和草药产品。在不告知医生的情况下,请勿开始新药治疗。
版权所有1996-2020 Cerner Multum,Inc.版本:7.01。
注意:本文档包含有关aflibercept眼药的副作用信息。此页面上列出的某些剂型可能不适用于品牌名称Eylea。
综上所述
较常见的副作用包括:眼内压升高。有关不良影响的完整列表,请参见下文。
对于消费者
适用于aflibercept眼科:眼内溶液
需要立即就医的副作用
除需要的效果外,阿柏西普眼药水(眼药中所含的活性成分)可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用aflibercept眼药时,请立即与您的医生或护士联系,检查是否出现以下任何副作用:
比较普遍;普遍上
- 失明
- 血腥的眼睛
- 模糊的视野
- 眼睛或眼皮发红
- 眼痛
- 看到闪光,光火花或面纱或窗帘
- 在眼前看到浮点
- 视力改变
不常见
- 注射部位出血或疼痛
- 眼睑肿胀
罕见
- 快速的心跳
- 发热
- 头痛
- 荨麻疹,瘙痒,皮疹或皮肤发红
- 嘶哑
- 刺激
- 关节疼痛,僵硬或肿胀
- 眼睛,脸,嘴唇,手或脚肿胀
- 胸闷
- 呼吸困难或吞咽
发病率未知
- 胸部,腹股沟或腿部疼痛,尤其是小腿疼痛
- 严重,突然头痛
- 言语不清
- 突然失去协调
- 手臂或腿突然,严重的虚弱或麻木
不需要立即就医的副作用
可能会发生aflibercept眼药的一些副作用,这些副作用通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
不常见
- 感觉就像眼中的东西
- 水汪汪的大眼睛
对于医疗保健专业人员
适用于aflibercept眼科药物:玻璃体内溶液
一般
较常见的不良反应包括结膜出血,眼痛,白内障,玻璃体脱离,玻璃体漂浮物和眼压升高。 [参考]
眼科
非常常见(10%或更多):结膜出血(28%),眼痛(13%),
常见(1%至10%):白内障,玻璃体漂浮物,角膜糜烂,眼内压升高,结膜充血,眼充血,玻璃体脱离,眼睛异物感,流泪增加,视力模糊,眼内炎症,视网膜色素上皮撕裂,注射部位出血,眼睑水肿,角膜水肿,视网膜变性,白内障,白内障核,白内障囊下,角膜擦伤,眼压升高,玻璃体漂浮物
罕见(0.1%至1%):视网膜脱离,视网膜撕裂,眼内炎注射部位疼痛,外伤性白内障[参考]
本地
常见(1%至10%):注射部位疼痛[参考]
心血管的
玻璃体内使用VEGF抑制剂与潜在的动脉血栓栓塞事件(ATE)风险相关,后者被定义为非致命性中风,非致命性心肌梗塞或血管性死亡(包括未知原因的死亡)。在与年龄相关的湿性黄斑变性(AMD)研究中,接受这种药物或兰尼单抗治疗的患者分别有1.8%(n = 32/1824)和1.5%(n = 9/595)出现在前52周内到96周分别为3.3%和3.2%。在糖尿病性黄斑水肿(DME)研究中,到52周为止,ATEs发生率分别为3.3%(n = 19/578)和2.8%(n = 8/287),以及6.4%(n = 37/578)和在接受第2周不同剂量给药方案或黄斑激光光凝治疗的患者中,到第100周时为4.2%(n = 12/287)(在最初的24周之后,所有患者都可以接受药物或激光治疗)。在视网膜静脉阻塞(RVO)研究的前6个月中,尚无ATE的报道。 [参考]
常见(1%至10%):动脉血栓栓塞事件[参考]
过敏症
罕见(0.1%至1%):过敏
参考文献
1. Cerner Multum,Inc.“英国产品特性摘要”。 00
2. Cerner Multum,Inc.“澳大利亚产品信息”。 00
3.“产品信息。Eylea(眼药用阿非贝普)。” Regeneron Pharmaceuticals Inc,纽约州塔里敦。
某些副作用可能没有报道。您可以将其报告给FDA。
2.2新生血管(湿)年龄相关性黄斑变性(AMD)
对于EYLEA的推荐剂量为2mg(0.05 mL或50微升)通过玻璃体内注射,每4周(约每28天,每月)的前12周(3个月)施用时,接着用2毫克(0.05毫升)中经由每8周(2个月)一次玻璃体内注射。尽管EYLEA每4周(大约每25天,每月一次)的剂量为2 mg,但大多数情况下,与每8周相比,每4周一次EYLEA的剂量在大多数患者中并未显示出其他疗效[参见临床研究(14.1) ] 。有些患者可能在前12周(3个月)后每4周(每月)服药。尽管效果不如建议的每8周一次给药方案有效,但也可以在有效治疗一年后每12周一次用一剂药物治疗患者。应定期评估患者。
视网膜静脉阻塞(RVO)后的黄斑水肿
对于EYLEA的推荐剂量为2mg(0.05 mL或50微升)通过玻璃体内注射给药一次,每4周(约每25天,每月)[见临床研究(14.2),(14.3)]。
2.4糖尿病性黄斑水肿(DME)
对于EYLEA的推荐剂量为2mg(0.05 mL或50微升)通过玻璃体内注射,每4周(约每28天,每月)用于第一5次注射施用,接着用2毫克(0.05毫升)通过玻璃体内注射一次,每8周(2个月)。虽然EYLEA每4周(大约每25天,每月)可能频繁地以2 mg的剂量给药,但是与每8周相比,每4周一次EYLEA的给药在大多数患者中并未显示出额外的疗效[参见临床研究(14.4) ] 。在开始的20周(5个月)后,有些患者可能需要每4周(每月)服药。
2.5糖尿病性视网膜病变(DR)
对于EYLEA的推荐剂量为2mg(0.05 mL或50微升)通过玻璃体内注射,每4周(约每28天,每月)用于第一5次注射施用,接着用2毫克(0.05毫升)通过玻璃体内注射一次,每8周(2个月)。尽管EYLEA每4周(大约每25天,每月)的剂量为2 mg,但大多数情况下,与每8周相比,每4周一次EYLEA的剂量在大多数患者中并未显示出额外的疗效[参见临床研究(14.5) ] 。在开始的20周(5个月)后,有些患者可能需要每4周(每月)服药。
给药准备-预填充注射器
预填充EYLEA玻璃注射器是无菌的,且仅用于单次使用。使用前应目视检查。如果可见颗粒,混浊或变色,或包装已打开或损坏,请勿使用。
在玻璃体内注射应与30号来执行×半英寸的注射针(未提供)。
预填充式注射器说明-图1:

使用无菌技术来进行下面的步骤:
1。准备
当准备管理EYLEA,打开纸箱,取出消毒的泡罩包装。小心地揭开无菌泡罩包装,以确保其内容物无菌。将注射器保持在无菌托盘中,直到准备好进行组装为止。
2。取出注射器
使用无菌技术,从消毒的泡罩包装中取出注射器。
3。扭力注射器盖
由一只手握住注射器和用拇指和另一只手的食指的注射器帽拧掉注射器盖(见图2)。
注意:为了避免损害产品的无菌性,不拉回到活塞。
图2:

4。连接针
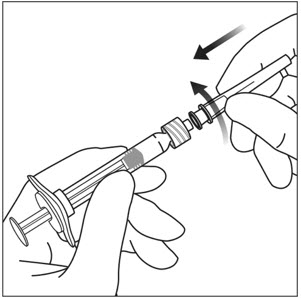
使用无菌技术,牢固地拧30号×½英寸的注射针到鲁尔锁注射器尖端(参见图3)。
图3:

注:当准备管理EYLEA,从针取下塑料针罩。
5。拆卸空气泡
保持与朝上针注射器,检查是否有气泡的注射器。如果有气泡,请用手指轻轻敲打注射器,直到气泡上升到顶部(见图4)。
图4:

6。排空并设定剂量
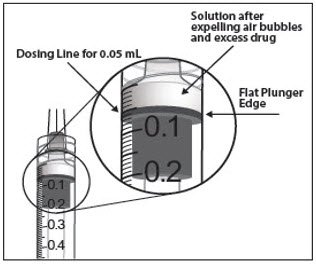
为了消除所有气泡和排出过量的药物,慢慢压下柱塞杆以对准柱塞圆顶边缘(参见图5a)与上针筒(相当于50微升)的黑线的给药(参见图5b)。
| 图5a: | 图5b: |
|
|
7。预装的注射器仅供一次性使用。注射后,任何未使用的产品必须丢弃。
准备给药-小瓶
使用前应目测检查EYLEA。如果看到颗粒,混浊或变色,则不得使用小瓶。
玻璃瓶是一次性使用。
使用无菌技术,开展以下准备步骤:
准备玻璃体腔注射单次使用下列医疗设备:
- 有5微米无菌过滤器针(19号×1.5英寸)的
- 1mL的无菌鲁尔锁注射器(有标记来测量0.05毫升)
- 无菌注射针(30号×½英寸)
- 从小瓶上取下塑料保护盖(请参见图6)。
图6: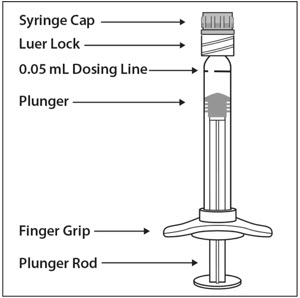
- 用酒精布清洁小瓶顶部(请参见图7)。
图7: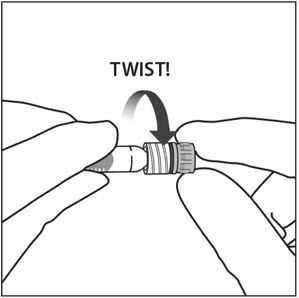
- 取出19号×1.5英寸,5微米,过滤器和针从包装中1毫升注射器。通过将过滤器针拧到鲁尔锁注射器尖端上,将其连接到注射器上(参见图8)。
图8:
- 将过滤针推入样品瓶塞的中心,直到将过滤针完全插入样品瓶中,并且尖端接触样品瓶的底部或底部边缘。
- 使用无菌技术将所有EYLEA小瓶内容物抽入注射器中,将小瓶保持直立位置,略微倾斜以便完全抽出。为了防止引入空气,请确保将滤针的斜角浸入液体中。退出过程中继续倾斜样品瓶,使过滤针的斜角浸入液体中(请参见图9a和图9b)。
图9a: 图9b: 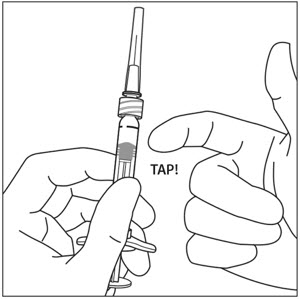
- 排空样品瓶时,请确保将柱塞杆充分拉回,以完全排空过滤针。
- 从注射器上取下过滤针,并正确处理过滤针。注意:滤针不可用于玻璃体内注射。
- 从包装中取出的30号×½英寸的注射针和注射针牢固地扭转到鲁尔锁注射器尖端的注射针连接到注射器(参见图10)。
图10:
- 准备使用EYLEA时,请从针头上取下塑料针头护罩。
- 握住注射器,使针头朝上,检查注射器是否有气泡。如果有气泡,请用手指轻轻敲打注射器,直到气泡上升到顶部(见图11)。
图11: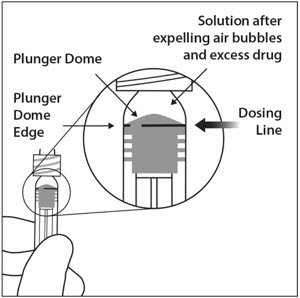
- 为了消除所有气泡并排出多余的药物,请缓慢按下柱塞,使柱塞尖端与注射器上标记0.05 mL的直线对齐(请参见图12a和图12b)。
图12a: 图12b: 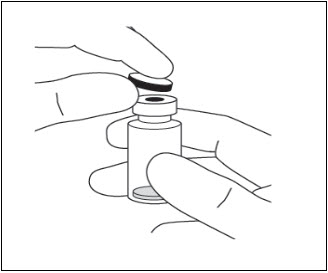
注射程序
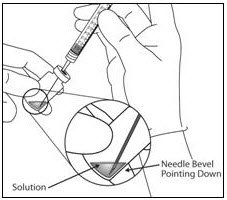
玻璃体内注射程序应在受控的无菌条件下进行,包括手术手消毒和使用无菌手套,无菌盖布和无菌眼睑窥器(或等效物)。注射前应给予足够的麻醉和局部广谱杀菌剂。
玻璃体内注射后,应立即监测患者眼内压的升高。适当的监视可能包括检查视神经乳头的灌注或眼压计。如果需要,应使用无菌穿刺针。
玻璃体内注射后,应指导患者立即报告任何暗示眼内炎或视网膜脱离的症状(例如眼痛,眼睛发红,畏光,视力模糊)[请参阅患者咨询信息(17) ]。
每个无菌,预填充的注射器或小瓶只能用于治疗一只眼睛。如果对侧眼需要治疗,则应使用新的预先填充的无菌注射器或小瓶,并且在将EYLEA应用于另一只眼睛之前,应更换无菌区域,注射器,手套,布,眼睑窥器,过滤器和注射针头。 。
注射后,任何未使用的产品必须丢弃。
Eylea的适应症和用法
Eylea适用于以下方面的治疗:
新血管性(湿性)年龄相关性黄斑变性(AMD)
视网膜静脉阻塞(RVO)后的黄斑水肿
糖尿病性黄斑水肿(DME)
1.4糖尿病视网膜病变(DR)
Eylea剂量和给药
重要注射说明
用于眼内玻璃体内注射。 Eylea只能由合格的医生进行管理。
预装注射器:需要使用30号×½英寸无菌注射针,但未提供。
样品瓶:需要5微米无菌过滤针(19号×1½英寸),1 mL鲁尔锁注射器和30号×1/2英寸无菌注射针。
Eylea的包装如下:
- 预装注射器
- 带注射组件的样品瓶套件(过滤针,注射器,注射针)
[请参阅供应/存储和处理方式(16) ] 。
2.2新生血管(湿性)年龄相关性黄斑变性(AMD)
对于Eylea的推荐剂量是在前12周(3个月)每4周(大约每28天,每月一次)通过玻璃体内注射给药2 mg(0.05 mL或50微升),然后通过玻璃体内注射2 mg(0.05 mL)每8周(2个月)注射一次。尽管Eylea每4周(大约每25天,每月一次)的剂量为2 mg,但与每8周相比,每4周一次Eylea的大多数患者并未显示出额外的疗效[参见临床研究(14.1) ] 。有些患者可能在前12周(3个月)后每4周(每月)服药。尽管效果不如建议的每8周一次给药方案有效,但也可以在有效治疗一年后每12周一次用一剂药物治疗患者。应定期评估患者。
视网膜静脉阻塞(RVO)后的黄斑水肿
Eylea的建议剂量为每4周一次(大约每25天,每月一次)玻璃体内注射2 mg(0.05 mL或50微升)[参见临床研究(14.2) , (14.3) ]。
2.4糖尿病黄斑水肿(DME)
对于Eylea的推荐剂量是:前5次注射每4周(大约每28天,每月一次)玻璃体内注射2 mg(0.05 mL或50微升),然后每8周一次玻璃体内注射2 mg(0.05 mL)周(2个月)。尽管Eylea每4周(大约每25天,每月一次)的剂量为2 mg,但与每8周相比,每4周一次Eylea的大多数患者并未显示出额外的疗效[参见临床研究(14.4) ] 。在开始的20周(5个月)后,有些患者可能需要每4周(每月)服药。
2.5糖尿病性视网膜病(DR)
对于Eylea的推荐剂量是:前5次注射每4周(大约每28天,每月一次)玻璃体内注射2 mg(0.05 mL或50微升),然后每8周一次玻璃体内注射2 mg(0.05 mL)周(2个月)。尽管Eylea每4周(大约每25天,每月一次)的剂量为2 mg,但与每8周相比,每4周一次Eylea的大多数患者并未表现出更多的疗效[参见临床研究(14.5) ] 。在开始的20周(5个月)后,有些患者可能需要每4周(每月)服药。
给药准备-预填充注射器
Eylea预装玻璃注射器是无菌的,仅供一次性使用。使用前应目视检查。如果可见颗粒,混浊或变色,或包装已打开或损坏,请勿使用。
玻璃体内注射应使用30号×½英寸注射针(未提供)进行。
预填充注射器说明–图1:

使用无菌技术执行以下步骤:
1.准备
准备使用Eylea时,请打开纸箱并取出灭菌的泡罩包装。小心地揭开无菌泡罩包装,以确保其内容物无菌。将注射器保持在无菌托盘中,直到准备好进行组装为止。
2.卸下注射器
使用无菌技术,从无菌泡罩包装中取出注射器。
3.拧紧注射器盖
由一只手握住注射器和用拇指和另一只手的食指的注射器帽拧掉注射器帽(参见图2 )。
注意:为避免损害产品的无菌性,请勿向后拉柱塞。
图2:

4.接针
使用无菌技术,将30号×½英寸的注射针牢固地拧到Luer锁注射器针尖上(参见图3 )。
图3:

注意:准备使用Eylea时,请从针头上取下塑料针头护罩。
5.拆除气泡
握住注射器,使针头朝上,检查注射器是否有气泡。如果有气泡,请用手指轻轻敲打注射器,直到气泡升至顶部(参见图4 )。
图4:

6.排空并设定剂量
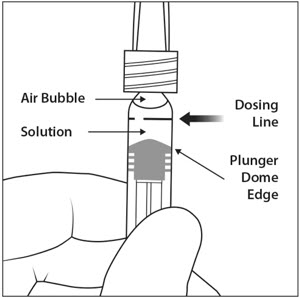
为了消除所有气泡并排出多余的药物,请缓慢按下柱塞杆,以使柱塞圆顶边缘(参见图5a )与注射器上的黑色剂量线(相当于50微升)对齐(参见图5b )。
| 图5a: | 图5b: |
|
|
7.预装的注射器仅供一次性使用。注射后,任何未使用的产品必须丢弃。
准备给药-小瓶
给药前应目视检查眼目。如果看到颗粒,混浊或变色,则不得使用小瓶。
玻璃小瓶仅供一次性使用。
使用无菌技术执行以下准备步骤:
准备使用以下一次性医疗器械进行玻璃体内注射:
- 5微米无菌过滤针(19号×1½英寸)
- 1 mL无菌Luer Lock注射器(标有0.05 mL标记)
- 无菌注射针(30英寸×½英寸)
- 从小瓶上取下塑料保护盖(请参见图6 )。
图6:
- 用酒精布清洁小瓶顶部(请参见图7 )。
图7:
- 从包装中取出19英寸×1.5英寸,5微米过滤嘴和1毫升注射器。将过滤器针拧到Luer锁定注射器针头上,将其连接到注射器上(请参见图8 )。
图8:

- 将过滤针推入样品瓶塞的中心,直到将过滤针完全插入样品瓶中,并且尖端接触样品瓶的底部或底部边缘。
- 使用无菌技术将所有Eylea小瓶内容物抽入注射器中,将小瓶保持直立位置,略微倾斜以便完全抽出。为了防止引入空气,请确保将滤针的斜角浸入液体中。抽出过程中继续倾斜样品瓶,使过滤针的斜角浸入液体中(请参见图9a和图9b )。
图9a: 图9b: 

- 排空样品瓶时,请确保将柱塞杆充分拉回,以完全排空过滤针。
- 从注射器上取下过滤针,并正确处理过滤针。注意:滤针不可用于玻璃体内注射。
- 从包装中取出30英寸×½英寸的注射针,然后将注射针牢固地拧到Luer Lock注射器尖端上,将注射针连接到注射器上(请参见图10 )。
图10:

- 准备使用Eylea时,请从针头上取下塑料针头护罩。
- 握住注射器,使针头朝上,检查注射器是否有气泡。如果有气泡,请用手指轻轻敲打注射器,直到气泡上升到顶部(参见图11 )。
图11:
- 为消除所有气泡并排出多余的药物,请缓慢按下柱塞,使柱塞尖端与注射器上标记0.05 mL的直线对齐(请参见图12a和图12b )。
图12a: 图12b: 

注射程序
玻璃体内注射程序应在受控的无菌条件下进行,包括手术手消毒和使用无菌手套,无菌盖布和无菌眼睑窥器(或等效物)。注射前应给予足够的麻醉和局部广谱杀菌剂。
玻璃体内注射后,应立即监测患者眼内压的升高。适当的监视可能包括检查视神经乳头的灌注或眼压计。如果需要,应使用无菌穿刺针。
玻璃体内注射后,应指导患者立即报告任何暗示眼内炎或视网膜脱离的症状(例如眼痛,眼睛发红,畏光,视力模糊)[请参阅患者咨询信息(17) ]。
每个无菌,预填充的注射器或小瓶只能用于治疗一只眼睛。如果对侧眼需要治疗,则应使用新的预先填充的无菌注射器或小瓶,在将Eylea应用于另一只眼睛之前,应更换无菌区域,注射器,手套,窗帘,眼睑窥器,过滤器和注射针头。 。
注射后,任何未使用的产品必须丢弃。
剂型和优势
Eylea是一种澄清,无色至浅黄色的溶液,可用:
- 注射:在单剂量预装玻璃注射器中2 mg / 0.05 mL
- 注射剂:单剂量玻璃小瓶中2 mg / 0.05 mL
禁忌症
眼或眼周感染
眼部或眼周感染的患者禁用Eylea。
活动性眼内炎症
Eylea是活动性眼内炎患者的禁忌症。
过敏症
Eylea是已知对aflibercept或Eylea中的任何赋形剂过敏的患者的禁忌症。过敏反应可能表现为皮疹,瘙痒,荨麻疹,严重的过敏/类过敏反应或严重的眼内炎症。
警告和注意事项
眼内炎和视网膜脱离
玻璃体腔内注射,包括与Eylea一起,已与眼内炎和视网膜脱离相关[见不良反应(6.1) ]。施用Eylea时必须始终使用正确的无菌注射技术。应指导患者立即报告任何暗示眼内炎或视网膜脱离的症状,并应适当治疗[见剂量和用法(2.8)和患者咨询信息(17) ]。
眼压升高
在玻璃体内注射后60分钟内,包括使用Eylea时,眼内压急剧上升[见不良反应(6.1) ]。在使用血管内皮生长因子(VEGF)抑制剂反复玻璃体内给药后,眼内压也持续升高。眼内压和视神经乳头的灌注应得到适当监测和控制[见剂量和用法(2.8) ]。
血栓栓塞事件
玻璃体内使用VEGF抑制剂(包括Eylea)后,存在潜在的动脉血栓栓塞事件(ATE)风险。 ATE定义为非致命性中风,非致命性心肌梗塞或血管性死亡(包括原因不明的死亡)。在第一年的湿性AMD研究中,报告的血栓栓塞事件发生率在接受Eylea治疗的患者合并组中为1.8%(1824年中的32个),而接受兰尼单抗治疗的患者为1.5%(595个中的9个);到96周为止,Eylea组的发生率为3.3%(1824年中为60),而兰尼单抗组为3.2%(595中为19)。从基线到第52周,DME研究的发生率在接受Eylea治疗的患者合并组中为3.3%(578名中的19名),而对照组为2.8%(287名中的8名)。从基线到第100周,接受Eylea治疗的患者合并组的发生率为6.4%(578名患者中的37名),而对照组为4.2%(287名患者中的12名)。在RVO研究的前六个月中,没有接受过Eylea治疗的患者发生血栓栓塞事件的报道。
不良反应
标签中其他地方描述了以下潜在的严重不良反应:
- 超敏反应[见禁忌症(4.3) ]
- 眼内炎和视网膜脱离[请参阅警告和注意事项(5.1) ]
- 眼内压升高[参见警告和注意事项(5.2) ]
- 血栓栓塞事件[请参阅警告和注意事项(5.3) ]
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与在相同或另一种药物的其他临床试验中观察到的不良反应率进行比较,并且可能无法反映出在实践中观察到的不良反应率。
在八项三期研究中,总共2980例接受Eylea治疗的患者构成了安全性人群。在这些患者中,有2379例患者接受了2 mg的推荐剂量治疗。在玻璃体内注射Eylea的<0.1%的患者中,发生了与注射程序相关的严重不良反应,包括眼内炎和视网膜脱离。接受Eylea治疗的患者中最常见的不良反应(≥5%)为结膜出血,眼痛,白内障,玻璃体脱离,玻璃体漂浮物和眼压升高。
新血管性(湿性)年龄相关性黄斑变性(AMD)
下述数据反映了两项24个月的双重掩盖对照临床研究(VIEW1和VIEW2)中1824例湿性AMD患者(包括1223例2 mg剂量的患者)接受Eylea暴露24个月(第一年为积极对照) )[参见临床研究(14.1) ]。
Eylea组在一项为期52周的双掩蔽2期研究中观察到的安全性数据与这些结果一致。
| 不良反应 | 基线至第52周 | 第96周的基准 | ||
|---|---|---|---|---|
| lea (N = 1824) | 主动控制(ranibizumab) (N = 595) | lea (N = 1824) | 对照(ranibizumab) (N = 595) | |
| 结膜出血 | 25% | 28% | 27% | 30% |
| 眼痛 | 9% | 9% | 10% | 10% |
| 白内障 | 7% | 7% | 13% | 10% |
| 玻璃体脱离 | 6% | 6% | 8% | 8% |
| 玻璃漂浮物 | 6% | 7% | 8% | 10% |
| 眼内压升高 | 5% | 7% | 7% | 11% |
| 眼充血 | 4% | 8% | 5% | 10% |
| 角膜上皮缺损 | 4% | 5% | 5% | 6% |
| 视网膜色素上皮的脱离 | 3% | 3% | 5% | 5% |
| 注射部位疼痛 | 3% | 3% | 3% | 4% |
| 眼睛异物感 | 3% | 4% | 4% | 4% |
| 流泪增加 | 3% | 1% | 4% | 2% |
| 视力模糊 | 2% | 2% | 4% | 3% |
| 眼内炎症 | 2% | 3% | 3% | 4% |
| 视网膜色素上皮撕裂 | 2% | 1% | 2% | 2% |
| 注射部位出血 | 1% | 2% | 2% | 2% |
| 眼睑浮肿 | 1% | 2% | 2% | 3% |
| 角膜水肿 | 1% | 1% | 1% | 1% |
| 视网膜脱离 | <1% | <1% | 1% | 1% |
在接受Eylea治疗的患者中,不到1%报道的不太常见的严重不良反应为超敏反应,视网膜撕裂和眼内炎。
视网膜静脉阻塞(RVO)后的黄斑水肿
下述数据反映了2项临床研究(COPERNICUS和GALILEO)中218例视网膜中央静脉闭塞(CRVO)后,每月2 mg剂量的Eylea暴露6个月,一次临床中91例视网膜分支静脉闭塞(BRVO)之后的暴露研究(VIBRANT)[参见临床研究(14.2) , (14.3) ]。
| 不良反应 | CRVO | BRVO | ||
|---|---|---|---|---|
| lea (N = 218) | 控制 (N = 142) | lea (N = 91) | 控制 (N = 92) | |
| 眼痛 | 13% | 5% | 4% | 5% |
| 结膜出血 | 12% | 11% | 20% | 4% |
| 眼内压升高 | 8% | 6% | 2% | 0% |
| 角膜上皮缺损 | 5% | 4% | 2% | 0% |
| 玻璃漂浮物 | 5% | 1% | 1% | 0% |
| 眼充血 | 5% | 3% | 2% | 2% |
| 眼睛异物感 | 3% | 5% | 3% | 0% |
| 玻璃体脱离 | 3% | 4% | 2% | 0% |
| 流泪增加 | 3% | 4% | 3% | 0% |
| 注射部位疼痛 | 3% | 1% | 1% | 0% |
| 视力模糊 | 1% | <1% | 1% | 1% |
| 眼内炎症 | 1% | 1% | 0% | 0% |
| 白内障 | <1% | 1% | 5% | 0% |
| 眼睑浮肿 | <1% | 1% | 1% | 0% |
在CRVO研究中,少于1%的接受Eylea治疗的患者报告的较少见的不良反应是角膜浮肿,视网膜撕裂,超敏反应和眼内炎。
糖尿病性黄斑水肿(DME)和糖尿病性视网膜病变(DR)
下述数据反映了从基线到第52周以及从基线到第100周的2项双重掩盖的对照临床研究(VIVID和VISTA)中,接受2mg剂量DME治疗的578例DME患者的Eylea暴露[参见临床研究( 14.4) 。
| 不良反应 | 基线至第52周 | 第100周的基准 | ||
|---|---|---|---|---|
| lea (N = 578) | 控制 (N = 287) | lea (N = 578) | 控制 (N = 287) | |
| 结膜出血 | 28% | 17% | 31% | 21% |
| 眼痛 | 9% | 6% | 11% | 9% |
| 白内障 | 8% | 9% | 19% | 17% |
| 玻璃漂浮物 | 6% | 3% | 8% | 6% |
| 角膜上皮缺损 | 5% | 3% | 7% | 5% |
| 眼内压升高 | 5% | 3% | 9% | 5% |
| 眼充血 | 5% | 6% | 5% | 6% |
| 玻璃体脱离 | 3% | 3% | 8% | 6% |
| 眼睛异物感 | 3% | 3% | 3% | 3% |
| 流泪增加 | 3% | 2% | 4% | 2% |
| 视力模糊 | 2% | 2% | 3% | 4% |
| 眼内炎症 | 2% | <1% | 3% | 1% |
| 注射部位疼痛 | 2% | <1% | 2% | <1% |
| 眼睑浮肿 | <1% | 1% | 2% | 1% |
在接受Eylea治疗的患者中,<1%的不良反应较不常见,包括超敏反应,视网膜脱离,视网膜撕裂,角膜浮肿和注射部位出血。
在PANORAMA试验中至第52周为止,在269例非增殖性糖尿病性视网膜病(NPDR)患者中观察到的安全性数据与在VIVID和VISTA 3期试验中观察到的安全性数据一致(请参见上表3 )。
免疫原性
与所有治疗性蛋白质一样,用Eylea治疗的患者也可能产生免疫反应。在血清样品中评估了Eylea的免疫原性。免疫原性数据反映了在免疫测定中测试结果被认为对Eylea抗体呈阳性的患者百分比。免疫应答的检测高度依赖于所用测定的敏感性和特异性,样品处理,样品收集时间,伴随用药和潜在疾病。由于这些原因,将抗Eylea抗体的发生率与针对其他产品的抗体的发生率进行比较可能会产生误导。
在潮湿的AMD,RVO和DME研究中,治疗组对Eylea的免疫反应发生率约为1%至3%。用Eylea给药24-100周后,在相似百分比的患者中检测到针对Eylea的抗体。有或没有免疫反应的患者在疗效或安全性方面没有差异。
在特定人群中的使用
怀孕
风险摘要
Eylea尚未在孕妇中进行充分且对照良好的研究。阿柏西普对兔子产生不利的胚胎胎儿影响,包括外部,内脏和骨骼畸形。未鉴定胎儿未观察到的不良反应水平(NOAEL)。在显示出可产生不利胚胎胎儿影响的最低剂量下,全身性暴露(基于游离aflibercept的AUC)约比在玻璃体腔内以推荐的临床剂量单次治疗后在人体中观察到的AUC值高6倍[请参见动物数据]。
动物繁殖研究并不总是能预测人类的反应,尚不清楚当将Eylea应用于孕妇时是否会造成胎儿伤害。基于aflibercept的抗VEGF作用机制[参见临床药理学(12.1) ],用Eylea治疗可能会对人类胚胎胎儿发育构成风险。只有在潜在益处证明对胎儿有潜在风险的情况下,才应在怀孕期间使用Eylea。
所有怀孕都有出生缺陷,流产或其他不良后果的背景风险。对于所指出的人群,主要出生缺陷和流产的背景风险尚不清楚。在美国普通人群中,在临床公认的怀孕中,主要先天缺陷和流产的估计背景风险分别为2-4%和15-20%。
数据
动物资料
在两项胚胎发育研究中,当在器官形成过程中每三天以≥3 mg / kg的剂量向怀孕的兔子给药,或在器官发生过程中以皮下剂量≥0.1mg / kg的每六天给药一次时,阿柏西普会产生不利的胚胎胎儿效应。
不利的胚胎胎儿影响包括植入后损失和胎儿畸形的发生率增加,包括阿纳萨卡,脐疝,diaphragm肌疝,胃痉挛,left裂,外rod,肠道闭锁,脊柱裂,脑脊髓膜膨出,心脏和主要血管缺损以及骨骼畸形(胸骨和肋骨;多椎骨弓和肋骨;骨化不完全)。在这些研究中,孕妇未观察到的不良反应水平(NOAEL)为每公斤3毫克。在兔中评估的所有剂量下,阿柏西普都会产生胎儿畸形,并且未鉴定出胎儿NOAEL。在显示出对兔子产生不利的胎儿毒性的最低剂量下(0.1 mg / kg),单次玻璃体内注射2 mg后,游离阿柏西普的全身暴露量(AUC)约为人体中全身暴露量(AUC)的6倍。
哺乳期
风险摘要
没有关于人乳中存在阿柏西普,药物对母乳喂养婴儿的影响或药物对乳汁产生/排泄的影响的信息。由于许多药物会从人乳中排出,并且由于存在吸收和损害婴儿生长发育的潜力,因此不建议在母乳喂养期间使用Eylea。
应当考虑母乳喂养的发育和健康益处,以及母亲对Eylea的临床需求以及Eylea对母乳喂养的孩子的任何潜在不利影响。
生殖潜力的男性和女性
避孕
建议具有生殖潜能的女性在初次给药之前,治疗期间以及最后一次玻璃体内注射艾叶莉之后至少3个月内使用有效的避孕方法。
不孕症
没有关于Eylea对人类生育力影响的数据。当以2 mg的玻璃体内剂量通过静脉注射给药时,Aflibercept对食蟹猴的雌性和雄性生殖系统产生不利影响,其剂量约为全身观察水平的1500倍。未确定没有观察到的不良反应水平(NOAEL)。在停止治疗后的20周内,这些发现是可逆的[见非临床毒理学(13.1) ]。
儿科用
Eylea在儿科患者中的安全性和有效性尚未确定。
老人用
在临床研究中,约76%(2049/2701)的患者接受Eylea治疗≥65岁,约46%(1250/2701)的患者≥75岁。在这些研究中,随着年龄的增长,在功效或安全性方面均未见明显差异。
Eylea说明
Aflibercept是一种重组融合蛋白,由与人IgG1 Fc部分融合的人VEGF受体1和2胞外域组成,配制成等渗溶液用于玻璃体内给药。阿柏西普是一种二聚体糖蛋白,蛋白质分子量为97千道尔顿(kDa),并含有糖基化,占总分子量的15%,因此总分子量为115 kDa。阿柏西普在重组中国仓鼠卵巢(CHO)细胞中产生。
Eylea(aflibercept)注射剂是无菌,透明,无色至浅黄色溶液。 Eylea是不含防腐剂的无菌水溶液,可在单剂量预填充玻璃注射器或单剂量玻璃小瓶中进行玻璃体内注射,该设计用于输送0.05 mL(50微升)的含2 mg阿非西普的溶液。 pH值为6.2的10 mM磷酸钠,40 mM氯化钠,0.03%聚山梨酯20和5%蔗糖。
Eylea-临床药理学
作用机理
血管内皮生长因子-A(VEGF-A)和胎盘生长因子(PlGF)是血管生成因子的VEGF家族的成员,可以充当内皮细胞的促有丝分裂,趋化性和血管通透性因子。 VEGF通过存在于内皮细胞表面的两个受体酪氨酸激酶VEGFR-1和VEGFR-2起作用。 PlGF仅与VEGFR-1结合,VEGFR-1也存在于白细胞表面。 VEGF-A激活这些受体可导致新血管形成和血管通透性。
阿柏西普充当结合VEGF-A和PlGF的可溶性诱饵受体,从而可以抑制这些同源VEGF受体的结合和激活。
药效学
新血管性(湿性)年龄相关性黄斑变性(AMD)
在临床研究中,从基线到第52周,所有治疗组疾病活动的解剖学指标均得到类似的改善。第一年未使用解剖学数据来影响治疗决策。
视网膜静脉阻塞(RVO)后的黄斑水肿
与基线相比,在第24周时观察到哥白尼,伽利略和振动型患者的平均视网膜厚度减少。解剖数据未用于影响治疗决策[参见临床研究(14.2) , (14.3) ]。
糖尿病性黄斑水肿(DME)
与基线相比,在第52周和第100周观察到VIVID和VISTA的平均视网膜厚度减少。未使用解剖学数据来影响Eylea的治疗决策[参见临床研究(14.4) ]。
药代动力学
玻璃体内给予眼药水以在眼睛中发挥局部作用。在玻璃体腔内注射Eylea后,患有湿性AMD,RVO或DME的患者,预期一部分给药剂量会与眼中的内源性VEGF结合形成无活性的aflibercept:VEGF复合物。一旦被吸收到全身循环中,阿柏西普在血浆中以游离阿柏西普(未结合VEGF)和循环内源性VEGF(即阿柏西普:VEGF复合物)更稳定的非活性形式存在。
吸收/分布
对患有湿性AMD,RVO和DME的患者进行玻璃体内注射每只眼Eylea 2 mg后,血浆中游离阿柏西普的平均C max为0.02 mcg / mL(范围:0至0.054 mcg / mL),0.05 mcg /分别为mL(范围:0至0.081 mcg / mL)和0.03 mcg / mL(范围:0至0.076 mcg / mL),并在1-3天内达到。在所有患者中,给药后两周均未检测到游离阿柏西普血浆浓度。每4周一次玻璃体内重复给药时,Aflibercept不会在血浆中积聚。据估计,向患者玻璃体内给药2 mg后,游离阿非西普的平均最大血浆浓度比半数最大结合全身性VEGF所需的阿非西普的浓度低100倍以上。
在静脉内(IV)给予阿柏西普后,游离阿柏西普的分布量已确定为约6L。
代谢/消除
阿柏西普是一种治疗性蛋白质,尚未进行药物代谢研究。预计Aflibercept会通过结合游离内源性VEGF的靶标介导处置和蛋白水解代谢来消除。静脉给予2至4 mg / kg阿柏西普剂量后,游离阿柏西普在血浆中的终末消除半衰期(t1 / 2)约为5至6天。
特定人群
肾功能不全
在一项湿性AMD研究中,对亚组患者(n = 492)进行药代动力学分析,其中43%有肾功能不全(轻度n = 120,中度n = 74,重度n = 16),显示血浆方面无差异每4或8周玻璃体内给药后的游离阿柏西普浓度。在RVO研究的患者和DME研究的患者中也观察到类似的结果。湿性AMD,RVO或DME患者无需根据肾功能不全进行剂量调整。
其他
对于任何已研究的人群(例如,性别,老年人),都不需要进行特殊的剂量调整。
非临床毒理学
致癌,诱变,生育力受损
尚未对阿柏西普的致突变性或致癌性进行过研究。作为一项为期6个月的研究的一部分,对猴子进行了为期6个月的研究,评估了猴子在静脉注射aflibercept的每周剂量为3至30 mg / kg的情况。在所有剂量水平下均观察到与女性生殖激素水平改变以及精子形态和运动能力改变有关的月经缺失或不规则。此外,雌性显示卵巢和子宫重量减少,同时黄体发育受损和成熟卵泡减少。这些变化与子宫和阴道萎缩有关。未确定没有观察到的不良反应水平(NOAEL)。静脉内施用猴子中评估的最低剂量的阿柏西普(3 mg / kg)导致游离阿柏西普的全身暴露量(AUC)比玻璃体内2 mg的人体全身暴露量高约1500倍。停止治疗后20周内所有变化都是可逆的。
动物毒理学和/或药理学
玻璃体腔注射剂量为每只眼睛2或4 mg,观察到玻璃体腔注射阿柏西普治疗的猴子鼻甲中呼吸道上皮的侵蚀和溃疡。在猴子的每只眼睛的NOAEL为0.5 mg时,玻璃体内注射2 mg后的全身暴露(AUC)是人类观察到的暴露的56倍。在临床研究中未观察到类似的效果[见临床研究(14) ]。
临床研究
新血管性(湿性)年龄相关性黄斑变性(AMD)
在湿性AMD患者的两项随机,多中心,双掩蔽,主动对照研究中评估了Eylea的安全性和有效性。两项研究(VIEW1和VIEW2)共治疗了2412例患者,并评估了疗效(Eylea为1817例)。在每项研究中,直到第52周,患者均以1:1:1:1的比例分配给4种给药方案中的1种:1)Eylea在最初的3次每月剂量后每8周每2周一次服用2 mg(Eylea 2Q8); 2)Eylea每4周注射2 mg(Eylea 2Q4); 3)每4周施用0.5 mg的Eylea(Eylea 0.5Q4);和4)雷珠单抗每4周给药0.5 mg(雷珠单抗0.5 mg Q4)。协议规定的访问每28±3天进行一次。患者年龄为49至99岁,平均76岁。
在这两项研究中,主要功效终点是维持视力的患者比例,定义为与基线相比在第52周丧失少于15视力的视力。 Eylea 2Q8和Eylea 2Q4组在第1年的临床疗效均与兰尼单抗0.5 mg Q4组相当。
下面的表4和图13显示了VIEW1和VIEW2研究的详细分析结果。
| 视图1 | 视图2 | |||||
|---|---|---|---|---|---|---|
| lea 2毫克Q8周* | lea 第4周2毫克 | 雷尼单抗 0.5毫克Q4星期 | lea 2毫克Q8周* | lea 第4周2毫克 | 雷尼单抗 0.5毫克Q4星期 | |
| 完整分析集 | N = 301 | N = 304 | N = 304 | N = 306 | N = 309 | N = 291 |
| BCVA =最佳矫正视力; CI =置信区间; ETDRS =早期治疗糖尿病性视网膜病研究; LOCF =结转上一个观察值(不结转基线值);提出95.1%的置信区间以调整研究期间进行的安全性评估 | ||||||
| ||||||
| 疗效结果 | ||||||
| 维持视力的患者比例(%) (<15个BCVA丢失字母) | 94% | 95% | 94% | 95% | 95% | 95% |
| 差异† (%) (95.1%CI) | 0.6 (-3.2,4.4) | 1.3 (-2.4、5.0) | 0.6 (-2.9,4.0) | -0.3 (-4.0,3.3) | ||
| 根据基线的ETDRS字母得分测得的BCVA平均变化 | 7.9 | 10.9 | 8.1 | 8.9 | 7.6 | 9.4 |
| LS平均值的差异† (95.1%CI) | 0.3 (-2.0,2.5) | 3.2 (0.9,5.4) | -0.9 (-3.1,1.3) | -2.0 (-4.1,0.2) | ||
| 从基线获得至少15个视力信的患者数量(%) | 92 (31%) | 114 (38%) | 94 (31%) | 96 (31%) | 91 (29%) | 99 (34%) |
| 差异† (%) (95.1%CI) | -0.4 (-7.7,7.0) | 6.6 (-1.0,14.1) | -2.6 (-10.2,4.9) | -4.6 (-12.1,2.9) | ||
治疗效果
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
美国日本医生

Gregory Aaen MD

Brian Aalbers DO

Glen Scott DO

Cecile Becker MD

Shruti Badhwar DO

渡邊剛

中山秀章 教授

村田朗

山内広平






















