获取国外加工均匀度药品价格,使用等信息,最快 24 小时回馈
加工均匀度
在本页面
- 盒装警告
- 适应症和用法
- 剂量和给药
- 剂型和优势
- 禁忌症
- 警告和注意事项
- 不良反应/副作用
- 在特定人群中使用
- 描述
- 临床药理学
- 非临床毒理学
- 临床研究
- 供应/存储和处理方式
- 病人咨询信息
- 用药指南
- EVENITY可能会增加心肌梗塞,中风和心血管死亡的风险[请参阅警告和注意事项( 5.1 )]。在前一年内患有心肌梗塞或中风的患者不应该开始EVENITY。考虑是否有其他心血管疾病危险因素的患者获益大于风险。如果患者在治疗过程中发生心肌梗塞或中风,应停止EVENITY。
1适应症和用途
绝经后骨质疏松妇女高骨折风险的治疗
EVENITY用于治疗高骨折风险的绝经后妇女骨质疏松症,定义为骨质疏松性骨折史或多种骨折危险因素;或对其他可用的骨质疏松症治疗无效或不耐受的患者。
使用限制
12个月的剂量治疗后,EVENITY的合成代谢作用减弱。因此,EVENITY的使用期限应限制为每月12剂。如果仍然需要进行骨质疏松症治疗,则应考虑继续使用抗吸收剂治疗[见剂量和给药方法( 2.2 )和临床研究( 14.1 )] 。
2剂量和给药
重要剂量和管理说明
- 需要两个单独的注射器(和两个单独的皮下注射)来管理210毫克EVENITY的总剂量。依次注入两个105 mg / 1.17 mL预填充注射器。
- EVENITY应由医疗保健提供者进行管理。
推荐用量
- 推荐的EVENITY剂量为210毫克,腹部,大腿或上臂皮下注射。每月管理一次EVENITY。
- EVENITY的治疗持续时间为12个月剂量。
- 在进行EVENITY治疗期间,应向患者充分补充钙和维生素D [请参阅警告和注意事项( 5.3 )和临床研究( 14.1 )] 。
- 如果错过了EVENITY剂量,则应尽快重新安排。此后,可以从最后一次服药的日期开始每月安排一次EVENITY。
准备和管理说明
第一步: 此前有dministration:
- 从纸箱中取出两个注射器。
- 服用前目视检查EVENITY是否有颗粒和变色。 EVENITY对乳白色透明,无色至浅黄色溶液。如果溶液混浊或变色或含有颗粒,请勿使用。
- 如果不使用注射器
- 任何部位出现裂纹或破裂
- 灰色的针帽缺失或未牢固连接
- 标签上打印的过期日期已过
- 任何部位出现裂纹或破裂
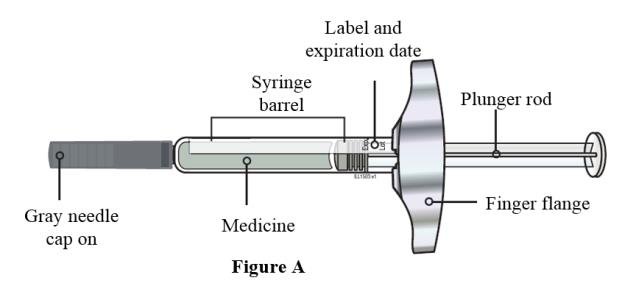
- 始终将预填充的注射器握在注射器筒上,以从托盘中取出注射器。参见图A。
- 不要抓住柱塞杆。
- 请勿抓住灰色的针帽。
- 准备注射之前,请勿取下灰色的针帽。
- 不要抓住柱塞杆。
- 注射前,让EVENITY在室温下静置至少30分钟。请勿以其他任何方式加热[请参阅供应/储存和处理方式( 16 )] 。

第2步:选择注射部位并准备注射器
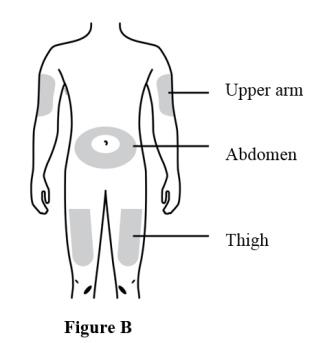
准备并清洗两个注射部位,两次注射各一个。参见图B。
 |
推荐的皮下注射部位包括:
●大腿
●腹部,肚脐周围只有两英寸的区域
●上臂外侧
用酒精湿巾清洁注射部位。让皮肤干燥。
●每次注射时,请选择其他站点。如果要使用相同的注射部位,请确保它与上次注射所使用的注射部位不同。
●请勿将其注入皮肤柔软,淤青,发红或坚硬的区域。避免注入有疤痕或妊娠纹的区域。
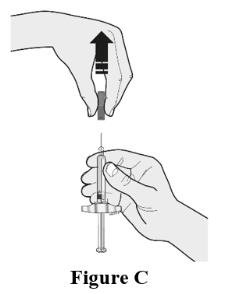
选择第一个注射器。准备注射时,将灰色的针帽笔直拉开并远离身体。参见图C。
 |
●不要将灰色的针头盖放回注射器上。
第三步:注入活力
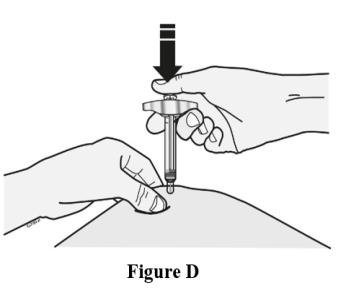
插入针头并皮下注射所有液体。不要管理肌肉或血管。参见图D。
 |
完成后,将注射器从皮肤上轻轻提起。
第4步:注射器和针头帽处置
立即将注射器和针头盖丢入最近的锐器容器中。
我mportant:重复与第二针筒所有步骤注入全剂量。
3剂型和强度
注射剂:在一次性使用的预填充注射器中,透明至乳白色,无色至浅黄色溶液105 mg / 1.17 mL。
全剂量的EVENITY需要两个一次性使用的预填充注射器。
4禁忌症
下列患者禁用EVENITY:
- 低钙血症。在开始使用EVENITY治疗之前,必须纠正先前存在的低钙血症[请参阅警告和注意事项( 5.3 ) ,不良反应( 6.1 )和在特定人群中使用( 8.7 )] 。
- 对romosozumab或产品制剂中任何成分的全身过敏史。反应包括血管性水肿,多形性红斑和荨麻疹[见警告和注意事项( 5.2 )和不良反应( 6.1 ) ] 。
5警告和注意事项
重大不良心脏事件(MACE)
在一项针对绝经后妇女的随机对照试验中,与使用阿仑膦酸盐治疗的患者相比,接受EVENITY治疗的患者的重大不良心脏事件(MACE),心血管死亡,非致命性心肌梗塞和非致命性中风的复合终点发生率更高[参见盒装警告和不良反应( 6.1 )] 。
在前一年内患有心肌梗塞或中风的患者不应开始EVENITY。考虑是否有其他心血管疾病危险因素的患者获益大于风险。监测心肌梗塞和中风的体征和症状,如果出现症状,指示患者立即就医。如果患者在治疗过程中发生心肌梗塞或中风,应停止EVENITY。
过敏反应
在接受EVENITY治疗的患者中,出现了过敏反应,包括血管性水肿,多形性红斑,皮炎,皮疹和荨麻疹。如果发生过敏性或其他临床上显着的过敏反应,请开始适当的治疗,并停止进一步使用EVENITY [请参阅禁忌症( 4 )和不良反应( 6.1 )]。
低钙血症
接受EVENITY的患者发生了低钙血症。在开始EVENITY之前纠正低钙血症[请参阅 禁忌症( 4 ),不良反应( 6.1 )和在特定人群中的使用( 8.7 ) ] 。
监测患者的低钙血症迹象和症状。患者在出院时应适当补充钙和维生素D [见剂量和用法( 2.2 )和临床研究( 14.1 )] 。
严重肾功能不全(估计肾小球滤过率[eGFR] 15至29 mL / min / 1.73 m 2 )或接受透析的患者,发生低血钙症的风险更大。监测血清钙并充分补充严重肾功能不全或正在接受钙和维生素D透析的患者。指导严重肾功能不全的患者(包括接受透析的患者)低钙血症的症状以及保持足够钙和钙维持钙水平的重要性补充维生素D。
颚骨坏死
下颌骨坏死(ONJ)可以自发发生,通常与拔牙和/或局部感染有关,延误了愈合,据报道在接受EVENITY的患者中。在开始EVENITY治疗之前,开药者应进行常规的口腔检查。与ONJ相关的药物(化学疗法,双膦酸盐,地诺单抗,血管生成抑制剂和皮质类固醇)的同时给药可能会增加罹患ONJ的风险。 ONJ的其他风险因素包括癌症,放疗,口腔卫生差,先前存在的牙齿疾病或感染,贫血和凝血病 [参见不良反应( 6.1 )] 。
对于需要侵入性牙科手术的患者,主治医师和/或口腔外科医生的临床判断应根据受益风险评估指导每位患者的治疗计划。怀疑患有或在EVENITY期间患有ONJ的患者应接受牙医或口腔外科医生的护理。在这些患者中,用牙科手术治疗ONJ可能会加重病情。应基于收益风险评估考虑终止EVENITY。
股骨粗隆下和干Dia端股骨骨折
据报道,接受EVENITY的患者发生股骨干非典型的低能量或低创伤性骨折[见不良反应( 6.1 )] 。这些骨折可能发生在股骨干中的任何位置,从小转子下方到to上张开上方,并且在没有粉碎迹象的情况下横向或短斜。尚未确定因果关系,因为这些骨折也发生在未经治疗的骨质疏松患者中。
非典型股骨骨折最常见,对患处的损伤很小或没有损伤。他们可能是双侧的,许多患者在受累区域报告前驱性疼痛,通常在完全骨折发生前几周到几个月表现为钝痛,大腿疼痛。
在EVENITY治疗期间,应建议患者报告新的或不寻常的大腿,臀部或腹股沟疼痛。任何出现大腿或腹股沟疼痛的患者均应被怀疑具有非典型骨折,并应进行评估以排除股骨不完全骨折。出现非典型股骨骨折的患者也应评估对侧肢体的骨折症状和体征。应基于获益风险评估考虑中断EVENITY治疗[见临床研究( 14 )] 。
6不良反应
标签的其他部分详细讨论了以下不良反应:
- 主要不良心脏事件[见黑框警告和警告S和注意事项(5.1)]
- 过敏[请参见禁忌症( 4 )和警告和注意事项( 5.2 )]
- 低钙血症[SEë禁忌(4)和警告和注意事项(5.3)]
- 下颌骨坏死[请参阅警告和注意事项( 5.4 )]
- 非典型转子下和骨干股骨骨折[见战争ñ英格斯和注意事项(5.5)]
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
在一项多中心,随机,双盲,安慰剂对照研究(研究1,NCT01575834)中对7180名年龄在55至90岁(平均年龄为71岁)的女性进行了评估,评估了EVENITY治疗绝经后骨质疏松的安全性。在12个月的双盲研究期内,每月分别有3581和3576名妇女分别接受至少一剂EVENITY和安慰剂治疗。女性每天至少接受500毫克钙和600国际单位维生素D补充,而77%的妇女在随机化后一周内(如果血清25-羟基维生素D浓度为40 ng / mL,则接受50,000至60,000国际单位维生素D的负荷剂量)或更少)。
在一项多中心,随机,双盲,阿仑膦酸盐对照研究(研究2,NCT01631214)中对55岁至90岁(平均)的4093名绝经后妇女进行了EVENITY治疗绝经后骨质疏松症的安全性评估年龄74岁)。在12个月的双盲研究期内,分别有2040和2014年的女性分别接受了至少一剂EVENITY和阿仑膦酸盐。女性每天至少接受500毫克钙和600国际单位维生素D的补充,而74%的妇女在随机化后的一周内(如果血清25-羟基维生素D的浓度为40 ng / mL或减)。
在研究1中,在12个月的双盲治疗期间,安慰剂组的全因死亡率为0.7%(24/3576),EVENITY组的为0.8%(29/3581)。安慰剂组非致命性严重不良事件的发生率为8.3%,EVENITY组为9.1%。安慰剂组因不良反应而退出研究的患者百分比为1.1%,EVENITY组为1.1%。 EVENITY(大于或等于5%,且发生率高于安慰剂)报告的最常见不良反应是关节痛和头痛。导致EVENITY中断的最常见不良反应是关节痛(安慰剂组为6名受试者[0.2%],EVENITY组为5名受试者[0.1%])。
在研究2中,在12个月的双盲治疗期间,阿仑膦酸盐组的全因死亡率发生率为1.1%(22/2014),而EVENITY组的全因死亡率为1.5%(30/2040)。阿仑膦酸钠组非致命性严重不良事件的发生率为13.3%,EVENITY组为11.9%。由于不良事件而退出研究的患者百分比在阿仑膦酸钠组中为1.2%,在EVENITY组中为1.2%。 EVENITY报告的最常见不良反应(大于或等于5%)是关节痛和头痛。
表1概述了至少一项研究中发生在大于等于2%的EVENITY治疗女性中的最常见不良反应。
| 研究1 | 研究2 | |||
| 首选条款 | 安慰剂 (N = 3576) n(%) | 便利性 (N = 3581) n(%) | 阿仑膦酸盐 (N = 2014) n(%) | 便利性 (N = 2040) n(%) |
| 关节痛 | 434(12.1) | 468(13.1) | 194(9.6) | 166(8.1) |
| 头痛 | 208(5.8) | 235(6.6) | 110(5.5) | 106(5.2) |
| 肌肉痉挛 | 140(3.9) | 163(4.6) | 81(4.0) | 70(3.4) |
| 周围水肿 | 67(1.9) | 86(2.4) | 38(1.9) | 34(1.7) |
| 虚弱 | 79(2.2) | 84(2.3) | 53(2.6) | 50(2.5) |
| 颈部疼痛 | 54(1.5) | 80(2.2) | 42(2.1) | 34(1.7) |
| 失眠 | 68(1.9) | 72(2.0) | 36(1.8) | 34(1.7) |
| 感觉异常 | 62(1.7) | 72(2.0) | 34(1.7) | 29(1.4) |
以下所述的不良反应来自研究1(安慰剂对照)和研究2(阿仑膦酸盐对照)的12个月治疗期。
重大不良心脏事件(MACE)
在安慰剂对照试验的12个月双盲治疗期间(研究1),EVENITY组的9位女性(0.3%)和安慰剂组的8位女性(0.2%)发生了心肌梗塞; EVENITY组的8名女性(0.2%)和安慰剂组的10名女性(0.3%)发生中风。这些事件发生在有无心肌梗塞或中风病史的患者中。 EVENITY组中有17名(0.5%)妇女发生心血管死亡,安慰剂组中有15名(0.4%)妇女发生心血管死亡。在EVENITY组中,接受MACE裁决的女性人数为30(0.8%),在安慰剂组中为29(0.8%),与EVENITY相比,EVEITY的危险比为1.03(95%置信区间[0.62,1.72])。安慰剂。
在主动对照试验的12个月双盲治疗期间(研究2),EVENITY组的16名女性(0.8%)和阿仑膦酸盐组的5名女性(0.2%)发生了心肌梗塞; EVENITY组的13名女性(0.6%)和阿仑膦酸盐组的7名女性(0.3%)发生了中风。这些事件发生在有无心肌梗塞或中风病史的患者中。 EVENITY组中有17名(0.8%)妇女发生心血管死亡,而阿仑膦酸盐组中有12名(0.6%)妇女发生心血管死亡。在EVENITY组中,接受MACE裁决的女性人数为41(2.0%),在阿仑膦酸盐组中为22(1.1%),与之相比,EVENITY的危险比为1.87(95%置信区间[1.11,3.14])。阿仑膦酸盐[见黑框警告和警告S和注意事项(5.1)]。
过敏反应
在这两个试验中,据报道,EVENITY组的364名(6.5%)妇女和对照组的365名(6.5%)妇女出现超敏反应。报告的反应包括血管性水肿(EVENITY组为3 [<0.1%]妇女,对照组为3 [<0.1%]妇女),多形性红斑(EVENITY组为1 [<0.1%]妇女,而对照组为无妇女。对照组),皮炎(EVENITY组中32名[0.6%]妇女,对照组中42名[0.8%]妇女),皮疹(EVENITY组中60名[1.1%]妇女与53名[0.9%])对照组的女性)和荨麻疹(活动组的23名女性[0.4%],对照组的27名[0.5%])。尽管没有报道EVENITY发生血管性水肿,皮炎和荨麻疹的发生率高于对照组,但仍有一些血管性水肿,皮炎和荨麻疹的病例与EVENITY的使用有关[见禁忌症( 4 )和警告和注意事项( 5.2 ) ]。 。
低钙血症
在这两个试验中,低血钙的不良事件发生在2名接受EVENITY治疗的女性和对照组中的1名女性中。据报道,EVENITY组的14名女性(0.2%)和对照组的10名女性(0.2%)的白蛋白调整后的血清钙降低至参考范围的下限以下(8.3 mg / dL)。没有接受EVENITY治疗的患者血清钙水平低于7.5 mg / dL。肾功能正常的患者在EVENITY给药后的第1个月出现白蛋白调整后的血清钙的最低点[见禁忌症( 4 )和警告和注意事项 ( 5.3 )] 。
注射部位反应
在这两个试验中,EVENITY组的278名女性(4.9%)和对照组的157名女性(2.8%)发生了注射部位反应。最常见的注射部位反应是疼痛(EVENITY组为94 [1.7%]名女性;对照组为70 [1.3%]名女性)和红斑(EVENITY组为80名[1.4%]女,14名[0.3%]对照组中的女性)。注射部位反应导致7例(0.1%)EVENITY治疗的患者和3例(<0.1%)的患者中止治疗。
颚骨坏死
在这两项试验中,一名患者在进行EVENITY治疗期间发生了颌骨坏死[见警告和注意事项( 5.4 )]。
股骨粗隆下和干Dia端骨折
在这两项试验中,在进行EVENITY治疗期间,一名患者发生了非典型股骨骨折[参见警告和注意事项( 5.5 )]。
免疫原性
与所有治疗性蛋白质一样,具有免疫原性的潜力。抗体形成的检测高度依赖于测定的灵敏度和特异性。另外,在测定中观察到的抗体(包括中和抗体)阳性的发生率可能受到几个因素的影响,包括测定方法,样品处理,样品收集的时间,伴随用药和潜在疾病。由于这些原因,将下述研究中的抗体发生率与其他研究中或其他romosozumab产品的抗体发生率进行比较可能会产生误导。
使用免疫测定法评估EVENITY的免疫原性,以检测抗romosozumab-aqqg 抗体。体外 生物 对那些受试者的血清抗romosozumab-aqqg抗体检测呈阳性的受试者进行了中性抗体检测。
在每月接受EVENITY 210 mg治疗的5914名绝经后妇女中,有18.1%的受试者产生了针对romosozumab-aqqg的抗体。在开发出针对罗莫单抗-aqqg的抗体的受试者中,有4.7%的抗体被归类为中和。罗莫单抗-aqqg抗体的开发与血清罗莫单抗-aqqg浓度降低有关[参见 [临床药理学( 12.3 )] 。罗莫单抗-aqqg抗体通常与EVENITY的功效或安全性变化无关。
8在特定人群中的使用
怀孕
风险摘要
EVENITY不适用于有生殖能力的女性。在动物生殖研究中,在器官发生期间每周向怀孕的大鼠施用romosozumab-aqqg,其暴露量大于临床暴露量的31倍,从而在后代中产生骨骼异常。在交配前和哺乳结束前对大鼠施用romosozumab-aqqg可使后代的股骨矿物质密度和/或皮质周长最小或略微降低,为人类预期暴露量的1.4至54倍[参见数据] 。
数据
动物资料
在初步和确定的胚胎-胎儿发育研究,生育力和胚胎发育研究以及产前和产后发育研究中,评估了romosozumab-aqqg对大鼠的生殖和发育影响。
在所有大鼠生殖毒性研究中,在75胎中,有1胎发生了骨骼畸形,其中有1胎是在皮脂中,每周给予皮下注射romosozumab-aqqg剂量为300 mg / kg(相当于在临床上所观察到的至少31倍)根据浓度-时间曲线[AUC]比较下的面积,每月皮下注射210毫克的人)。
在雌雄大鼠的后代中,从同居到交配和哺乳前6周,每周服用romosozumab-aqqg剂量,股骨骨膜和皮质内膜周长分别以10、60和300 mg / kg降低(相当于1.4、18和54倍)根据AUC比较,每月皮下注射210毫克后的临床暴露)。皮质厚度增加至300 mg / kg(相当于预期临床暴露量的54倍)。股骨干phy端骨矿物质密度在60和300 mg / kg时略有下降(相当于预期临床暴露量的18和54倍)。
哺乳期
风险摘要
EVENITY不适用于有生殖能力的女性。在动物研究中,从同居前的六周开始,通过交配和哺乳,怀孕的大鼠每周以10、60或300 mg / kg的剂量接受romosozumab-aqqg的剂量(相当于每月皮下注射剂量的临床暴露量的1.4、18或54倍)在210毫克(基于AUC比较的基础上),由于妊娠和/或哺乳期暴露,romosozumab-aqqg在出生后第21天时的剂量为孕产妇暴露的0.01至2.4倍,呈剂量依赖性。
儿科用
小儿患者尚未确定EVENITY的安全性和有效性。
老人用
在EVENITY的临床研究中,有6544名绝经后骨质疏松妇女,其中5234岁(80%)年龄在65岁以上,2390名(37%)年龄在75岁以上。在这些受试者和较年轻的受试者之间未观察到安全性或疗效的总体差异,其他报告的临床经验也未发现老年和较年轻患者的反应差异,但是不能排除某些老年患者的敏感性更高。
肾功能不全
肾功能不全的患者无需调整剂量。
患有严重肾功能不全(按MDRD方程估计肾小球滤过率[eGFR] 15至29 mL / min / 1.73 m 2 )或接受透析的患者,发生低血钙症的风险更高[请参阅禁忌症( 4 ) ,警告和注意事项( 5.3 )和不良反应( 6.1 ) ] 。监测严重肾功能不全或正在接受透析的患者的钙浓度并适当补充钙和维生素D。
11说明
Romosozumab-aqqg是一种人源化单克隆抗体(IgG2),通过重组DNA技术在哺乳动物细胞系(中国仓鼠卵巢)中产生,该抗体结合并抑制硬化素。 Romosozumab-aqqg的分子量约为149 kDa。
EVENITY(romosozumab-aqqg)注射液为无菌,不含防腐剂,透明至乳白色,无色至浅黄色溶液,可在一次性使用的预填充注射器中进行皮下注射。
需要使用两个105 mg / 1.17 mL的一次性预装注射器来管理210 mg的推荐剂量EVENITY [请参阅剂量和用法( 2.1 )] 。每个一次性填充注射器在注射用水(USP)中提供1.17 mL的溶液,其中包含105 mg的romosozumab-aqqg,乙酸盐(3.8 mg),钙(0.61 mg),聚山梨酯20(0.07 mg)和蔗糖(70 mg),和氢氧化钠至pH为5.2。
12临床药理学
作用机理
EVENITY抑制硬化素的作用,硬化素是骨骼代谢中的调节因子。 EVENITY增加骨骼的形成,并在较小程度上减少骨骼的吸收。动物研究表明,romosozumab-aqqg通过刺激成骨细胞活性刺激小梁和皮质骨表面上的新骨形成,从而导致小梁和皮质骨量增加以及骨骼结构和强度得到改善[请参见非临床毒理学( 13.2 )和临床研究( 14.1 )。 ] 。
药效学
在绝经后患有骨质疏松症的妇女中,EVENITY增加了骨形成标志物1型N型端肽原胶原(P1NP)的浓度,在开始治疗后2周,与安慰剂相比,从基线开始的峰值升高约145%,随后恢复至安慰剂的浓度第9个月,从基线下降到比第12个月安慰剂所见的浓度变化低约15%。
与安慰剂相比,EVENITY在开始治疗后2周降低了骨吸收标记1型胶原C-端肽(CTX),与基线相比最大降低了约55%。 CTX仍低于安慰剂所见的浓度,比第12个月安慰剂所见的浓度变化低约25%。
终止EVENITY后,P1NP水平在12个月内恢复到基线; CTX在3个月内上升到基线以上,并在第12个月恢复到基线水平。
药代动力学
在健康志愿者中单次服用210毫克EVENITY,得出的最大romosozumab-aqqg血清平均浓度(C max )平均为22.2(5.8)mcg / mL,平均ASD为389 (127)微克*天/毫升。每月向绝经后妇女服用210毫克后的第3个月,达到稳态浓度。在第3、6、9和12个月的平均谷值血清romosozumab-aqqg浓度范围为8到13 mcg / mL。
Romosozumab-aqqg表现出非线性的药代动力学,其暴露比剂量成比例地增加(例如,皮下剂量范围从0.1到10 mg / kg的100倍增加,平均AUC inf增加550倍[批准的推荐剂量的0.03到3.3倍一个70公斤的女士)。
吸收性
达到最大Romosozumab-aqqg浓度的中位时间(T max )为5天(范围:2至7天)。
分配
稳态时的估计分配量约为3.92L。
Elimina吨离子
Romosozumab-aqqg表现出非线性的药代动力学,随着剂量的增加,romosozumab-aqqg的清除率降低。单次皮下给药3 mg / kg(70千克妇女的批准推荐剂量)后,罗莫昔单抗-aqqg的估计平均全身清除率(CL / F)为0.38 mL / hr / kg。平均有效t 1/2为每4周3剂3 mg / kg剂量(70公斤妇女批准的推荐剂量)后12.8天。
代谢
romosozumab-aqqg的代谢途径尚未鉴定。作为人源化IgG2单克隆抗体,预计romosozumab-aqqg会通过分解代谢途径以类似于内源IgG的方式降解为小肽和氨基酸。
影响药物动力学的抗产物抗体的形成
抗romozozumab-aqqg抗体的开发与血清romosozumab-aqqg浓度降低有关。抗romozozumab-aqqg抗体的存在导致romosozumab-aqqg的平均浓度降低至22%。中和抗体的存在导致romosozumab-aqqg的平均浓度降低多达63% [参见不良反应( 6.2 )] 。
特定人群
根据年龄(20-89岁),性别,种族,疾病状态(低骨量或骨质疏松),先前接触过阿仑膦酸盐或肾功能不全(包括终末期肾),未观察到罗莫单抗-aqqg药代动力学的临床显着差异需要透析的疾病(ESRD)。 ESRD不需要透析对romosozumab-aqqg药代动力学的影响尚不清楚。
体重
romosozumab-aqqg的暴露随体重增加而降低。
13毒理学
致癌,诱变,生育力受损
致癌性
在一项大鼠致癌性研究中,从8周到98周龄,通过皮下注射向Sprague-Dawley大鼠每周一次分别给予3、10或50 mg / kg的romosozumab-aqqg剂量,导致全身暴露量高达每月皮下注射210毫克EVENITY(基于AUC比较)后,在人体中观察到的全身暴露量是19倍。在所有剂量下,Romosozumab-aqqg引起骨量的剂量依赖性增加,小梁和皮质骨增厚。 romosozumab-aqqg对死亡率没有影响,并且romosozumab-aqqg不会导致雄性或雌性大鼠肿瘤发生率显着增加。
致突变性
诱变作用尚未得到评估,因为预计单克隆抗体不会改变DNA或染色体。
生育能力受损
给予皮下注射romosozumab-aqqg最高300 mg / kg的雄性和雌性大鼠,未观察到对生育力的影响(根据AUC比较,每月皮下注射210 mg EVENITY后,人体观察到的全身暴露量高达54倍)。皮下注射6个月,每周一次剂量最高100 mg / kg的大鼠和食蟹猕猴的生殖器官均未见效果(分别暴露于人体,每月皮下注射剂量210 mg分别达到37和90倍)根据AUC比较)。
动物毒理学与药理学
每周皮下注射Romosozumab-aqqg剂量达100 mg / kg,每周一次,每次26次后,在大鼠和猴子中均未观察到不良反应,分别相当于人体每月一次皮下注射剂量达37 mg和90倍。 210毫克EVENITY(基于AUC比较)。
根据AUC比较,在卵巢切除的大鼠和猴子中,每周一次接受romosozumab-aqqg剂量进行的骨骼安全性研究长达12个月,产生的暴露量是给予人每月210 mg全身暴露量的1至21倍。 Romosozumab-aqqg可通过增加骨膜,皮质内膜和小梁表面的骨形成,并减少骨小梁和皮质内表面的骨吸收来增加骨骼质量并改善松质骨微结构和皮质骨的几何形状。骨量的增加与骨强度的增加显着相关。在大鼠和猴子中,所有骨骼部位的骨质量维持在人类暴露1到21倍的剂量范围内,而椎骨在人类暴露19到21倍的剂量下略有改善。没有证据表明矿化缺陷,类骨质堆积或编织的骨形成。
14临床研究
绝经后妇女骨质疏松症的治疗
研究1 (NCT01575834)是一项随机,双盲,安慰剂对照的研究,研究对象为55至90岁(平均年龄为71岁)的绝经后女性,其骨矿物质密度(BMD)T分数在-2.5总髋部或股骨颈。女性被随机接受为期12个月的EVENITY(N = 3589)或安慰剂(N = 3591)皮下注射。基线时,有18%的女性患有椎骨骨折。经过12个月的治疗期后,两臂妇女均过渡到开放标签抗吸收治疗(denosumab)12个月,同时对初始治疗不知情。妇女每天要补充500至1000毫克钙和600至800国际单位的维生素D。共同的主要疗效终点是在第12和24个月出现新的椎骨骨折。
对骨折的影响
与安慰剂相比,EVENITY到第12个月显着降低了新椎骨骨折的发生率。此外,与从安慰剂转为denosumab的女性相比,在第一年接受EVENITY并转为denosumab的女性,其骨折风险一直持续到第二年。
| 妇女比例 骨折 | 绝对风险 减少 (%) (95%CI) a | 相对风险 减少 (%) ( 95%CI) a | p值b | ||
| 在第12个月 | 安慰剂 (N = 3591) | 便利性 (N = 3589) | |||
| 新椎体骨折 | 1.8% | 0.5% | 1.3 (0.8、1.8) | 73 (53,84) | <0.001 |
| 在第24个月 | 安慰剂跟着 地诺单抗 (N = 3591) | 紧随其后的是 地诺单抗 (N = 3589) | |||
| 新椎体骨折 | 2.5% | 0.6% | 1.9 (1.3、2.5) | 75 (60,84) | <0.001 |
| N =随机分配的受试者数 一种。绝对风险和相对风险降低是基于Mantel-Haenszel方法进行的,该方法针对年龄和普遍的椎骨骨折层进行了调整。 b。 P值基于调整年龄和普遍椎骨骨折层的逻辑回归模型。 | |||||
EVENITY在12个月时显着降低了临床骨折(有症状椎骨骨折和非椎骨骨折的复合终点)的发生率。但是,在比较第12个月或第24个月接受EVENITY治疗的妇女与接受安慰剂治疗的妇女时,这些临床骨折中有88%是非椎骨骨折,并且非椎骨骨折的发生率在统计学上没有显着差异。
对骨矿物质密度( BMD )的影响
与第12个月的安慰剂相比,EVENITY显着增加了腰椎,全髋和股骨颈的BMD。BMD的治疗差异在腰椎为12.7%,在全髋为5.8%,在股骨颈为5.2%。
在第12个月从EVENITY过渡到denosumab之后,BMD持续增加直至第24个月。在从安慰剂过渡到denosumab的患者中,Bdenosumab的使用也会使BMD升高。当比较从EVENITY过渡到denosumab的患者与从安慰剂过渡到denosumab的患者时,EVENITY和安慰剂患者在12个月达到的BMD差异总体保持在24个月。没有证据表明在基线年龄,基线BMD或地理区域所定义的各亚组中,腰椎或全髋关节对BMD的影响存在差异。
终止EVENITY后,在没有后续抗吸收治疗的情况下,BMD会在12个月内恢复到大约基线水平[参见适应症和用法( 1.2 )] 。
骨组织学和组织形态计量学
在第2个月,第12个月和/或第24个月从139名绝经后骨质疏松的妇女中总共获得了154个经ilia骨活检标本。所有这些活检都足以进行定性组织学检查,而138例(90%)足以进行完全定量检查组织形态计量学评估。对接受EVENITY治疗的女性进行的定性组织学评估显示,所有时间点的骨骼结构和质量均正常。没有证据表明有编织的骨头,矿化缺陷或骨髓纤维化。
在第2和12个月对活组织检查的组织形态计量学评估比较了EVENITY与安慰剂的效果(EVENITY组在第2个月有15个标本,第12个月有39个标本,第2个月有14个标本,第12个月有31个标本)。在接受EVENITY治疗的妇女中,在第2个月,小梁和皮质内表面骨形成的组织形态计量学指数增加。这些对骨形成的影响伴随着骨吸收指数的降低。在第12个月,骨形成和吸收指数均随EVENITY降低,而骨量以及小梁和皮质厚度增加。
研究2 (NCT01631214)是一项对年龄55至90岁(平均年龄74岁)的绝经后妇女在整个髋部或股骨颈的BMD T分数小于或等于-2.5的随机,双盲,阿仑膦酸盐对照研究。在整个髋部或股骨颈处有一个中度或重度椎体骨折或两个轻度椎体骨折,或BMD T分数小于或等于-2.0,并且有两个中度或重度椎体骨折或有股骨近端骨折史。妇女被随机分配(1:1)接受每月皮下注射EVENITY(N = 2046)或口服阿仑膦酸钠70毫克(N = 2047),持续12个月,其中500至1000 mg钙和600至800国际单位维生素D每天补充。在12个月的治疗期后,两臂妇女每周都要过渡到开放标签的阿仑膦酸盐70毫克,同时对初次治疗视而不见。
这是事件驱动的审判。这两个主要功效终点是在24个月时形态计量学的椎骨骨折的发生率,以及在主要分析期间首次出现临床骨折的时间,当至少330名受试者发生临床骨折且所有受试者均完成了24个月的随访时,才结束。临床骨折是非椎骨骨折和有症状椎骨骨折的复合终点。
对骨折的影响
EVENITY在24个月时显着降低了新椎骨骨折的发生率(见表3)。
| 妇女比例 断裂率(%) | 降低风险 | p值b | |||
| 阿仑膦酸盐 单独 (N = 2047) | 便利性 其次是 阿仑膦酸盐 (N = 2046) | 绝对风险 减少率(%) (95%CI) a | 相对风险 减少率(%) (95%CI) a | ||
| 新椎体骨折 到第24个月 | 8.0% | 4.1% | 4.0(2.5,5.6) | 50(34,62) | <0.001 |
| N =随机分配的受试者数 一种。绝对风险和相对风险降低是基于Mantel-Haenszel方法进行的,该方法针对年龄分层,基线总髋部BMD T分数(≤-2.5,> -2.5)以及基线时存在严重的椎骨骨折进行了调整。 b 。 P值基于新脊椎骨折的逻辑回归模型),调整了年龄分层,基线总髋部BMD T分数以及基线时是否存在严重的脊椎骨折。 | |||||
在主要分析阶段结束之前,EVENITY显着降低了临床骨折的风险(参见表4)。这是一项事件驱动的试验,随访时间因受试者而异。初步分析期间受试者随访的中位时间为33个月。在主要分析期间,非椎骨骨折患者占临床骨折患者的83%。
| 妇女比例 断裂(%)的 | 危害比(95%CI) c | 的p值c | ||
| 阿仑膦酸盐 (N = 2047) | 跟随的活动 由阿仑膦酸盐 (N = 2046) | |||
| 通过临床骨折 初步分析期b | 13.0% | 9.7% | 0.73(0.61,0.88) | <0.001 |
| N =随机分配的受试者数 一种。 %=在主要分析期间出现临床骨折的受试者人数/ N * 100%;随访的持续时间因受试者而异。 b。初步分析期结束时,至少有330名受试者确认了临床骨折事件,所有受试者均完成了第24个月的研究访问。初步分析期间随访的中位时间为33个月。 C。危险比和P值基于Cox比例危险模型,根据年龄层,基线总髋部BMD T分数和基线处存在严重椎骨骨折进行了调整 | ||||
在主要分析期间(中位随访33个月),EVENITY继之以阿仑膦酸钠也显着降低了非椎骨骨折的风险,与之相比,危险比为0.81(95%CI:0.66,0.99; p = 0.04)。单用阿仑膦酸盐。
对骨矿物质密度(BMD)的影响
与第12个月的阿仑膦酸盐相比,EVENITY显着增加了腰椎,全髋关节和股骨颈的BMD。BMD的治疗差异为:腰椎8.7%,全髋部3.3%和股骨颈3.2%。
与单独使用阿仑膦酸盐相比,用EVENITY治疗12个月,再用阿仑膦酸盐治疗12个月,BMD显着增加。在第12个月时,观察到的BMD随阿仑膦酸盐的升高而在24个月时保持不变。在第24个月,BMD的治疗差异在腰椎为8.1%,在整个髋部为3.8%,在股骨颈为3.8%。
没有证据表明在基线年龄,基线BMD或地理区域所定义的各亚组中,腰椎或全髋关节对BMD的影响存在差异。
16供应/存储和处理方式
供应方式
EVENITY(romosozumab-aqqg)注射液为透明至乳白色,无色至浅黄色溶液,用于一次性预装注射器中的皮下注射。
每个一次性使用的预填充注射器均包含105毫克的EVENITY,可交付量为1.17毫升。要提供全剂量,请注射两个105 mg / 1.17 mL预装的EVENITY注射器,一个接一个,总剂量为210 mg。
- NDC 55513-880-02:纸箱,装两个105 mg / 1.17 mL一次性预装注射器。
预填充注射器不是用天然橡胶乳胶制成的。
储存和处理
- 在原始纸箱中将EVENITY冷藏在2°C至8°C(36°F至46°F)的温度下,以避光。不要冻结。不要摇晃。
- 如果从冰箱中取出,EVENITY可以在原始纸箱中保持在最高25°C(77°F)的室温下,必须在30天内使用。如果30天内未使用,请丢弃EVENITY。
- 请勿将EVENITY暴露在高于25°C(77°F)的温度下。
17患者咨询信息
注意:本文档包含有关romosozumab的副作用信息。此页面上列出的某些剂型可能不适用于品牌名称Evenity。
对于消费者
适用于romosozumab:皮下溶液
警告
皮下途径(可注射)
警告:心肌梗塞,中风和心血管死亡的潜在风险罗莫唑单抗可能会增加心肌梗塞,中风和心血管死亡的风险。在上一年患有心肌梗塞或中风的患者中不应该开始使用罗莫昔单抗。考虑是否有其他心血管危险因素的患者获益大于风险。如果患者在治疗过程中发生心肌梗塞或中风,应停用romosozumab-aqqg。
需要立即就医的副作用
除其所需的作用外,romosozumab(Evenity中包含的活性成分)可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用romosozumab时,请立即咨询医生或护士是否出现以下任何副作用:
比较普遍;普遍上
- 快速的心跳
- 发热
- 荨麻疹,瘙痒,皮疹
- 嘶哑
- 刺激
- 关节疼痛,僵硬或肿胀
- 皮肤发红
- 眼睑,脸,嘴唇,手或脚肿胀
- 胸闷
- 呼吸困难或吞咽
不常见
- 面部,眼睑,嘴唇,舌头,喉咙,手,腿,脚或生殖器上的大型蜂巢状肿胀
- 体重快速增加
- 手或脚刺痛
- 体重异常增加或减少
罕见
- 胸痛或不适
- 混乱
- 呼吸困难
- 说话困难
- 双重视野
- 头痛
- 下颚沉重的感觉
- 无法移动手臂,腿部或面部肌肉
- 无法说话
- 心律不齐
- 跛行
- 牙齿松动
- 情绪或精神变化
- 手,臂,脚,腿或脸的肌肉抽筋
- 恶心
- 嘴,指尖或脚周围麻木和刺痛
- 手臂,下颌,背部或颈部疼痛或不适
- 口腔或下巴疼痛,肿胀或麻木
- 大腿疼痛,肿胀,压痛和淤青
- 癫痫发作
- 言语缓慢
- 胃痉挛
- 出汗
- 震颤
- 呕吐
不需要立即就医的副作用
可能会出现romosozumab的某些副作用,这些副作用通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 搬家困难
- 肌肉疼痛或僵硬
不常见
- 出血,起泡,灼热,寒冷,皮肤变色,压力感,荨麻疹,感染,炎症,瘙痒,肿块,麻木,疼痛,皮疹,发红,疤痕,酸痛,刺痛,肿胀,压痛,刺痛,溃疡或注射部位的温度
- 力量不足或丧失
- 睡眠困难
对于医疗保健专业人员
适用于romosozumab:皮下溶液
一般
最常见的不良反应包括关节痛和头痛。 [参考]
心血管的
在临床试验中,与阿仑膦酸盐相比,该药物增加了心血管死亡,心脏病和中风的风险,但与安慰剂相比没有增加;接受这种药物的16名女性(0.8%)发生了心肌梗塞,而接受这种药物和阿仑膦酸的13名患者(0.5%)和7名(0.3%)分别接受了阿仑膦酸盐和中风的有5名(0.2%)。这些事件发生在有或没有MI或中风病史的女性中。接受这种药物和阿仑膦酸盐治疗的患者分别发生心血管死亡(17(0.8%)和12(0.6%))。接受该药物和阿仑膦酸盐治疗的患者中,积极判定的MACE(严重的不良心脏事件;心血管死亡,非致命性MI和非致命性中风的复合终点)的差异分别为41%(2%)和22%(1.1%)。
在安慰剂对照试验中,MACE阳性判定的女性人数无显着差异,两组均为0.8%。
常见(1%至10%):周围水肿
罕见(0.1%至1%):心肌梗塞,心肌死亡
神经系统
神经系统
常见(1%至10%):头痛,感觉异常
罕见(0.1%至1%):中风
在临床试验期间,该药物在阿仑膦酸盐试验中增加了心血管死亡,心脏病发作和中风的风险,但在安慰剂试验中未增加;接受这种药物的16名女性(0.8%)发生了心肌梗塞,而接受这种药物和阿仑膦酸盐的患者中分别有13名(0.5%)和7名(0.3%)的接受阿仑膦酸盐和中风的女性占5(0.2%)。这些事件发生在有或没有心梗或中风病史的女性身上。接受该药物和阿仑膦酸盐治疗的患者中,积极判定的MACE(严重的不良心脏事件;心血管死亡,非致命性MI和非致命性中风的复合终点)的差异分别为41%(2%)和22%(1.1%)。
在安慰剂对照试验中,MACE阳性判定的女性人数无显着差异,两组均为0.8%。
过敏症
常见(1%至10%):过敏反应(血管性水肿,多形性红斑,皮炎,皮疹,荨麻疹)
在临床试验中,有6.5%的女性报告了超敏反应;反应包括血管性水肿和多形性红斑(少于0.1%),皮炎(0.6%),皮疹(1.1%)和荨麻疹(0.4%)。
本地
常见(1%至10%):注射部位反应
278位患者(4.9%)发生注射部位反应,包括注射部位疼痛(1.7%)和红斑(1.4%)。
肌肉骨骼
在临床试验期间,有1位接受此药的患者发生了颌骨坏死。 1例患者也发生了非典型股骨骨折。
非常常见(10%或更多):关节痛(高达13.1%)
常见(1%至10%):肌肉痉挛,颈部疼痛
非常罕见(少于0.01%):颌骨坏死,非典型股骨骨折
其他
常见(1%至10%):乏力
精神科
常见(1%至10%):失眠
免疫学的
在临床试验期间,接受该药的5914名绝经后妇女中有18.1%的人产生了抗体。 4.7%的抗体被归类为中和。抗体的产生与较低的血清药物浓度有关,但是与安全性和功效的改变无关。
非常常见(10%或更高):抗药物抗体(18.1%)
新陈代谢
罕见(0.1%至1%):低钙血症
在临床试验中,有2名接受这种药物的妇女发生了低钙血症。据报道,有14名(0.2%)妇女的白蛋白调节血清钙降低至低于8.3 mg / dL。没有调整过的血清钙低于7.5 mg / dL的报道。肾功能正常的患者在经过白蛋白调整后的血清钙中出现最低点。
参考文献
1.“产品信息。均匀性(romosozumab)。”美国安进(Amgen USA),千橡市,CA。
某些副作用可能没有报道。您可以将其报告给FDA。
准备和管理说明
第一步: 此前有dministration:
- 从纸箱中取出两个注射器。
- 服用前目视检查EVENITY是否有颗粒和变色。 EVENITY对乳白色透明,无色至浅黄色溶液。如果溶液混浊或变色或含有颗粒,请勿使用。
- 如果不使用注射器
- 任何部位出现裂纹或破裂
- 灰色的针帽缺失或未牢固连接
- 标签上打印的过期日期已过
- 任何部位出现裂纹或破裂
- 始终将预填充的注射器握在注射器筒上,以从托盘中取出注射器。参见图A。
- 不要抓住柱塞杆。
- 请勿抓住灰色的针帽。
- 准备注射之前,请勿取下灰色的针帽。
- 不要抓住柱塞杆。
- 注射前,让EVENITY在室温下静置至少30分钟。请勿以其他任何方式加热[请参阅供应/储存和处理方式( 16 )] 。
第2步:选择注射部位并准备注射器
准备并清洗两个注射部位,两次注射各一个。参见图B。
 |
推荐的皮下注射部位包括:
●大腿
●腹部,肚脐周围只有两英寸的区域
●上臂外侧
用酒精湿巾清洁注射部位。让皮肤干燥。
●每次注射时,请选择其他站点。如果要使用相同的注射部位,请确保它与上次注射所使用的注射部位不同。
●请勿将其注入皮肤柔软,淤青,发红或坚硬的区域。避免注入有疤痕或妊娠纹的区域。
选择第一个注射器。准备注射时,将灰色的针帽笔直拉开并远离身体。参见图C。
 |
●不要将灰色的针头盖放回注射器上。
第三步:注入活力
插入针头并皮下注射所有液体。不要管理肌肉或血管。参见图D。
 |
完成后,将注射器从皮肤上轻轻提起。
第4步:注射器和针头帽处置
立即将注射器和针头盖丢入最近的锐器容器中。
我mportant:重复与第二针筒所有步骤注入全剂量。
- EVENITY可能会增加心肌梗塞,中风和心血管死亡的风险[请参阅警告和注意事项( 5.1 )]。在前一年内患有心肌梗塞或中风的患者不应该开始EVENITY。考虑是否有其他心血管疾病危险因素的患者获益大于风险。如果患者在治疗过程中发生心肌梗塞或中风,应停止EVENITY。
1适应症和用途
绝经后骨质疏松妇女高骨折风险的治疗
EVENITY用于治疗高骨折风险的绝经后妇女骨质疏松症,定义为骨质疏松性骨折史或多种骨折危险因素;或对其他可用的骨质疏松症治疗无效或不耐受的患者。
使用限制
12个月的剂量治疗后,EVENITY的合成代谢作用减弱。因此,EVENITY的使用期限应限制为每月12剂。如果仍然需要进行骨质疏松症治疗,则应考虑继续使用抗吸收剂治疗[见剂量和给药方法( 2.2 )和临床研究( 14.1 )] 。
2剂量和给药
重要剂量和管理说明
- 需要两个单独的注射器(和两个单独的皮下注射)来管理210毫克EVENITY的总剂量。依次注入两个105 mg / 1.17 mL预填充注射器。
- EVENITY应由医疗保健提供者进行管理。
推荐用量
- 推荐的EVENITY剂量为210毫克,腹部,大腿或上臂皮下注射。每月管理一次EVENITY。
- EVENITY的治疗持续时间为12个月剂量。
- 在进行EVENITY治疗期间,患者应充分补充钙和维生素D [请参阅警告和注意事项( 5.3 )和临床研究( 14.1 )] 。
- 如果错过了EVENITY剂量,则应尽快重新安排。此后,可以从最后一次服药的日期开始每月安排一次EVENITY。
准备和管理说明
第一步: 此前有dministration:
- 从纸箱中取出两个注射器。
- 服用前目视检查EVENITY是否有颗粒和变色。 EVENITY对乳白色透明,无色至浅黄色溶液。如果溶液混浊或变色或含有颗粒,请勿使用。
- 如果不使用注射器
- 任何部位出现裂纹或破裂
- 灰色的针帽缺失或未牢固连接
- 标签上打印的过期日期已过
- 任何部位出现裂纹或破裂
- 始终将预填充的注射器握在注射器筒上,以从托盘中取出注射器。参见图A。
- 不要抓住柱塞杆。
- 请勿抓住灰色的针帽。
- 准备注射之前,请勿取下灰色的针帽。
- 不要抓住柱塞杆。
- 注射前,让EVENITY在室温下静置至少30分钟。请勿以其他任何方式加热[请参阅供应/存储和处理方式( 16 )] 。

第2步:选择注射部位并准备注射器
准备并清洗两个注射部位,两次注射各一个。参见图B。
 |
推荐的皮下注射部位包括:
●大腿
●腹部,肚脐周围只有两英寸的区域
●上臂外侧
用酒精湿巾清洁注射部位。让皮肤干燥。
●每次注射时,请选择其他站点。如果要使用相同的注射部位,请确保它与上次注射所使用的注射部位不同。
●请勿将其注入皮肤柔软,淤青,发红或坚硬的区域。避免注入有疤痕或妊娠纹的区域。
选择第一个注射器。准备注射时,将灰色的针帽笔直拉开并远离身体。参见图C。
 |
●不要将灰色的针头盖放回注射器上。
第三步:注入活力
插入针头并皮下注射所有液体。不要管理肌肉或血管。参见图D。
 |
完成后,将注射器从皮肤上轻轻提起。
第4步:注射器和针头帽处置
立即将注射器和针头盖丢入最近的锐器容器中。
我mportant:重复与第二针筒所有步骤注入全剂量。
3剂型和强度
注射剂:在一次性使用的预填充注射器中,透明至乳白色,无色至浅黄色溶液105 mg / 1.17 mL。
全剂量的EVENITY需要两个一次性使用的预填充注射器。
4禁忌症
下列患者禁用EVENITY:
- 低钙血症。在开始使用EVENITY治疗之前,必须纠正先前存在的低钙血症[请参阅警告和注意事项( 5.3 ) ,不良反应( 6.1 )和在特定人群中使用( 8.7 )] 。
- 对romosozumab或产品制剂中任何成分的全身过敏史。反应包括血管性水肿,多形性红斑和荨麻疹[见警告和注意事项( 5.2 )和不良反应( 6.1 ) ] 。
5警告和注意事项
重大不良心脏事件(MACE)
在绝经后妇女的一项随机对照试验中,与使用阿仑膦酸盐治疗的患者相比,接受EVENITY治疗的患者的重大不良心脏事件(MACE),心血管死亡,非致命性心肌梗塞和非致命性中风的复合终点发生率更高[参见盒装警告和不良反应( 6.1 )] 。
在前一年内患有心肌梗塞或中风的患者不应开始EVENITY。考虑是否有其他心血管疾病危险因素的患者获益大于风险。监测心肌梗塞和中风的体征和症状,如果出现症状,指示患者立即就医。如果患者在治疗过程中发生心肌梗塞或中风,应停止EVENITY。
过敏反应
在接受EVENITY治疗的患者中,出现了过敏反应,包括血管性水肿,多形性红斑,皮炎,皮疹和荨麻疹。如果发生过敏性或其他临床上显着的过敏反应,请开始适当的治疗,并停止进一步使用EVENITY [请参阅禁忌症( 4 )和不良反应( 6.1 )]。
低钙血症
接受EVENITY的患者发生了低钙血症。在开始EVENITY之前纠正低钙血症[请参阅 禁忌症( 4 ),不良反应( 6.1 )和在特定人群中的使用( 8.7 ) ] 。
监测患者的低钙血症迹象和症状。患者在出院时应适当补充钙和维生素D [见剂量和用法( 2.2 )和临床研究( 14.1 )] 。
严重肾功能不全(估计肾小球滤过率[eGFR] 15至29 mL / min / 1.73 m 2 )或接受透析的患者,发生低血钙症的风险更大。监测血清钙并充分补充严重肾功能不全或正在接受钙和维生素D透析的患者。指导严重肾功能不全的患者(包括接受透析的患者)低钙血症的症状以及保持足够钙和钙维持钙水平的重要性补充维生素D。
颚骨坏死
下颌骨坏死(ONJ)可以自发发生,通常与拔牙和/或局部感染有关,延误了愈合,据报道在接受EVENITY的患者中。在开始EVENITY治疗之前,开药者应进行常规的口腔检查。与ONJ相关的药物(化学疗法,双膦酸盐,地诺单抗,血管生成抑制剂和皮质类固醇)的同时给药可能会增加罹患ONJ的风险。 ONJ的其他风险因素包括癌症,放疗,口腔卫生差,先前存在的牙齿疾病或感染,贫血和凝血病 [参见不良反应( 6.1 )] 。
对于需要侵入性牙科手术的患者,主治医师和/或口腔外科医生的临床判断应根据受益风险评估指导每位患者的治疗计划。怀疑患有或在EVENITY期间患有ONJ的患者应接受牙医或口腔外科医生的护理。在这些患者中,用牙科手术治疗ONJ可能会加重病情。应基于收益风险评估考虑终止EVENITY。
股骨粗隆下和干Dia端股骨骨折
据报道,接受EVENITY治疗的患者股骨干典型的低能量或低创伤性骨折[见不良反应( 6.1 )] 。这些骨折可能发生在股骨干中的任何位置,从小转子下方到to上张开上方,并且在没有粉碎迹象的情况下横向或短斜。尚未确定因果关系,因为这些骨折也发生在未经治疗的骨质疏松患者中。
非典型股骨骨折最常见,对患处的损伤很小或没有损伤。他们可能是双侧的,许多患者在受累区域报告前驱性疼痛,通常在完全骨折发生前几周到几个月表现为钝痛,大腿疼痛。
在EVENITY治疗期间,应建议患者报告新的或不寻常的大腿,臀部或腹股沟疼痛。任何出现大腿或腹股沟疼痛的患者均应被怀疑具有非典型骨折,并应进行评估以排除股骨不完全骨折。出现非典型股骨骨折的患者也应评估对侧肢体的骨折症状和体征。应基于获益风险评估考虑中断EVENITY治疗[见临床研究( 14 )] 。
6不良反应
标签的其他部分详细讨论了以下不良反应:
- 主要不良心脏事件[见黑框警告和警告S和注意事项( 5.1 )]
- 过敏[请参见禁忌症( 4 )和警告和注意事项( 5.2 )]
- 低钙血症[SEë禁忌( 4 )和警告和注意事项( 5.3 )]
- 下颌骨坏死[请参阅警告和注意事项( 5.4 )]
- 非典型转子下和骨干股骨骨折[见战争ñ英格斯和注意事项( 5.5 )]
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
在一项多中心,随机,双盲,安慰剂对照研究(研究1,NCT01575834)中对7180名年龄在55至90岁(平均年龄为71岁)的女性进行了评估,评估了EVENITY治疗绝经后骨质疏松的安全性。在12个月的双盲研究期内,每月分别有3581和3576名妇女分别接受至少一剂EVENITY和安慰剂治疗。女性每天至少接受500毫克钙和600国际单位维生素D补充,而77%的妇女在随机化后一周内(如果血清25-羟基维生素D浓度为40 ng / mL,则接受50,000至60,000国际单位维生素D的负荷剂量)或更少)。
在一项多中心,随机,双盲,阿仑膦酸盐对照研究(研究2,NCT01631214)中对55岁至90岁(平均)的4093名绝经后妇女进行了EVENITY治疗绝经后骨质疏松症的安全性评估年龄74岁)。在12个月的双盲研究期内,分别有2040和2014年的女性分别接受了至少一剂EVENITY和阿仑膦酸盐。女性每天至少接受500毫克钙和600国际单位维生素D的补充,而74%的妇女在随机化后的一周内(如果血清25-羟基维生素D的浓度为40 ng / mL或减)。
在研究1中,在12个月的双盲治疗期间,安慰剂组的全因死亡率为0.7%(24/3576),EVENITY组的为0.8%(29/3581)。安慰剂组非致命性严重不良事件的发生率为8.3%,EVENITY组为9.1%。安慰剂组因不良反应而退出研究的患者百分比为1.1%,EVENITY组为1.1%。 EVENITY(大于或等于5%,且发生率高于安慰剂)报告的最常见不良反应是关节痛和头痛。导致EVENITY中断的最常见不良反应是关节痛(安慰剂组为6名受试者[0.2%],EVENITY组为5名受试者[0.1%])。
在研究2中,在12个月的双盲治疗期间,阿仑膦酸盐组的全因死亡率发生率为1.1%(22/2014),而EVENITY组的全因死亡率为1.5%(30/2040)。阿仑膦酸钠组非致命性严重不良事件的发生率为13.3%,EVENITY组为11.9%。由于不良事件而退出研究的患者百分比在阿仑膦酸钠组中为1.2%,在EVENITY组中为1.2%。 EVENITY报告的最常见不良反应(大于或等于5%)是关节痛和头痛。
表1概述了至少一项研究中发生在大于等于2%的EVENITY治疗女性中的最常见不良反应。
| 研究1 | 研究2 | |||
| 首选条款 | 安慰剂 (N = 3576) n(%) | 便利性 (N = 3581) n(%) | 阿仑膦酸盐 (N = 2014) n(%) | 便利性 (N = 2040) n(%) |
| 关节痛 | 434(12.1) | 468(13.1) | 194(9.6) | 166(8.1) |
| 头痛 | 208(5.8) | 235(6.6) | 110(5.5) | 106(5.2) |
| 肌肉痉挛 | 140(3.9) | 163(4.6) | 81(4.0) | 70(3.4) |
| 周围水肿 | 67(1.9) | 86(2.4) | 38(1.9) | 34(1.7) |
| 虚弱 | 79(2.2) | 84(2.3) | 53(2.6) | 50(2.5) |
| 颈部疼痛 | 54(1.5) | 80(2.2) | 42(2.1) | 34(1.7) |
| 失眠 | 68(1.9) | 72(2.0) | 36(1.8) | 34(1.7) |
| 感觉异常 | 62(1.7) | 72(2.0) | 34(1.7) | 29(1.4) |
以下所述的不良反应来自研究1(安慰剂对照)和研究2(阿仑膦酸盐对照)的12个月治疗期。
重大不良心脏事件(MACE)
在安慰剂对照试验的12个月双盲治疗期间(研究1),EVENITY组的9位女性(0.3%)和安慰剂组的8位女性(0.2%)发生了心肌梗塞; EVENITY组的8名女性(0.2%)和安慰剂组的10名女性(0.3%)发生中风。这些事件发生在有无心肌梗塞或中风病史的患者中。 EVENITY组中有17名(0.5%)妇女发生心血管死亡,安慰剂组中有15名(0.4%)妇女发生心血管死亡。在EVENITY组中,接受MACE裁决的女性人数为30(0.8%),在安慰剂组中为29(0.8%),与EVENITY相比,EVEITY的危险比为1.03(95%置信区间[0.62,1.72])。安慰剂。
在主动对照试验的12个月双盲治疗期间(研究2),EVENITY组的16名女性(0.8%)和阿仑膦酸盐组的5名女性(0.2%)发生了心肌梗塞; EVENITY组的13名女性(0.6%)和阿仑膦酸盐组的7名女性(0.3%)发生了中风。这些事件发生在有无心肌梗塞或中风病史的患者中。 EVENITY组中有17名(0.8%)妇女发生心血管死亡,而阿仑膦酸盐组中有12名(0.6%)妇女发生心血管死亡。在EVENITY组中,接受MACE裁决的女性人数为41(2.0%),在阿仑膦酸盐组中为22(1.1%),与之相比,EVENITY的危险比为1.87(95%置信区间[1.11,3.14])。阿仑膦酸盐[见黑框警告和警告S和注意事项( 5.1 )]。
过敏反应
在这两个试验中,据报道,EVENITY组的364名(6.5%)妇女和对照组的365名(6.5%)妇女出现超敏反应。报告的反应包括血管性水肿(EVENITY组为3 [<0.1%]妇女,对照组为3 [<0.1%]妇女),多形性红斑(EVENITY组为1 [<0.1%]妇女,而对照组为无妇女。对照组),皮炎(EVENITY组中32名[0.6%]妇女,对照组中42名[0.8%]妇女),皮疹(EVENITY组中60名[1.1%]妇女与53名[0.9%])对照组的女性)和荨麻疹(活动组的23名女性[0.4%],对照组的27名[0.5%])。尽管没有报道EVENITY发生血管性水肿,皮炎和荨麻疹的发生率高于对照组,但仍有一些血管性水肿,皮炎和荨麻疹病例被确定与EVENITY的使用有关[见禁忌症( 4 )和警告和注意事项( 5.2 ) ]。 。
低钙血症
在这两个试验中,低血钙的不良事件发生在2名接受EVENITY治疗的女性和对照组中的1名女性中。据报道,EVENITY组的14名女性(0.2%)和对照组的10名女性(0.2%)的白蛋白调整后的血清钙降低至参考范围的下限以下(8.3 mg / dL)。没有接受EVENITY治疗的患者血清钙水平低于7.5 mg / dL。肾功能正常的患者在EVENITY给药后的第1个月出现白蛋白调整后的血清钙的最低点[见禁忌症( 4 )和警告和注意事项 ( 5.3 )] 。
注射部位反应
在这两个试验中,EVENITY组的278名女性(4.9%)和对照组的157名女性(2.8%)发生了注射部位反应。最常见的注射部位反应是疼痛(EVENITY组为94 [1.7%]名女性;对照组为70 [1.3%]名女性)和红斑(EVENITY组为80名[1.4%]女,14名[0.3%]对照组中的女性)。注射部位反应导致7例(0.1%)EVENITY治疗的患者和3例(<0.1%)的患者中止治疗。
颚骨坏死
在这两项试验中,一名患者在进行EVENITY治疗期间发生了颌骨坏死[见警告和注意事项( 5.4 )]。
股骨粗隆下和干Dia端骨折
在这两项试验中,在进行EVENITY治疗期间,一名患者发生了非典型股骨骨折[参见警告和注意事项( 5.5 )]。
免疫原性
与所有治疗性蛋白质一样,具有免疫原性的潜力。抗体形成的检测高度依赖于测定的灵敏度和特异性。另外,在测定中观察到的抗体(包括中和抗体)阳性的发生率可能受到几个因素的影响,包括测定方法,样品处理,样品收集的时间,伴随用药和潜在疾病。由于这些原因,将下述研究中的抗体发生率与其他研究中或其他romosozumab产品的抗体发生率进行比较可能会产生误导。
使用免疫测定法评估EVENITY的免疫原性,以检测抗romosozumab-aqqg 抗体。体外 生物 对那些受试者的血清抗romosozumab-aqqg抗体检测呈阳性的受试者进行了中性抗体检测。
在每月接受EVENITY 210 mg治疗的5914名绝经后妇女中,有18.1%的受试者产生了针对romosozumab-aqqg的抗体。在开发出针对罗莫单抗-aqqg的抗体的受试者中,有4.7%的抗体被归类为中和。罗莫单抗-aqqg抗体的开发与血清罗莫单抗-aqqg浓度降低有关[参见 [临床药理学( 12.3 )] 。罗莫单抗-aqqg抗体通常与EVENITY的功效或安全性变化无关。
8在特定人群中的使用
怀孕
风险摘要
EVENITY不适用于有生殖能力的女性。在动物生殖研究中,在器官发生期间每周向怀孕的大鼠施用romosozumab-aqqg,其暴露量大于临床暴露量的31倍,从而在后代中产生骨骼异常。在交配前和哺乳结束前对大鼠施用romosozumab-aqqg可使后代的股骨矿物质密度和/或皮质周长最小或略微降低,为人类预期暴露量的1.4至54倍[参见数据] 。
数据
动物资料
在初步和确定的胚胎-胎儿发育研究,生育力和胚胎发育研究以及产前和产后发育研究中,评估了romosozumab-aqqg对大鼠的生殖和发育影响。
在所有大鼠生殖毒性研究中,在75胎中,有1胎发生了骨骼畸形,其中有1胎是在皮脂中,每周给予皮下注射romosozumab-aqqg剂量为300 mg / kg(相当于在临床上所观察到的至少31倍)根据浓度-时间曲线[AUC]比较下的面积,每月皮下注射210毫克的人)。
在雌雄大鼠的后代中,从同居到交配和哺乳前6周,每周服用romosozumab-aqqg剂量,股骨骨膜和皮质内膜周长分别以10、60和300 mg / kg降低(相当于1.4、18和54倍)根据AUC比较,每月皮下注射210毫克后的临床暴露)。皮质厚度增加至300 mg / kg(相当于预期临床暴露量的54倍)。股骨干phy端骨矿物质密度在60和300 mg / kg时略有下降(相当于预期临床暴露量的18和54倍)。
哺乳期
风险摘要
EVENITY不适用于有生殖能力的女性。在动物研究中,从同居前的六周开始,通过交配和哺乳,怀孕的大鼠每周以10、60或300 mg / kg的剂量接受romosozumab-aqqg的剂量(相当于每月皮下注射剂量的临床暴露量的1.4、18或54倍)在210毫克(基于AUC比较的基础上),由于妊娠和/或哺乳期暴露,romosozumab-aqqg在出生后第21天时的剂量为孕产妇暴露的0.01至2.4倍,呈剂量依赖性。
儿科用
小儿患者尚未确定EVENITY的安全性和有效性。
老人用
在EVENITY的临床研究中,有6544名绝经后骨质疏松妇女,其中5234岁(80%)年龄在65岁以上,2390名(37%)年龄在75岁以上。在这些受试者和较年轻的受试者之间未观察到安全性或疗效的总体差异,其他报告的临床经验也未发现老年和较年轻患者的反应差异,但是不能排除某些老年患者的敏感性更高。
肾功能不全
肾功能不全的患者无需调整剂量。
患有严重肾功能不全(按MDRD方程估计肾小球滤过率[eGFR] 15至29 mL / min / 1.73 m 2 )或接受透析的患者,发生低血钙症的风险更高[请参阅禁忌症( 4 ) ,警告和注意事项( 5.3 )和不良反应( 6.1 ) ] 。监测严重肾功能不全或正在接受透析的患者的钙浓度并适当补充钙和维生素D。
11说明
Romosozumab-aqqg是一种人源化单克隆抗体(IgG2),通过重组DNA技术在哺乳动物细胞系(中国仓鼠卵巢)中产生,该抗体结合并抑制硬化素。 Romosozumab-aqqg的分子量约为149 kDa。
EVENITY(romosozumab-aqqg)注射液为无菌,不含防腐剂,透明至乳白色,无色至浅黄色溶液,可在一次性使用的预填充注射器中进行皮下注射。
需要使用两个105 mg / 1.17 mL的一次性预装注射器来管理210 mg的推荐剂量EVENITY [请参阅剂量和用法( 2.1 )] 。每个一次性填充注射器在注射用水(USP)中提供1.17 mL的溶液,其中包含105 mg的romosozumab-aqqg,乙酸盐(3.8 mg),钙(0.61 mg),聚山梨酯20(0.07 mg)和蔗糖(70 mg),和氢氧化钠至pH为5.2。
12临床药理学
作用机理
EVENITY抑制硬化素的作用,硬化素是骨骼代谢中的调节因子。 EVENITY增加骨骼的形成,并在较小程度上减少骨骼的吸收。动物研究表明,romosozumab-aqqg通过刺激成骨细胞活性刺激小梁和皮质骨表面上的新骨形成,从而导致小梁和皮质骨量增加以及骨骼结构和强度得到改善[请参见非临床毒理学( 13.2 )和临床研究( 14.1 )。 ] 。
药效学
在绝经后患有骨质疏松症的妇女中,EVENITY增加了骨形成标志物1型N型端肽原胶原(P1NP)的浓度,在开始治疗后2周,与安慰剂相比,从基线开始的峰值升高约145%,随后恢复至安慰剂的浓度第9个月,从基线下降到比第12个月安慰剂所见的浓度变化低约15%。
与安慰剂相比,EVENITY在开始治疗后2周降低了骨吸收标记1型胶原C-端肽(CTX),与基线相比最大降低了约55%。 CTX仍低于安慰剂所见的浓度,比第12个月安慰剂所见的浓度变化低约25%。
终止EVENITY后,P1NP水平在12个月内恢复到基线; CTX在3个月内上升到基线以上,并在第12个月恢复到基线水平。
药代动力学
在健康志愿者中单次服用210毫克EVENITY,得出的最大romosozumab-aqqg血清平均浓度(C max )平均为22.2(5.8)mcg / mL,平均ASD为389 (127)微克*天/毫升。每月向绝经后妇女服用210毫克后的第3个月,达到稳态浓度。在第3、6、9和12个月的平均谷值血清romosozumab-aqqg浓度范围为8到13 mcg / mL。
Romosozumab-aqqg表现出非线性的药代动力学,其暴露比剂量成比例地增加(例如,皮下剂量范围从0.1到10 mg / kg的100倍增加,平均AUC inf增加550倍[批准的推荐剂量的0.03到3.3倍一个70公斤的女士)。
吸收性
达到最大Romosozumab-aqqg浓度的中位时间(T max )为5天(范围:2至7天)。
分配
稳态时的估计分配量约为3.92L。
Elimina吨离子
Romosozumab-aqqg表现出非线性的药代动力学,随着剂量的增加,romosozumab-aqqg的清除率降低。单次皮下给药3 mg / kg(70千克妇女的批准推荐剂量)后,罗莫昔单抗-aqqg的估计平均全身清除率(CL / F)为0.38 mL / hr / kg。平均有效t 1/2为每4周3剂3 mg / kg剂量(70公斤妇女批准的推荐剂量)后12.8天。
代谢
romosozumab-aqqg的代谢途径尚未鉴定。作为人源化IgG2单克隆抗体,预计romosozumab-aqqg会通过分解代谢途径以类似于内源IgG的方式降解为小肽和氨基酸。
影响药物动力学的抗产物抗体的形成
抗romozozumab-aqqg抗体的开发与血清romosozumab-aqqg浓度降低有关。抗romozozumab-aqqg抗体的存在导致romosozumab-aqqg的平均浓度降低至22%。中和抗体的存在导致romosozumab-aqqg的平均浓度降低多达63% [参见不良反应( 6.2 )] 。
特定人群
根据年龄(20-89岁),性别,种族,疾病状态(低骨量或骨质疏松),先前接触过阿仑膦酸盐或肾功能不全(包括终末期肾),未观察到罗莫单抗-aqqg药代动力学的临床显着差异需要透析的疾病(ESRD)。 ESRD不需要透析对romosozumab-aqqg药代动力学的影响尚不清楚。
体重
romosozumab-aqqg的暴露随体重增加而降低。
13毒理学
致癌,诱变,生育力受损
致癌性
在一项大鼠致癌性研究中,从8周到98周龄,通过皮下注射向Sprague-Dawley大鼠每周一次分别给予3、10或50 mg / kg的romosozumab-aqqg剂量,导致全身暴露量高达每月皮下注射210毫克EVENITY(基于AUC比较)后,在人体中观察到的全身暴露量是19倍。在所有剂量下,Romosozumab-aqqg引起骨量的剂量依赖性增加,小梁和皮质骨增厚。 romosozumab-aqqg对死亡率没有影响,并且romosozumab-aqqg不会导致雄性或雌性大鼠肿瘤发生率显着增加。
致突变性
诱变作用尚未得到评估,因为预计单克隆抗体不会改变DNA或染色体。
生育能力受损
给予皮下注射romosozumab-aqqg最高300 mg / kg的雄性和雌性大鼠,未观察到对生育力的影响(根据AUC比较,每月皮下注射210 mg EVENITY后,人体观察到的全身暴露量高达54倍)。皮下注射6个月,每周一次剂量最高100 mg / kg的大鼠和食蟹猕猴的生殖器官均未见效果(分别暴露于人体,每月皮下注射剂量210 mg分别达到37和90倍)根据AUC比较)。
动物毒理学与药理学
每周皮下注射Romosozumab-aqqg剂量达100 mg / kg,每周一次,每次26次后,在大鼠和猴子中均未观察到不良反应,分别相当于人体每月一次皮下注射剂量达37 mg和90倍。 210毫克EVENITY(基于AUC比较)。
根据AUC比较,在卵巢切除的大鼠和猴子中,每周一次接受romosozumab-aqqg剂量进行的骨骼安全性研究长达12个月,产生的暴露量是给予人每月210 mg全身暴露量的1至21倍。 Romosozumab-aqqg可通过增加骨膜,皮质内膜和小梁表面的骨形成,并减少骨小梁和皮质内表面的骨吸收来增加骨骼质量并改善松质骨微结构和皮质骨的几何形状。骨量的增加与骨强度的增加显着相关。在大鼠和猴子中,所有骨骼部位的骨质量维持在人类暴露1到21倍的剂量范围内,而椎骨在人类暴露19到21倍的剂量下略有改善。没有证据表明矿化缺陷,类骨质堆积或编织的骨形成。
14临床研究
绝经后妇女骨质疏松症的治疗
研究1 (NCT01575834)是一项随机,双盲,安慰剂对照的研究,研究对象为55至90岁(平均年龄为71岁)的绝经后女性,其骨矿物质密度(BMD)T分数在-2.5总髋部或股骨颈。女性被随机接受为期12个月的EVENITY(N = 3589)或安慰剂(N = 3591)皮下注射。基线时,有18%的女性患有椎骨骨折。经过12个月的治疗期后,两臂妇女均过渡到开放标签抗吸收治疗(denosumab)12个月,同时对初始治疗不知情。妇女每天要补充500至1000毫克钙和600至800国际单位的维生素D。共同的主要疗效终点是在第12和24个月出现新的椎骨骨折。
对骨折的影响
与安慰剂相比,EVENITY到第12个月显着降低了新椎骨骨折的发生率。此外,与从安慰剂转为denosumab的女性相比,在第一年接受EVENITY并转为denosumab的女性,其骨折风险一直持续到第二年。
| 妇女比例 骨折 | 绝对风险 减少 (%) (95%CI) a | 相对风险 减少 (%) ( 95%CI) a | p值b | ||
| 在第12个月 | 安慰剂 (N = 3591) | 便利性 (N = 3589) | |||
| 新椎体骨折 | 1.8% | 0.5% | 1.3 (0.8、1.8) | 73 (53,84) | <0.001 |
| 在第24个月 | 安慰剂跟着 地诺单抗 (N = 3591) | 紧随其后的是 地诺单抗 (N = 3589) | |||
| 新椎体骨折 | 2.5% | 0.6% | 1.9 (1.3、2.5) | 75 (60,84) | <0.001 |
| N =随机分配的受试者数 一种。绝对风险和相对风险降低是基于Mantel-Haenszel方法进行的,该方法针对年龄和普遍的椎骨骨折层进行了调整。 b。 P值基于调整年龄和普遍椎骨骨折层的逻辑回归模型。 | |||||
EVENITY在12个月时显着降低了临床骨折(有症状椎骨骨折和非椎骨骨折的复合终点)的发生率。但是,在比较第12个月或第24个月接受EVENITY治疗的妇女与接受安慰剂治疗的妇女时,这些临床骨折中有88%是非椎骨骨折,并且非椎骨骨折的发生率在统计学上没有显着差异。
对骨矿物质密度( BMD )的影响
与第12个月的安慰剂相比,EVENITY显着增加了腰椎,全髋和股骨颈的BMD。BMD的治疗差异在腰椎为12.7%,在全髋为5.8%,在股骨颈为5.2%。
在第12个月从EVENITY过渡到denosumab之后,BMD持续增加直至第24个月。在从安慰剂过渡到denosumab的患者中,Bdenosumab的使用也会使BMD升高。当比较从EVENITY过渡到denosumab的患者与从安慰剂过渡到denosumab的患者时,EVENITY和安慰剂患者在12个月达到的BMD差异总体保持在24个月。没有证据表明在基线年龄,基线BMD或地理区域所定义的各亚组中,腰椎或全髋关节对BMD的影响存在差异。
After EVENITY discontinuation, BMD returns to approximately baseline levels within 12 months in the absence of follow-on antiresorptive therapy [see Indications and Usage ( 1.2 )] .
Bone Histology and Histomorphometry
A total of 154 transiliac crest bone biopsy specimens were obtained from 139 postmenopausal women with osteoporosis at month 2, month 12, and/or month 24. All of these biopsies were adequate for qualitative histology and 138 (90%) were adequate for full quantitative histomorphometry assessment. Qualitative histology assessments from women treated with EVENITY showed normal bone architecture and quality at all time points. There was no evidence of woven bone, mineralization defects, or marrow fibrosis.
Histomorphometry assessments on biopsies at months 2 and 12 compared the effect of EVENITY with placebo (15 specimens at month 2 and 39 specimens at month 12 in the EVENITY group, 14 specimens at month 2 and 31 specimens at month 12 in the placebo group). At month 2 in women treated with EVENITY, histomorphometric indices of bone formation at trabecular and endocortical surfaces were increased. These effects on bone formation were accompanied by a decrease in indices of bone resorption. At month 12, both bone formation and resorption indices were decreased with EVENITY, while bone volume, and trabecular and cortical thickness were increased.
Study 2 (NCT01631214) was a randomized, double-blind, alendronate-controlled study of postmenopausal women aged 55 to 90 years (mean age of 74 years) with BMD T-score less than or equal to −2.5 at the total hip or femoral neck and either one moderate or severe vertebral fracture or two mild vertebral fractures, or BMD T-score less than or equal to -2.0 at the total hip or femoral neck and either two moderate or severe vertebral fractures or a history of a proximal femur fracture. Women were randomized (1:1) to receive either monthly subcutaneous injections of EVENITY (N = 2046) or oral alendronate 70 mg weekly (N = 2047) for 12 months, with 500 to 1000 mg calcium and 600 to 800 international units vitamin D supplementation daily. After the 12-month treatment period, women in both arms transitioned to open-label alendronate 70 mg weekly while remaining blinded to their initial treatment.
This was an event driven trial. The two primary efficacy endpoints were the incidence of morphometric vertebral fracture at 24 months and time to the first clinical fracture through the primary analysis period, which ended when at least 330 subjects had a clinical fracture and all subjects had completed the 24-month visit. Clinical fracture was a composite endpoint of nonvertebral fracture and symptomatic vertebral fracture.
Effect on Fractures
EVENITY significantly reduced the incidence of new vertebral fracture at 24 months (see Table 3).
| Proportion of Women with Fracture (%) | 降低风险 | p-value b | |||
| Alendronate Alone (N = 2047) | EVENITY Followed by Alendronate (N = 2046) | 绝对风险 Reduction (%) (95% CI) a | 相对风险 Reduction (%) (95% CI) a | ||
| New vertebral fracture through Month 24 | 8.0% | 4.1% | 4.0 (2.5, 5.6) | 50 (34, 62) | <0.001 |
| N = Number of subjects randomized 一种。 Absolute and relative risk reductions are based on the Mantel-Haenszel method adjusting for age strata, baseline total hip BMD T-score (≤ -2.5, > -2.5), and presence of severe vertebral fracture at baseline. b . P-value is based on logistic regression model for new vertebral fracture) adjusting for age strata, baseline total hip BMD T-score, and presence of severe vertebral fracture at baseline. | |||||
EVENITY significantly reduced the risk of clinical fracture through the end of the primary analysis period (see Table 4). This was an event-driven trial and the duration of follow-up varied across subjects. The median duration of subject follow-up for the primary analysis period was 33 months. Subjects with nonvertebral fracture comprised 83% of the subjects with clinical fracture during the primary analysis period.
| Proportion of Women with Fracture (%) a | Hazard Ratio (95% CI) c | p-value c | ||
| Alendronate Alone (N = 2047) | EVENITY Followed by Alendronate (N = 2046) | |||
| Clinical fracture through primary analysis period b | 13.0% | 9.7% | 0.73 (0.61, 0.88) | <0.001 |
| N= Number of subjects randomized 一种。 % = number of subjects who had a clinical fracture through the primary analysis period/N*100%; the duration of follow-up varied across subjects. b。 Primary analysis period ended when clinical fracture events were confirmed for at least 330 subjects and all subjects completed the month 24 study visit. The median duration of follow-up for the primary analysis period was 33 months. C。 Hazard ratio and P-value are based on Cox proportional hazards model adjusting for age strata, baseline total hip BMD T-score, and presence of severe vertebral fracture at baseline | ||||
EVENITY followed by alendronate also significantly reduced the risk of nonvertebral fracture through the primary analysis period (with a median follow-up of 33 months), with a hazard ratio of 0.81 (95% CI: 0.66, 0.99; p = 0.04) compared to alendronate alone.
Effect on Bone Mineral Density (BMD)
EVENITY significantly increased BMD at the lumbar spine, total hip, and femoral neck compared with alendronate at month 12. The treatment differences in BMD were 8.7% at the lumbar spine, 3.3% at the total hip, and 3.2% at the femoral neck.
Twelve months of treatment with EVENITY followed by 12 months of treatment with alendronate significantly increased BMD compared with alendronate alone. The BMD increase with EVENITY over alendronate observed at month 12 was maintained at month 24. The treatment differences in BMD at month 24 were 8.1% at the lumbar spine, 3.8% at the total hip, and 3.8% at the f
已知共有39种药物与Evenity(romosozumab)相互作用。
- 1主要药物相互作用
- 38种中等程度的药物相互作用
检查互动
最常检查的互动
查看均匀性(romosozumab)与下列药物的相互作用报告。
- 对乙酰氨基酚
- 沙丁胺醇
- 阿托伐他汀
- 苯甲酸酯
- 头孢芬(头孢呋辛)
- 克林霉素
- 强力霉素
- Forteo(teriparatide)
- 氢氯噻嗪
- 羟氯喹
- 氯沙坦
- 抒情诗(普瑞巴林)
- 奥美拉唑
- 恩丹西酮
- Plavix(氯吡格雷)
- 氯化钾
- 强的松
- ProAir HFA(沙丁胺醇)
- 异丙嗪
- Repatha(evolocumab)
均匀性(romosozumab)疾病相互作用
与均匀性(romosozumab)共有3种疾病相互作用,包括:
- 低钙血症
- 心肌梗塞/中风
- 颌骨坏死
药物相互作用分类
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
- 审批历史 FDA的药物史
美国日本医生

Heather Benjamin MD

Heather Benjamin MD

Heather Miske DO

Heather Miske DO

Bert Hepner DO

渡邊剛

渡邊剛

宮崎総一郎 中部大学特聘教授

百村伸一 教授
