获取国外Lazanda鼻喷剂药品价格,使用等信息,最快 24 小时回馈
Lazanda鼻喷剂
在本页面
- 盒装警告
- 适应症和用法
- 剂量和给药
- 剂型和优势
- 禁忌症
- 警告和注意事项
- 不良反应/副作用
- 药物相互作用
- 在特定人群中使用
- 药物滥用和依赖性
- 过量
- 描述
- 临床药理学
- 非临床毒理学
- 临床研究
- 供应/存储和处理方式
- 用药指南
警告:危及生命的呼吸抑制;意外接触;细胞色素P450 3A4相互作用;与苯并二氮杂卓或其他中枢神经系统抑制剂同时使用;药物错误风险;上瘾,滥用和误用; REMS;和新生儿阿片类药物戒断综合征
危及生命的呼吸抑制
LAZANDA治疗的患者发生了严重的,威胁生命的和/或致命的呼吸抑制,包括在非阿片类药物耐受患者中使用和剂量不当。监测呼吸抑制,尤其是在启动LAZANDA期间或增加剂量后。用LAZANDA替代任何其他芬太尼产品可能会导致致命的过量[请参阅警告和注意事项(5.1)]。
由于存在呼吸抑制的风险,LAZANDA在包括头痛/偏头痛在内的急性或术后疼痛以及阿片类非耐受性患者的治疗中禁忌使用。 [见禁忌症(4)]
意外接触
意外接触甚至一剂LAZANDA,特别是在儿童中,都可能导致致命过量的芬太尼[见警告和注意事项(5.1)]。据报道,意外摄入经粘膜速释芬太尼产品的儿童死亡。必须将LAZANDA放在儿童无法触及的地方[请参阅警告和注意事项(5.2)]。
细胞色素P450 3A4相互作用
LAZANDA与所有细胞色素P450 3A4抑制剂同时使用可能导致芬太尼血浆浓度增加,这可能增加或延长不良反应,并可能导致致命的呼吸抑制。另外,终止同时使用的细胞色素P450 3A4诱导剂可能导致芬太尼血浆浓度增加。监测接受LAZANDA和任何CYP3A4抑制剂或诱导剂的患者[见警告和注意事项(5.3),药物相互作用(7),临床药理学(12.2)]。
与苯二氮卓类或其他中枢神经系统抑制剂同时使用的风险
阿片类药物与苯二氮卓类或其他中枢神经系统(CNS)抑制剂(包括酒精)并用可能会导致严重的镇静,呼吸抑制,昏迷和死亡[请参阅警告和注意事项(5.4),药物相互作用(7)]。
- 保留伴随使用LAZANDA和苯二氮卓类或其他CNS抑制剂的处方,以供其他治疗选择不足的患者使用。
- 将剂量和持续时间限制在所需的最低限度。
- 跟踪患者的呼吸抑制和镇静症状和体征。
用药错误的风险
与其他芬太尼产品相比,LAZANDA的药代动力学特征存在实质性差异,这导致芬太尼吸收程度的临床重要差异,可能导致致命的过量[见剂量和用法(2.1),警告和注意事项(5.5)]。
- 处方时,请勿将每mcg的患者从任何其他芬太尼产品转换为LAZANDA。
- 分配时,请勿用LAZANDA处方替代其他芬太尼产品。
上瘾,滥用和滥用
LAZANDA使患者和其他使用者面临阿片类药物成瘾,滥用和滥用的风险,这可能导致用药过量和死亡。在开LAZANDA处方前,应评估每个患者的风险,并定期监测所有患者的这些行为和状况的发展[请参阅警告和注意事项(5.6)]。
风险评估和缓解策略(REMS)访问计划
由于存在滥用,滥用,成瘾和用药过量的风险,因此只能通过食品和药物管理局要求的限制性计划(称为风险评估和缓解策略(REMS))获得LAZANDA。根据透粘膜立即释放芬太尼(TIRF)REMS Access计划,门诊病人,开门诊病人,药房和分销商开具的医疗保健专业人员必须加入该计划。 [请参阅警告和注意事项(5.7)]有关更多信息,请访问www.TIRFREMSaccess.com或致电1-866-822-1483。
新生儿阿片类药物戒断综合征
怀孕期间长期使用LAZANDA会导致新生儿阿片类药物戒断综合征,如果不加以识别和治疗,可能会危及生命,并需要根据新生儿科专家制定的方案进行管理。如果孕妇需要长时间使用阿片类药物,则应告知患者新生儿阿片类药物戒断综合征的风险,并确保可获得适当的治疗[见警告和注意事项(5.8)]。
处方信息要点
处方信息要点
这些重点内容不包括安全有效地使用LAZANDA所需的所有信息。查看LAZANDA的完整处方信息
LAZANDA®(芬太尼)鼻喷剂CII
最初的美国批准:1968年
警告:危及生命的呼吸抑制;意外接触;细胞色素P450 3A4相互作用;与苯并二氮杂PIN或其他中枢神经系统抑制剂同时使用有风险;药物错误风险;上瘾,滥用和误用; REMS;和新生儿阿片类药物戒断综合征
有关完整的框内警告,请参阅完整的处方信息。
- 已经发生严重的,威胁生命的和/或致命的呼吸抑制。密切监视,尤其是在开始或增加剂量后。由于存在致命的呼吸抑制的危险,LAZANDA禁止用于阿片类药物非耐受性患者)以及急性或术后疼痛(包括头痛/偏头痛)的治疗。 ((4,5.1)
- 意外接触LAZANDA,尤其是儿童,可能导致致命过量的芬太尼。请将本品放在儿童不能接触的地方。确保正确的存储和处置。 (5.2)
- 与CYP3A4抑制剂同时使用(或停止CYP3A4诱导剂的使用)会导致致命的过量芬太尼。 (5.3,7)
- 阿片类药物与苯二氮卓类或其他中枢神经系统(CNS)抑制剂(包括酒精)并用可能会导致严重的镇静,呼吸抑制,昏迷和死亡。保留相应的处方,以供其他治疗选择不足的患者使用;将剂量和持续时间限制在所需的最低限度,并注意患者的呼吸抑制和镇静症状和体征(5.4、7)。
- 处方时,请勿将每mcg的患者从任何其他口服经粘膜芬太尼产品转换为LAZANDA。 (2.1,5.5)
- 分配时,请勿用任何其他芬太尼产品替代(5.5)
- LAZANDA使用户面临成瘾,滥用和误用的风险,这可能导致用药过量和死亡。在开处方并定期监测这些行为和状况之前,应评估患者的风险。 (5.6)
- LAZANDA仅可通过称为TIRF REMS Access程序的受限制程序使用。要求门诊病人,药房和分销商开处方的门诊病人,医疗保健专业人员。 (5.7)
- 怀孕期间长时间使用LAZANDA会导致新生儿阿片类药物戒断综合征,如果不加以识别和治疗,可能会危及生命。如果孕妇需要长时间使用阿片类药物,请告知患者新生儿阿片类药物戒断综合征的风险,并确保可获得适当的治疗。 (5.8)
---------------------------最近的主要变化-------------------- -------
警告和注意事项(5.1)10/2019
---------------------------指示和用法-------------------- -------
LAZANDA是一种鸦片激动剂,可用于治疗18岁及以上的癌症患者突破性疼痛,这些患者已在接受治疗,并且对于潜在的持续性癌症疼痛可以全天候接受阿片类药物治疗。 (1)
被认为是阿片类药物耐受的患者是那些每天连续服用至少一周,每天至少60毫克吗啡,每小时至少25 mcg透皮芬太尼,至少30毫克口服阿片类药物的患者每天羟考酮,每天至少8 mg口服氢吗啡酮,每天至少25 mg口服羟吗啡酮,每天至少60 mg口服氢可酮或每天等剂量的另一类阿片类镇痛药,持续一周或更长时间。服用LAZANDA时,患者必须全天候使用阿片类药物。
使用限制
- 不适用于阿片类药物非耐受性患者。
- 不适用于治疗急性或术后疼痛,包括头痛/偏头痛,牙齿疼痛或急诊室。
- 作为TIRF REMS Access计划的一部分,LAZANDA只能分配给该计划的门诊病人[请参阅警告和注意事项( 5.7 ) 。对于LAZANDA的住院管理(例如,医院,疗养院和规定用于住院的长期护理机构),不需要患者和处方药注册。
- - - - - - - - - - - -剂量和给药 - - - - - - - - - - - -
- 服用LAZANDA时,患者必须全天候使用阿片类药物。 (1)
- 根据个体患者的治疗目标,在最短的时间内使用最低的有效剂量(2.1)
- 根据疼痛的严重程度,患者的反应,先前的镇痛经验以及成瘾,滥用和误用的风险因素,个性化剂量。 (2.1)
- 所有患者的LAZANDA初始剂量均为100 mcg(一次喷入一个鼻孔)(2.2)
- 分别滴定至100 mcg至200 mcg至300 mcg至400 mcg至600 mcg的有效剂量,最高可至800 mcg,以提供足够的镇痛作用并具有可耐受的副作用。 (2.3)
- 剂量是向一个鼻孔中单次喷雾,向每个鼻孔中单次喷雾(2次喷雾),向单个鼻孔中一次3次单喷雾(交替的鼻孔)或向每个鼻孔两次(4次喷雾)。每24小时不超过四剂。 (2.2,2.3)
- 等待至少2个小时,然后再用LAZANDA治疗突破性疼痛发作。 (2.2)
- 在任何发作期间,如果30分钟内仍无法充分缓解疼痛,则患者可以按照其医疗保健提供者的指示使用急救药物。 (2.3)
- 当不再需要阿片类药物治疗时,请考虑停用LAZANDA并逐渐降低其他阿片类药物的使用量,以最大程度地减少可能的戒断效果。 (2.6)
-----------------------剂量形式和强度-----------------------
- 鼻喷雾剂:每次喷雾剂都会递送100 mcL的溶液,其中包含100 mcg,300 mcg或400 mcg芬太尼碱。 (3)装在装有8个喷雾剂的5 mL瓶中。
-----------------------------------禁忌症-------------- -----------
- 阿片类药物非耐受性患者(4)
- 处理急性或术后疼痛,包括头痛/偏头痛和牙科疼痛,或在急诊室。 (4)
- 严重的呼吸抑制。 (4)
- 急性或重度支气管哮喘,处于不受监视的环境中或没有复苏设备。 (4)
- 已知或怀疑的胃肠道梗阻,包括麻痹性肠梗阻。 (4)
- 已知对芬太尼或LAZANDA成分过敏。 (4)
---------------------------警告和注意事项--------------------
- 慢性肺病患者或老年人,恶病质或虚弱的患者危及生命的呼吸抑制:密切监测,尤其是在开始和滴定过程中。 (5.9)
- 5-羟色胺综合症:血清素能药物的同时给药可能会危及生命。如果怀疑血清素综合症,请停用LAZANDA。 (5.10)
- 肾上腺皮质功能不全:如果确诊,应进行生理性皮质类固醇替代治疗,并让患者戒断阿片类药物。 (5.11)
- 严重低血压:在剂量开始和滴定期间进行监测。循环休克患者应避免使用LAZANDA。 (5.12)
- 颅内压增高,脑肿瘤,头部受伤或意识受损的患者使用的风险:监测镇静和呼吸抑制。避免在意识障碍或昏迷患者中使用LAZANDA。 (5.13)
- - - - - - - - - - - - - - - - - 不良反应 - - - - - - - -------------
- 最常见的不良反应(发生率≥5%)是呕吐,恶心,头晕,发热和便秘。 (6.1)
要报告可疑的不良反应,请致电1-844-452-9263与West Therapeutic Development,LLC联系,或致电1-800-FDA-1088与FDA联系或访问www.fda.gov/medwatch 。
- - - - - - - - - - - - - - - - 药物相互作用 - - - - - - - - ------------
- 混合激动剂/拮抗剂和部分激动剂阿片类镇痛药:避免与LAZANDA一起使用,因为它们可能会降低LAZANDA的镇痛作用或引起戒断症状。 (7)
---------------------------在特定人群中使用------------------- -
- 怀孕:可能造成胎儿伤害。 (8.1)
- 哺乳期:不建议。 (8.2)
- 肾和肝功能不全:慎用LAZANDA。 (8.6)
有关患者咨询信息和药物治疗指南,请参见17。修订日期:10/2019
完整的处方信息:目录
警告:危及生命的呼吸抑制;意外接触;细胞色素P450 3A4相互作用;与苯并二氮杂卓或其他中枢神经系统抑制剂同时使用;药物错误风险;上瘾,滥用和误用; REMS;和新生儿阿片类药物戒断综合征
1适应症和用途
2剂量和给药
3剂量形式和强度
4禁忌症
5警告和注意事项
6不良反应
7药物相互作用
8在特定人群中的使用
9药物滥用与依赖
10过量
11说明
12临床药理学
13毒理学
14临床研究
15供应方式
16患者咨询
用药指南
主要显示面板-POUCH
主显示屏-100 MCG标签
主要显示面板-100 MCG瓶装纸箱
主显示屏-300 MCG标签
主要显示面板-300 MCG瓶装纸箱
主显示屏-400 MCG标签
主显示屏-400 MCG瓶装纸箱
Lazanda鼻喷雾剂的适应症和用法
LAZANDA用于治疗18岁及以上的癌症患者突破性疼痛,这些患者已在接受治疗并且对于潜在的持续性癌症疼痛耐心全天使用阿片类药物治疗。
被视为阿片类药物耐受的患者是那些连续至少一周服用以下药物的患者:每天60毫克口服吗啡,每小时25毫克透皮芬太尼,每天30毫克口服羟考酮,每天8毫克口服氢吗啡酮,或每天至少25毫克口服羟吗啡酮,或每天至少60毫克口服氢可酮,或等阿镇痛剂量的另一片阿片类药物持续一周或更长时间。服用LAZANDA时,患者必须全天候使用阿片类药物。
使用限制:
- 不适用于阿片类药物非耐受性患者。
- 不适用于治疗急性或术后疼痛,包括头痛/偏头痛,牙齿疼痛或急诊室[见禁忌症( 4 )]。
- 作为TIRF REMS Access计划的一部分,LAZANDA只能分配给该计划中的门诊患者。 [请参阅警告和注意事项( 5.7 )] 。对于LAZANDA的住院管理(例如,医院,疗养院和规定住院使用的长期护理机构),不需要患者入组。
Lazanda鼻喷雾剂的剂量和用法
重要剂量和管理说明
2.1重要的剂量和管理说明
在门诊处方LAZANDA的医疗保健专业人员必须参加TIRF REMS Access计划,并遵守REMS的要求,以确保安全使用LAZANDA [请参阅警告和注意事项(5.7)]。
根据个体患者的治疗目标,在最短的时间内使用最低的有效剂量。
重要的是,在任何时候都应尽量减少可供患者使用的力量,以防止混乱和可能的药物过量。
考虑到患者的疼痛严重程度,患者的反应,先前的止痛治疗经验以及成瘾,滥用和误用的风险因素,分别为每个患者启动给药方案。
密切监测患者的呼吸抑制,尤其是在开始治疗的最初24-72小时内,以及在LAZANDA剂量增加后,并相应地调整剂量[参见警告和注意事项(5.1)]。
指示患者和护理人员采取措施安全地存储LAZANDA,并在不再需要时尽快处置未使用的LAZANDA [请参阅警告和注意事项(5.2、5.6),患者咨询信息(17)]。
LAZANDA与其他芬太尼产品没有生物等效性。请勿将患者从其他芬太尼产品中每mcg转换为mcg。没有任何其他芬太尼产品的转化指导。 (注:这包括芬太尼的口服,经皮或肠胃外制剂。)[请参阅警告和注意事项(5.5)]。
LAZANDA不是任何其他口服经粘膜芬太尼产品的通用版本[请参阅警告和注意事项(5.5)]。
初始剂量
2.2初始剂量
对所有患者(包括从另一种芬太尼产品转换而来的患者)使用LAZANDA进行治疗,方法是使用100 mcg LAZANDA喷雾剂(在一个鼻孔中喷雾1剂)。
重复加药
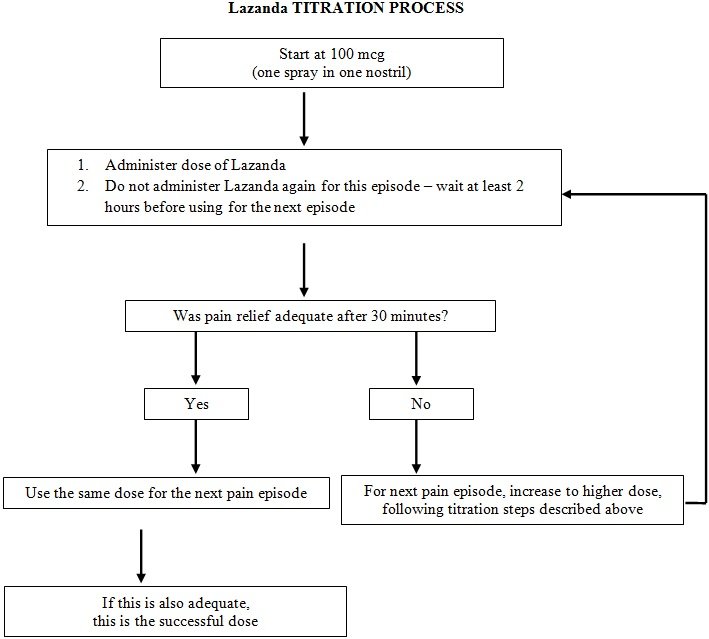
如果在服用100 mcg单次喷雾剂后30分钟内获得了足够的镇痛效果,则以该剂量治疗随后的突破性疼痛发作。
如果前100 mcg剂量不能达到足够的镇痛效果,则在连续的发作性疼痛发作期间逐步增加剂量,直到达到具有可耐受副作用的充分镇痛效果为止。
患者必须至少等待2个小时,才能使用LAZANDA治疗另一例突破性癌症疼痛发作。
滴定和维持治疗
2.3滴定和维持治疗
滴定法
剂量滴定的目的是确定有效且可耐受的维持剂量,以持续管理突破性癌症疼痛发作。 LAZANDA的有效和可耐受剂量将由各个患者的剂量滴定确定。
滴定步骤:如果前100 mcg剂量未达到足够的镇痛作用,则在连续的发作性疼痛发作中逐步增加剂量,直到达到具有可耐受副作用的充分镇痛作用为止。
患者必须至少等待2个小时,才能使用LAZANDA治疗另一例突破性癌症疼痛发作。
滴定步骤应为:
| 拉赞达剂量 | 如何服用剂量 |
| 100微克 | 使用100 mcg剂量;一喷一喷 |
| 200微克 | 使用100 mcg剂量;总共两次喷雾,每个鼻孔一次喷雾 |
| 300微克 | 使用100 mcg剂量;总共三喷,右鼻孔交替喷一遍,左鼻孔第二喷,右鼻窦第三喷 |
| 400微克 | 使用100 mcg的剂量,总共进行四次喷雾,在右鼻孔中交替使用一种喷雾,在左鼻孔中进行第二次喷雾,在右鼻孔中进行第三次喷雾,在左鼻孔中进行第四次喷雾。 要么 使用400微克剂量;一喷一喷 |
| 600微克 | 使用300 mcg剂量;总共两次喷雾,每个鼻孔一次喷雾 |
| 800 | 使用400微克剂量;总共两次喷雾,每个鼻孔一次喷雾 |
患者应在第二次发作性疼痛发作时确认适用于他们的LAZANDA的剂量,并与他们的医生联系,以确定该剂量是否合适,或是否需要进一步调整。
尚未在临床研究中评估高于800 mcg剂量的安全性和有效性。避免使用剂量强度的组合来治疗发作,因为这可能导致混淆和给药错误。

为了最大程度地减少与LAZANDA相关的不良反应的风险并确定合适的剂量,在滴定过程中必须由医疗专业人员进行严格监督。
维持疗法
确定合适的剂量后,指导患者在以后的每次突破性癌痛发作中使用该剂量。将LAZANDA的使用量限制为每天四剂或更少。
患者必须至少等待2个小时,才能使用LAZANDA治疗另一例突破性癌症疼痛发作。
在任何突破性癌症疼痛发作期间,如果在LAZANDA给药后30分钟后疼痛缓解不充分,或者在允许下一剂LAZANDA之前(即2小时内)发生了另一次突破性癌症疼痛发作,则患者可以使用按照其医疗保健提供者的指示抢救药物。
剂量重新调整
2.4剂量调整
如果对滴定的LAZANDA剂量的反应(镇痛或不良反应)明显改变,则可能需要调整剂量以确保维持适当的剂量。
如果每天经历四次以上的突破性疼痛,请重新评估用于持续性基础癌症疼痛的长效阿片类药物的剂量。如果改变了长效阿片类药物或长效阿片类药物的剂量,请根据需要重新评估并重新滴定LAZANDA剂量,以确保患者服用适当的剂量。
限制每天使用LAZANDA来治疗四次或更少发作性疼痛。
当务之急是要由医疗专业人员对任何剂量的重新滴定进行仔细的监测。
LAZANDA的管理
2.5 LAZANDA的管理
指导患者正确使用LAZANDA。
使用前,先将其喷洒到袋子中(共4喷)以对设备进行底涂。如果5天未使用该产品,请喷涂一次以重新上底漆。要进行灌注,请按照提供的说明进行操作[请参阅药物治疗指南]。
将LAZANDA瓶子的喷嘴短距离(约½英寸或1 cm)插入鼻子,并指向鼻子的鼻梁,稍微倾斜瓶子。
用力向下按手指把手,直到听到“喀哒”声,并且计数窗口中的数字增加一。
告知患者细雾喷雾剂并不总是能在鼻粘膜上感觉到,而是要依靠听得见的滴答声和剂量计数器的前进来确认已经施用了雾剂。
中止治疗
2.6中止治疗
对于不再需要阿片类药物治疗的患者,请考虑停用LAZANDA并逐步向下滴定其他阿片类药物,以最大程度地减少可能的停药效应。对于继续接受慢性阿片类药物治疗而引起的持续性疼痛,但不再需要突破性疼痛的患者,通常可以立即终止LAZANDA治疗[见药物滥用和依赖性(9.3)]。
处置LAZANDA
2.7 LAZANDA的处置
指导患者和护理人员正确处理所有未使用,部分使用和使用过的LAZANDA瓶子。必须将所有瓶中剩余的液体喷入包装中提供的小袋中,以便尽快进行安全处理。
指导患者如何正确执行此操作。如果瓶中残留有不需要的治疗性喷雾剂,请指示患者将其喷雾到袋中,直到计数窗口中出现数字“ 8”,并且瓶中不再有完整的治疗性喷雾剂。计数器升至“ 8”后,患者应继续向下按压手指把手总共四次,以从瓶中排出任何残留药物。喷出8剂治疗喷剂后,患者将不会听到喀哒声,并且计数器也不会超过“ 8”。进一步喷出的喷雾剂将不是完全喷雾剂,应始终留在小袋中,不得用于治疗。
指示患者和护理人员密封小袋,然后将其和空瓶放入儿童安全的存储容器中。处理小袋后,患者必须立即用肥皂和水洗手。患者必须将装有小袋和瓶子的儿童安全容器丢弃到垃圾箱中。
患者或护理人员必须继续将LAZANDA奶瓶存放在专门提供的儿童安全容器中,并将小袋存放在儿童无法触及的地方,直到如上所述能够适当处置为止。
指导患者处置LAZANDA瓶,如果自从首次使用LAZANDA瓶以来已经60天或更长时间,请重新开始。
如果看护者或患者在处置LAZANDA瓶时需要其他帮助,请致电West Therapeutic Development,LLC的免费电话(1-844-452-9263)。
剂型和优势
LAZANDA的鼻喷雾剂经配制可喷雾100 mcL的溶液,其中包含100 mcg,300 mcg或400 mcg芬太尼碱。
禁忌症
LAZANDA禁忌症:
阿片类药物非耐受性患者:任何剂量的阿片类药物非耐受性患者都可能发生危及生命的呼吸抑制和死亡[见适应症和用法(1);警告和注意事项( 5.1 )] 。
·急性或术后疼痛,包括头痛/偏头痛和牙齿疼痛,或在急诊室。
·在不受监视的环境中或没有复苏设备的情况下进行的急性或重度支气管哮喘[请参阅警告和注意事项( 5.9 )]
·已知或怀疑的胃肠道梗阻,包括麻痹性肠梗阻[请参阅警告和注意事项( 5.14 )]
已知对芬太尼或LAZANDA成分的超敏反应(例如,过敏反应,超敏反应) [请参阅不良反应( 6.2 )]。
警告和注意事项
危及生命的呼吸抑制
据报告,即使使用阿片类药物,严重,威胁生命或致命的呼吸抑制也是如此。如果不立即识别和治疗呼吸抑制,可能会导致呼吸停止和死亡。呼吸抑制的管理可能包括密切观察,支持措施以及使用阿片类药物拮抗剂,具体取决于患者的临床状况[参见剂量过量(10)]。阿片类药物引起的呼吸抑制导致的二氧化碳(CO2)滞留会加剧阿片类药物的镇静作用。
虽然在使用LAZANDA的任何时候都可能发生严重的,威胁生命的或致命的呼吸抑制,但在开始治疗或增加剂量后风险最大。密切监测患者的呼吸抑制,尤其是在LAZANDA剂量增加后及开始治疗后的最初24-72小时内。
为了降低呼吸抑制的风险,LAZANDA的正确剂量和滴定至关重要[请参阅剂量和用法(2.1)]。高估LAZANDA剂量可能导致首剂过量致命。用LAZANDA替代任何其他芬太尼产品可能会导致致命的过量[请参阅警告和注意事项(5.5)]。
LAZANDA可能会给未开处方的人和不耐受阿片类药物的人致命。
意外摄入(或接触)甚至一剂LAZANDA,尤其是儿童(在儿童中),都可能由于过量的芬太尼而导致呼吸抑制和死亡[参见警告和注意事项(5.2)]。
阿片类药物可引起与睡眠有关的呼吸系统疾病,包括中枢性睡眠呼吸暂停(CSA)和与睡眠有关的低氧血症。阿片类药物的使用以剂量依赖性方式增加了CSA的风险。对于患有CSA的患者,请考虑使用最佳方法来降低阿片类药物的剂量以减少阿片类药物的使用量[参见剂量和用法( 2.4 ) ]。
意外摄入或接触导致儿童服用过量的风险增加
据报道,意外摄入经粘膜速释芬太尼产品的儿童死亡。
必须告知患者及其监护人LAZANDA所含药物的量可能对儿童致命。内科医生和配药师必须特别向患者或看护者询问孩子是否在家中(全天候或探视),并就不慎暴露对儿童的危害提供咨询。
必须指示患者及其看护者将使用和未使用的剂量单位放在儿童接触不到的地方。虽然所有设备在使用后都应立即丢弃,但部分消耗的设备会对儿童构成特殊风险。万一单位未完全消耗完,必须尽快妥善处置[请参阅患者咨询信息(17)]。
《 LAZANDA药物指南》中提供了有关正确储存,管理,处置的详细说明,以及管理过量的LAZANDA的重要说明。鼓励患者完整阅读此信息,并给他们机会回答他们的问题。
同时使用或停用细胞色素P450 3A4抑制剂和诱导剂的风险
LAZANDA与CYP3A4抑制剂(例如大环内酯类抗生素(例如红霉素),唑类抗真菌药(例如酮康唑)和蛋白酶抑制剂(例如利托那韦))同时使用可能会增加血浆中的芬太尼浓度并延长阿片类药物的不良反应,可能会导致潜在的致命性呼吸抑制[请参阅警告和注意事项( 5.2 )] ,尤其是在达到稳定剂量的LAZANDA之后添加抑制剂时。同样,在接受LAZANDA治疗的患者中停用CYP3A4诱导剂(如利福平,卡马西平和苯妥英钠)可能会增加芬太尼的血浆浓度并延长阿片类药物的不良反应。当在接受LAZANDA治疗的患者中使用LAZANDA和CYP3A4抑制剂或停用CYP3A4诱导剂时,应密切监测患者并定期减少LAZANDA的剂量,直至达到稳定的药物作用[见剂量和给药方法( 2.3 ),药物相互作用( 7 )]。
LAZANDA与CYP3A4诱导剂的同时使用或CYP3A4抑制剂的停用可能降低芬太尼血浆浓度,阿片类药物疗效或可能导致对芬太尼产生身体依赖性的患者出现戒断综合征。当将LAZANDA与CYP3A4诱导剂一起使用或停用CYP3A4抑制剂时,应定期密切监测患者并在需要维持足够的镇痛或出现阿片类药物戒断症状时考虑增加阿片类药物的剂量[见剂量和给药方法( 2.6 ),药物相互作用( 7 ) ]。
与苯二氮卓类或其他中枢神经系统抑制剂同时使用的风险
LAZANDA与苯二氮卓类药物或其他中枢神经系统抑制剂(例如非苯二氮卓类镇静剂/催眠药,抗焦虑药,镇定剂,肌肉松弛剂,全身麻醉剂,抗精神病药,其他阿片类药物,酒精类药物)并用可能会导致严重的镇静,呼吸抑制,昏迷和死亡。 )。由于存在这些风险,因此这些药物应同时开处方以供其他治疗选择不充分的患者使用。
观察性研究表明,与单独使用阿片类镇痛药相比,同时使用阿片类镇痛药和苯二氮卓类药物会增加与药物相关的死亡风险。由于具有相似的药理特性,可以合理预期与其他使用阿片类镇痛药的中枢神经系统抑制药同时使用的风险相似[见药物相互作用(7)]。
如果决定与阿片类镇痛药同时开具苯二氮杂或其他中枢神经系统抑制剂,则应开出最低有效剂量和最短持续使用时间。在已经接受阿片类镇痛药的患者中,开处方的苯二氮卓类或其他中枢神经系统抑制剂的起始剂量要比不存在阿片类药物时要低,并根据临床反应进行滴定。如果已经服用苯二氮卓类药物或其他中枢神经系统抑制剂的患者开始使用阿片类镇痛剂,则应开始降低阿片类镇痛剂的初始剂量,并根据临床反应进行滴定。密切关注患者的呼吸抑制和镇静症状和体征。
向患者和护理人员提供有关LAZANDA与苯二氮卓类或其他CNS抑制剂(包括酒精和非法药物)一起使用时呼吸抑制和镇静的风险的建议。建议患者不要驾驶或操作重型机械,直到确定同时使用苯二氮卓类或其他CNS抑制剂的效果为止。筛查患者是否存在滥用药物的风险,包括阿片类药物滥用和滥用,并警告他们与使用其他中枢神经系统抑制药(包括酒精和非法药物)有关的用药过量和死亡风险[请参阅药物相互作用(7),患者咨询信息( 17)]。
用药错误的风险
处方时,请勿将患者从任何其他芬太尼产品转换为LAZANDA,因为mcg / mcg为基础,因为以微克/微克为基础的LAZANDA和其他芬太尼产品并不等效。
LAZANDA不是其他透粘膜速释芬太尼(TIRF)制剂的通用版本。分配时,在任何情况下都不要用LAZANDA处方替代任何其他TIRF处方。其他TIRF配方和LAZANDA不等效。与其他芬太尼产品(包括其他TIRF制剂)相比,LAZANDA的药代动力学特征存在实质性差异,这导致芬太尼吸收速率和程度的临床重要差异。由于这些差异,用LAZANDA替代任何其他芬太尼产品可能会导致致命的过量。
没有任何其他芬太尼产品的安全转换说明可用于患者。 (注:这包括芬太尼的口服,经皮或肠胃外制剂。)因此,对于阿片类药物耐受的患者,LAZANDA的初始剂量应始终为ONE 100 mcg喷雾剂。每个患者应单独滴定以提供足够的镇痛作用,同时最大程度地减少副作用[见剂量和用法(2.3)]。
上瘾,滥用和滥用
LAZANDA含有芬太尼II类受控物质。作为阿片类药物,LAZANDA使使用者面临上瘾,滥用和滥用的风险[请参阅药物滥用和依赖性(9)]。
尽管任何人上瘾的风险尚不明确,但可能会在适当处方LAZANDA的患者中发生。如果滥用或滥用药物,则可能以推荐剂量上瘾。
在开处方LAZANDA之前,应评估每个患者的阿片类药物成瘾,滥用或滥用的风险,并监测所有接受LAZANDA的患者的这些行为和状况的发展。具有个人或家庭药物滥用史(包括吸毒或酗酒或成瘾)或精神疾病(如严重抑郁症)的患者的风险增加。但是,这些潜在风险不应妨碍任何给定患者的疼痛适当管理。可能会给风险增加的患者开处方阿片类药物,例如LAZANDA,但在此类患者中使用时,必须对LAZANDA的风险和正确使用进行深入的咨询,并对成瘾,滥用和滥用的迹象进行严格监控。
阿片类药物是吸毒者和成瘾性疾病患者所寻求的,并且会被转用于刑事犯罪。处方或分发LAZANDA时请考虑这些风险。减少这些风险的策略包括开出最小剂量的适当药物,并建议患者正确处置未使用的药物[请参阅患者咨询信息( 17 )] 。请与当地的州专业许可委员会或州控制的物质管理局联系,以获取有关如何预防和检测此产品的滥用或转移的信息。
透粘膜速释芬太尼(TIRF)风险评估和缓解策略(REMS)访问计划
由于存在滥用,滥用,成瘾和用药过量的风险[请参阅警告和注意事项(5.6)] ,因此只能通过REMS的受限制程序(称为TIRF REMS Access程序)使用LAZANDA。根据TIRF REMS Access计划,门诊病人,开给门诊病人,药房和分销商的医疗专业人员必须参加该计划。对于LAZANDA的住院管理(例如,医院,疗养院和开具住院使用处方的长期护理设施),不需要患者和开处方者的注册。
TIRF REMS Access程序的必需组件是:
·开处方LAZANDA的医疗保健专业人员必须查看TIRF REMS Access计划的开处方教育材料,加入该计划并遵守REMS要求。
·要接受LAZANDA,门诊患者必须了解其风险和收益并签署《患者处方药协议》。
·分配LAZANDA的药房必须加入该计划,并同意遵守REMS要求。
·分发LAZANDA的批发商和分销商必须注册该计划,并且仅分发给授权药房。
有关更多信息,包括合格药房/分销商的列表,请访问www.tirfremsaccess.com或致电1-866-822-1483。
新生儿阿片类药物戒断综合征
怀孕期间长时间使用LAZANDA可能导致新生儿停药。与成人类鸦片戒断综合征不同,新生儿类鸦片戒断综合征如果不得到认可和治疗,可能会危及生命,并且需要根据新生儿科专家制定的方案进行管理。观察新生儿的新生儿阿片戒断综合征的征兆,并据此进行处理。建议孕妇长时间使用阿片类药物有新生儿阿片戒断综合症的风险,并确保可获得适当的治疗[见在特定人群中使用(8.1),患者咨询信息(17)]。
慢性肺病患者或老年人,恶病质或虚弱患者的危及生命的呼吸抑制
禁忌在没有监测的情况下或在没有复苏设备的情况下,在患有急性或重度支气管哮喘的患者中使用LAZANDA。
慢性肺病患者:经LAZANDA治疗的患有严重慢性阻塞性肺疾病或肺心病的患者,以及呼吸储备,低氧血症,高碳酸血症或先前存在呼吸抑制显着下降的患者,其呼吸驱动功能降低的风险增加,包括呼吸暂停,即使使用推荐剂量的LAZANDA [请参阅警告和注意事项( 5.1 )] 。
老年,恶病质或虚弱的患者:老年,恶病质或虚弱的患者更可能发生危及生命的呼吸抑制,因为与年轻,健康的患者相比,他们的药代动力学或清除率发生了变化[请参阅警告和注意事项( 5.1 )] 。
密切监视此类患者,尤其是在启动和滴定LAZANDA以及与其他抑制呼吸的药物同时给予LAZANDA时[请参见警告和注意事项( 5.1 )] 。或者,考虑在这些患者中使用非阿片类镇痛药。
血清素综合症与血清素能药物的同时使用
据报道,在同时使用芬太尼和5-羟色胺能药物的过程中,可能会危及生命的5-羟色胺综合征病例。血清素能药物包括选择性5-羟色胺再摄取抑制剂(SSRIs),5-羟色胺和去甲肾上腺素再摄取抑制剂(SNRIs),三环抗抑郁药(TCA),曲普坦,5-HT3受体拮抗剂,影响血清素能神经递质系统的药物(例如,米氮平,曲唑酮,曲马多) ,某些肌肉松弛剂(例如环苯扎林,美他沙酮)和会削弱5-羟色胺代谢的药物(包括MAO抑制剂,既用于治疗精神疾病的抑制剂,也包括其他药物,如利奈唑胺和静脉注射亚甲蓝) [请参阅药物相互作用( 7 ) ] 。这可能发生在建议的剂量范围内。
5-羟色胺综合征症状可能包括精神状态变化(例如,躁动,幻觉,昏迷),自主神经不稳定(例如,心动过速,不稳定的血压,体温过高),神经肌肉畸变(例如,反射亢进,不协调,僵硬)和/或胃肠道症状(例如恶心,呕吐,腹泻)。症状的发作通常在数小时至数天的同时使用中发生,但可能在此之后发生。如果怀疑血清素综合症,请停用LAZANDA。
肾上腺功能不全
据报道,使用阿片类药物导致肾上腺皮质功能不全的病例,多于使用一个月以上。肾上腺功能不全的表现可能包括非特异性症状和体征,包括恶心,呕吐,厌食,疲劳,虚弱,头晕和低血压。如果怀疑肾上腺功能不全,请尽快通过诊断测试确认诊断。如果诊断出肾上腺功能不全,请使用生理替代剂量的皮质类固醇治疗。使患者断奶,以使肾上腺功能恢复,并继续皮质类固醇治疗直至肾上腺功能恢复。可以尝试使用其他阿片类药物,因为有些病例报道使用了其他阿片类药物,但没有肾上腺功能不全的复发。可用的信息不能确定任何特定的阿片类药物更可能与肾上腺功能不全有关。
严重低血压
LAZANDA可能导致非卧床患者的严重低血压,包括体位性低血压和晕厥。降低血压或同时服用某些中枢神经系统抑制药(例如吩噻嗪或全身麻醉剂)已使维持血压的能力受到损害的患者风险增加[见药物相互作用(7)]。开始或滴定LAZANDA剂量后,监测这些患者的低血压迹象。在循环休克患者中,LAZANDA可能引起血管舒张,从而进一步降低心输出量和血压。循环休克患者应避免使用LAZANDA。
颅内压增高,脑肿瘤,头部受伤或意识受损的患者使用的风险
在可能易受颅内CO 2保留作用影响的患者(例如,那些有颅内压升高或脑肿瘤证据的患者)中,LAZANDA可能会降低呼吸驱动力,并且所产生的CO 2保留会进一步增加颅内压。监视此类患者的镇静和呼吸抑制迹象,尤其是在开始使用LAZANDA疗法时。
阿片类药物也可能使头部受伤患者的临床病情变得模糊。避免在意识障碍或昏迷患者中使用LAZANDA。
胃肠道疾病患者的使用风险
LAZANDA禁用于患有已知或疑似胃肠道梗阻(包括麻痹性肠梗阻)的患者。
LAZANDA中的芬太尼可能引起Oddi括约肌痉挛。阿片类药物可能导致血清淀粉酶增加。监测包括急性胰腺炎在内的胆道疾病患者的症状是否恶化。
癫痫病患者的癫痫发作风险增加
LAZANDA中的芬太尼可能会增加癫痫发作患者的癫痫发作频率,并可能增加在其他与癫痫发作相关的临床环境中发生癫痫发作的风险。监测有癫痫病史的患者,以防LAZANDA治疗期间癫痫发作控制恶化。
驾驶和操作机械的风险
LAZANDA可能会损害执行潜在危险活动(如驾驶汽车或操作机器)所需的智力或身体能力。警告患者不要驾驶或操作危险的机器,除非他们对LAZANDA的耐受性宽容并且知道他们将如何对药物做出反应。
心脏疾病
静脉注射芬太尼可能会导致心动过缓。因此,患有心律失常的患者应谨慎使用LAZANDA。
不良反应
临床研究经验
由于临床试验是在广泛不同的条件下进行的,因此不能将在某种产品的临床试验中观察到的不良事件发生率与另一种药物的临床试验中发生的发生率直接进行比较,并且可能无法反映实际中观察到的发生率。
LAZANDA的安全性已在总共523名具有突破性癌症疼痛的阿片耐受性患者中进行了评估。在长期研究中,患者的平均治疗时间为73天,其中153名患者接受了3个月以上的治疗。继续进入安全性研究的开放标签扩展期的患者已经接受了长达26个月的治疗。
LAZANDA的临床试验旨在评估治疗突破性癌症疼痛的安全性和有效性。所有患者还因持续的癌症疼痛而服用阿片类药物,如持续释放的吗啡,持续释放的羟考酮或经皮芬太尼。表1中显示的不良反应数据反映了接受LAZANDA治疗突破性癌症疼痛以及伴随类鸦片药物持续性疼痛的患者中经历每种不良反应的患者的实际百分比。没有尝试纠正其他阿片类药物的同时使用,LAZANDA治疗的持续时间或与癌症相关的症状。包括因果关系或严重程度在内的不良事件。表1列出了在滴定期间按最大接受剂量发生的总人群中总发生率为5%或更高的不良反应。将LAZANDA分配给这些不良事件的剂量反应关系的能力受到这些研究中使用的滴定方案的限制。
表1:在滴定过程中以> 5%的频率发生的不良反应
系统器官类MedDRA首选术语,n(%) | 100微克 (N = 483) | 200微克 (N = 380) | 400微克 (N = 301) | 800微克 (N = 161) | 总 (N = 516) |
胃肠道疾病 | |||||
恶心 | 19(4) | 6(2) | 6(2) | 5(3) | 35(7) |
呕吐 | 14(3) | 10(3) | 9(3) | 1(1) | 33(6) |
神经系统疾病 | |||||
头晕 | 14(3) | 11(3) | 6(2) | 4(2) | 31(6) |
表2按剂量列出了确定最终滴定剂量后发生的总人群中总发生率≥5%的不良反应。
表2:在维持治疗期间发生的不良反应的频率≥5%
系统器官类MedDRA首选术语,n(%) | 100微克 (N = 61) | 200微克 (N = 68) | 400微克 (N = 109) | 800微克 (N = 108) | 总 (N = 346) |
胃肠道疾病 | |||||
呕吐 | 8(13) | 5(7) | 9(8) | 12(11) | 34(10) |
恶心 | 4(7) | 6(9) | 4(4) | 9(8) | 23(7) |
便秘 | 6(10) | 1(1) | 8(7) | 5(5) | 20(6) |
一般疾病和给药部位情况 | |||||
发热 | 3(5) | 5(7) | 8(7) | 6(6) | 22(6) |
下面列出的不良反应代表接受LAZANDA期间≥1%的临床试验患者发生的不良反应。事件按系统器官类别分类。
眼疾:干眼,肿胀,上睑下垂,斜视
血液和淋巴系统疾病:贫血,中性粒细胞减少
心脏疾病:心肺骤停
胃肠道疾病:呕吐,恶心,便秘,腹泻,腹痛,胃炎,腹水,口干,消化不良,口腔溃疡,proctalgia
一般疾病和给药部位条件:发热,疲劳,周围水肿,乏力,水肿
肝胆疾病:黄疸
免疫系统疾病:超敏反应
感染和侵染:尿路感染,肺炎,鼻咽炎,感染,鼻炎,上呼吸道感染,支气管炎
伤害,中毒和程序并发症:坠落
调查:体重减轻,血液碱性磷酸酶升高
代谢和营养失调:脱水,食欲不振,高血糖,厌食
肌肉骨骼和结缔组织疾病:背痛,四肢疼痛,关节痛
神经系统疾病:头晕,嗜睡,头痛,消化不良
精神疾病:焦虑,失眠,抑郁,精神错乱,神志不清,躁动
呼吸,胸和纵隔疾病:呼吸困难,鼻出血,咳嗽,咽喉痛,鼻腔不适,鼻漏,鼻充血,滴鼻后,肺栓塞
皮肤和皮下组织疾病:瘙痒,多汗症,褥疮,口腔溃疡
血管疾病:高血压,深静脉血栓形成
上市后经验
在批准后使用芬太尼的过程中,发现了以下不良反应。由于这些反应是从不确定大小的人群中自愿报告的,因此并非总是能够可靠地估计其发生频率或建立与药物暴露的因果关系。
5-羟色胺综合症:在与阿片类药物同时使用5-羟色胺能药物的过程中,已经报告了5-羟色胺综合症的病例,这可能危及生命。
肾上腺皮质功能不全:有报告称使用阿片类药物会导致肾上腺皮质功能不全,使用时间超过一个月以上。
过敏反应:据报道,LAZANDA中含有过敏反应。
雄激素缺乏症:长期使用阿片类药物已发生雄激素缺乏症[见临床药理学( 12.2 )]。
药物相互作用
表3列出了与LAZANDA具有临床意义的药物相互作用。
表3:与LAZANDA具有临床意义的药物相互作用
CYP3A4抑制剂 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
临床影响: | LAZANDA和CYP3A4抑制剂的同时使用可增加血浆中芬太尼的浓度,导致增加或延长的阿片类药物作用,尤其是在达到稳定剂量的LAZANDA后添加抑制剂时[见警告和注意事项(5.4)]。 停止使用CYP3A4抑制剂后,随着抑制剂作用的降低,芬太尼的血浆浓度将降低[见临床药理学(12.3)],导致对阿芬太尼产生身体依赖性的患者的阿片类药物疗效降低或戒断综合征。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
介入: | 如果需要同时使用,请考虑降低LAZANDA的剂量,直至达到稳定的药物作用。定期监测患者的呼吸抑制和镇静作用。 如果停止使用CYP3A4抑制剂,请考虑增加LAZANDA剂量,直至达到稳定的药物作用。监测阿片类药物戒断症状。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
例子 | 大环内酯类抗生素(例如红霉素),唑类抗真菌药(例如酮康唑),蛋白酶抑制剂(例如利托那韦),葡萄柚汁 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
CYP3A4诱导剂 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
临床影响: | LAZANDA和CYP3A4诱导剂的同时使用可降低芬太尼的血浆浓度[见临床药理学(12.3)] ,导致对芬太尼有身体依赖性的患者疗效下降或戒断综合征发作[见警告和注意事项(5.18) )] 。 停止使用CYP3A4诱导剂后,随着诱导剂作用的降低,芬太尼血浆浓度将升高[见临床药理学(12.3)] ,这可能会增加或延长治疗作用和不良反应,并可能导致严重的呼吸抑制。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
介入: | 如果需要同时使用,请考虑增加LAZANDA的剂量,直到达到稳定的药物作用。监测阿片类药物戒断症状。如果停止使用CYP3A4诱导剂,应考虑降低LAZANDA剂量并监测呼吸抑制的迹象。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
例子 | 利福平,卡马西平,苯妥英 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
苯二氮卓类和其他中枢神经系统抑制剂 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
临床影响: | 由于具有附加的药理作用,苯并二氮杂and和其他中枢神经系统抑制剂(包括酒精)的并用可能增加低血压,呼吸抑制,镇静,昏迷和死亡的风险。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
介入: | 保留这些药物的处方,以供其他治疗选择不足的患者使用。将剂量和持续时间限制在所需的最低限度。密切注意患者的呼吸抑制和镇静症状[见警告和注意事项(5.4)]。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
例子: | 苯二氮卓类和其他镇静剂/催眠药,抗焦虑药,镇定剂,肌肉松弛剂,全身麻醉药,抗精神病药,其他阿片类药物,酒精。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
血清素药物 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
临床影响: | 阿片类药物与其他影响5-羟色胺能神经递质系统的药物同时使用会导致血清素综合征[见警告和注意事项5.10]。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
介入: | 如果需要同时使用,请仔细观察患者,尤其是在治疗开始和剂量调整期间。如果怀疑血清素综合症,请停用LAZANDA。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
例子: | 选择性5-羟色胺再摄取抑制剂(SSRIs),5-羟色胺和去甲肾上腺素再摄取抑制剂(SNRIs),三环抗抑郁药(TCA),曲坦类,5-HT3受体拮抗剂,影响5-羟色胺神经递质系统的药物(例如,米氮平,曲唑酮,曲马多),某些肌肉松散剂(即环苯扎林,美他沙酮),单胺氧化酶(MAO)抑制剂(旨在治疗精神疾病的抑制剂以及其他药物,如利奈唑胺和静脉注射亚甲蓝)。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
单胺氧化酶抑制剂(MAOIs) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
临床影响: | MAOI与阿片类药物的相互作用可能表现为5-羟色胺综合征[见警告和注意事项(5.10)]或阿片类药物毒性(如呼吸抑制,昏迷) [见警告和注意事项(5.1)]。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
介入: | 不建议在服用MAOI的患者中或在停止此类治疗的14天内使用LAZANDA。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
例子: | 苯乙肼,环丙亚胺,利奈唑胺 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
注意:本文档包含有关芬太尼的副作用信息。此页面上列出的某些剂型可能不适用于品牌名称Lazanda。 对于消费者适用于芬太尼:锭剂/锭剂,喷雾剂,片剂 其他剂型:
警告舌下途径(喷雾) 警告:危及生命的呼吸抑制,意外摄入;细胞色素P450 3A4相互作用;与苯二氮卓类或其他中枢神经系统抑制剂并用的风险;用药错误的风险;上瘾,滥用和滥用; REMS;和新生儿阿片类药物戒断综合征发生严重,威胁生命和/或致命的呼吸抑制。密切监视,尤其是在开始或增加剂量后。由于致命的呼吸抑制风险,在非阿片类药物耐受性患者以及急性或术后疼痛(包括头痛/偏头痛)的治疗中禁忌使用芬太尼舌下喷雾剂,误服芬太尼舌下喷雾剂(尤其是儿童)可能导致致命性过量服用芬太尼。请将本品放在儿童不能接触的地方。确保适当的存储和处置与CYP3A4抑制剂同时使用(或终止CYP3A4诱导剂)会导致致命的过量芬太尼过量的阿片类药物与苯二氮卓类或其他中枢神经系统抑制剂一起使用,包括酒精可能会导致严重的镇静,呼吸抑制,昏迷和死亡。保留相应的处方,以供其他治疗选择不足的患者使用;将剂量和持续时间限制在所需的最低限度,并根据患者的呼吸抑制和镇静症状和体征进行处方。在处方时,请勿将患者以mcg / mcg的剂量从任何其他经口粘膜芬太尼产品转换为芬太尼舌下喷雾剂。芬太尼舌下喷雾剂会使使用者面临成瘾,滥用和误用的风险,这可能导致用药过量和死亡。在开处方并定期监测这些行为和状况之前评估患者的风险。芬太尼舌下喷剂只能通过称为TIRF REMS Access程序的受限程序来使用。门诊,药房和分销商开出的门诊医生,医疗专业人员必须参加该计划。怀孕期间长时间使用芬太尼舌下喷剂可能导致新生儿阿片类药物戒断综合征,如果不加以认可和治疗,可能会危及生命。如果孕妇需要长时间使用阿片类药物,请告知患者新生儿阿片类药物戒断综合征的风险,并确保提供适当的治疗。 颊粘膜途径(电影;锭剂/锭剂;片剂) 由于存在致命的呼吸抑制的危险,因此阿片类非耐受性患者以及包括头痛/偏头痛在内的急性或术后疼痛的治疗均禁止使用透粘膜柠檬酸芬太尼柠檬酸盐。在治疗期间监测呼吸抑制。意外摄入芬太尼可能导致致命的过量服用,尤其是在儿童中;请将本品放在儿童不能接触的地方。与CYP3A4抑制剂或诱导剂一起使用可能会改变芬太尼的血浆水平,导致致命的过量芬太尼过量,建议进行监测。阿片类药物与苯二氮卓类或其他中枢神经系统抑制剂(包括酒精)并用可能会导致严重的镇静,呼吸抑制,昏迷和死亡。对于没有足够替代治疗选择的患者,应同时开处方,将剂量和持续时间限制在所需的最低限度,并监测呼吸抑制和镇静作用。开处方时,请勿将患者从其他任何芬太尼产品中以每mcg为基础转换为mcg。分配时,请勿用任何其他芬太尼产品替代。芬太尼是一种附表II受控物质,具有与其他阿片类镇痛药相似的滥用责任。在开始治疗之前评估风险,并监测治疗期间是否存在滥用,滥用和成瘾的迹象。仅可通过称为透粘膜即时释放芬太尼风险评估和缓解策略(TIRF REMS)访问程序的受限程序获得。要求门诊病人,药房和分销商开处方的门诊病人,医疗保健专业人员。怀孕期间长时间使用可能会导致新生儿阿片戒断综合征。如果孕妇需要长时间使用,请告知患者潜在的胎儿风险并确保可获得适当的治疗。 舌下途径(平板电脑) 由于致命的呼吸抑制危险,阿片类非耐受性患者以及急性或术后疼痛(包括头痛/偏头痛)的治疗均禁止使用舌下柠檬酸芬太尼。在治疗期间监测呼吸抑制。意外摄入芬太尼可能导致致命的过量服用,尤其是在儿童中;请将本品放在儿童不能接触的地方。与CYP3A4抑制剂或诱导剂一起使用可能会改变芬太尼的血浆水平,导致致命的剂量过量,建议进行监测。阿片类药物与苯二氮卓类或其他中枢神经系统抑制剂(包括酒精)并用可能会导致严重的镇静,呼吸抑制,昏迷和死亡。对于没有足够替代治疗选择的患者,应同时开处方,将剂量和持续时间限制在所需的最低限度,并监测呼吸抑制和镇静作用。开处方时,请勿将患者从其他任何芬太尼产品中以每mcg为基础转换为mcg。分配时,请勿用任何其他芬太尼产品替代。芬太尼是一种附表II受控物质,具有与其他阿片类镇痛药相似的滥用责任。在开始治疗之前评估风险,并监测治疗期间是否存在滥用,滥用和成瘾的迹象。仅可通过称为透粘膜即时释放芬太尼风险评估和缓解策略(TIRF REMS)访问程序的受限程序获得。要求门诊病人,药房和分销商开处方的门诊病人,医疗保健专业人员。怀孕期间长时间使用可能会导致新生儿阿片戒断综合征。如果孕妇需要长时间使用,请告知患者潜在的胎儿风险并确保可获得适当的治疗。 需要立即就医的副作用除其所需的作用外,芬太尼(Lazanda中包含的活性成分)可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。 服用芬太尼时,如果有下列任何副作用,请立即与医生联系: 比较普遍;普遍上
不常见
如果服用芬太尼时出现以下任何过量症状,请立即寻求紧急帮助: 服用过量的症状
不需要立即就医的副作用芬太尼可能会产生某些副作用,通常不需要医治。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。 请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问: 比较普遍;普遍上
不常见
发病率未知
对于医疗保健专业人员适用于芬太尼:颊膜,颊片,复方粉,注射液,静脉内溶液,鼻喷雾剂,口服锭剂,口服透粘膜锭剂,舌下喷雾剂,舌下片剂,经皮装置,经皮薄膜缓释 一般最常见的不良反应包括头痛,恶心,呕吐,头晕和便秘。 [参考] 神经系统很常见(10%或更多):嗜睡,头晕 常见(1%至10%):镇静,发热,疲劳,嗜睡,震颤,头痛,发冷,烦躁,不适,精神错乱,思维异常,焦虑,烦躁不安 罕见(0.1%至1%):感觉过敏 非常罕见(少于0.01%):严重偏瘫性偏头痛 未报告的频率:口齿不清,感觉异常,感觉异常,震颤 上市后报告:意识丧失,眩晕,昏迷,休克,抽搐[Ref] 偶尔有癫痫发作的报道,但一些研究者建议,报道的类似癫痫发作的事件可能是芬太尼引起的僵硬发作。 [参考] 心血管的常见(1%至10%):心动过速 罕见(0.1%至1%):窦性心动过速,胸痛,高血压,低血压,心 罕见(小于0.1%):心律不齐,心脏骤停 未报告频率:晕厥,血管舒张,心动过缓,重婚,心肌梗塞 上市后报告:循环性抑郁症[参考] 一项报告表明,由于其他原因,硬膜外芬太尼可能掩盖了接受芬太尼治疗的患者的心肌缺血性疼痛。另一报告提示某些接受相关麻醉药舒芬太尼的患者可能发生QTc间隔延长。另一报告暗示芬太尼是主动脉瓣狭窄和充血性心力衰竭患者脉动交替的潜在原因。 然而,芬太尼已被一些人主张为冠状动脉手术的令人满意的药物。 [参考] 胃肠道非常常见(10%或更多):恶心(18%),呕吐(10%),便秘 常见(1%至10%):口干,腹胀,胃炎,吞咽困难,消化不良,胃食管反流病,腹水,呕血,味觉变态,腹痛,脱水,厌食,恶病质,呕吐,口干,口腔溃疡/口腔炎,舌头浮肿 罕见(0.1%至1%):腹部膨大,肠胃胀气 罕见(少于0.1%):胆管十二指肠括约肌痉挛 未报告频率:腹泻 上市后报告:肠梗阻,龋齿,牙齿脱落,牙龈退缩,牙龈炎,牙龈出血,嘴唇浮肿,咽水肿,牙龈出血,溃疡[参考] 泌尿生殖罕见(0.1%至1%):尿retention留 非常稀有(少于0.01%):暴行 未报告频率:尿路感染,排尿障碍,血尿,尿急,排尿困难[参考] 皮肤科非常常见(10%或更多):离子电渗透皮系统:应用部位反应-红斑(14%) 常见(1%至10%):应用部位刺激,瘙痒 罕见(0.1%至1%):多汗症,皮疹 罕见(少于0.1%):全身性皮疹 未报告的频率:囊泡,丘疹/脓疱,皮肤干燥和剥落,囊泡性皮疹伤口部位渗血/出血,伤口部位炎症/红斑 上市后报告:应用部位排出,应用部位出血,应用部位感染,皮疹和结ab,糜烂,感觉异常,应用部位坏死[参考] 去除离子电渗透皮系统后24小时,约60%的患者皮肤部位出现红肿。多数皮肤事件分类为轻度,红斑和丘疹。 2例患者在应用部位色素沉着持续2至3周; 3名患者在应用部位出现矩形标记,并持续了3个月。 [参考] 过敏症稀有(小于0.1%):过敏[参考] 血液学观察到的溶血可能与快速注射大量低渗的芬太尼(Lazanda中包含的活性成分)溶液有关。因此,作者建议降低注射速度和/或等渗液体中的混合物。 [参考] 常见(1%至10%):贫血,中性粒细胞减少,淋巴结病,血小板减少,白细胞减少,天冬氨酸转氨酶升高,血碱性磷酸酶升高,血糖升高,血乳酸升高,白蛋白血症,血管舒张[参考] 免疫学的罕见(0.1%至1%):口腔念珠菌病,蜂窝组织炎,肺炎,泌尿道感染,口腔疱疹,肠胃炎,喉炎 非常罕见(少于0.01%):硬膜外给药后复发性单纯疱疹感染[参考] 新陈代谢常见(1%至10%):乏力,周围水肿,体重减轻,低钾血症,低钠血症,低钙血症 非常罕见(少于0.01%):抗利尿激素不当综合征 未报告频率:异常愈合,脱水[参考] 内分泌罕见(0.1%至1%):冲洗[参考] 肌肉骨骼常见(1%至10%):跌倒/意外伤害,背痛,关节痛,关节肿胀,肌肉无力,肌阵挛,不自主的肌肉收缩,肌肉僵硬(涉及包括呼吸道在内的呼吸肌组织) 未报告频率:腿抽筋,肌痛 上市后报告:步态/协调异常[参考] 眼科罕见(0.1%至1%):视力模糊,干眼 稀有(小于0.1%):视力异常[参考] 精神科常见(1%至10%):抑郁,精神错乱,幻觉,失眠 罕见(0.1%至1%):焦虑,烦躁,躁动,躁动,神志不清,异常的梦,人格解体,抑郁,情绪低落,欣快,del妄 未报告频率:紧张[参考] 呼吸道常见(1%至10%):呼吸困难,鼻炎,打哈欠,呼吸窘迫,呼吸暂停,呼吸缓慢,通气不足,呼吸抑制 罕见(0.1%至1%):咳嗽,支气管分泌增加,发声困难,咽喉痛,喘息,缺氧,劳累性呼吸困难 非常罕见(少于0.01%):急性非心源性肺水肿 未报告频率:哮喘,打ic,肺不张,换气过度 上市后报告:呼吸停止[参考] 参考文献1.“产品信息。Ionsys(芬太尼)。” Ortho McNeil Pharmaceutical,新泽西州Raritan。 2. Weinger MB,Swerdlow NR,Millar WL“先前健康的产后急性期post妄和锥体外系体征。” Anesth Analg 67(1988):291-5 3. Goroszeniuk T,Albin M,Jones RM“从简单的芬太尼-依托咪酯麻醉中恢复后的全身性大发作。” Anesth Analg 65(1986):979-81 4. Noble DW,Morrison LM,Brockway MS,Mcclure JH“硬膜外芬太尼后的呼吸抑制”。 Br J Anaesth 72(1994):251 5. Palmer CM“鞘内注射芬太尼-吗啡后,早期呼吸抑制”。麻醉学74(1991):1153-5 6. Smith NT,Benthuysen JL,Bickford RG,Sanford TJ,Blasco T,Duke PC,N头,Dec-Silver H“阿片类药物麻醉诱导期间发作–它们是阿片类药物诱导的刚性吗?”麻醉学71(1989):852-62 7. Sebel PS,Bovill JG,“芬太尼和抽搐”。 Anesth Analg 62(1983):858-9 8. Cerner Multum,Inc.“英国产品特性摘要”。 00 9. Rao TL,Mummaneni N,El-Etr AA“惊厥:对静脉注射芬太尼的异常反应。” Anesth Analg 61(1982):1020-1 10. Eisenach JC“鞘内阿片类药物引起的呼吸抑制”。麻醉学75(1991):712 11. Bernstein KJ,Klausner MA,“用于术后疼痛的与透皮芬太尼(duragesic(r))有关的潜在危险。” Dis Colon Rectum 37(1994):1339-40 12. Comstock MK,Carter JG,Moyers JR,Stevens WC“与高剂量芬太尼诱导麻醉相关的刚性和高碳酸血症”。麻醉Analg 60(1981):362-3 13.丹尼尔·D·萨夫瓦特(Safwat AM),“服用芬太尼后出现巨大的癫痫发作”。麻醉学59(1983):78 14. Mirenda J,Tabatabai M,Wong K“大剂量芬太尼麻醉后,僵硬和延长的硬度大于24小时。”麻醉学69(1988):624-5 15. Crawford RD,Baskoff JD“与芬太尼有关的man妄。”麻醉学53(1980):168-9 16. Sandler AN,Baxter AD,Katz J,Samson B,Friedlander M,Norman P,Koren G,Roger S,Hull K,Klein J“腹部子宫切除术后透皮芬太尼的双盲安慰剂对照试验:呼吸和药代动力学作用。”麻醉学81(1994):1169-80 17. Jackson FW“芬太尼和木箱。”胃肠病学106(1994):820-1 18. Benthuysen JL,Stanley TH“关于已报告的芬太尼癫痫发作的可能性质。”麻醉学62(1985):205 19. Varrassi G,Celleno D,Capogna G等。 “蛛网膜下腔芬太尼对老年人的通气作用。”麻醉47(1992):558-62 20. Arandia HY,Patil VU“大剂量芬太尼后声门闭合。”麻醉学66(1987):574-5 21. Streisand JB,Bailey PL,LeMaire L,MA Ashburn,Tarver SD,Varvel J,Stanley TH“芬太尼诱导的人类志愿者僵化和意识丧失。发病率,持续时间和血浆浓度。”麻醉学78(1993):629-34 22. Harper MH,Hickey RF,Cromwell TH,Linwood S“芬太尼和芬太尼加氟哌啶对人的呼吸抑制作用的程度和持续时间。” Pharmacol Exp Ther 199(1976):464-8 23. Gil-Gouveia R,宾夕法尼亚州威尔金森,Kaube H:“用于食管胃镜检查的芬太尼镇静引起的严重偏瘫偏头痛发作。”神经学63(2004):2446-7 24. Steinberg RB,Gilman DE,Johnson F,3d“使用透皮芬太尼治疗的患者的急性毒性del妄。” Anesth Analg 75(1992):1014-6 25. Hoien AO“服用芬太尼后发生的另一例重大癫痫发作”。麻醉学60(1984):387-8 26. Brockway MS,Noble DW,Sharwood-Smith GH,McClure JH,“硬膜外芬太尼后严重呼吸抑制。” Br J Anaesth 64(1990):243-5 27. Hays LR,Stillner V,Littrell R“与口服摄入有关的芬太尼依赖性”。麻醉学77(1992):819-20 28. Blair JR,Pruett JK,Crumrine RS,Balser JJ“延长QT间隔与大剂量鸦片的给药有关”。麻醉学67(1987):442-3 29. Oden RV,Karagianes TG“可能通过硬膜外芬太尼镇痛掩盖术后心肌缺血。”麻醉学74(1991):941-3 30. Freeman AB,Steinbrook RA,“芬太尼注射后,主动脉瓣狭窄和充血性心力衰竭患者的脉搏交替性复发。” Can Anaesth Soc J 32(1985):654-7 31. Sebel PS,Bovill JG,Boekhorst RA,Rog N“大剂量芬太尼麻醉的心血管作用”。麻醉麻醉学报(26)(1982):308-15 32. Hilgenberg JC,Johantgen WC“蛛网膜下腔麻醉期间静脉注射芬太尼后心动过缓”。 Anesth Analg 59(1980):162-3 33. Sosis M“芬太尼和呕吐”。 Can Anaesth Soc J 32(1985):314-5 34. Gaskey NJ,Ferriero L,Pournaras L,Seecof J“使用芬太尼明显增加了妇科短期住院患者的恶心和呕吐。” AANA J 54(1986):309-11 35. White MJ,Berghausen EJ,Dumont SW,Tsueda K,Schroeder JA,Vogel RL,Heine MF,Huang KC“连续硬膜外输注吗啡和芬太尼时的副作用”。 Can J Anaesth 39(1992):576-82 36. McCammon RL,Viegas OJ,Stoelting RK,Dryden GE“与麻醉药相关的纳洛酮逆转了胆总管十二指肠括约肌痉挛。”麻醉学48(1978):437 37.“ Multum Information Services,Inc.专家评审小组” 38. Chin JL,Sharpe JR,“精神分裂症和麻醉:新的考虑”。乌克兰杂志130(1983):371 39. Stoukides CA,Stegman M“与透皮芬太尼相关的弥漫性皮疹。”临床药物11(1992):222 40. Bennett MJ,Anderson LK,McMillan JC,Ebertz JM,Hanifin JM,Hirshman CA“麻醉期间与芬太尼皮内皮肤试验阳性有关的过敏反应。” Can Anaesth Soc J 33(1986):75-8 41. Zucker-Pinchoff B,Ramanathan S“对硬膜外芬太尼的过敏反应。”麻醉学杂志71(1989):599-601 42. Furuya H,Okumura F“大剂量芬太尼给药后的溶血作用”。 Anesth Analg 65(1986):207-8 43. Valley MA,Bourke DL,McKenzie AM“接受硬膜外芬太尼治疗的患者的胸,唇单纯疱疹病毒感染复发。”麻醉学76(1992):1056-7 44. Kokko H,PD馆,Afrin LB“抗利尿激素分泌不当的芬太尼相关综合征”。药物疗法22(2002):1188-92 45. Soto J,Sacristan JA,Alsar MJ“由于芬太尼引起的肺水肿?”。麻醉47(1992):913-4 46. Ananthanarayan C“芬太尼的令人讨厌的效果”。麻醉45(1990):595 47. Bohrer H,Fleischer F,Werning P“通过中央静脉导管给药的芬太尼推注的药效”。麻醉45(1990):18-21 48. Phua WT,Teh BT,Jong W,Lee TL,Tweed WA“芬太尼大剂量的推翻效果”。 Can J Anaesth 38(1991):330-4 49. Tweed WA,Dakin D:“大剂量注射芬太尼后出现爆炸性咳嗽。” Anesth Analg 92(2001):1442-3 某些副作用可能没有报道。您可以将其报告给FDA。 滴定和维持治疗2.3滴定和维持治疗 滴定法 剂量滴定的目的是确定有效且可耐受的维持剂量,以持续管理突破性癌症疼痛发作。 LAZANDA的有效和可耐受剂量将由各个患者的剂量滴定确定。 滴定步骤:如果前100 mcg剂量未达到足够的镇痛作用,则在连续的发作性疼痛发作中逐步增加剂量,直到达到具有可耐受副作用的充分镇痛作用为止。 患者必须至少等待2个小时,才能使用LAZANDA治疗另一例突破性癌症疼痛发作。 滴定步骤应为:
患者应在第二次发作性疼痛发作时确认适用于他们的LAZANDA的剂量,并与他们的医生联系,以确定该剂量是否合适,或是否需要进一步调整。 尚未在临床研究中评估高于800 mcg剂量的安全性和有效性。避免使用剂量强度的组合来治疗发作,因为这可能导致混淆和给药错误。
为了最大程度地减少与LAZANDA相关的不良反应的风险并确定合适的剂量,在滴定过程中必须由医疗专业人员进行严格监督。 维持疗法 确定合适的剂量后,指导患者在以后的每次突破性癌痛发作中使用该剂量。将LAZANDA的使用量限制为每天四剂或更少。 患者必须至少等待2个小时,才能使用LAZANDA治疗另一例突破性癌症疼痛发作。 在任何突破性癌症疼痛发作期间,如果在LAZANDA给药后30分钟后疼痛缓解不充分,或者在允许下一剂LAZANDA之前(即2小时内)发生了另一次突破性癌症疼痛发作,则患者可以使用按照其医疗保健提供者的指示抢救药物。 剂量重新调整2.4剂量调整 如果对滴定的LAZANDA剂量的反应(镇痛或不良反应)明显改变,则可能需要调整剂量以确保维持适当的剂量。 如果每天经历四次以上的突破性疼痛,请重新评估用于持续性基础癌症疼痛的长效阿片类药物的剂量。如果改变了长效阿片类药物或长效阿片类药物的剂量,请根据需要重新评估并重新滴定LAZANDA剂量,以确保患者服用适当的剂量。 限制每天使用LAZANDA来治疗四次或更少发作性疼痛。 当务之急是要由医疗专业人员对任何剂量的重新滴定进行仔细的监测。 LAZANDA的管理2.5 LAZANDA的管理 指导患者正确使用LAZANDA。 使用前,先将其喷洒到袋子中(共4喷)以对设备进行底涂。如果5天未使用该产品,请喷涂一次以重新上底漆。要进行灌注,请按照提供的说明进行操作[请参阅药物治疗指南]。 告知患者细雾喷雾剂并不总是能在鼻粘膜上感觉到,而是要依靠听得见的滴答声和剂量计数器的前进来确认已经施用了雾剂。 中止治疗2.6中止治疗 对于不再需要阿片类药物治疗的患者,请考虑停用LAZANDA并逐步向下滴定其他阿片类药物,以最大程度地减少可能的停药效应。对于继续接受慢性阿片类药物治疗而引起的持续性疼痛,但不再需要突破性疼痛的患者,通常可以立即终止LAZANDA治疗[见药物滥用和依赖性(9.3)]。 处置LAZANDA2.7 LAZANDA的处置 指导患者和护理人员正确处理所有未使用,部分使用和使用过的LAZANDA瓶子。必须将所有瓶中剩余的液体喷入包装中提供的小袋中,以便尽快进行安全处理。 指导患者如何正确执行此操作。如果瓶中残留有不需要的治疗性喷雾剂,请指示患者将其喷雾到袋中,直到计数窗口中出现数字“ 8”,并且瓶中不再有完整的治疗性喷雾剂。计数器升至“ 8”后,患者应继续向下按压手指把手总共四次,以从瓶中排出任何残留药物。喷出8剂治疗喷剂后,患者将不会听到喀哒声,并且计数器也不会超过“ 8”。进一步喷出的喷雾剂将不是完全喷雾剂,应始终留在小袋中,不得用于治疗。 指示患者和护理人员密封小袋,然后将其和空瓶放入儿童安全的存储容器中。处理小袋后,患者必须立即用肥皂和水洗手。患者必须将装有小袋和瓶子的儿童安全容器丢弃到垃圾箱中。 患者或护理人员必须继续将LAZANDA奶瓶存放在专门提供的儿童安全容器中,并将小袋存放在儿童无法触及的地方,直到如上所述能够适当处置为止。 指导患者处置LAZANDA瓶,如果自从首次使用LAZANDA瓶以来已经60天或更长时间,请重新开始。 如果看护者或患者在处置LAZANDA瓶时需要其他帮助,请致电West Therapeutic Development,LLC的免费电话(1-844-452-9263)。 盒装警告 警告:危及生命的呼吸抑制;意外接触;细胞色素P450 3A4相互作用;与苯并二氮杂卓或其他中枢神经系统抑制剂同时使用;药物错误风险;上瘾,滥用和误用; REMS;和新生儿阿片类药物戒断综合征 危及生命的呼吸抑制 LAZANDA治疗的患者发生了严重的,威胁生命的和/或致命的呼吸抑制,包括在非阿片类药物耐受患者中使用和剂量不当。监测呼吸抑制,尤其是在启动LAZANDA期间或增加剂量后。用LAZANDA替代任何其他芬太尼产品可能会导致致命的过量[请参阅警告和注意事项( 5.1 )]。 由于存在呼吸抑制的风险,LAZANDA在包括头痛/偏头痛在内的急性或术后疼痛以及阿片类非耐受性患者的治疗中禁忌使用。 [见禁忌症( 4 )] 意外接触 意外接触甚至一剂LAZANDA,特别是在儿童中,都可能导致致命过量的芬太尼[见警告和注意事项( 5.1 )]。据报道,意外摄入经粘膜速释芬太尼产品的儿童死亡。 LAZANDA必须放在儿童无法触及的地方[请参阅警告和注意事项( 5.2 )]。 细胞色素P450 3A4相互作用 LAZANDA与所有细胞色素P450 3A4抑制剂同时使用可能导致芬太尼血浆浓度增加,这可能增加或延长不良反应,并可能导致致命的呼吸抑制。另外,终止同时使用的细胞色素P450 3A4诱导剂可能导致芬太尼血浆浓度增加。监测接受LAZANDA和任何CYP3A4抑制剂或诱导剂的患者[见警告和注意事项( 5.3 ),药物相互作用( 7 ),临床药理学( 12.2 )]。 与苯二氮卓类或其他中枢神经系统抑制剂同时使用的风险 阿片类药物与苯二氮卓类或其他中枢神经系统(CNS)抑制剂(包括酒精)并用可能会导致严重的镇静,呼吸抑制,昏迷和死亡[请参阅警告和注意事项( 5.4 ),药物相互作用( 7 )]。
用药错误的风险 与其他芬太尼产品相比,LAZANDA的药代动力学特征存在实质性差异,这导致芬太尼吸收程度的临床重要差异,可能导致致命的过量[见剂量和用法( 2.1 ),警告和注意事项( 5.5 )]。
上瘾,滥用和滥用 LAZANDA使患者和其他使用者面临阿片类药物成瘾,滥用和滥用的风险,这可能导致用药过量和死亡。在开LAZANDA处方前,应评估每个患者的风险,并定期监测所有患者的这些行为和状况的发展[请参阅警告和注意事项( 5.6 )]。 风险评估和缓解策略(REMS)访问计划 由于存在滥用,滥用,成瘾和用药过量的风险,因此只能通过食品和药物管理局要求的限制性计划(称为风险评估和缓解策略(REMS))获得LAZANDA。根据透粘膜立即释放芬太尼(TIRF)REMS Access计划,门诊病人,开门诊病人,药房和分销商开具的医疗保健专业人员必须加入该计划。 [请参阅警告和注意事项( 5.7 )]有关更多信息,请访问www.TIRFREMSaccess.com或致电1-866-822-1483。 新生儿阿片类药物戒断综合征 怀孕期间长期使用LAZANDA会导致新生儿阿片类药物戒断综合征,如果不加以识别和治疗,可能会危及生命,并需要根据新生儿科专家制定的方案进行管理。如果孕妇长时间需要使用阿片类药物,则应告知患者新生儿阿片类药物戒断综合征的风险,并确保可获得适当的治疗[见警告和注意事项( 5.8 )]。 处方信息要点处方信息要点 这些重点内容不包括安全有效地使用LAZANDA所需的所有信息。查看LAZANDA的完整处方信息 LAZANDA®(芬太尼)鼻喷剂CII 最初的美国批准:1968年 警告:危及生命的呼吸抑制;意外接触;细胞色素P450 3A4相互作用;与苯并二氮杂PIN或其他中枢神经系统抑制剂同时使用有风险;药物错误风险;上瘾,滥用和误用; REMS;和新生儿阿片类药物戒断综合征 有关完整的框内警告,请参阅完整的处方信息。
---------------------------最近的主要变化-------------------- ------- 警告和注意事项( 5.1 )10/2019 ---------------------------指示和用法-------------------- ------- LAZANDA是一种鸦片激动剂,可用于治疗18岁及以上的癌症患者突破性疼痛,这些患者已在接受治疗,并且对于潜在的持续性癌症疼痛可以全天候接受阿片类药物治疗。 ( 1 ) 被认为是阿片类药物耐受的患者是那些每天连续服用至少一周,每天至少60毫克吗啡,每小时至少25 mcg透皮芬太尼,至少30毫克口服阿片类药物的患者每天羟考酮,每天至少8 mg口服氢吗啡酮,每天至少25 mg口服羟吗啡酮,每天至少60 mg口服氢可酮或每天等剂量的另一类阿片类镇痛药,持续一周或更长时间。服用LAZANDA时,患者必须全天候使用阿片类药物。 使用限制
- - - - - - - - - - - -剂量和给药 - - - - - - - - - - - -
-----------------------剂量形式和强度-----------------------
-----------------------------------禁忌症-------------- -----------
---------------------------警告和注意事项--------------------
- - - - - - - - - - - - - - - - - 不良反应 - - - - - - - -------------
要报告可疑的不良反应,请致电1-844-452-9263与West Therapeutic Development,LLC联系,或致电1-800-FDA-1088与FDA联系或访问www.fda.gov/medwatch 。 - - - - - - - - - - - - - - - - 药物相互作用 - - - - - - - - ------------
---------------------------在特定人群中使用------------------- -
有关患者咨询信息和药物治疗指南,请参见17 。修订日期:10/2019 完整的处方信息:目录警告:危及生命的呼吸抑制;意外接触;细胞色素P450 3A4相互作用;与苯并二氮杂卓或其他中枢神经系统抑制剂同时使用;药物错误风险;上瘾,滥用和误用; REMS;和新生儿阿片类药物戒断综合征 1适应症和用途 2剂量和给药 3剂量形式和强度 4禁忌症 5警告和注意事项 6不良反应 7药物相互作用 8在特定人群中的使用 9药物滥用与依赖 10过量 11说明 12临床药理学 13毒理学 14临床研究 15供应方式 16患者咨询 用药指南 主要显示面板-POUCH 主显示屏-100 MCG标签 主要显示面板-100 MCG瓶装纸箱 主显示屏-300 MCG标签 主要显示面板-300 MCG瓶装纸箱 主显示屏-400 MCG标签 主显示屏-400 MCG瓶装纸箱 Lazanda鼻喷雾剂的适应症和用法LAZANDA用于治疗18岁及以上的癌症患者突破性疼痛,这些患者已在接受治疗并且对于潜在的持续性癌症疼痛耐心全天使用阿片类药物治疗。 被视为阿片类药物耐受的患者是那些连续至少一周服用以下药物的患者:每天60毫克口服吗啡,每小时25毫克透皮芬太尼,每天30毫克口服羟考酮,每天8毫克口服氢吗啡酮,或每天至少25毫克口服羟吗啡酮,或每天至少60毫克口服氢可酮,或等阿镇痛剂量的另一片阿片类药物持续一周或更长时间。服用LAZANDA时,患者必须全天候使用阿片类药物。 使用限制:
Lazanda鼻喷雾剂的剂量和用法重要剂量和管理说明2.1重要的剂量和管理说明 在门诊开具LAZANDA的医疗保健专业人员必须参加TIRF REMS Access计划,并遵守REMS的要求,以确保安全使用LAZANDA [请参阅警告和注意事项( 5.7 )]。 初始剂量2.2初始剂量 对所有患者(包括从另一种芬太尼产品转换而来的患者)使用LAZANDA进行治疗,方法是使用100 mcg LAZANDA喷雾剂(在一个鼻孔中喷雾1剂)。 重复加药 如果在服用100 mcg单次喷雾剂后30分钟内获得了足够的镇痛效果,则以该剂量治疗随后的突破性疼痛发作。 滴定和维持治疗2.3滴定和维持治疗 滴定法 剂量滴定的目的是确定有效且可耐受的维持剂量,以持续管理突破性癌症疼痛发作。 LAZANDA的有效和可耐受剂量将由各个患者的剂量滴定确定。 滴定步骤:如果前100 mcg剂量未达到足够的镇痛作用,则在连续的发作性疼痛发作中逐步增加剂量,直到达到具有可耐受副作用的充分镇痛作用为止。 患者必须至少等待2个小时,才能使用LAZANDA治疗另一例突破性癌症疼痛发作。 滴定步骤应为:
患者应在第二次发作性疼痛发作时确认适用于他们的LAZANDA的剂量,并与他们的医生联系,以确定该剂量是否合适,或是否需要进一步调整。 尚未在临床研究中评估高于800 mcg剂量的安全性和有效性。避免使用剂量强度的组合来治疗发作,因为这可能导致混淆和给药错误。
为了最大程度地减少与LAZANDA相关的不良反应的风险并确定合适的剂量,在滴定过程中必须由医疗专业人员进行严格监督。 维持疗法 确定合适的剂量后,指导患者在以后的每次突破性癌痛发作中使用该剂量。将LAZANDA的使用量限制为每天四剂或更少。 患者必须至少等待2个小时,才能使用LAZANDA治疗另一例突破性癌症疼痛发作。 在任何突破性癌症疼痛发作期间,如果在LAZANDA给药后30分钟后疼痛缓解不充分,或者在允许下一剂LAZANDA之前(即2小时内)发生了另一次突破性癌症疼痛发作,则患者可以使用按照其医疗保健提供者的指示抢救药物。 剂量重新调整2.4剂量调整 如果对滴定的LAZANDA剂量的反应(镇痛或不良反应)明显改变,则可能需要调整剂量以确保维持适当的剂量。 如果每天经历四次以上的突破性疼痛,请重新评估用于持续性基础癌症疼痛的长效阿片类药物的剂量。如果改变了长效阿片类药物或长效阿片类药物的剂量,请根据需要重新评估并重新滴定LAZANDA剂量,以确保患者服用适当的剂量。 限制每天使用LAZANDA来治疗四次或更少发作性疼痛。 当务之急是要由医疗专业人员对任何剂量的重新滴定进行仔细的监测。 LAZANDA的管理2.5 LAZANDA的管理 指导患者正确使用LAZANDA。 使用前,先将其喷洒到袋子中(共4喷)以对设备进行底涂。如果5天未使用该产品,请喷涂一次以重新上底漆。要进行灌注,请按照提供的说明进行操作[请参阅药物治疗指南]。 告知患者细雾喷雾剂并不总是能在鼻粘膜上感觉到,而是要依靠听得见的滴答声和剂量计数器的前进来确认已经施用了雾剂。 中止治疗2.6中止治疗 对于不再需要阿片类药物治疗的患者,请考虑停用LAZANDA并逐步向下滴定其他阿片类药物,以最大程度地减少可能的停药效应。对于继续接受慢性阿片类药物治疗而引起的持续性疼痛,但不再需要突破性疼痛的患者,通常可以立即终止LAZANDA治疗[见药物滥用和依赖性( 9.3 )]。 处置LAZANDA2.7 LAZANDA的处置 指导患者和护理人员正确处理所有未使用,部分使用和使用过的LAZANDA瓶子。必须将所有瓶中剩余的液体喷入包装中提供的小袋中,以便尽快进行安全处理。 指导患者如何正确执行此操作。如果瓶中残留有不需要的治疗性喷雾剂,请指示患者将其喷雾到袋中,直到计数窗口中出现数字“ 8”,并且瓶中不再有完整的治疗性喷雾剂。计数器升至“ 8”后,患者应继续向下按压手指把手总共四次,以从瓶中排出任何残留药物。喷出8剂治疗喷剂后,患者将不会听到喀哒声,并且计数器也不会超过“ 8”。进一步喷出的喷雾剂将不是完全喷雾剂,应始终留在小袋中,不得用于治疗。 指示患者和护理人员密封小袋,然后将其和空瓶放入儿童安全的存储容器中。处理小袋后,患者必须立即用肥皂和水洗手。患者必须将装有小袋和瓶子的儿童安全容器丢弃到垃圾箱中。 患者或护理人员必须继续将LAZANDA奶瓶存放在专门提供的儿童安全容器中,并将小袋存放在儿童无法触及的地方,直到如上所述能够适当处置为止。 指导患者处置LAZANDA瓶,如果自从首次使用LAZANDA瓶以来已经60天或更长时间,请重新开始。 如果看护者或患者在处置LAZANDA瓶时需要其他帮助,请致电West Therapeutic Development,LLC的免费电话(1-844-452-9263)。 剂型和优势LAZANDA的鼻喷雾剂经配制可喷雾100 mcL的溶液,其中包含100 mcg,300 mcg或400 mcg芬太尼碱。 禁忌症LAZANDA禁忌症: 阿片类药物非耐受性患者:任何剂量的阿片类药物非耐受性患者都可能发生危及生命的呼吸抑制和死亡[见适应症和用法(1);警告和注意事项( 5.1 )] 。 ·急性或术后疼痛,包括头痛/偏头痛和牙齿疼痛,或在急诊室。 ·在不受监视的环境中或没有复苏设备的情况下进行的急性或重度支气管哮喘[请参阅警告和注意事项( 5.9 )] ·已知或怀疑的胃肠道梗阻,包括麻痹性肠梗阻[请参阅警告和注意事项( 5.14 )] 已知对芬太尼或LAZANDA成分的超敏反应(例如,过敏反应,超敏反应) [请参阅不良反应( 6.2 )]。 警告和注意事项危及生命的呼吸抑制据报告,即使使用阿片类药物,严重,威胁生命或致命的呼吸抑制也是如此。如果不立即识别和治疗呼吸抑制,可能会导致呼吸停止和死亡。呼吸抑制的管理可能包括密切观察,支持措施和使用阿片类药物拮抗剂,具体取决于患者的临床状况[参见剂量过量( 10 )]。阿片类药物引起的呼吸抑制导致的二氧化碳(CO2)滞留会加剧阿片类药物的镇静作用。 虽然在使用LAZANDA的任何时候都可能发生严重的,威胁生命的或致命的呼吸抑制,但在开始治疗或增加剂量后风险最大。密切监测患者的呼吸抑制,尤其是在LAZANDA剂量增加后及开始治疗后的最初24-72小时内。 为了降低呼吸抑制的风险,LAZANDA的正确剂量和滴定至关重要[请参阅剂量和用法( 2.1 )]。高估LAZANDA剂量可能导致首剂过量致命。用LAZANDA替代任何其他芬太尼产品可能会导致致命的过量[请参阅警告和注意事项( 5.5 )]。 LAZANDA可能会给未开处方的人和不耐受阿片类药物的人致命。 意外摄入(或接触)甚至一剂LAZANDA,尤其是儿童(在儿童中),都可能因过量的芬太尼而导致呼吸抑制和死亡[参见警告和注意事项( 5.2 )]。 阿片类药物可引起与睡眠有关的呼吸系统疾病,包括中枢性睡眠呼吸暂停(CSA)和与睡眠有关的低氧血症。阿片类药物的使用以剂量依赖性方式增加了CSA的风险。对于患有CSA的患者,请考虑使用最佳方法来降低阿片类药物的剂量以减少阿片类药物的使用量[参见剂量和用法( 2.4 ) ]。 意外摄入或接触导致儿童服用过量的风险增加据报道,意外摄入经粘膜速释芬太尼产品的儿童死亡。 必须告知患者及其监护人LAZANDA所含药物的量可能对儿童致命。内科医生和配药师必须特别向患者或看护者询问孩子是否在家中(全天候或探视),并就不慎暴露对儿童的危害提供咨询。 必须指示患者及其看护者将使用和未使用的剂量单位放在儿童接触不到的地方。虽然所有设备在使用后都应立即丢弃,但部分消耗的设备会对儿童构成特殊风险。如果未完全消耗掉某个装置,则必须尽快对其进行适当处置[请参阅患者咨询信息( 17 )]。 《 LAZANDA药物指南》中提供了有关正确储存,管理,处置的详细说明,以及管理过量的LAZANDA的重要说明。鼓励患者完整阅读此信息,并给他们机会回答他们的问题。 同时使用或停用细胞色素P450 3A4抑制剂和诱导剂的风险LAZANDA与CYP3A4抑制剂(例如大环内酯类抗生素(例如红霉素),唑类抗真菌药(例如酮康唑)和蛋白酶抑制剂(例如利托那韦))同时使用可能会增加血浆中的芬太尼浓度并延长阿片类药物的不良反应,可能会导致潜在的致命性呼吸抑制[请参阅警告和注意事项( 5.2 )] ,尤其是在达到稳定剂量的LAZANDA之后添加抑制剂时。同样,在接受LAZANDA治疗的患者中停用CYP3A4诱导剂(如利福平,卡马西平和苯妥英钠)可能会增加芬太尼的血浆浓度并延长阿片类药物的不良反应。当在接受LAZANDA治疗的患者中使用LAZANDA和CYP3A4抑制剂或停用CYP3A4诱导剂时,应密切监测患者并定期减少LAZANDA的剂量,直至达到稳定的药物作用[见剂量和给药方法( 2.3 ),药物相互作用( 7 )]。 LAZANDA与CYP3A4诱导剂的同时使用或CYP3A4抑制剂的停用可能降低芬太尼血浆浓度,阿片类药物疗效或可能导致对芬太尼产生身体依赖性的患者出现戒断综合征。当将LAZANDA与CYP3A4诱导剂一起使用或停用CYP3A4抑制剂时,应定期密切监测患者并在需要维持足够的镇痛或出现阿片类药物戒断症状时考虑增加阿片类药物的剂量[见剂量和给药方法( 2.6 ),药物相互作用( 7 ) ]。 与苯二氮卓类或其他中枢神经系统抑制剂同时使用的风险LAZANDA与苯二氮卓类药物或其他中枢神经系统抑制剂(例如非苯二氮卓类镇静剂/催眠药,抗焦虑药,镇定剂,肌肉松弛剂,全身麻醉剂,抗精神病药,其他阿片类药物,酒精类药物)并用可能会导致严重的镇静,呼吸抑制,昏迷和死亡。 )。由于存在这些风险,因此这些药物应同时开处方以供其他治疗选择不充分的患者使用。 观察性研究表明,与单独使用阿片类镇痛药相比,同时使用阿片类镇痛药和苯二氮卓类药物会增加与药物相关的死亡风险。由于具有相似的药理特性,可以合理预期与其他使用阿片类镇痛药的中枢神经系统抑制药同时使用的风险相似[见药物相互作用( 7 )]。 如果决定与阿片类镇痛药同时开具苯二氮杂或其他中枢神经系统抑制剂,则应开出最低有效剂量和最短持续使用时间。在已经接受阿片类镇痛药的患者中,开处方的苯二氮卓类或其他中枢神经系统抑制剂的起始剂量要比不存在阿片类药物时要低,并根据临床反应进行滴定。如果已经服用苯二氮卓类药物或其他中枢神经系统抑制剂的患者开始使用阿片类镇痛剂,则应开始降低阿片类镇痛剂的初始剂量,并根据临床反应进行滴定。密切关注患者的呼吸抑制和镇静症状和体征。 向患者和护理人员提供有关LAZANDA与苯二氮卓类或其他CNS抑制剂(包括酒精和非法药物)一起使用时呼吸抑制和镇静的风险的建议。建议患者不要驾驶或操作重型机械,直到确定同时使用苯二氮卓类或其他CNS抑制剂的效果为止。筛查患者是否存在滥用毒品的风险,包括阿片类药物滥用和滥用,并警告他们与使用其他中枢神经系统抑制药(包括酒精和非法药物)有关的用药过量和死亡风险[请参阅药物相互作用( 7 ),患者咨询信息( 17 )]。 用药错误的风险处方时,请勿将患者从任何其他芬太尼产品转换为LAZANDA,因为mcg / mcg为基础,因为以微克/微克为基础的LAZANDA和其他芬太尼产品并不等效。 LAZANDA不是其他透粘膜速释芬太尼(TIRF)制剂的通用版本。分配时,在任何情况下都不要用LAZANDA处方替代任何其他TIRF处方。其他TIRF配方和LAZANDA不等效。与其他芬太尼产品(包括其他TIRF制剂)相比,LAZANDA的药代动力学特征存在实质性差异,这导致芬太尼吸收速率和程度的临床重要差异。由于这些差异,用LAZANDA替代任何其他芬太尼产品可能会导致致命的过量。 没有任何其他芬太尼产品的安全转换说明可用于患者。 (注:这包括芬太尼的口服,经皮或肠胃外制剂。)因此,对于阿片类药物耐受的患者,LAZANDA的初始剂量应始终为ONE 100 mcg喷雾剂。每位患者应单独滴定以提供足够的镇痛作用,同时最大程度减少副作用[见剂量和用法( 2.3 )]。 上瘾,滥用和滥用LAZANDA含有芬太尼II类受控物质。作为阿片类药物,LAZANDA使使用者面临上瘾,滥用和滥用的风险[请参阅药物滥用和依赖性(9)]。 尽管任何人上瘾的风险尚不明确,但可能会在适当处方LAZANDA的患者中发生。如果滥用或滥用药物,则可能以推荐剂量上瘾。 在开处方LAZANDA之前,应评估每个患者的阿片类药物成瘾,滥用或滥用的风险,并监测所有接受LAZANDA的患者的这些行为和状况的发展。具有个人或家庭药物滥用史(包括吸毒或酗酒或成瘾)或精神疾病(如严重抑郁症)的患者的风险增加。但是,这些潜在风险不应妨碍任何给定患者的疼痛适当管理。可能会给风险增加的患者开处方阿片类药物,例如LAZANDA,但在此类患者中使用时,必须对LAZANDA的风险和正确使用进行深入的咨询,并对成瘾,滥用和滥用的迹象进行严格监控。 阿片类药物是吸毒者和成瘾性疾病患者所寻求的,并且会被转用于刑事犯罪。处方或分发LAZANDA时请考虑这些风险。减少这些风险的策略包括开出最小剂量的适当药物,并建议患者正确处置未使用的药物[请参阅患者咨询信息( 17 )] 。请与当地的州专业许可委员会或州控制的物质管理局联系,以获取有关如何预防和检测此产品的滥用或转移的信息。 透粘膜速释芬太尼(TIRF)风险评估和缓解策略(REMS)访问计划由于存在滥用,滥用,成瘾和用药过量的风险[请参阅警告和注意事项(5.6)] ,因此只能通过REMS的受限制程序(称为TIRF REMS Access程序)使用LAZANDA。根据TIRF REMS Access计划,门诊病人,开给门诊病人,药房和分销商的医疗专业人员必须参加该计划。对于LAZANDA的住院管理(例如,医院,疗养院和开具住院使用处方的长期护理设施),不需要患者和开处方者的注册。 TIRF REMS Access程序的必需组件是: ·开处方LAZANDA的医疗保健专业人员必须查看TIRF REMS Access计划的开处方教育材料,加入该计划并遵守REMS要求。 ·要接受LAZANDA,门诊患者必须了解其风险和收益并签署《患者处方药协议》。 ·分配LAZANDA的药房必须加入该计划,并同意遵守REMS要求。 ·分发LAZANDA的批发商和分销商必须注册该计划,并且仅分发给授权药房。 有关更多信息,包括合格药房/分销商的列表,请访问www.tirfremsaccess.com或致电1-866-822-1483。 新生儿阿片类药物戒断综合征怀孕期间长时间使用LAZANDA可能导致新生儿停药。与成人类鸦片戒断综合征不同,新生儿类鸦片戒断综合征如果不得到认可和治疗,可能会危及生命,并且需要根据新生儿科专家制定的方案进行管理。观察新生儿的新生儿阿片戒断综合征的征兆,并据此进行处理。建议孕妇长时间使用阿片类药物有新生儿阿片戒断综合症的风险,并确保可获得适当的治疗[见在特定人群中使用( 8.1 ),患者咨询信息( 17 )]。 慢性肺病患者或老年人,恶病质或虚弱患者的危及生命的呼吸抑制禁忌在没有监测的情况下或在没有复苏设备的情况下,在患有急性或重度支气管哮喘的患者中使用LAZANDA。 慢性肺病患者:经LAZANDA治疗的患有严重慢性阻塞性肺疾病或肺心病的患者,以及呼吸储备,低氧血症,高碳酸血症或先前存在呼吸抑制显着下降的患者,其呼吸驱动功能降低的风险增加,包括呼吸暂停,即使使用推荐剂量的LAZANDA [请参阅警告和注意事项( 5.1 )] 。 Elderly, Cachectic, or Debilitated Patients : Life-threatening respiratory depression is more likely to occur in elderly, cachectic, or debilitated patients because they may have altered pharmacokinetics or altered clearance compared to younger, healthier patients [see Warnings and Precautions ( 5.1 )]. Monitor such patients closely, particularly when initiating and titrating LAZANDA and when LAZANDA is given concomitantly with other drugs that depress respiration [see Warnings and Precautions ( 5.1 )] . Alternatively, consider the use of non-opioid analgesics in these patients. 血清素综合症与血清素能药物的同时使用Cases of serotonin syndrome, a potentially life-threatening condition, have been reported during concomitant use of fentanyl with serotonergic drugs. Serotonergic drugs include selective serotonin reuptake inhibitors (SSRIs), serotonin and norepinephrine reuptake inhibitors (SNRIs), tricyclic antidepressants (TCAs), triptans, 5-HT3 receptor antagonists, drugs that affect the serotonergic neurotransmitter system (eg, mirtazapine, trazodone, tramadol), certain muscle relaxants (ie, cyclobenzaprine, metaxalone), and drugs that impair metabolism of serotonin (including MAO inhibitors, both those intended to treat psychiatric disorders and also others, such as linezolid and intravenous methylene blue) [see Drug Interactions ( 7 )] . This may occur within the recommended dosage range. Serotonin syndrome symptoms may include mental status changes (eg, agitation, hallucinations, coma), autonomic instability (eg, tachycardia, labile blood pressure, hyperthermia), neuromuscular aberrations (eg, hyperreflexia, incoordination, rigidity), and/or gastrointestinal symptoms (eg, nausea, vomiting, diarrhea). The onset of symptoms generally occurs within several hours to a few days of concomitant use, but may occur later than that. Discontinue LAZANDA if serotonin syndrome is suspected. Adrenal InsufficiencyCases of adrenal insufficiency have been reported with opioid use, more often following greater than one month of use. Presentation of adrenal insufficiency may include non-specific symptoms and signs including nausea, vomiting, anorexia, fatigue, weakness, dizziness, and low blood pressure. If adrenal insufficiency is suspected, confirm the diagnosis with diagnostic testing as soon as possible. If adrenal insufficiency is diagnosed, treat with physiologic replacement doses of corticosteroids. Wean the patient off of the opioid to allow adrenal function to recover and continue corticosteroid treatment until adrenal function recovers. Other opioids may be tried as some cases reported use of a different opioid without recurrence of adrenal insufficiency. The information available does not identify any particular opioids as being more likely to be associated with adrenal insufficiency. Severe HypotensionLAZANDA may cause severe hypotension including orthostatic hypotension and syncope in ambulatory patients. There is increased risk in patients whose ability to maintain blood pressure has already been compromised by a reduced blood volume or concurrent administration of certain CNS depressant drugs (eg phenothiazines or general anesthetics) [see Drug Interactions ( 7 )]. Monitor these patients for signs of hypotension after initiating or titrating the dosage of LAZANDA. In patients with circulatory shock, LAZANDA may cause vasodilation that can further reduce cardiac output and blood pressure. Avoid the use of LAZANDA in patients with circulatory shock. Risks of Use in Patients with Increased Intracranial Pressure, Brain Tumors, Head Injury, or Impaired ConsciousnessIn patients who may be susceptible to the intracranial effects of CO 2 retention (eg, those with evidence of increased intracranial pressure or brain tumors), LAZANDA may reduce respiratory drive, and the resultant CO 2 retention can further increase intracranial pressure. Monitor such patients for signs of sedation and respiratory depression, particularly when initiating therapy with LAZANDA. Opioids may also obscure the clinical course in a patient with a head injury. Avoid the use of LAZANDA in patients with impaired consciousness or coma. Risks of Use in Patients with Gastrointestinal ConditionsLAZANDA is contraindicated in patients with known or suspected gastrointestinal obstruction, including paralytic ileus. The fentanyl in LAZANDA may cause spasm of the sphincter of Oddi. Opioids may cause increases in serum amylase. Monitor patients with biliary tract disease, including acute pancreatitis for worsening symptoms. Increased Risk of Seizures in Patients with Seizure DisordersThe fentanyl in LAZANDA may increase the frequency of seizures in patients with seizure disorders, and may increase the risk of seizures occurring in other clinical settings associated with seizures. Monitor patients with a history of seizure disorders for worsened seizure control during LAZANDA therapy. Risks of Driving and Operating MachineryLAZANDA may impair the mental or physical abilities needed to perform potentially hazardous activities such as driving a car or operating machinery. Warn patients not to drive or operate dangerous machinery unless they are tolerant to the effects of LAZANDA and know how they will react to the medication. Cardiac DiseaseIntravenous fentanyl may produce bradycardia. Therefore, use LAZANDA with caution in patients with bradyarrhythmias. 不良反应临床研究经验Because clinical trials are conducted under widely varying conditions, adverse event rates observed in the clinical trials of a drug product cannot be directly compared to rates in the clinical trials of another drug and may not reflect the rates observed in practice. The safety of LAZANDA has been evaluated in a total of 523 opioid-tolerant patients with breakthrough cancer pain. The average duration of therapy in patients in the long-term study was 73 days, with 153 patients being treated for over 3 months. Patients continuing into the open-label extension period of the safety study have been treated for up to 26 months. The clinical trials of LAZANDA were designed to evaluate safety and efficacy in treating breakthrough cancer pain; all patients were also taking concomitant opioids, such as sustained-release morphine, sustained-release oxycodone, or transdermal fentanyl, for their persistent cancer pain. The adverse reaction data presented in Table 1 reflect the actual percentage of patients experiencing each adverse effect among patients who received LAZANDA for breakthrough cancer pain along with a concomitant opioid for persistent cancer pain. There has been no attempt to correct for concomitant use of other opioids, duration of LAZANDA therapy, or cancer-related symptoms. Adverse events are included regardless of causality or severity. Table 1 lists adverse reactions with an overall frequency of 5% or greater within the total population that occurred during titration by maximum dose received. The ability to assign LAZANDA a dose-response relationship to these adverse events is limited by the titration schemes used in these studies. Table 1: Adverse Reactions That Occurred During Titration at a Frequency of > 5%
Table 2 lists, by dose, adverse reactions with an overall frequency of ≥5% within the total population that occurred after a final titrated dose had been determined. Table 2: Adverse Reactions That Occurred During Maintenance Treatment at a Frequency of ≥5%
The adverse reactions listed below represent those that occurred in ≥1% of patients from clinical trials while receiving LAZANDA. Events are classified by system organ class. Eye disorders: dry eye, swelling, ptosis, strabismus Blood and Lymphatic System Disorders: anemia, neutropenia Cardiac Disorders: cardiorespiratory arrest Gastrointestinal Disorders: vomiting, nausea, constipation, diarrhea, abdominal pain, gastritis, ascites, dry mouth, dyspepsia, mouth ulcer, proctalgia General Disorders and Administration Site Conditions: pyrexia, fatigue, edema peripheral, asthenia, edema Hepatobiliary Disorders: jaundice 免疫系统疾病:超敏反应 Infections and Infestations: urinary tract infection, pneumonia, nasopharyngitis, infection, rhinitis, upper respiratory tract infection, bronchitis Injury, Poisoning and Procedural Complications: fall Investigations: weight decreased, blood alkaline phosphatase increased Metabolism and Nutrition Disorders: dehydration, decreased appetite, hyperglycemia, anorexia Musculoskeletal and Connective Tissue Disorders: back pain, pain in extremity, arthralgia Nervous System Disorders: dizziness, somnolence, headache, dysgeusia Psychiatric Disorders: anxiety, insomnia, depressi 已知共有539种药物与Lazanda(芬太尼)相互作用。
检查互动最常检查的互动查看Lazanda(芬太尼)与以下药物的相互作用报告。
Lazanda(芬太尼)酒精/食物相互作用与Lazanda(芬太尼)发生1种酒精/食物相互作用 Lazanda(芬太尼)疾病相互作用与Lazanda(芬太尼)有18种疾病相互作用,包括:
药物相互作用分类
药物状态
美国日本医生 Heather Benjamin MD经验:11-20年  Heather Benjamin MD经验:11-20年  Suzanne Reitz MD经验:11-20年  Heather Miske DO经验:11-20年  Heather Miske DO经验:11-20年  渡邊剛经验:21年以上  渡邊剛经验:21年以上  宮崎総一郎 中部大学特聘教授经验:21年以上  百村伸一 教授经验:21年以上  百村伸一 教授经验:21年以上 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||