获取国外Cipro(口服混悬剂)药品价格,使用等信息,最快 24 小时回馈
Cipro(口服混悬剂)
警告
- 这种药物可能会导致严重的副作用,例如肌腱发炎或撕裂;手臂,手,腿或脚的神经问题;和神经系统问题。这些可以单独发生或同时发生。它们可能在开始使用Cipro(环丙沙星口服混悬液)后数小时至数周内发生。其中一些影响可能不会消失,并可能导致残疾或死亡。
- 60岁以上的人受刺激或撕裂的肌腱的机会更大;心脏,肾脏或肺移植患者;或服用类固醇药物的人。肌腱问题可能会在治疗后长达几个月的时间内发生。如果脚踝,肩膀,手或其他关节的背部疼痛,淤青或肿胀,请立即致电医生。如果您无法移动关节或承受重压,或者听到或感觉到喀哒声或啪啪声,请立即致电医生。
- 如果您有神经问题的迹象,请立即致电医生。这些可能包括无法应付高温或低温;改变触觉;或手臂,手,腿或脚的灼痛,麻木,刺痛,疼痛或无力。
- 如果您有神经系统问题的迹象,请立即致电医生。这些可能包括焦虑,做梦,睡眠困难,视力变化,头昏眼花,感到困惑,感到紧张或烦躁,不安,幻觉(看到或听到不在那里的东西),新的或较差的行为或情绪变化(例如抑郁或自杀,癫痫发作或非常头痛的想法。
- 如果您患有重症肌无力,请勿服用。重症肌无力患者使用Cipro(环丙沙星口服混悬液)时,出现了非常糟糕的呼吸甚至致命的呼吸问题。
- 对于某些健康问题,Cipro(环丙沙星口服混悬液)仅在其他药物无法使用或无效时使用。与医生交谈,以确保环丙沙星(环丙沙星口服混悬液)的益处大于风险。
Cipro的用途:
- 它用于治疗或预防细菌感染。
在服用Cipro之前,我需要告诉我的医生什么?
- 如果您对环丙沙星或Cipro的任何其他部位过敏(环丙沙星口服混悬液)。
- 如果您对Cipro过敏(环丙沙星口服混悬液);环丙沙星(环丙沙星口服混悬液)的任何部分;或任何其他药物,食物或物质。告诉您的医生有关过敏以及您有什么症状。
- 如果您有以下任何健康问题:ECG长时间QTc或其他不正常的心跳,心跳缓慢或钾或镁水平低。
- 如果您有心力衰竭(心脏虚弱)。
- 如果您最近有心脏病发作。
- 如果您曾经遇到以下任何健康问题:神经问题或肌腱问题。
- 如果您过去服用Cipro(环丙沙星口服混悬液)或类似药物时肌腱发炎或撕裂。
- 如果您有主动脉瘤(主动脉的膨大或鼓胀,即从心脏出来的主要血管)或您有患此健康问题的风险。这包括您是否还有其他血管问题,高血压或某些健康问题,例如Marfan综合征或Ehlers-Danlos综合征。
- 如果您正在服用任何可能导致某种类型的心跳不正常(延长QT间隔)的药物。有许多药物可以做到这一点。如果不确定,请咨询您的医生或药剂师。
- 如果您正在服用以下任何药物:度洛西汀,茶碱,替扎尼定或唑吡坦。
- 如果您正在母乳喂养或计划母乳喂养。
这不是与Cipro(环丙沙星口服混悬液)相互作用的所有药物或健康问题的列表。
告诉您的医生和药剂师您所有的药物(处方药或非处方药,天然产品,维生素)和健康问题。您必须检查以确保服用所有药物和健康问题的Cipro(环丙沙星口服混悬液)是安全的。未经医生许可,请勿开始,停止或更改任何药物的剂量。
服用Cipro时我需要了解或做什么?
- 告诉所有医疗保健提供者您服用Cipro(环丙沙星口服混悬液)。这包括您的医生,护士,药剂师和牙医。
- 在您看到Cipro(环丙沙星口服混悬液)如何影响您之前,请避免驾驶和执行其他需要提醒您注意的任务或动作。
- 如果您长时间服用Cipro(环丙沙星口服混悬液),请检查血液。与您的医生交谈。
- 像这样的药物已经发生了高血糖和低血糖。大多数时候,低血糖发生在糖尿病患者中,他们正在服用降低胰岛素等血糖的药物。血糖过低会导致昏迷,甚至导致死亡。按照医生的指示检查血糖。
- 告诉医生您是否有高血糖或低血糖的症状,如呼吸,闻起来像水果,头晕,呼吸急促,心跳加快,感到困惑,困倦,感觉虚弱,潮红,头痛,口渴或饥饿,尿频,摇晃或出汗。
- 请勿使用超过要求的时间。可能会发生第二次感染。
- 告诉医生您是否服用了含有咖啡因的药物,或者您是否食用或饮用了含有咖啡因的产品,例如茶,咖啡,可乐或巧克力。
- 您可能会更容易被晒伤。避免阳光,日光灯和日光浴床。使用防晒霜,并穿上可保护您免受阳光照射的衣服和眼镜。
- 除非医生告知您要少喝些非咖啡因液体,否则请多喝。
- 很少发生非常糟糕的,有时甚至是致命的过敏反应。与您的医生交谈。
- Cipro(环丙沙星口服混悬液)很少,甚至有时会造成致命的影响。这些包括肌肉或关节,肾脏,肝脏,血液和其他问题。如有疑问,请与医生交谈。
- 环丙沙星(环丙沙星口服混悬液)可能会导致某种类型的异常心跳(延长QT间隔)。如果心跳加快,不正常的心跳或晕倒,请立即致电医生。
- 如果您有肝脏问题的迹象,例如尿黑,感到疲倦,不饿,胃部或胃部不适,大便色浅,呕吐或皮肤或眼睛发黄,请立即致电医生。
- 如果您超过60岁,请小心使用Cipro(环丙沙星口服混悬液)。您可能会有更多的副作用。
- 对18岁以下的儿童进行护理。与医生交谈。
- 告诉医生您是否怀孕或计划怀孕。您需要在怀孕期间谈论使用Cipro(环丙沙星口服混悬液)的益处和风险。
如何最好地服用这种药(西普罗)?
按照医生的指示使用Cipro(环丙沙星口服混悬液)。阅读提供给您的所有信息。请严格按照所有说明进行操作。
- 在一天的同一时间服用Cipro(环丙沙星口服混悬液)。
- 食用或不食用。
- 拿一杯水喝。
- 每次使用前请摇匀约15秒钟。
- 仔细测量液体剂量。使用Cipro(环丙沙星口服混悬液)随附的测量设备。
- 不要咀嚼混合物。
- 保持盖子紧闭。
- 请勿将液体悬浮液放在进料管上。
- 使用量匙后,请用肥皂和水清洗,并确保其完全干燥后再使用。
- 请勿将Cipro(环丙沙星口服混悬液)与乳制品(如牛奶或酸奶)或富含钙的果汁一起服用。如果餐食中含有这些产品,则可以在全餐时服用。
- 在抗酸剂,去羟肌苷,镧,硫糖铝,奎尼普利,铋,司维拉姆,多种维生素或其他含有镁,钙,铝,铁或锌的产品之前或之后的2小时服用Cipro(环丙沙星口服混悬液)。
- 即使您感觉良好,也应按照医生或其他医疗保健提供者的指示继续使用Cipro(环丙沙星口服混悬液)。
如果我错过了剂量怎么办?
- 想一想就服用一次错过的剂量。
- 如果已接近您下一次服药的时间,请跳过错过的服药时间,然后回到正常时间。
- 请勿同时服用2剂或额外剂量。
我需要马上打电话给我的医生什么副作用?
警告/警告:尽管这种情况很少见,但有些人在服药时可能会有非常严重的副作用,有时甚至是致命的副作用。如果您有以下任何与严重不良副作用相关的症状或体征,请立即告诉医生或寻求医疗帮助:
- 过敏反应的迹象,如皮疹;麻疹;瘙痒;发红或发烧的皮肤发红,肿胀,起泡或脱皮;喘息胸部或喉咙发紧;呼吸,吞咽或说话困难;异常嘶哑或嘴,脸,嘴唇,舌头或喉咙肿胀。
- 肾脏问题的征兆,例如无法通过尿液,改变通过的尿量,尿液中的血液或体重增加很大。
- 胸痛或压力。
- 气促。
- 摇晃。
- 行走困难。
- 阴道瘙痒或分泌物。
- 口腔中有白色斑点。
- 晒斑。
- 发烧,发冷或嗓子疼;任何无法解释的瘀伤或出血;或感到非常疲倦或虚弱。
- 肌肉疼痛或无力。
- 无法集中精力。
- 内存问题或丢失。
- 可能会发生非常严重的皮肤反应(Stevens-Johnson综合征/中毒性表皮坏死溶解)。它可能导致非常严重的健康问题,这种问题可能不会消失,甚至会导致死亡。如果您有红色,肿胀,起泡或脱皮的迹象(发烧或不发烧),请立即寻求医疗帮助;眼睛发红或发炎;口腔,喉咙,鼻子或眼睛上有疮。
- 腹泻常见于抗生素。很少发生称为C diff相关腹泻(CDAD)的严重形式。有时,这会导致致命的肠道问题(结肠炎)。在服用抗生素期间或之后几个月,可能会发生CDAD。如果您有胃痛,痉挛或大便稀疏,水样或流血的大便,请立即致电医生。治疗腹泻之前,请先咨询医生。
- 服用这种药物后的两个月内,发生了从心脏(主动脉)出来的主血管罕见但严重的问题,特别是在老年人中。这包括主动脉的眼泪或破裂。这可能导致严重的出血甚至死亡。造成这种影响的原因尚不清楚。如果您的腹部,胸部或背部突然剧烈疼痛且无法消除,请立即致电医生。
Cipro还有哪些其他副作用?
所有药物都可能引起副作用。但是,许多人没有副作用,或者只有很小的副作用。如果这些副作用或任何其他副作用困扰您或不消失,请致电您的医生或获得医疗帮助:
- 胃部不适或呕吐。
- 腹泻。
- 头痛。
这些并非所有可能发生的副作用。如果您对副作用有疑问,请致电您的医生。打电话给您的医生,征求有关副作用的医疗建议。
您可以致电1-800-332-1088向FDA报告副作用。您也可以在https://www.fda.gov/medwatch报告副作用。
如果怀疑OVERDOSE:
如果您认为服药过量,请致电毒物控制中心或立即就医。准备好告诉或显示采取了什么,采取了多少,何时发生。
如何存储和/或丢弃Cipro?
- 在室温或冰箱中存放液体(悬浮液)。不要冻结。 2周后丢弃所有未使用的零件。
- 将所有药物放在安全的地方。将所有毒品放在儿童和宠物够不到的地方。
- 扔掉未使用或过期的药物。除非被告知,否则不要冲厕所或倒水。如果您对扔出药物的最佳方法有疑问,请咨询您的药剂师。您所在地区可能有毒品回收计划。
消费者信息使用
- 如果症状或健康问题没有好转或恶化,请致电医生。
- 不要与他人共享您的药物,也不要服用他人的药物。
- 该药还带有一个称为《用药指南》的额外患者情况说明书。仔细阅读。每次重新填充Cipro(环丙沙星口服混悬液)时,请再次阅读。如果您对Cipro(环丙沙星口服混悬液)有任何疑问,请与医生,药剂师或其他医疗服务提供者联系。
- 如果您认为服药过量,请致电毒物控制中心或立即就医。准备好告诉或显示采取了什么,采取了多少,何时发生。
注意:本文档包含有关环丙沙星的副作用信息。此页面上列出的某些剂型可能不适用于Cipro品牌。
综上所述
Cipro的常见副作用包括:关节痛。有关不良影响的完整列表,请参见下文。
对于消费者
适用于环丙沙星:口服散剂,口服片剂
其他剂型:
- 静脉内溶液
警告
口服途径(片剂,片剂,缓释片,悬浮液)
氟喹诺酮类药物(包括环丙沙星)与同时发生的致残性和潜在不可逆的严重不良反应有关,包括肌腱炎和肌腱破裂,周围神经病变和中枢神经系统作用。在出现这些严重不良反应的患者中,请停用环丙沙星并避免使用氟喹诺酮类药物。对于无并发症的尿路感染,没有其他替代治疗选择的患者,可使用环丙沙星。氟喹诺酮类药物(包括环丙沙星)可能会加重重症肌无力患者的肌肉无力。避免患有重症肌无力史的患者。
口服途径(悬浮液;平板电脑,延长释放;平板电脑)
氟喹诺酮类药物(包括环丙沙星)与同时发生的致残性和潜在不可逆转的严重不良反应相关,包括肌腱炎和肌腱破裂,周围神经病变和中枢神经系统作用。在出现这些严重不良反应的患者中,请停用环丙沙星并避免使用氟喹诺酮类药物。对于没有其他治疗方法的患者,应保留环丙沙星用于慢性支气管炎或急性鼻窦炎的急性加重。氟喹诺酮类药物(包括盐酸环丙沙星)可能会加重重症肌无力患者的肌肉无力。避免患有重症肌无力史的患者。
需要立即就医的副作用
环丙沙星(Cipro中包含的活性成分)及其所需的作用可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用环丙沙星时,如果有下列任何副作用,请立即咨询医生:
比较普遍;普遍上
- 腹泻
罕见
- 血腥或黑色的柏油样便
- 灼烧,爬行,发痒,麻木,刺,“针刺”或刺痛感
- 肤色变化
- 排尿改变
- 胸痛或不适
- 胸闷或沉重
- 发冷
- 笨拙或不稳定
- 混乱
- 耳朵持续发出铃声或嗡嗡声或其他无法解释的声音
- 咳嗽或吐血
- 从躺着或坐着的姿势突然起床时头晕,晕眩或头晕
- 快速,不规则,剧烈震动或心跳或脉搏加快
- 发热
- 头痛,剧烈和跳动
- 听力损失
- 荨麻疹或贴边,皮疹
- 关节刚度
- 面部,眼睑,嘴唇,舌头,喉咙,手,腿,脚或生殖器上的大型蜂巢状肿胀
- 浅色凳子
- 肌肉疼痛或僵硬
- 恶心
- 噩梦
- 手麻木
- 关节疼痛
- 手臂,下颌,背部或颈部疼痛或不适
- 皮肤下疼痛的红色肿块,主要在腿上
- 敲打耳朵
- 眼睑或眼睛,面部,嘴唇或舌头周围浮肿或肿胀
- 脸部,脖子,手臂发红,偶尔上胸部发红
- 癫痫发作
- 严重的腹部或胃部疼痛,痉挛或灼痛
- 腿,手臂,手或脚的晃动
- 脸,脚或小腿肿胀
- 颈部,腋窝或腹股沟淋巴结肿大,疼痛或触痛
- 白带厚实,白带,无异味或有轻微气味
- 肌肉控制或协调不稳,发抖或其他问题
- 不寻常的嗜睡,迟钝,疲倦,虚弱或呆滞感
- 呕吐
- 口腔或舌头上有白色斑点
- 眼睛或皮肤发黄
发病率未知
- 皮肤起泡,脱皮或松弛
- 嘴唇,指甲或手掌呈蓝色
- 骨痛
- 腹泻,水样和严重的,也可能是血腥的
- 呼吸,咀嚼或说话困难
- 双重视野
- 肌肉过度紧张
- 不适感
- 感觉,看到或听到不存在的东西
- 增加皮肤对阳光的敏感性
- 对疼痛或触摸的敏感性增加
- 心律不齐或缓慢
- 情绪变化
- 流鼻血
- 心跳加快
- 皮肤病变为红色,中心常为紫色
- 看到,听到或感觉不到的东西
- 皮肤灼热感
- 严重晒伤
- 嘴唇或嘴中的疮,溃疡或白斑
- 异常出血或瘀伤
- 异常兴奋,紧张或躁动
- 阴道酵母菌感染
不需要立即就医的副作用
环丙沙星可能会发生一些副作用,这些副作用通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
不常见
- 流鼻涕
- 打喷嚏
- 鼻塞
对于医疗保健专业人员
适用于环丙沙星:静脉注射溶液,口服粉剂,口服片剂,口服片剂缓释
一般
最常见的副作用(来自所有制剂的临床试验,剂量,治疗时间和适应症)是恶心,腹泻,肝功能检查异常,呕吐和皮疹。静脉注射制剂最常见的副作用是恶心,腹泻,呕吐,注射和输注部位反应,皮疹和转氨酶升高(暂时性)。 [参考]
胃肠道
常见(1%至10%):恶心,腹泻,呕吐,消化不良
罕见(0.1%至1%):腹部疼痛/不适,胃肠道(GI)疼痛,肠胃胀气
稀有(0.01%至0.1%):淀粉酶升高,与抗生素相关的结肠炎,胰腺炎
未报告频率:艰难梭菌相关性腹泻,便秘,胃肠道出血,肠梗阻,肠穿孔,口干,口腔溃疡,上腹痛,吞咽困难,脂肪酶升高,口腔粘膜疼痛,烧心,胃酸倒流,肠易激综合征,下腹加重疼痛
上市后报道:胃肠道念珠菌病,口腔念珠菌病,假膜性结肠炎[参考]
很少有可能导致致命结局的抗生素相关性结肠炎。
在抗菌治疗期间或之后,已报道了伪膜性结肠炎症状的发作。 [参考]
皮肤科
普通(1%至10%):皮疹
罕见(0.1%至1%):瘙痒,荨麻疹
稀有(0.01%至0.1%):血管水肿,光敏反应,出汗/多汗症,瘀斑,起泡
非常罕见(少于0.01%):多形红斑,结节性红斑,史蒂文斯-约翰逊综合症(可能危及生命),中毒表皮坏死溶解(可能危及生命)
未报告频率:剥脱性皮炎,紫癜,灼热,光毒性反应,皮肤干燥,斑丘疹,皮肤病,囊泡性皮疹,红斑,色素沉着,皮肤念珠菌病,大疱性天疱疮,囊泡,小叶性脂膜炎,光诱发的急性尿道上皮炎性反应和全身症状(DRESS)
上市后报告:急性全身性皮疹,脓疱病,固定性喷发[参考]
当患者暴露于强烈的阳光下(例如,当用于治疗或预防旅行者的腹泻时),光敏性最常见。
一名患有轻度全身性红斑的27岁女性在此前5天的疗程后开始第二次口服该药后出现中毒性表皮坏死(TEN)。服用第二剂后出现皮疹,高烧和腹泻,并表现为弥漫性皮疹,60%的皮肤表皮脱落,嘴唇脱屑,休克和呼吸窘迫。她死于TEN的第28个医院工作日,右心衰竭和急性呼吸窘迫综合征。截至2003年,文献中报道了9例TEN,包括5例死亡。
在上市后的经历中还报告了结节性红斑,史蒂文斯-约翰逊综合症(可能威胁生命)和TEN(可能威胁生命)。 [参考]
神经系统
据报道有2例使用这种药物和膦甲酸的患者出现癫痫发作。癫痫发作与药物给药之间的时间关联表明可能存在药物相互作用。在两种情况下均未建立因果关系。两种药物都是致癫痫药。同时使用可能会增加癫痫发作的风险。
据报道,感觉或感觉运动性轴索性多发性神经病(影响小轴突和/或大轴突)导致感觉异常,感觉不足,感觉异常和虚弱。
一项调查报告了11例与此药物相关的周围神经病。严重程度从轻度和可逆到严重和持续不等。在1例中,一名44岁女性出现了麻木,异常性疼痛,感觉不足,震颤,电和弥漫性烧灼感,抽搐,迷失方向,视力障碍,恶心,温度不耐受,皮疹和心;她在29个月后仍保持残疾。
在上市后的经历中,也曾报道眼球震颤,失眠,感觉异常,感觉不足,肌张力亢进,颅内高压和重症肌无力加重。 [参考]
常见(1%至10%):头痛,头晕/头晕,中枢神经系统障碍
罕见(0.1%至1%):睡眠障碍,味觉障碍,癫痫发作(包括癫痫持续状态),感觉异常,感觉异常,眩晕,听力下降
罕见(0.01%至0.1%):晕厥,感觉不足,震颤,耳鸣,偏头痛,嗅觉神经障碍,气味障碍,听力障碍
非常罕见(少于0.01%):协调障碍,颅内高压,良性颅内高压/假瘤脑,重症肌无力加重,感觉异常
未报告频率:无反应,共济失调,高渗,失眠,眼球震颤,味觉变态/不良味,嗜睡/嗜睡,不协调,注意力不集中,运动障碍,重症肌无力,轻瘫,无菌性脑膜炎,脑血栓形成,大惊厥,吞咽困难,吞咽困难,感觉轴突性多发性神经病,感觉运动轴突性多发性神经病
上市后报告:味觉下降,周围神经病(可能是不可逆的),多发性神经病[参考]
血液学
很少有全血细胞减少症(威胁生命或致命的结果)和骨髓抑制(威胁生命)的报道;在上市后的经验中也有报道。
据报道,用维生素K拮抗剂治疗的患者INR升高。 [参考]
常见(1%至10%):嗜酸性粒细胞增多
罕见(0.1%至1%):血小板减少症,血小板增多症
罕见(0.01%至0.1%):白细胞减少症,贫血,中性粒细胞减少症,白细胞增多症,全血细胞减少症,骨髓抑制,凝血酶原水平异常
非常罕见(少于0.01%):溶血性贫血,粒细胞缺乏症
未报告频率:血细胞比容降低,血小板计数减少,血小板计数增加,凝血酶原时间延长,凝血酶原减少,血液透析,血红蛋白减少,白细胞计数减少,非典型淋巴细胞计数增加,未成熟的WBCs,血液单核细胞增多,沉淀率升高,嗜酸性粒细胞增多计数,淋巴结肿大
上市后报告:高铁血红蛋白血症,INR增加,凝血酶原时间延长或减少[参考]
肝的
肝坏死很少发展为威胁生命的肝衰竭。在上市后的经验中还报告了肝坏死和肝功能衰竭(包括致命病例)。 [参考]
常见(1%至10%):肝功能检查异常,转氨酶升高
罕见(0.1%至1%):胆红素升高,肝功能损害,胆汁淤积性黄疸/胆汁淤积性黄疸,黄疸
罕见(0.01%至0.1%):肝炎,肝坏死
非常罕见(小于0.01%):肝功能衰竭
未报告频率:AST升高,ALT升高,GGT升高[参考]
精神科
据报道,有抑郁症和精神病反应(可能最终导致自残行为,例如自杀观念/想法以及企图或完全自杀)。
在上市后的经历中也曾报道过躁动,困惑和中毒精神病。 [参考]
普通(1%至10%):躁动不安
罕见(0.1%至1%):精神运动亢进/躁动,神志不清,迷失方向,产生幻觉
稀有(0.01%至0.1%):焦虑反应,异常的梦,抑郁,精神病
未报告的频率:人格解体,失眠,狂躁反应,噩梦,妄想症,恐怖症,中毒精神病,神经质,自残行为,自杀观念/想法,未遂自杀,完全自杀,卡塔尼亚,躁狂症(包括躁狂症)
上市后报告:Deli妄[参考]
泌尿生殖
据报道,患有碱性尿液的患者患有结晶性尿毒症,并不一定会导致肾毒性。在生理尿pH下,结晶尿的风险被认为是较小的。
上市后的经历也曾报道过阴道念珠菌病。 [参考]
常见(1%至10%):阴道念珠菌病
稀有(0.01%至0.1%):血尿,结晶尿
未报告频率:白蛋白尿,圆筒状尿,尿频,出血性膀胱炎,阴道炎,痛经,念珠菌,多尿,尿道出血,尿retention留,尿路感染,真菌性阴道病,细菌性阴道炎,排尿困难,尿异味,女性生殖器,尿频,排尿急症,阴道瘙痒[参考]
本地
常见(1%到10%):局部IV部位反应,注射和输注部位反应(例如静脉炎,血栓性静脉炎)
未报告频率:静脉输注对注射部位有刺激性和硬结[参考]
如果输注时间为30分钟或更短,局部IV部位反应会更频繁地发生。这些反应表现为局部皮肤反应,输注完成后迅速消失。
据报道,静脉输注时间为30分钟或更短(而不是建议的1小时)或使用了手背的小静脉时,会出现注射部位刺激和硬结的情况。 [参考]
肌肉骨骼
关节炎主要是儿科患者的关注。但是,在接受这种药物的成年囊性纤维化患者中至少有1例病例。尽管囊性纤维化关节炎和肥厚性肺性骨关节炎通常发生在7%至8%的成年人和青少年囊性纤维化中,但该患者表现出的关节炎也不相似。报告中的几个要素有力地支持了环丙沙星诱导的关节炎的诊断,例如:与其他报告的疑似喹诺酮诱导的关节炎病例的发病时间一致(通常在开始治疗后3周);患者缺乏关节痛病史;再次发生挑战时;和在停药后(通常在停药后2周)缓解症状。
肌腱炎伴腱断裂已在许多病例报告中得到了证明。一名患有慢性肾功能衰竭的患者在环丙沙星(Cipro中包含的活性成分)治疗4天后出现双侧跟腱断裂。尽管在整个人群中,肾移植患者和患有终末期肾病的患者倾向于发生跟腱炎和破裂的风险增加,但已证明使用喹诺酮会进一步增加该风险(接受喹诺酮治疗的患者为12%,而接受喹诺酮治疗的患者为7%)。非喹诺酮类药物治疗的患者)。
截至1994年10月,已向美国FDA报告了25例跟腱断裂。手或肩膀也发生了一些破裂。确定的其他危险因素包括年龄和使用皮质类固醇。
在2006年至2008年之间,已向澳大利亚药品不良反应委员会(ADRAC)提交了23例肌腱炎报告,其中包括跟腱炎,肌腱断裂以及肌腱疼痛和肿胀的报告。该报告主要针对年龄在56岁以上的男性患者(15例),他们使用这种药物2到14天。在报告的病例中,有19例主要是氟喹诺酮(通常是环丙沙星)。但是,大多数报告中都没有记录伴随严重疾病的细节。
小儿患者的肌肉骨骼副作用包括关节痛,步态异常,关节检查异常,关节扭伤,腿痛,背痛,关节病,骨痛,疼痛,肌痛,手臂痛以及关节活动范围减少(膝盖,肘部) ,脚踝,臀部,手腕,肩膀)。
在上市后的经验中还曾报道过肌痛,肌腱炎和肌腱断裂。 [参考]
罕见(0.1%至1%):肌肉骨骼疼痛(例如,四肢疼痛,背痛,胸痛),关节痛
罕见(0.01%至0.1%):肌痛,关节炎,肌张力增加和痉挛,肌腱破裂(主要是跟腱)
非常罕见(少于0.01%):肌腱炎,肌无力
未报告的频率:关节病(包括可疑的可疑病例),关节僵硬,血清肌酸磷酸激酶升高,关节检查异常,关节扭伤,关节炎,骨痛,关节活动范围减少(膝盖,肘部,踝关节,臀部,手腕,肩膀),下巴疼痛,颈部疼痛,痛风发作,关节肿胀,肌肉痉挛,夜间痉挛,膝盖发炎
上市后报告:肌阵挛,肌无力,抽搐[Ref]
心血管的
尖锐湿疣的报道主要发生在有QT延长危险因素的患者中。
在上市后的经验中也曾报道过血管炎。 [参考]
罕见(0.1%至1%):心动过速,血管舒张,低血压
稀有(0.01%至0.1%):血管炎
未报告频率:心绞痛,心肺骤停,心肌梗塞,高血压,心,、心动过缓,心律不齐,房扑,心脏杂音,心血管衰竭,心室性变,心室重度,腹部主动脉杂音,体位性低血压
售后报告:QT延长/心电图QT延长,尖尖扭转型,室性心律失常[参考]
其他
罕见(0.1%至1%):念珠菌感染,霉菌性超感染,疼痛,发烧,不适/感觉不适,乏力,水肿
非常罕见(小于0.01%):步态干扰/步态异常
没有报告的频率:烦躁,潮红,口渴,血清钙升高,血清钾升高,甘油三酸酯升高,血清白蛋白降低,血清钾降低,血清总蛋白降低,血清茶碱升高,血清苯妥英钠改变,发冷,肿胀,乳房疼痛,成就感,无力,疲劳,耻骨上疼痛,严酷,压痛,真菌感染,体温升高
上市后报告:血清胆固醇升高[参考]
据报道,同时接受茶碱的患者血清茶碱水平升高。
在上市后的经验中也有步态障碍和血钾升高的报道。 [参考]
新陈代谢
喹诺酮类抗生素与症状性低血糖有关。 [参考]
罕见(0.1%至1%):血液碱性磷酸酶升高,食欲/厌食症减少,食物摄入减少
稀有(0.01%至0.1%):高血糖,低血糖
未报告频率:LDH升高,尿酸升高,血糖升高,尿酸降低,血糖降低,酸中毒,症状性低血糖[参考]
肾的
罕见(0.1%至1%):肾功能不全,肾衰竭
罕见(0.01%至0.1%):肾小管间质性肾炎
未报告频率:血清肌酐升高,肾结石,BUN升高,BUN降低,肾功能异常,过敏性间质性肾炎,肾炎,与肌红蛋白相关的急性肾损伤/衰竭[参考]
导致非少尿性肾功能衰竭的过敏性间质性肾炎已在许多病例报告中进行了描述。几例包括皮疹,发烧和关节痛的症状,并伴有嗜酸性粒细胞增多和嗜酸性粒细胞增多症。过敏性间质性肾炎的病例通常对短期应用皮质类固醇激素治疗有反应。 [参考]
眼科
罕见(0.1%至1%):视觉障碍(例如,色盲,复视,光敏)
非常罕见(小于0.01%):视觉颜色失真
未报告的频率:视力下降,视力模糊,白内障,多点状双凸状浑浊,眼痛[参考]
喹诺酮类抗生素与白内障和多点状点状晶状体混浊有关。 [参考]
过敏症
过敏反应的范围从荨麻疹到过敏反应,包括危及生命的过敏性休克。
据报道,至少有2例患者发生了与使用该药物有关的皮肤血管炎。停药后无需医疗干预即可解决血管炎。
上市后的经验中也有类似血清病的反应和过敏性休克(危及生命)。 [参考]
稀有(0.01%至0.1%):过敏反应,过敏性休克(威胁生命),过敏性水肿
非常罕见(小于0.01%):过敏反应,血清病样反应
未报告频率:过敏反应,坏死性血管炎,皮肤血管炎[参考]
呼吸道
罕见(0.01%至0.1%):呼吸困难(包括哮喘病)
未报告频率:支气管痉挛,咯血,喉水肿,呼吸骤停,鼻出血,打cc,肺水肿,胸腔积液,肺栓塞,呼吸窘迫,喘息,咳嗽,上呼吸道感染,咽炎,鼻咽炎[参考]
内分泌
未报告频率:男性乳房发育症[参考]
免疫学的
未报告频率:Jarisch-Herxheimer反应[参考]
口服环丙沙星与一例Jarisch-Herxheimer反应(以低血压,心动过速和弥散性血管内凝血为特征)相关,该患者患有tick传复发热,年龄为14岁。 [参考]
参考文献
1. Norrby SR“喹诺酮类药物的副作用:喹诺酮类药物与其他抗生素的比较”。 Eur J临床微生物感染Dis 10(1991):378-83
2. Campoli-Richards DM,Monk JP,价格A,Benfield P,Todd PA,病房A“环丙沙星:其抗菌活性,药代动力学特性和治疗用途的综述。”毒品35(1988):373-447
3. Cerner Multum,Inc.“澳大利亚产品信息”。 00
4. Cerner Multum,Inc.“英国产品特性摘要”。 00
5. Fourcroy JL,Berner B,Chiang YK,Cramer M,Rowe L,Shore N“新型每日一次的环丙沙星缓释片制剂对妇女单纯性尿路感染的疗效和安全性。”抗微生物剂Chemother 49(2005):4137-43
6.“产品信息。CiproXR(环丙沙星)。”拜耳制药公司,康涅狄格州西黑文。
7.“产品信息。Cipro(环丙沙星)。”拜耳,康涅狄格州西黑文。
8.“摘自疾病控制与预防中心。最新消息:邮政雇员炭疽预防相关不良事件-新泽西州,纽约市和哥伦比亚特区大都会地区,2001年。”牙买加286(2001):2935-6
9. Kothur K,Singh M,Dayal D“环丙沙星诱导的过敏样反应。” Eur J Pediatr 165(2006):573-4
10. Heyd A,Haverstock D“对老年人群口服和静脉注射环丙沙星安全性的回顾性分析。”临床杂志22(2000):1239-50
11. Juillerat P,Pittet V,Felley C等。 “克罗恩病治疗中的药物安全性。”文摘76(2007):161-8
12. Ramakrishnan K,Scheid DC,“成人急性肾盂肾炎的诊断和治疗”。美国家庭医生71(2005):933-42
13. Ball P“环丙沙星:不良经历概述”。抗微生物化学杂志18(1986):187-93
14.Alexander RB,Propert KJ,Schaeffer AJ等。 “环丙沙星或坦索罗辛在患有慢性前列腺炎/慢性盆腔疼痛综合征的男性中:一项随机,双盲试验。” Ann Intern Med 141(2004):581-9
15. Schacht P,Arcieri G,Hullmann R“口服环丙沙星的安全性。基于临床试验结果的更新。” Am J Med 87(1989):s98-102
16. Overholser BR,Kays MB,Forrest A,Sowinski KM“与口服环丙沙星药代动力学有关的性相关差异”。临床药学杂志44(2004):1012-22
17. Bilton D,Henig N,Morrissey B,Gotfried M“在环丙沙星中添加吸入的妥布霉素以使成人支气管扩张的铜绿假单胞菌感染急性加重。”胸部130(2006):1503-10
18. Harmon T,Burkhart G,Applebaum H“母乳喂养的婴儿穿孔的假膜性结肠炎”。 J Pediatr Surg 27(1992):744-6
19. Bauwens JE,McFarland LV,Melcher SA“使用环丙沙星后复发的艰难梭菌病”。 Ann Pharmacother 31(1997):1090
20. Ferguson J,McEwen J,AlAjmi H,Purkins L,Colman PJ和Willavize SA“在健康受试者中,曲伐沙星与其他喹诺酮类药物的光敏潜力比较。”抗微生物化学杂志45(2000):503-9
21. Knoell KA,Lynch JM,“由环丙沙星和阳光照射引起的光诱导性急性皮疹性脓疱病”。 Int J Dermatol 48(2009):1141-3
22. KimyaiAsadi A,Usman A,Nousari HC“环丙沙星诱导的大疱性类天疱疮”。 J Am Acad Dermatol 42(2000):847
23. Kushner JM,Peckman HJ,Snyder CR“与氟喹诺酮类药物有关的癫痫发作”。 Ann Pharmacother 35(2001):1194-8
24. McDermott JL,Gideonse N,Campbell JW,“在住院的老年患者中与环丙沙星给药有关的急性del妄”。 J Am Geriatr Soc 39(1991):909-10
25. Mumford CJ,Ginsberg L“环丙沙星和重症肌无力”。 BMJ 301(1990):818
26. Gasser TC,Ebert SC,Graversen PH,Madsen PO“环丙沙星在肾功能受损患者中的药代动力学研究”。美国医学杂志82(1987):139-41
27. Fanhavard P,Sanchorawala V,Oh J,Moser EM,Smith SP“同时使用膦甲酸和环丙沙星可能会增加癫痫发作的可能性。” Ann Pharmacother 28(1994):869-72
28. Jay GT,菲茨杰拉德·JM,“环丙沙星诱导的del妄”。 Ann Pharmacother 31(1997):252
29. Arcieri G,August R,Becker N等人,“美国环丙沙星的临床经验”。 Eur J临床微生物学5(1986):220-5
30. McCue JD,Zandt JR“与使用环丙沙星和甲氧苄氨嘧啶-磺胺甲恶唑相关的急性精神病”。美国医学杂志90(1991):528-9
31. Cohen JS“与氟喹诺酮类药物相关的周围神经病变”。 Ann Pharmacother 35(2001):1540-7
32. Paton JH,Reeves DS,“氟喹诺酮类抗生素:微生物学,药代动力学和临床用途”。毒品36(1988):193-228
33. Akhtar S,Ahmad H“环丙沙星诱导的卡塔尼亚。” J Clin Psychiatry 54(1993):115-6
34. Moore B,Safani M,Keesey J“环丙沙星可能加重重症肌无力。”柳叶刀扬(1988):882
35. Maddix DS,Stefani,“重症肌无力和环丙沙星”。 Ann Pharmacother 26(1992):265-6
36. Isaacson SH,Carr J,Rowan AJ,“环丙沙星诱导的复杂的部分癫痫状态表现为急性精神错乱状态。”神经学43(1993):1619-21
37. P,Moitinho E,Elizade I,Cirera I,Tolosa E牧师,“接受盐酸环丙沙星治疗的患者的可逆性口腔运动障碍”。神经病学杂志243(1996):616-7
38. Arcieri G,Griffith E,Gruenwaldt G等人“一种新的喹诺酮类抗菌药物环丙沙星的临床经验调查”。临床药理学杂志(1988):179-89
39. Slavich IL,Gleffe Rf和Haas EJ“环丙沙星治疗期间发生的巨大癫痫发作”。牙买加261(1989):558-9
40. Altes J,Gasco J,De Antonio J,Villalonga C“环丙沙星和del妄”。 Ann Intern Med 110(1989):170-1
41. Darwish T“环丙沙星在健康患者中诱发的癫痫发作”。新西兰医学杂志121(2008):104-5
42. Fleming LW,Phillips G,Stewart WK,Scott AC“口服环丙沙星治疗连续性非卧床腹膜透析患者的腹膜炎”。 J Antimicrob Chemother 25(1990):441-8
43. Karki SD,Bentley DW,Raghavan M“癫痫发作与环丙沙星和茶碱联合治疗。” DICP 24(1990):595-6
44. Whyte CA,Shivdat-Nanhoe R,Kramer P“阿莫西林诱导的脑膜炎病例”。临床感染Dis 46(2008):642
45. Schwartz MT,Calvert JF,“与环丙沙星有关的潜在神经毒性”。 Ann Pharmacother 24(1990):138-40
46. Semel JD,Allen N“同时接受茶碱和亚胺培南或环丙沙星或甲硝唑的患者的癫痫发作。”南方医学杂志84(1991):465-8
47. Winrow AP,Supramaniam G“服用环丙沙星后良性颅内高压”。弓Dis儿童65(1990):1165-6
48. Rosolen A,Drigo P,Zanesco L“与环丙沙星有关的急性偏瘫”。 BMJ 309(1994):1411
49. Tattevin P,Messiaen T,Pras V,Ronco P,Biour M“服用环丙沙星后的精神错乱和全身性癫痫发作”。肾透析透析移植物13(1998):2712-3
50. Dutta TK,Badhe BA,“环丙沙星引起的骨髓抑制”。研究生医学杂志75(1999):571-3
51. Imrie K,Gold W,Salit I,基廷,“环丙沙星诱导的中性粒细胞减少和多形性红斑”。 Am J Hematol 43(1993):159-60
52. Starr JA,Ragucci KR,“与静脉注射环丙沙星有关的血小板减少症”。药物疗法25(2005):1030-4
53. Oh YR,Carr-Lopez SM,Probasco JM,Crawley PG“左氧氟沙星诱导的自身免疫性溶血性贫血”。 Ann Pharmacother 37(2003):1010-3
54. Andrews PA,Robinson GT,“与环丙沙星相关的血管内溶血和间质性肾炎。”尼弗龙83(1999):359-60
55. Labowitz JK,Silverman WB:“环丙沙星引起的胆汁淤积性黄疸”。 Dig Dis Sci 42(1997):192-4
56. Villenueuve JP,Davies C,Cote J“怀疑环丙沙星引起的肝毒性。” Ann Pharmacother 29(1995):257-9
57. Sherman O,Beizer JL,“可能由环丙沙星引起的急性胆汁淤积性黄疸。” Ann Pharmacother 28(1994):1162-4
58. Grasmick BK,Lehr VT,Sundareson AS“可能与环丙沙星有关的剧烈肝衰竭。” Ann Pharmacother 26(1992):636-9
59. Fuchs S,Simon Z和Brezis M“与环丙沙星有关的致命性肝衰竭。”柳叶刀343(1994):738-9
60. Stratta P,Lazzarich E,Canavese C,Bozzola C,Monga G“环丙沙星晶体性肾病”。 Am J Kidney Dis 50(2007):330-5
61. Mcgarvey WC,Singh D,Trevino SG“与氟喹诺酮类抗生素有关的部分跟腱断裂:病例报告和文献复习。”脚踝关节17(1996):496-8
62. Qian Q,Nasr SH,Akogyeram CO,Sethi S“在环丙沙星给药的情况下,肌红蛋白相关的急性肾脏损伤”。 Am J Kidney Dis 59(2012):462-6
63. Carrasco JM,Garcia B,Andujar C,Garrote F,de Juana P,Bermejo T“与环丙沙星有关的腱炎”。 Ann Pharmacother 31(1997):120
64. Poon CCH,Sundaram NA,“与环丙沙星相关的自发性双侧跟腱断裂”。 Med J Aust 166(1997):665
65. Alfaham M,Holt ME,Goodchild MC“服用环丙沙星的囊性纤维化患者的关节病”。 Br Med J(Clin Res Ed)295(1987):699
66.药物不良反应咨询委员会(ADRAC)和TGA的药物不良反应部门“澳大利亚药物不良反应简报”。 。” ([2008年10月]):
67. Donck JB,Segaert MF,Vanrenterghem YF,“肾移植受者中的氟喹诺酮类和跟腱病”。移植58(1994):736-7
68. Samuelson WM,Pleasants RA,Whitaker MS“成年囊性纤维化患者继发环丙沙星的关节炎”。 Ann Pharmacother 27(1993):302-3
69. Khaliq Y,Zhanel GG,“与氟喹诺酮有关的肌腱病:文献综述”。临床感染Dis 36(2003):1404-1410
70. Zabraniecki L,Negrier I,Vergne P,Arnaud M,Bonnet C,Bertin P,Treves R“氟喹诺酮引起的肌腱病:6例报告”。 J Rheumatol 23(1996):516-20
71. Berger RE“与环丙沙星,氧氟沙星,左氧氟沙星,加替沙星和莫西沙星相关的尖端扭转率”。 Urol 174(2005):165
72. Nair MK,Patel K,Starer PJ:“环丙沙星引起的美沙酮依赖患者的扭转性扭转性发作”。成瘾103(2008):2062-4
73. Frothingham R“与环丙沙星,氧氟沙星,左氧氟沙星,加替沙星和莫西沙星相关的点状扭转率”。药物疗法21(2001):1468-72
74. Atasoy H,Erdem G,Ceyhan M,Ecevit Z,Kanra G“与环丙沙星在婴儿中使用有关的高血压。” Ann Pharmacother 29(1995):1049
75. Owens RC Jr,Nolin TD,“与抗菌素相关的QT间隔延长:关注点”。临床感染Dis 43(2006):1603-1611
76. Lapi F,Wilchesky M,Kezouh A,Benisty JI,Ernst P,Suissa S“氟喹诺酮类药物和严重心律失常的风险:一项基于人群的研究。”临床感染Dis 55(2012):1457-65
77. Briasoulis A,Agarwal V和Pierce WJ,“氟喹诺酮类药物引起的QT延长和扭转性扭转性瘫痪:常用药物的不良反应很少。”心脏病学120(2011):103-110
78. Owens RC Jr,Ambrose PG“与氟喹诺酮类药物有关的尖端糖精”。 Pharmacotherapy 22(2002):663-8;和讨论668-72
79. Kelesidis T,Canseco E“喹诺酮引起的低血糖:危及生命但可能可逆的副作用。”美国医学杂志123号(2010):e5-6
80. Lin G,Hays DP,Spillane L“环丙沙星和格列本脲相互作用引起的难治性低血糖症”。毒素临床杂志42(2004):295-7
81. Ying LS,Johnson CA“环丙沙星诱导的间质性肾炎”。临床药物8(1989):518-21
82. Anand,“环丙沙星肾毒性”。 Arch Intern Med 153(1993):2705-6
83. Gonski PN“环丙沙星引起的老年患者肾功能衰竭”。 Med J Aust 154(1991):638-9
84. Ortiz A,JJ广场,Egido J,“环丙沙星相关的肾小管间质性肾炎伴线性管状基底膜沉积物。”尼弗龙60(1992):248
85. Hatton J,Haagensen D“与环丙沙星有关的肾功能不全”。药物疗法10(1990):337-40
86. Rippelmeyer DJ,Synhavsky,“环丙沙星和过敏性间质性肾炎”。 Ann Intern Med 109(1988):170
87. Rastogi S,Atkinson JLD,McCarthy JT“与环丙沙星有关的过敏性肾病。” Mayo Clin Proc 65(1990):987-9
88. Allon M,Lopez EJ,Min KW“由于环丙沙星引起的急性肾衰竭。” Arch Intern Med 150(1990):2187-9
89. Simpson J,Watson AR,Mellersh A,Nelson CS,Dodd K“伤寒,环丙沙星和肾衰竭。”儿童大拱门66(1991):1083-4
90. Murray KM,Wilson MG,“怀疑环丙沙星诱导的间质性肾炎。” Ann Pharmacother 24(1990):379-80
91. Hootkins R,Fenves AZ,Stephens MK“口服环丙沙星治疗继发的急性肾衰竭:三例病例并文献复习。” Clin Nephrol 32(1989):75-8
92. Thorsteinsson SB,Bergan T,Oddsdottir S,Rohwedder R,Holm R“晶体和环丙沙星,尿液pH和水合的影响。”化学疗法32(1986):408-17
93. Lucena MI,Marquez M,Velasco JL,Andrade RJ“患有获得性免疫缺陷综合症的患者归因于环丙沙星的急性肾衰竭。” Arch Intern Med 155(1995):114
94. Shih DJ,Korbet SM,Rydel JJ,Schwartz MM“与环丙沙星相关的肾血管炎”。 Am J Kidney Dis 26(1995):516-9
95. Helmink R,Benediktsson H“环丙沙星诱导的过敏性间质性肾炎。”尼弗龙55(1990):432-3
96. Tomas S,Pedro-Botet J,Auget T“环丙沙星和免疫复合物介导的疾病”。实习医生杂志(1991):550-1
97. Roujeau JC, Kelly JP, Naldi L, et al. “药物的使用以及史蒂文斯-约翰逊综合征或中毒性表皮坏死溶解的风险。”英格兰医学杂志333(1995):1600-7
98. Tierney BC, Martin SW, Franzke LH, et al. "Serious Adverse Events among Participants in the Centers for Disease Control and Prevention's Anthrax Vaccine and Antimicrobial Availability Program for Persons at Risk for Bioterrorism-Related Inhalational Anthrax." Clin Infect Dis 37 (2003): 905-11
99. Nedorost ST, Dijkstra JW, Handel DW "Drug-induced photosensitivity reaction." Arch Dermatol 125 (1989): 433-4
100. Ho DY, Song JC, Wang CC "Anaphylactoid reaction to ciprofloxacin." Ann Pharmacother 37 (2003): 1018-23
101. Peters B, Pinching AJ "Fatal anaphylaxis associated with ciprofloxacin in a patient with AIDS related complex." BMJ 298 (1989): 605
102. Granowitz EV "Photosensitivity rash in a patient being treated with ciprofloxacin." J Infect Dis 160 (1989): 910-1
103. Miller MS, Gaido F, Rourk MH Jr, Spock A "Anaphylactoid reactions to ciproflaxacin in cystic fibrosis patients." Pediatr Infect Dis J 10 (1991): 164-5
104. Slama TG "Serum sickness-like illness associated with ciprofloxacin." Antimicrob Agents Chemother 34 (1990): 904-5
105. Hallgren J, Tengvall-Linder M, Persson M, Wahlgren CF "Stevens-Johnson syndrome associated with ciprofloxacin: A review of adverse cutaneous events reported in Sweden as associated with this drug." J Am Acad Dermatol 49(5 Suppl) (2003): 267-9
106. Win A, Evers ML, Chmel H "Stevens-johnson syndrome presumably induced by ciprofloxacin." Int J Dermatol 33 (1994): 512-4
107. Wurtz RM, Abrams D, Becker S, Jacobson MA, Mass MM, Marks SH "Anaphylactoid drug reactions to ciprofloxacin and rifampicin in HIV-infected patients." Lancet 1 (1989): 955-6
108. Maunz G, Conzett T, Zimmerli W "Cutaneous vasculitis associated with fluoroquinolones." Infection 37 (2009): 466-8
109. Reano M, Vives R, Rodriguez J, Daroca P, Canto G, Fernandez J "Ciprofloxacin-induced vasculitis." Allergy 52 (1997): 599-600
110. Kennedy CA, Goetz MB, Mathisen GE "Ciprofloxacin-induced anaphylactoid reactions in patients infected with the human immunodeficiency virus." West J Med 153 (1990): 563-4
111. Davis H, Mcgoodwin E, Reed TG "Anaphylactoid reactions reported after treatment with ciprofloxacin." Ann Intern Med 111 (1989): 1041-3
112. Choe U, Rothschild BM, Laitman L "Ciprofloxacin-induced vasculitis." N Engl J Med 320 (1989): 257-8
113. Berger TG, Franklin N "Anaphylactoid reaction to ciprofloxacin in a patient infected with the human immunodeficiency virus." J Am Acad Dermatol 26 (1992): 256-7
114. Jongen-Lavrencic M, Schneeberger PM, van der Hoeven JG "Ciprofloxacin-induced toxic epidermal necrolysis in a patient with systemic lupus erythematosus." Infection 31 (2003): 428-9
115. Stubbings J, Sheehan-Dare R, Walton S "Cutaneous vasculitis due to ciprofloxacin." BMJ 305 (1992): 29
116. Rodriguez E, Martinez JA, Torres M, Nubiiola A, Buges J "Lobular panniculitis associated with ciprofloxacin." Br Med J 300 (1990): 1468
117. Lieu PK, Tok SC, Ismail NH, Chng HH "Ciproflaxin-induced cutaneous vasculitis." Allergy 52 (1997): 593-4
118. Tham TC, Allen G, Hayes D, et al "Possible association between toxic epidermal necrolysis and ciprofloxacin." Lancet 338 (1991): 522
某些副作用可能没有报道。您可以将其报告给FDA。
小儿患者的剂量
cUTI或肾盂肾炎的剂量和初始治疗途径(即静脉内或口服)应根据感染的严重程度来确定。 CIPRO应按照表3中的说明进行管理。使用共同包装的量匙对CIPRO口服混悬液进行管理[参见剂量和用法(2.7)]。
| 感染 | 剂量 | 频率 | 总时长 |
|---|---|---|---|
并发尿路或肾盂肾炎 (1至17岁的患者) | 10 mg / kg至20 mg / kg (每剂最大750毫克;即使体重超过51千克的患者也不得超过) | 每12小时 | 10-21天 |
吸入性炭疽(暴露后) 2 | 15毫克/千克 (每剂最大500毫克) | 每12小时 | 60天 |
瘟疫2,3 | 15毫克/千克 (每剂最大500毫克) | 每8至12小时 | 10-21天 |
肾功能不全患者的剂量调整
环丙沙星主要通过肾脏排泄消除。但是,该药物也会通过肝脏的胆道系统和肠道代谢并部分清除。这些替代的药物消除途径似乎可以补偿肾功能不全患者肾脏排泄减少。但是,建议对剂量进行一些调整,特别是对于严重肾功能不全的患者。表4显示了肾功能不全患者的剂量指南。
肌酐清除率(mL / min) | 剂量 |
> 50 | 参见常规剂量。 |
30-50 | 每12小时250-500毫克 |
5–29 | 每18小时250-500毫克 |
血液透析或腹膜透析患者 | 每24小时250-500 mg(透析后) |
当仅知道血清肌酐浓度时,可以使用以下公式估算肌酐清除率:
男性-肌酐清除率(mL / min)=体重(kg)x(140-年龄) | |
72 x血清肌酐(mg / dL) | |
女性-0.85倍于男性计算得出的值。 | |
血清肌酐应代表肾功能的稳定状态。
对于有严重感染和严重肾功能不全的患者,可以在上述间隔内给予750 mg单位剂量。应该仔细监测患者。
cUTI和肾盂肾炎的临床试验排除了中度至重度肾功能不全的小儿患者。对于中度至重度肾功能不全(即肌酐清除率<50 mL / min / 1.73m 2 )的小儿患者,没有必要的剂量调整信息。
重要管理说明
与多价阳离子
在镁/铝抗酸剂之前至少2小时或之后6小时施用CIPRO;聚合磷酸盐粘合剂(例如司维拉姆,碳酸镧)或硫糖铝酸盐; VIDEX®(去羟肌苷)可咀嚼/缓冲片剂或口服溶液儿科粉末;其他高度缓冲的药物;或其他含有钙,铁或锌的产品。
与乳制品
应避免将CIPRO与乳制品(如牛奶或酸奶)或钙强化果汁同时使用,因为可能会降低吸收。但是,CIPRO可能与包含这些产品的餐食一起服用。
接受CIPRO的患者的水合作用
确保接受CIPRO的患者有足够的水分,以防止形成高浓度尿液。喹诺酮类曾有结晶性尿症的报道。
指导患者进行适当的CIPRO管理[请参阅患者咨询信息(17)]。
口服悬浮液的CIPRO微胶囊的重组说明
CIPRO口服混悬液的浓度为5%(100毫升中5克环丙沙星)和10%(100毫升中10克环丙沙星)。 CIPRO口服混悬液由两种成分(微胶囊和稀释剂)组成,在分配前必须将其混合。
剂量 | 5% (250毫克/ 5毫升) | 10% (500毫克/ 5毫升) |
250毫克 | 5毫升 | 2.5毫升 |
500毫克 | 10毫升 | 5毫升 |
750毫克 | 15毫升 | 7.5毫升 |
悬浮液的制备:
第1步  | 小瓶装有微胶囊,大瓶装有稀释剂。 | 第2步 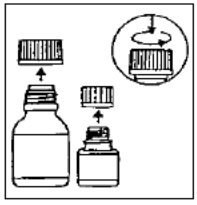 | 打开两个瓶子。儿童安全帽:向左旋转时,请按照保护帽上的说明向下按。 |
第三步 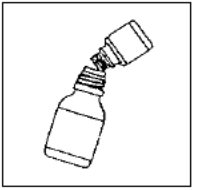 | 将微胶囊完全倒入较大的稀释剂瓶中。不要在悬浮液中加水。 | 步骤4  |
|
步骤5:在瓶标签上写上重新配制的口服混悬剂的有效期。
复原后的产品可能会在30°C(86°F)以下的温度下存储14天。防止冻结。
最终的环丙沙星混悬液不得添加任何其他成分。由于CIPRO口服混悬剂的物理特性,不应通过饲管或NG(鼻胃)管进行给药。
CIPRO复溶后口服混悬液管理说明
- •
- 每次使用前都要剧烈摇晃CIPRO口服混悬液约15秒钟。
- •
- 使用为患者提供的联合包装的量匙茶匙管理CIPRO口服混悬液(见图1)
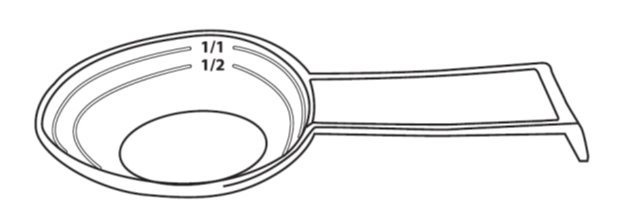
图1:共同包装的5 mL量匙茶匙
提供了共包装的分装茶匙(5mL),带有1/2(2.5 mL)和1/1(5 mL)的标记
- •
- 使用后,用洗洁精在流水下清洗刻度茶匙,并彻底干燥。
- •
- 不要咀嚼CIPRO口服混悬液中的微胶囊,而是将其整个吞下。
- •
- 之后可能会喝水。
- •
- 每次使用后,请按照瓶盖上的说明正确地重新盖上瓶子。
治疗完成后,不应再次使用CIPRO口服混悬剂。
在成人和小儿患者中使用Co-pack包装的勺子口服CIPRO的剂量
表:口服5%的Cipro:复溶后每5 mL 250 mg环丙沙星
感染 | 体重(公斤) | 通过使用共装勺量匙测量匙的剂量* | 剂量强度 (毫克) |
复杂性尿路或肾盂肾炎(1至17岁的患者) 1 和瘟疫2 | 9公斤至12公斤 | 1/2茶匙(2.5毫升) | 125毫克 |
13公斤至18公斤 | 1茶匙(5毫升) | 250毫克 | |
19公斤至24公斤 | 1至1.5茶匙(5毫升至7.5毫升) | 250mg̶̶至375 mg | |
25 kg至31 kg | 1.5到2茶匙(7.5毫升到10毫升) | 375至500毫克 | |
32 kg至37 kg | 1½至2½茶匙(7.5 mL至12.5 mL) | 375毫克至625毫克 | |
38公斤以上 | 2至3茶匙(10毫升至15毫升) | 500毫克至750毫克 | |
吸入性炭疽(暴露后) 3 | 9公斤至12公斤 | 1/2茶匙(2.5毫升) | 125毫克 |
13公斤至18公斤 | 1茶匙(5毫升) | 250毫克 | |
19公斤至24公斤 | 1至1.5茶匙(5毫升至7.5毫升) | 250mg̶̶至375 mg | |
25公斤以上 | 2茶匙(10毫升) | 500毫克 |
*为患者提供带有标记1/2(2.5)mL和1/1(5 mL)的刻度茶匙(5mL)。
1每12小时管理一次,持续10-21天[请参阅剂量和用法(2.2)]
2儿科患者每8-12小时给药一次,持续10-21天[见剂量和给药方法(2.2)] ;成人,每12小时给药一次,持续14天[请参阅剂量和用法(2.1)]
3每60小时服用一次,每12小时一次[请参阅剂量和用法(2.1和2.2)]
感染 | 体重(公斤) | 通过使用共装量匙*测量匙的剂量(匙匙(体积)(体积)) | 剂量强度 (毫克) |
复杂性尿路或肾盂肾炎(1至17岁的患者) 1 和瘟疫2 | 13 kg至24 kg | 1/2茶匙(2.5毫升) | 250毫克 |
25公斤 | 1/2至1茶匙(2.5 mL至5 mL) | 250毫克至500毫克 | |
26 kg至37 kg | 1茶匙(5毫升) | 500毫克 | |
38公斤以上 | 1至1½茶匙(5毫升至7.5毫升) | 500 mg至最大剂量750 mg | |
吸入性炭疽(暴露后) 3 | 13 kg至24 kg | 1/2茶匙(2.5毫升) | 250毫克 |
25公斤以上 | 1茶匙(5毫升) | 500毫克 |
*为患者提供带有标记1/2(2.5)mL和1/1(5 mL)的刻度茶匙(5mL)。
1每12小时管理一次,持续10-21天[请参阅剂量和用法(2.2)]
2儿科患者每8-12小时给药一次,持续10-21天[见剂量和给药方法(2.2)] ;成人,每12小时给药一次,持续14天[请参阅剂量和用法(2.1)]
3每60小时服用一次,每12小时一次[请参阅剂量和用法(2.1和2.2)]
- •
- 氟喹诺酮,包括环丙沙星®,已经禁用和已经发生一起可能不可逆转的严重不良反应[见警告和注意事项(相关5.1 )],包括:
- •
- 肌腱炎和肌腱破裂[见警告和注意事项( 5.2 )]。
- •
- 周围神经病变[请参阅警告和注意事项( 5.3 )]。
- •
- 中枢神经系统影响[请参阅警告和注意事项( 5.4 )]。
- 立即经历任何严重不良反应的患者应停用Cipro,并避免使用氟喹诺酮类药物(包括Cipro) [请参阅警告和注意事项( 5.1 )] 。
- •
- 氟喹诺酮类药物(包括Cipro)可能会加重重症肌无力患者的肌肉无力。患有重症肌无力史的患者应避免服用Cipro 。 [请参阅警告和注意事项( 5.5 )]。
- •
- 由于氟喹诺酮类药物(包括Cipro)已引起严重的不良反应[请参阅警告和注意事项( 5.1-5.16 )] ,因此,Cipro可供以下适应症无替代治疗选择的患者使用:
- •
- 慢性支气管炎的急性加重[见适应症和用法( 1.10 )]。
- •
- 急性单纯性膀胱炎[见适应症和用法( 1.11 )]。
- •
- 急性鼻窦炎[见适应症和用法( 1.12 )]。
Cipro的适应症和用法
皮肤和皮肤结构感染
环丙沙星是在成人患者适用于治疗由大肠杆菌,肺炎克雷伯菌,阴沟肠杆菌,奇异变形杆菌,普通变形杆菌,普罗维登斯stuartii,摩氏摩根,弗氏柠檬酸杆菌,铜绿假单胞菌,甲氧西林敏感的金黄色葡萄球菌,甲氧西林infectionscaused皮肤和皮肤结构的易感染的表皮葡萄球菌或化脓性链球菌。
骨和关节感染
Cipro适用于成年患者,用于治疗由阴沟肠杆菌,粘质沙雷氏菌或铜绿假单胞菌引起的骨和关节感染。
复杂的腹腔内感染
Cipro适用于成年患者,用于治疗大肠杆菌,铜绿假单胞菌,变形杆菌,肺炎克雷伯菌和脆弱拟杆菌引起的复杂腹腔内感染(与甲硝唑联用) 。
传染性腹泻
环丙沙星是在成人患者适用于治疗由大肠杆菌引起(产肠毒素菌株)感染性腹泻,空肠弯曲菌,志贺氏菌的鲍氏†,痢疾志贺菌,弗氏志贺菌或宋内氏痢疾†当指示抗菌治疗。
†尽管治疗此器官系统中这种生物体引起的感染显示出临床上显着的结果,但仅对不到10位患者进行了疗效研究。
伤寒(肠热)
Cipro适用于成年患者,用于治疗由伤寒沙门氏菌引起的伤寒(肠热) 。环丙沙星在消除慢性伤寒携带者状态方面的功效尚未得到证实。
单纯性宫颈和尿道淋病
Cipro适用于成年患者,用于治疗由于淋病奈瑟氏球菌引起的单纯性宫颈和尿道淋病[请参阅警告和注意事项( 5.17 )]。
吸入性炭疽(暴露后)
Cipro适用于从出生到17岁的成年人和小儿吸入性炭疽(暴露后),以减少暴露于雾化炭疽杆菌后疾病的发生或进展。
在人体内达到的环丙沙星血清浓度可作为替代终点,有可能合理地预测临床获益,并为批准该适应症提供了初步依据。 1在2001年10月的炭疽生物恐怖袭击中获得了环丙沙星用于炭疽暴露后预防的支持性临床信息[请参阅临床研究( 14.2 )]。
鼠疫
Cipro可以治疗鼠疫,包括鼠疫耶尔森氏菌(鼠疫耶尔森氏菌)引起的鼠疫,包括肺炎和败血性鼠疫,从出生到17岁,成人和儿科患者都可预防鼠疫。由于可行性原因,不能在患有鼠疫的人类中进行环丙沙星的功效研究。因此,该适应症仅基于在动物中进行的功效研究[见临床研究( 14.3 )] 。
慢性细菌性前列腺炎
Cipro在成年患者中适用于治疗由大肠杆菌或奇异变形杆菌引起的慢性细菌性前列腺炎。
下呼吸道感染
Cipro在成人患者中适用于治疗由大肠杆菌,肺炎克雷伯菌,阴沟肠杆菌,奇异变形杆菌,铜绿假单胞菌,流感嗜血杆菌,副流感嗜血杆菌或肺炎链球菌引起的下呼吸道感染。
Cipro不是治疗继发于肺炎链球菌的假定或确诊的肺炎的首选药物。
Cipro可用于治疗由卡他莫拉菌引起的慢性支气管炎(AECB)的急性加重。
由于氟喹诺酮类药物(包括Cipro)已引起严重的不良反应[请参阅警告和注意事项( 5.1-5.16 )],并且对于某些患者AECB是自限性的,因此对于没有其他治疗选择的患者,应将Cipro保留用于AECB的治疗。
尿路感染
成人泌尿道感染环丙沙星在成人患者表示治疗由大肠杆菌,肺炎克雷伯氏菌,阴沟肠杆菌,粘质沙雷氏菌,变形杆菌尿路感染,雷氏普罗威登斯菌,摩氏摩根菌,克氏柠檬酸杆菌,弗氏柠檬酸杆菌,铜绿假单胞菌,甲氧西林敏感的表皮葡萄球菌,腐生葡萄球菌或粪肠球菌。
急性单纯性膀胱炎Cipro在成年女性患者中适用于治疗由大肠杆菌或腐生葡萄球菌引起的急性单纯性膀胱炎。
由于氟喹诺酮类药物(包括Cipro)已引起严重的不良反应[请参阅警告和注意事项( 5 .1-5.16)],并且对于某些患者,急性并发性膀胱炎是自限性的,因此应将Cipro保留用于患有以下疾病的急性并发性膀胱炎患者没有其他治疗选择。
小儿合并尿路感染和肾盂肾炎Cipro适用于1至17岁的小儿患者,用于治疗大肠埃希氏菌引起的复杂尿路感染(cUTI)和肾盂肾炎[请参阅特定人群的使用( 8.4 )] 。
尽管在临床试验中有效,但是由于与对照组相比,包括与关节和/或周围组织有关的反应,不良反应的发生率增加,Cipro在儿科人群中不是首选药物。与其他氟喹诺酮类药物一样,Cipro与幼年动物负重关节的关节炎和组织病理学变化有关[请参阅警告和注意事项( 5.13 ),不良反应( 6.1 ),在特定人群中使用( 8.4 )和非临床毒理学( 13.2 )] 。
急性鼻窦炎
Cipro在成年患者中适用于治疗由流感嗜血杆菌,肺炎链球菌或卡他莫拉菌引起的急性鼻窦炎。
由于氟喹诺酮类药物(包括Cipro)已引起严重的不良反应[请参阅警告和注意事项( 5.1-5.15 )],并且对于某些患者,急性鼻窦炎是自限性的,因此对于没有其他治疗选择的患者,应将Cipro保留用于治疗急性鼻窦炎。
用法
为减少耐药菌的产生并保持Cipro和其他抗菌药物的有效性,Cipro仅应用于治疗或预防已被证实或强烈怀疑由易感细菌引起的感染。当可获得文化和药敏性信息时,在选择或修改抗菌疗法时应考虑它们。在缺乏此类数据的情况下,局部流行病学和易感性模式可能有助于经验性治疗的选择。
如果怀疑厌氧生物导致感染,应采取适当的治疗措施。治疗前应进行适当的培养和药敏试验,以分离和鉴定引起感染的生物并确定其对环丙沙星的敏感性。在知道这些测试结果之前,可以开始用Cipro进行治疗;一旦获得结果,应继续适当的治疗。
与其他药物一样,铜绿假单胞菌的某些分离物在用环丙沙星治疗期间可能会很快产生耐药性。在治疗期间定期进行的培养和药敏试验不仅会提供有关抗菌剂治疗效果的信息,而且还会提供有关细菌耐药性可能出现的信息。
Cipro剂量和用法
Cipro片剂和口服混悬剂应按照相应的剂量指南表中的说明口服。
成人剂量
确定任何特定患者的剂量和持续时间必须考虑到感染的严重程度和性质,致病微生物的敏感性,患者宿主防御机制的完整性以及肾和肝功能的状况。如果临床上有临床判断,则可对成年患者服用Cipro片剂或口服混悬剂。使用联合包装的量匙对Cipro进行口服混悬[见剂量和用法( 2.7 )]。
| |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
如果临床上有医师酌情决定的话,以Cipro IV开始治疗的患者可改用Cipro Tablets或口服混悬剂(见表2) [见临床药理学(12.3)]。
Cipro口服剂量 | 等效Cipro IV剂量 |
每12小时250毫克片剂 | 每12小时静脉注射200毫克 |
每12小时500毫克片剂 | 每12小时静脉注射400毫克 |
每12小时750毫克片剂 | 每8小时静脉注射400 mg |
小儿患者的剂量
cUTI或肾盂肾炎的剂量和初始治疗途径(即静脉内或口服)应根据感染的严重程度来确定。应当按照表3中的说明进行Cipro的给药。使用共同包装的量匙对Cipro进行口服混悬液给药[参见剂量和用法(2.7)]。
| 感染 | 剂量 | 频率 | 总时长 |
|---|---|---|---|
并发尿路或肾盂肾炎 (1至17岁的患者) | 10 mg / kg至20 mg / kg (每剂最大750毫克;即使体重超过51千克的患者也不得超过) | 每12小时 | 10-21天 |
吸入性炭疽(暴露后) 2 | 15毫克/千克 (每剂最大500毫克) | 每12小时 | 60天 |
瘟疫2,3 | 15毫克/千克 (每剂最大500毫克) | 每8至12小时 | 10-21天 |
肾功能不全患者的剂量调整
环丙沙星主要通过肾脏排泄消除。但是,该药物也会通过肝脏的胆道系统和肠道代谢并部分清除。这些替代的药物消除途径似乎可以补偿肾功能不全患者肾脏排泄减少。但是,建议对剂量进行一些调整,特别是对于严重肾功能不全的患者。表4显示了肾功能不全患者的剂量指南。
肌酐清除率(mL / min) | 剂量 |
> 50 | 参见常规剂量。 |
30-50 | 每12小时250-500毫克 |
5–29 | 每18小时250-500毫克 |
血液透析或腹膜透析患者 | 每24小时250-500 mg(透析后) |
当仅知道血清肌酐浓度时,可以使用以下公式估算肌酐清除率:
男性-肌酐清除率(mL / min)=体重(kg)x(140-年龄) | |
72 x血清肌酐(mg / dL) | |
女性-0.85倍于男性计算得出的值。 | |
血清肌酐应代表肾功能的稳定状态。
对于有严重感染和严重肾功能不全的患者,可以在上述间隔内给予750 mg单位剂量。应该仔细监测患者。
cUTI和肾盂肾炎的临床试验排除了中度至重度肾功能不全的小儿患者。对于中度至重度肾功能不全(即肌酐清除率<50 mL / min / 1.73m 2 )的小儿患者,没有必要的剂量调整信息。
重要管理说明
与多价阳离子在镁/铝抗酸剂之前至少2小时或之后6小时服用Cipro;聚合磷酸盐粘合剂(例如司维拉姆,碳酸镧)或硫糖铝酸盐; VIDEX®(去羟肌苷)可咀嚼/缓冲片剂或口服溶液儿科粉末;其他高度缓冲的药物;或其他含有钙,铁或锌的产品。
与乳制品应当避免将Cipro与乳制品(如牛奶或酸奶)或钙强化果汁同时使用,因为可能会降低吸收。但是,Cipro可能与包含这些产品的餐食一起服用。
接受环丙沙星治疗的患者的水合作用确保接受Cipro的患者充足的水分,以防止形成高浓度尿液。喹诺酮类曾有结晶性尿症的报道。
指导患者进行适当的Cipro给药[请参阅患者咨询信息(17)]。
口服悬浮液的Cipro微胶囊的重组说明
分别以5%(100毫升中5克环丙沙星)和10%(100毫升中10克环丙沙星)的浓度提供Cipro口服混悬液。 Cipro口服混悬液由两种成分(微胶囊和稀释剂)组成,在分配前必须将其合并。
剂量 | 5% (250毫克/ 5毫升) | 10% (500毫克/ 5毫升) |
250毫克 | 5毫升 | 2.5毫升 |
500毫克 | 10毫升 | 5毫升 |
750毫克 | 15毫升 | 7.5毫升 |
悬浮液的制备:
第1步  | 小瓶装有微胶囊,大瓶装有稀释剂。 | 第2步  | 打开两个瓶子。儿童安全帽:向左旋转时,请按照保护帽上的说明向下按。 |
第三步  | 将微胶囊完全倒入较大的稀释剂瓶中。不要在悬浮液中加水。 | 步骤4  |
|
步骤5:在瓶标签上写上重新配制的口服混悬剂的有效期。
复原后的产品可能会在30°C(86°F)以下的温度下存储14天。防止冻结。
最终的环丙沙星混悬液不得添加任何其他成分。由于Cipro口服混悬剂的物理特性,不应通过饲喂管或NG(鼻胃)管进行口服混悬。
Cipro重组后口服悬浮液的管理说明
- •
- 每次使用前都要剧烈摇晃Cipro口服混悬液约15秒钟。
- •
- 使用为患者提供的联合包装的量匙茶匙管理Cipro口服混悬液(见图1)

图1:共同包装的5 mL量匙茶匙
提供了共包装的分装茶匙(5mL),带有1/2(2.5 mL)和1/1(5 mL)的标记
- •
- 使用后,用洗洁精在流水下清洗刻度茶匙,并彻底干燥。
- •
- 不要咀嚼Cipro口服混悬液中的微胶囊,而是将其整个吞下。
- •
- 之后可能会喝水。
- •
- 每次使用后,请按照瓶盖上的说明正确地重新盖上瓶子。
治疗完成后,不应重复使用Cipro口服混悬剂。
成人和小儿患者使用Co-pack勺子口服Cipro的悬浮液剂量
表:口服5%的Cipro:复溶后每5 mL 250 mg环丙沙星
感染 | 体重(公斤) | 通过使用共装勺量匙测量匙的剂量* | 剂量强度 (毫克) |
复杂性尿路或肾盂肾炎(1至17岁的患者) 1 和瘟疫2 | 9公斤至12公斤 | 1/2茶匙(2.5毫升) | 125毫克 |
13公斤至18公斤 | 1茶匙(5毫升) | 250毫克 | |
19公斤至24公斤 | 1至1.5茶匙(5毫升至7.5毫升) | 250mg̶̶至375 mg | |
25 kg至31 kg | 1.5到2茶匙(7.5毫升到10毫升) | 375至500毫克 | |
32 kg至37 kg | 1½至2½茶匙(7.5 mL至12.5 mL) | 375毫克至625毫克 | |
38公斤以上 | 2至3茶匙(10毫升至15毫升) | 500毫克至750毫克 | |
吸入性炭疽(暴露后) 3 | 9公斤至12公斤 | 1/2茶匙(2.5毫升) | 125毫克 |
13公斤至18公斤 | 1茶匙(5毫升) | 250毫克 | |
19公斤至24公斤 | 1至1.5茶匙(5毫升至7.5毫升) | 250mg̶̶至375 mg | |
25公斤以上 | 2茶匙(10毫升) | 500毫克 |
*为患者提供带有标记1/2(2.5)mL和1/1(5 mL)的刻度茶匙(5mL)。
1每12小时管理一次,持续10-21天[请参阅剂量和用法(2.2)]
2儿科患者每8-12小时给药一次,持续10-21天[见剂量和给药方法(2.2)] ;成人,每12小时给药一次,持续14天[请参阅剂量和用法(2.1)]
3每60小时服用一次,每12小时一次[请参阅剂量和用法(2.1和2.2)]
感染 | 体重(公斤) | 通过使用共装量匙*测量匙的剂量(匙匙(体积)(体积)) | 剂量强度 (毫克) |
复杂性尿路或肾盂肾炎(1至17岁的患者) 1 和瘟疫2 | 13 kg至24 kg | 1/2茶匙(2.5毫升) | 250毫克 |
25公斤 | 1/2至1茶匙(2.5 mL至5 mL) | 250毫克至500毫克 | |
26 kg至37 kg | 1茶匙(5毫升) | 500毫克 | |
38公斤以上 | 1至1½茶匙(5毫升至7.5毫升) | 500 mg至最大剂量750 mg | |
吸入性炭疽(暴露后) 3 | 13 kg至24 kg | 1/2茶匙(2.5毫升) | 250毫克 |
25公斤以上 | 1茶匙(5毫升) | 500毫克 |
*为患者提供带有标记1/2(2.5)mL和1/1(5 mL)的刻度茶匙(5mL)。
1每12小时管理一次,持续10-21天[请参阅剂量和用法(2.2)]
2儿科患者每8-12小时给药一次,持续10-21天[见剂量和给药方法(2.2)] ;成人,每12小时给药一次,持续14天[请参阅剂量和用法(2.1)]
3每60小时服用一次,每12小时一次[请参阅剂量和用法(2.1和2.2)]
剂型和优势
平板电脑
- •
- 250 mg微黄色,薄膜包衣,圆形,一侧印有“ BAYER”,另一侧印有“ CIP 250”
- •
- 500 mg,略带黄色,薄膜包衣,胶囊状,一侧印有“ BAYER”,另一侧印有“ CIP 500”
口服悬浮液
- •
- 5%的口服混悬液:复溶后每5 mL 250 mg环丙沙星
- •
- 10%口服混悬剂:复溶后每5 mL 500 mg环丙沙星
禁忌症
过敏症
对具有环丙沙星,喹诺酮类抗菌药的任何成员或任何产品成分有超敏反应史的人禁用环丙沙星[见警告和注意事项( 5.7 )]。
替扎尼定
禁忌与替扎尼定同时给药[见药物相互作用( 7 )]。
警告和注意事项
禁用和潜在的不可逆的严重不良反应,包括腱炎和腱断裂,周围神经病变和中枢神经系统影响
氟喹诺酮类药物(包括Cipro)与来自不同身体系统的残疾以及潜在的不可逆的严重不良反应相关联,这些不良反应可能在同一患者中同时发生。常见的不良反应包括肌腱炎,肌腱断裂,关节痛,肌痛,周围神经病和中枢神经系统影响(晕眩,焦虑,抑郁,失眠,严重头痛和意识模糊)。这些反应可以在启动Cipro后几小时到几周内发生。任何年龄的或不具有预先存在的风险因素的患者都经历过这些不良反应[见警告和注意事项( 5.2 , 5.3 , 5.4 )]。
在出现任何严重不良反应的最初征兆或症状时,立即停止使用Cipro。此外,在经历了任何与氟喹诺酮有关的严重不良反应的患者中,避免使用氟喹诺酮类药物(包括Cipro)。
肌腱炎和肌腱断裂
在所有年龄段,氟喹诺酮类药物(包括Cipro)都与肌腱炎和肌腱破裂的风险增加有关[见警告和注意事项( 5.1 )和不良反应( 6.2 )] 。这种不良反应最常见于跟腱,也有肩袖,肩膀,手,二头肌,拇指和其他腱的报道。起始于Cipro的数小时或数天内,或完成氟喹诺酮治疗后的数月之内,可能会发生肌腱炎或肌腱破裂。
在60岁以上的患者,服用皮质类固醇药物的患者以及进行肾脏,心脏或肺移植的患者中,发生氟喹诺酮相关性肌腱炎和肌腱断裂的风险增加。其他可能独立增加肌腱断裂风险的因素包括剧烈的体力活动,肾功能衰竭和先前的肌腱疾病,例如类风湿关节炎。服用氟喹诺酮类药物但没有上述危险因素的患者也发生腱炎和肌腱破裂。如果患者感到疼痛,肿胀,发炎或肌腱破裂,请立即停止使用Cipro。有肌腱疾病史或肌腱炎或肌腱破裂的患者应避免使用氟喹诺酮类药物,包括Cipro [见不良反应( 6.2 )]。
周围神经病变
氟喹诺酮类药物(包括Cipro)与周围神经病变的风险增加有关。据报道,接受氟喹诺酮类药物(包括Cipro)的患者出现感觉神经或感觉运动性轴索性多发性神经病,影响小轴突和/或大轴突,导致感觉异常,感觉不足,感觉异常和虚弱。可以环丙沙星开始后不久出现的症状,并且可以在一些患者中不可逆的[见警告和注意事项( 5.1 )和不良反应( 6.1 , 6.2 )]。
如果患者出现周围神经病的症状(包括疼痛,灼痛,刺痛,麻木和/或虚弱),或其他感觉改变(包括轻触,疼痛,温度,位置感和振动感觉和/或运动强度)立即停止使用Cipro。为了最小化不可逆病情的发展。谁曾经历过周围神经病避免氟喹诺酮类药物,包括环丙沙星,患者[见不良反应( 6.1 , 6.2 )]。
中枢神经系统的影响
精神病学不良反应氟喹诺酮类药物(包括Cipro)与精神病性不良反应的风险增加有关,包括:中毒性精神病,进展为自杀观念/思想,幻觉或妄想症的精神病性反应;抑郁或自残行为,例如未遂或完全自杀;焦虑,激动或神经质;混乱,del妄,迷失方向或注意力不集中;失眠或噩梦;记忆障碍。这些反应可能在第一剂之后发生。如果发生这些反应,建议接受Cipro的患者立即通知其医疗保健提供者,停药,并采取适当的护理。
中枢神经系统不良反应氟喹诺酮类药物(包括Cipro)与癫痫发作(惊厥),颅内压升高(伪肿瘤),头晕和震颤的风险增加有关。与其他氟喹诺酮类药物一样,已知环丙沙星会引发癫痫发作或降低癫痫发作阈值。癫痫持续状态的病例已有报道。与所有氟喹诺酮类药物一样,在癫痫病患者以及已知或疑似中枢神经系统疾病的患者中谨慎使用Cipro,这些疾病可能易导致癫痫发作或降低癫痫发作阈值(例如,严重的脑动脉硬化,抽搐的既往史,脑血流量减少,脑部改变)结构或中风),或存在其他可能导致癫痫发作或降低癫痫发作阈值的危险因素(例如某些药物治疗,肾功能不全)。如果发生癫痫发作,请停止使用Cipro并采取适当的护理措施[请参阅不良反应( 6.1 )和药物相互作用( 7 )]。
重症肌无力加重
氟喹诺酮类药物(包括Cipro)具有神经肌肉阻滞活性,并可能加重重症肌无力患者的肌肉无力。上市后的严重不良反应,包括死亡和需要通气支持,与重症肌无力患者使用氟喹诺酮有关。患有重症肌无力史的患者应避免使用Cipro [请参阅不良反应( 6.2 )]。
其他严重甚至有时是致命的不良反应
在接受包括Cipro在内的喹诺酮类药物治疗的患者中,还报告了其他严重的,有时甚至是致命的不良反应,其中一些是由于超敏反应,有些是由于病因不明。这些事件可能很严重,通常会在多次给药后发生。临床表现可能包括以下一种或多种:
- •
- 发烧,皮疹或严重的皮肤病反应(例如中毒性表皮坏死,史蒂文斯-约翰逊综合征);
- •
- 血管炎;关节痛肌痛血清病
- •
- 过敏性肺炎;
- •
- 间质性肾炎;急性肾功能不全或衰竭;
- •
- 肝炎;黄疸;急性肝坏死或衰竭;
- •
- 贫血,包括溶血和再生障碍性贫血;血小板减少症,包括血栓性血小板减少性紫癜;白细胞减少症粒细胞缺乏症全血细胞减少症和/或其他血液学异常。
中止环丙沙星立即在皮疹,黄疸,或提起超敏反应和支持性措施的任何其它符号的第一外观[见不良反应( 6.1 , 6.2 )]。
过敏反应
据报道,在接受氟喹诺酮治疗的患者(包括Cipro)中,首次服用某些药物后会发生严重的,偶发性的致命过敏反应。一些反应伴有心血管衰竭,意识丧失,刺痛,咽部或面部水肿,呼吸困难,荨麻疹和瘙痒。只有少数患者有过敏反应史。严重的过敏反应需要立即用肾上腺素和其他复苏措施进行紧急治疗,包括氧气,静脉输液,静脉注射抗组胺药,皮质类固醇,加压胺和气道处理(包括插管),如所示[见不良反应( 6.1 )]。
肝毒性
Cipro报道了严重的肝毒性病例,包括肝坏死,危及生命的肝衰竭和致命事件。急性肝损伤起病迅速(1-39天),通常与超敏反应有关。损伤的模式可以是肝细胞性,胆汁淤积性或混合性。大多数具有致命结果的患者年龄大于55岁。如果出现肝炎的任何体征和症状(例如厌食,黄疸,尿色深,瘙痒或腹部嫩痛),请立即停止治疗。
可以有转氨酶的暂时增加,碱性磷酸酶,或胆汁郁积性黄疸,特别是在患者前面的肝损伤,谁用环丙沙星处理[见不良反应( 6.2 , 6.3 )]。
5.9主动脉瘤和夹层的风险
流行病学研究表明,在使用氟喹诺酮类药物后两个月内,主动脉瘤和夹层动脉瘤的发生率增加,特别是在老年患者中。尚未确定增加风险的原因。对于患有已知主动脉瘤的患者或主动脉瘤风险较高的患者,仅在没有其他可用的抗菌治疗方法时才使用Cipro。
伴随茶碱的严重不良反应
据报道,同时服用Cipro和茶碱的患者发生严重和致命的反应。这些反应包括心脏骤停,癫痫发作,癫痫持续状态和呼吸衰竭。还出现恶心,呕吐,震颤,易怒或心慌的情况。
尽管已经报道了单独接受茶碱的患者发生了类似的严重不良反应,但不能消除Cipro可能增强这些反应的可能性。如果不能避免同时使用,则监测茶碱的血清水平并适当调整剂量[见药物相互作用( 7 )]。
艰难梭菌相关性腹泻
克洛斯特里迪
1.工作原理
- Cipro是环丙沙星的品牌(商标)名称。环丙沙星是一种对多种不同细菌有效的抗生素。环丙沙星将两种细菌酶拓扑异构酶IV和DNA促旋酶转化为有毒酶,抑制了DNA和其他DNA过程的产生和修复。
- Cipro属于一组被称为氟喹诺酮类药物(也称为喹诺酮类)的药物。
2.优势
- Cipro可用于治疗各种感染,例如发生在尿路,前列腺,呼吸道,鼻窦,骨骼和关节,腹部和生殖器区域的那些感染。但是,它通常仅在其他替代疗法失败或无法使用时,才用于治疗尿路感染,慢性支气管炎和鼻窦炎。
- 除其他感染外,还可用于治疗鼠疫或单纯性淋病。
- 当人们暴露于炭疽病时,可以作为预防措施。
- 对多种不同的革兰氏阳性和革兰氏阴性细菌的敏感菌株有效,例如:金黄色葡萄球菌(仅对甲氧西林敏感的菌株),表皮葡萄球菌(对甲氧西林敏感的分离株),化脓性链球菌,大肠杆菌,肺炎克雷伯菌和铜绿假单胞菌。对阴沟肠杆菌,变形杆菌,寻常变形杆菌,斯氏普罗维登斯氏菌,摩根氏摩根氏菌和弗氏柠檬酸杆菌也有效。
- 环丙沙星可以以环丙沙星的名称作为通用名获得。
3.缺点
如果您的年龄在18至60岁之间,不服用其他药物或没有其他医疗状况,则您更可能会遇到的副作用包括:
- 腹泻,恶心,肝功能异常检查,呕吐,关节痛或皮疹。
- 肌醇和其他氟喹诺酮类药物与肌腱炎和肌腱破裂,周围神经病变(手指和脚趾的神经痛)和中枢神经系统影响(影响大脑的副作用,包括精神病,抽搐,幻觉)有关。这些副作用可能是不可逆的,并且在某些患者中可能一起发生。在开始使用左氧氟沙星后的任何时间和任何患者中都可能发生。如果发生任何这些非常严重的副作用,应立即停用Cipro,将来应避免使用所有氟喹诺酮类药物。在60岁以上,服用皮质类固醇或有器官移植史的人群中,肌腱炎和肌腱断裂的风险增加。先前的肌腱疾病或剧烈活动也可能增加风险。
- 也可能引起焦虑,失眠,精神病,神经痛或感觉丧失,心电图异常,增加对光的敏感性等作用。
- 除非儿童患有某些无法用其他抗生素治疗的严重感染,否则不应该给18岁以下的儿童服用。儿童更容易受到Cipro的不良影响。
- 重症肌无力患者可能会加剧肌肉无力。
- 偶尔有严重的,有时甚至危及生命的不良反应,例如肝损害和过敏反应。
- 可能引发癫痫发作或增加癫痫发作的风险。
- 可能会干扰糖尿病患者的血糖水平;需要仔细监测血糖。
- 可能引起光敏反应和皮肤裸露区域严重晒伤。
- 不适合患有重症肌无力,某些心律失常或儿科患者的患者(除非给予预防以防止吸入炭疽或鼠疫)。肾功能不好的人可能需要减少剂量。可能会导致肝损伤或心律失常。
- 可能与某些药物相互作用,包括抗酸剂或含铁或锌的制剂。在这些准备工作之前至少两个小时或之后两个小时进行给药。
注意:一般而言,老年人或儿童,患有某些疾病(例如肝脏或肾脏问题,心脏病,糖尿病,癫痫发作)的人或服用其他药物的人更有可能出现更大范围的副作用。有关所有副作用的完整列表,请单击此处。
4.底线
Cipro是治疗多种感染的有效抗生素。但是,不应将其用于18岁以下的儿童,而在成年人中则应保留这种药物,以免未经其他抗生素治疗。副作用包括肌腱炎和肌腱破裂。
5.秘诀
- 可以带或不带食物一起服用。严格按照指示进行操作,并在指定的时间范围内服用,以减少产生抗药性细菌的风险,除非副作用导致及早停用。
- 仅当由医生开具处方时,如果使用不当,应使用该药物来治疗易感细菌引起的感染,这会增加产生耐药菌的机会,并增加您产生副作用的风险。
- 不要在含镁/铝的抗酸剂或其他含有钙,铁或锌的产品两个小时内服用Cipro。其他产品也可能影响吸收(检查产品信息)。
- 避免将Cipro与乳制品(例如牛奶或酸奶)或钙强化果汁一起服用。但是,Cipro可能与含钙的餐点一起服用。
- 服用Cipro时,请避免阳光直射,并避免过度暴露在阳光下。在户外时要戴防晒霜。
- 服用Cipro时要保持充足的水分,避免尿液中形成晶体。
- 如果您遇到肌腱疼痛,肿胀,发炎或破裂,请立即停止使用Cipro,并与您的医疗保健提供者联系。
- 如果您的手指和脚趾感到疼痛,刺痛或麻木,请立即停止使用Cipro,并与您的医疗保健提供者联系;或任何中枢神经系统影响(例如妄想症,抑郁症,幻觉);严重的皮疹;黄疸(皮肤发黄);心跳改变;或任何过敏反应的迹象。
- 如果在服用Cipro时或停药后数月出现慢性腹泻,请寻求医疗建议。
- 如果Cipro使您感到头晕或疲劳,请不要驾驶或操作机械。避免饮酒。
6.响应和有效性
- 给药后一到两个小时,Cipro的峰值浓度达到;但是,可能最多需要48小时才能消除与感染相关的症状。
7.互动
与Cipro相互作用的药物可能会降低其作用,影响其作用时间,增加副作用,或者与Cipro一起服用时的作用较小。两种药物之间的相互作用并不总是意味着您必须停止服用其中一种药物。但是,有时确实如此。与您的医生谈谈应如何管理药物相互作用。
可能与Cipro相互作用的常见药物包括:
- 含钙,镁或铝的抗酸剂
- 抗惊厥药,例如苯妥英
- 降血糖药,例如格列美脲或格列本脲
- 咖啡因
- 氯氮平
- 皮质类固醇,如泼尼松。可能会增加肌腱炎或肌腱破裂的风险
- 环孢素
- 肠清洁剂,如甲基硫酸钠
- 利尿剂
- 乳酸菌
- 甲氨蝶呤
- NSAID,例如布洛芬,双氯芬酸或萘普生
- 光敏剂,如氨基乙酰丙酸
- 丙磺舒
- 延长QTc的药物,例如胺碘酮,多潘立酮,美沙酮,恩丹西酮或氟哌啶醇
- 硫糖铝
- 含钙,铁或锌的补品
- 茶碱
- 替扎尼定
- 华法林
- 接种疫苗,例如卡介苗,霍乱或伤寒
- 维生素K
- 任何抑制或诱导CYP3A4或CYP1A2的药物。
请注意,此列表并不包含所有内容,仅包括可能与Cipro相互作用的常用药物。有关交互的完整列表,请参阅Cipro的处方信息。
参考文献
环丙沙星(环丙沙星)[包装插页]。修订于09/2019。拜耳医药保健制药公司https://www.drugs.com/pro/cipro.html
版权所有1996-2020 Drugs.com。修订日期:2020年1月9日。
已知共有586种药物与环丙沙星(环丙沙星)相互作用。
- 137种主要药物相互作用
- 372种中等程度的药物相互作用
- 77次次要药物相互作用
检查互动
最常检查的互动
查看Cipro(环丙沙星)与以下药物的相互作用报告。
- 沙丁胺醇
- 氨氯地平
- 阿司匹林
- 咖啡因
- 酸果蔓
- 弗拉基(甲硝唑)
- 速尿
- 加巴喷丁
- 布洛芬
- 布洛芬
- Lasix(速尿)
- 左甲状腺素
- 立普妥(阿托伐他汀)
- 赖诺普利
- 二甲双胍
- 二甲双胍
- 甲氨蝶呤
- 奥美拉唑
- 奥美拉唑
- 强的松
- 强的松
- 拟甲状腺素(左甲状腺素)
- 曲马多
- 曲唑酮
- 泰诺(对乙酰氨基酚)
- 维生素D3(胆钙化固醇)
- Xanax(阿普唑仑)
- 酸奶
- Zoloft(舍曲林)
环丙沙星(环丙沙星)酒精/食物相互作用
Cipro(环丙沙星)与酒精/食物有3种相互作用
环丙沙星(环丙沙星)疾病相互作用
与环丙沙星(环丙沙星)有10种疾病相互作用,包括:
- 结肠炎
- 中枢神经系统疾病
- 重症肌无力
- 周围神经病
- QT间期延长
- 肌腱炎
- 结晶尿
- 糖尿病
- 血液透析
- 肾功能不全
药物相互作用分类
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
- 审批历史 FDA的药物史
美国日本医生

Heather Benjamin MD

Heather Benjamin MD

Heather Miske DO

Heather Miske DO

Bert Hepner DO

渡邊剛

渡邊剛

宮崎総一郎 中部大学特聘教授

百村伸一 教授
