获取国外i3odine Max药品价格,使用等信息,最快 24 小时回馈
i3odine Max
免责声明:FDA尚未发现该药物是安全有效的,并且该标签尚未获得FDA的批准。有关未经批准的药物的更多信息,请点击此处。
在本页面
- 适应症和用法
- 剂量和给药
- 剂型和优势
- 禁忌症
- 警告和注意事项
- 不良反应/副作用
- 药物相互作用
- 在特定人群中使用
- 过量
- 描述
- 临床药理学
- 供应/存储和处理方式
- 病人咨询信息
1适应症和用途
I 3 odine MAX TM用于治疗甲状腺功能亢进症和部分甲状腺癌。
i3odine Max剂量和用法
辐射安全
- I 3 odine MAX TM是放射性药物。采取适当的安全措施,以尽量减少对患者和医护人员的辐射暴露[请参阅警告和注意事项(5.7)] :
- 仅由在安全使用和处理放射性物质方面经过特殊培训和经验合格,并且其经验和培训已经得到授权许可使用放射性药物的适当政府机构批准的医生或在其指导下使用。
- 在操作和管理产品时,请使用防水手套。
- 在产品的使用寿命内保持足够的屏蔽。
- 给药前立即用合适的放射性校准系统测量患者剂量。
重要管理说明
- 请勿将I 3 odine MAX TM随附的浓碘化钠I 131溶液直接施用于患者。浓碘化碘131溶液必须在给药前稀释并制备[见剂量和给药方法(2.4)] 。
- 用药前要对有生殖能力的女性进行妊娠试验,以验证是否没有妊娠[见禁忌症(4)和在特定人群中的使用(8.1,8.3)] 。
- 指导患者在给药前至少2小时和给药后2小时禁食,以确保吸收。
- 指导患者在服用碘化钠I 131之前和之后进行水合,并经常排空以增强尿液对甲状腺未吸收的放射性碘的清除作用(请参阅警告和注意事项(5.2)) 。
- 指导患者在服用放射性碘前两周保持低碘饮食,并在摄取或成像过程中持续几天[见警告和注意事项(5.8)和药物相互作用(7)] 。
- 指导患者在服用碘化钠I 131前三天停止抗甲状腺治疗[见警告和注意事项(5.8)和药物相互作用(7)] 。
- 对于有肾功能不全病史的患者,请评估肾功能以制定治疗计划并考虑剂量测定法[请参见在特定人群中使用(8.6)] 。
- 在治疗后的一个月内获得全血细胞计数。如果患者显示出白细胞减少症或血小板减少症,应使用剂量测定法确定安全的碘化钠I 131活性,同时向骨髓中递送少于2 Gy的葡萄糖[见警告和注意事项(5.2)] 。
推荐剂量和用法
个性化治疗
口服碘化钠I 131胶囊或溶液的建议剂量取决于甲状腺的摄取量以及腺体的大小。甲状腺吸收和大小应在治疗之前由医生确定,并且可能对计算要给予个体患者的治疗剂量有用。
甲亢的治疗
建议口服剂量为148至370 MBq(4至10 mCi)。有毒的结节性甲状腺肿可能需要更大剂量。
甲状腺癌的治疗
建议口服剂量为1100至3700 MBq(30至100 mCi)。对于随后的转移灶消融,推荐的口服剂量为3700至7400 MBq(100至200 mCi)。
稀释和制备说明
碘化钠I 131稀溶液的制备
- 使用产品瓶标签上的校准日期和放射性核素浓度,计算所需的体积,以MBq或mCi表示所需的剂量。
- 使用屏蔽注射器除去所需的体积。
- 使用屏蔽注射器将所需体积转移至适当屏蔽的接收瓶中。
- 将稀释液添加到接收瓶中,以产生所需体积的最终剂量。
- 推荐的稀释剂是纯水,其中含有0.2%的硫代硫酸钠作为还原剂。不应使用酸性稀释剂,因为它们可能导致pH值降至7.5以下并刺激碘I-131氢碘酸挥发。
- 将剂量放在一个有遮盖的容器中,用吸管给病人服用
碘化钠I 131胶囊的制备
- I 3 odine MAX TM每次准备的胶囊剂量包括一个大明胶胶囊和一个小明胶胶囊。每个大胶囊是空的,每个小胶囊包含约300 mg无水磷酸氢二钠作为吸收缓冲液。
- 使用产品瓶标签上的校准日期和放射性核素浓度,计算所需的体积,以MBq或mCi表示所需的剂量。
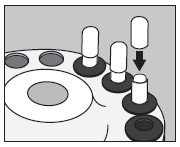
- 如下所示,通过将胶囊分成两部分来打开I 3 odine MAX TM随附的一个大胶囊:

- 如下图所示,将I 3 odine MAX TM随附的未打开的小胶囊插入空的大胶囊的下半部分:

- 使用适当的注射器,从小瓶中取出所需体积的碘化氢I 131溶液(最大150微升),如下所示:

- 如下图所示,从顶部注入小胶囊的中心:

- 将大胶囊的上半部滑到下半部,以完全覆盖小胶囊,然后轻轻向下推直至锁定,如下图所示:

- 给药前立即在合适的放射性校准系统中测量患者剂量。
- 可以将准备好的胶囊存放在合适的聚丙烯容器中,并在7天内放入铅锅中直至使用。
辐射剂量法
- 与甲状腺摄取碘化物I 131相关的生物动力学模型和辐射剂量分布取决于饮食中摄取的稳定碘化物和假定甲状腺激素的正常产生。表1显示了成年人的平均摄取百分比范围(73.7千克参考模型)。表1不能用于治疗计划。
- 对于在激素产生中被碘化物吸收所阻断的甲状腺,碘化物I 131的有效半衰期约为1.4小时;对于“低”至“高”摄取,I 131的有效半衰期约为80至90小时。
| ||||
| 成人口服活性碘盐I 131的吸收剂量(mGy / MBq)(73.7 kg参考模型) | ||||
| 器官 | 甲状腺对I 131的摄取(施用的活性%A 0 ) 口服后24小时 | |||
甲状腺受阻 | 低摄取† | 中等吸收† | 高摄取† | |
| 肾上腺 | 0.044 | 0.051 | 0.055 | 0.059 |
| 骨表面 | 0.030 | 0.089 | 0.12 | 0.16 |
| 脑 | 0.021 | 0.093 | 0.13 | 0.17 |
| 乳房 | 0.020 | 0.038 | 0.048 | 0.058 |
| 胆囊壁 | 0.037 | 0.043 | 0.046 | 0.049 |
| 胃肠道 | ||||
| 食管 | 0.024 | 0.10 | 0.14 | 0.19 |
| 胃壁 | 0.87 | 0.77 | 0.71 | 0.66 |
| 小肠壁 | 0.035 | 0.033 | 0.032 | 0.032 |
| 结肠壁 | 0.14 | 0.14 | 0.14 | 0.14 |
| (大肠壁上方) | 0.12 | 0.12 | 0.12 | 0.12 |
| (下大肠壁降低) | 0.17 | 0.17 | 0.17 | 0.16 |
| 心墙 | 0.062 | 0.089 | 0.10 | 0.12 |
| 肾脏 | 0.27 | 0.27 | 0.27 | 0.27 |
| 肝 | 0.050 | 0.093 | 0.12 | 0.14 |
| 肺 | 0.053 | 0.10 | 0.13 | 0.15 |
| 肌肉 | 0.026 | 0.084 | 0.12 | 0.15 |
| 卵巢 | 0.038 | 0.037 | 0.036 | 0.035 |
| 胰腺 | 0.060 | 0.064 | 0.066 | 0.068 |
| 红骨髓 | 0.031 | 0.072 | 0.095 | 0.12 |
| 唾液腺 | 0.27 | 0.22 | 0.19 | 0.16 |
| 皮肤 | 0.019 | 0.043 | 0.057 | 0.071 |
| 脾 | 0.064 | 0.069 | 0.072 | 0.075 |
| 睾丸 | 0.025 | 0.024 | 0.023 | 0.22 |
| 胸腺 | 0.024 | 0.10 | 0.14 | 0.19 |
| 甲状腺 | 2.2 | 280‡ | 430‡ | 580‡ |
| 膀胱壁 | 0.54 | 0.45 | 0.39 | 0.34 |
| 子宫 | 0.045 | 0.042 | 0.040 | 0.038 |
| 其余器官 | 0.029 | 0.084 | 0.11 | 0.15 |
| 每次活动的有效剂量(mSv / MBq) | 0.28 | 14‡ | 22‡ | 29‡ |
剂型和优势
I 3 odine MAX TM可按客户订购的体积提供,强度范围为校准时间的18.5-129.5 GBq / mL(500-3500 mCi / mL)。每个I 3 odine MAX TM试剂盒均包含一个容器的碘化钠I-131溶液和两个或多个装有明胶胶囊的泡罩包装。每个泡罩包装包含5#1空明胶胶囊和5#2明胶胶囊,其中填充了约300 mg磷酸氢二钠无水。提供大的空明胶胶囊和小明胶胶囊,其中包含约300 mg无水磷酸氢二钠作为吸收缓冲液,以及碘化钠I-131溶液,用于制备治疗性的碘化钠I 131胶囊。
禁忌症
I 3 odine MAX TM禁忌症:
- 呕吐和腹泻患者[见警告和注意事项(5.7)] 。
- 怀孕[请参阅警告和注意事项(5.4),请参见在特定人群中使用(8.1)] 。
- 泌乳[见警告和注意事项(5.5)] 。
- 同时接受抗甲状腺治疗的患者[见警告和注意事项(5.1)和药物相互作用(7)] 。
警告和注意事项
放射诱发的甲状腺炎
碘化钠I 131可能导致甲状腺炎并释放甲状腺激素,这可能加剧甲状腺功能亢进症和甲毒性心脏病[见不良反应(6)] 。在治疗甲状腺功能亢进症时,请考虑使用抗甲状腺药物进行预处理以帮助消耗甲状腺激素。服用碘化氢I 131前三天停止抗甲状腺治疗[见药物相互作用(7)] 。考虑在治疗前或治疗后使用β受体阻滞剂,以最大程度地降低甲状腺功能亢进和甲状腺风暴的风险。
甲状腺炎可能引起腺体肿大,导致颈部压痛和肿胀,吞咽疼痛,喉咙痛和咳嗽;碘化钠I 131服用后大约第三天会发生。考虑使用止痛药或消炎药进行治疗。
辐射诱发的毒性
碘化物I 131可能引起辐射诱导的毒性[请参阅不良反应(6)] :
- 剂量依赖性死亡(骨髓抑制,恶性肿瘤)。
- 剂量依赖性的造血抑制表现为碘化钠I 131给药后3-5周出现的短暂性血小板减少症或中性粒细胞减少症,可能导致感染或出血的敏感性增加。
- 唾液腺毒性:涎腺炎,口干症。
- 泪腺毒性:结膜炎,干眼症和泪溢。
在治疗后的一个月内获得全血细胞计数。如果患者显示出白细胞减少症或血小板减少症,则应使用剂量测定法确定安全的碘化钠I 131活性,同时向骨髓输送少于2 Gy的碘。
建议服用碘化氢I 131后保持一周水合,并通过唾液分泌刺激唾液流动(例如无糖糖果或口香糖,毛果芸香碱和抗坏血酸),以减少唾液腺的辐射暴露。
建议患者在服用放射性碘后经常排空以增强排泄。
过敏反应
接受碘化钠I 131的患者可能会发生包括过敏反应在内的超敏反应。尽管碘不被认为是过敏原,但与胶囊的赋形剂或化学成分(如硫代硫酸钠)有关的超敏反应也可能发生。获取并记录过敏史,尤其是亚硫酸盐过敏。紧急复苏设备和人员应立即可用[见不良反应(6)] 。
胎儿毒性
I 3 odine MAX TM在怀孕期间是禁忌的,因为碘化钠I 131穿过胎盘,胎儿暴露可导致新生儿甲状腺功能减退。公开文献中的多个报道描述了在子宫内暴露于碘化钠I 131后新生儿的甲状腺功能减退。一些新生儿甲状腺功能减退的病例很严重且不可逆。验证有生育能力的女性的怀孕状况开始HICON®治疗之前。建议女性和有生育能力男性的用HICON®治疗期间使用有效的避孕方法和最后一次给药后至少六个月[见特殊人群中使用(8.1,8.3)]。
哺乳期增加对乳房组织的辐射暴露
HICON®在哺乳期妇女是禁忌的,因为碘化钠通过乳房组织与泌乳在碘化钠同向转运体的表达增加的I 131倍的浓缩物在乳房。文献描述了停止母乳喂养后5-32周,乳腺组织中放射性碘的摄入量达到中度至明显。建议哺乳期妇女在服用碘化钠I 131之前至少6周停止母乳喂养,以便有足够的时间发生内卷,并避免乳房组织中碘化钠I 131的浓度过高。考虑服用抑制泌乳的药物。在给予碘化钠I 131之前应考虑进行诊断闪烁显像,以评估乳房组织对摄取的持久性。如果在产后服用碘化氢I 131,则哺乳期的母亲不应母乳喂养婴儿[见特殊人群的使用(8.2)] 。
短暂性不育
有报道称,碘化钠I 131治疗后,男性的睾丸功能出现暂时性剂量相关性损害,女性短暂性卵巢功能不全。考虑预期将接受累积碘化钠I 131剂量大于19,000 MBq(520 mCi)的男性的精子储备[请参见在特定人群中使用(8.3)] 。
辐射风险
家庭联络
指导患者按照接受HICON®,以尽量减少其他人或环境的辐射污染后辐射的安全防范措施。患者应避免与他人特别是孕妇和儿童密切接触,并注意避免体液污染他人或环境。
患者和医疗保健提供者
HICON®有助于患者的整体长期累积的辐射暴露,这是与癌症风险增加有关。遵循安全处理和管理,以最大程度地减少对患者和医疗保健提供者的辐射暴露。
治疗效果降低的风险
某些食物或药物可能会改变碘化钠I 131在甲状腺的吸收,并降低其有效性。最近摄入任何形式的稳定碘化物,或使用甲状腺或抗甲状腺药物可能会减少甲状腺对碘化钠I 131的摄取[见药物相互作用(7)] 。
不良反应
以下和标签中其他地方描述了以下严重不良反应:
- 辐射诱发的甲状腺炎[见警告和注意事项(5.1)] 。
- 辐射引起的毒性[参见警告和注意事项(5.2)]。
- 过敏反应[请参阅警告和注意事项(5.3)]。
- 胎儿毒性[见警告和注意事项(5.4),在特定人群中使用(8.1)]。
- 哺乳期增加对乳房组织的辐射暴露[见警告和注意事项(5.5),在特定人群中使用(8.2) ]。
- 暂时性不育症[见警告和注意事项(5.6),在特定人群中使用(8.3) ]。
- 辐射暴露[请参阅警告和注意事项(5.7)]。
在碘化钠I 131的批准后使用期间,已经确认了以下不良反应。由于这些反应是由不确定大小的人群自愿报告的,因此,始终无法可靠地估计其发生频率或建立与药物暴露的因果关系。
- 胃肠道疾病:涎腺炎,唾液腺功能障碍,恶心,呕吐,胃炎。
- 心脏疾病:胸痛,心动过速。
- 皮肤和皮下组织疾病:瘙痒,皮疹,荨麻疹。
- 内分泌失调:甲状腺功能低下,甲状腺功能亢进,甲状腺毒性危机,甲状旁腺功能低下
- 一般疾病和给药部位状况:甲状腺局部肿胀或碘化物致癌部位。
- 血液和淋巴疾病包括死亡:骨髓抑制,贫血,白细胞减少症,血小板减少症和血液异常。
- 良性,恶性和未指明的肿瘤(包括囊肿和息肉):急性白血病,实体癌。
- 眼部疾病:泪腺功能障碍。
- 先天性,家族性和遗传性疾病:先天性甲状腺功能减退症,染色体异常。
- 免疫系统疾病:支气管痉挛。
- 神经系统疾病:头痛,*脑水肿。
- 呼吸,胸和纵隔疾病:**放射性肺炎,**肺纤维化。
*碘化物-avid脑转移患者
**有碘化物-avid肺转移的患者
药物相互作用
- 骨髓抑制剂的同时使用可能会由于使用大剂量碘化钠I 131而导致造血系统的抑郁症[参见警告和注意事项(5.2)] 。
- 许多药物和含碘化物的食物会干扰甲状腺中放射性碘化物的积累。在使用碘化钠I 131之前,回顾患者的病史,当前的药物治疗和最近的诊断测试[参见警告和注意事项(5.8)] 。
- 建议患者在服用放射性碘前两周保持低碘饮食,并在摄取或成像过程中持续几天,并在接受表2所示程序之前停止服用以下产品。
| 药物种类 | 建议提款时间 |
| 亚硫酰胺药物 (例如,丙基硫氧嘧啶,甲巯咪唑,卡巴咪唑) | 3天 |
| 含碘的多种维生素 | 10天 |
| 天然或合成甲状腺激素 三碘甲状腺素 甲状腺素 | 2周 4个星期 |
| 含碘化物的食物:加碘盐,乳制品,蛋黄,海鲜,火鸡和肝脏 | 2周 |
| 海带,琼脂,角叉菜胶,Lugol溶液 | 3周 |
| 碘化钾饱和溶液 | 3周 |
| 局部碘化物 (例如,手术皮肤准备) | 3周 |
| 静脉造影剂 水溶性 亲脂的 | 2个月 6个月 |
| 胺碘酮 | 6个月 |
在特定人群中的使用
怀孕
风险摘要
I 3 odine MAX TM在怀孕期间是禁忌的,因为胎儿暴露会导致新生儿甲状腺功能减退症,在某些情况下是严重且不可逆的。来自公开文献的数据描述了胎儿暴露后甲状腺异常。包括甲状腺发育不全和甲状腺功能减退(参见数据)。尚未进行动物生殖研究。
临床考虑。
胎儿/新生儿不良反应
暴露于碘化钠I 131的胎儿会发展为新生儿甲状腺功能减退症。子宫内暴露于碘I 131后,新生儿甲状腺功能减退症的诊断延迟会导致严重的后遗症,例如智力下降和骨龄延迟。监测任何在子宫内暴露于碘化钠I 131后出生的婴儿的甲状腺功能。
数据
人数据
碘化钠I 131穿过胎盘,胎儿的甲状腺在妊娠的第10-12周开始开始浓缩碘化物。在孕期4-26周内,孕妇以333 – 8325 MBq(9 – 225 mCi)的剂量暴露于碘化氢I 131的文献报道中,最常见的不良结局是甲状腺功能低下的婴儿和儿童。
哺乳期
风险摘要
在哺乳期禁用I 3 odine MAX TM ,因为在哺乳期I 131会通过乳腺组织中碘化钠同向转运体的表达增加而集中在乳房中[见警告和注意事项(5.5)] 。如果在产后服用碘化钠I 131,则哺乳期的母亲不应母乳喂养。另外,为了使吸收到乳腺组织的辐射剂量最小,在服用碘化钠I 131之前,应至少停止哺乳和吸乳至少6周(见数据)。妇女可能会随着另一个孩子的出生而进行母乳喂养。
通过母乳暴露于碘I 131的婴儿有发生甲状腺功能低下的风险,因为碘I 131分布在母乳中,其浓度可能等于或大于母体血浆中的浓度(参见数据)。
数据
人数据
有限的公开文献描述了碘化钠I 131转移到母乳中和母乳喂养的婴儿甲状腺吸收的情况。给药后36-48小时在母乳中检测到的碘化钠I 131的量为注射剂量的1-27%(注射剂量在1.1 – 5143 MBq之间)。
生殖潜力的男性和女性
由于胎儿甲状腺功能低下的风险,I 3 odine MAX TM禁用于妊娠[见在特定人群中使用(8.1)] 。
验孕
在有生育能力的女性中进行妊娠试验,并在开始治疗前确认没有妊娠[参见剂量和用法(2.2),警告和注意事项(5.4) ]。
避孕
建议有生育潜力的雌性和雄性在使用碘化钠I-131的治疗期间以及最后一次服用碘化钠I-131的至少六个月后使用有效的避孕方法。
不孕症
女性
碘化钠I 131处理可能会影响生育能力。碘化钠I 131治疗后,女性出现短暂性闭经和卵巢功能不全。文献描述了用累积剂量为1000 – 59,000 MBq(27 – 1594 mCi)的碘化钠I 131治疗的女性中短暂的月经周期不规则,包括闭经和卵巢衰竭的报道。
雄性
碘化钠I 131处理可能会影响生育能力。讨论预期将接受高累积剂量碘化钠I 131的男性的精子储备。碘化钠I 131治疗后,睾丸功能的短暂剂量相关损伤已有报道。文献描述了使用碘化氢I 131剂量为370 MBq – 22,000 MBq(10 – 595 mCi)处理的男性的报告,这些基因导致睾丸功能暂时受损(包括生精)。永久性损伤的累积剂量范围从19,000-29,000 MBq(520-800 mCi)不等。
儿科用
尚未确定在儿科患者中的安全性和有效性。儿科患者因辐射暴露而终生罹患恶性肿瘤的风险增加
老人用
临床经验尚未发现老年患者与年轻患者相比安全性或有效性存在差异。然而,肾功能受损的患者中,老年患者更容易出现肾功能下降,而放射线暴露的可能性更大[见《特定人群的使用》(8.6),《临床药理学》(12.3) ]。
肾功能不全
碘化物I 131主要通过肾脏排泄。肾功能损害会降低碘化钠I 131的排泄,并增加辐射暴露量和辐射毒性风险。对于有肾功能不全病史的患者,请评估肾功能以制定治疗计划并考虑剂量。碘化物I 131是可透析的。血液透析可用于减少全身辐射暴露[见临床药理学(12.3)]。
过量
如果暴露于放射剂量的碘化钠I 131超过预期的治疗剂量,则应提供一般支持治疗,促进频繁排尿,监测骨髓和甲状腺的抑制作用。考虑在暴露后4到6个小时内立即给予甲状腺阻断剂(例如碘化钾(KI)或高氯酸盐)。评估使用甲状腺阻断剂对碘化钠I 131治疗失败的风险的益处。如果甲状腺功能减退,建议适当的替代疗法。
i3odine Max说明
I 3 odine MAX TM是放射性治疗剂,可提供碘化钠I 131的浓缩溶液,其放射性浓度范围为18.5-129.5 GBq / mL(500-3500 mCi / mL)。每毫升浓缩溶液均包含标记量的碘化钠I 131溶液,该溶液在0.05M氢氧化钠中配制,并加入0.02M硫代硫酸钠作为稳定剂。碘化钠I 131溶液的pH值大于7.5。
带有I 3 odine MAX TM的浓碘化钠I 131溶液用于制备口服强度不等的碘化钠I 131胶囊或碘化钠I 131溶液,用于口服治疗。
碘化钠I 131溶液的化学名称为Na 131 I,分子量为153.99。用于制备碘化钠I 131胶囊最终剂型的硬明胶胶囊包含约300 mg无水磷酸氢二钠USP作为吸收缓冲液。
物理特性
碘I-131通过β发射和相关的γ发射而衰减,物理半衰期为8.04天。主要辐射排放列于表4。
| 辐射 | 平均百分比 解体 | 平均能量 (keV) |
| Beta-1 | 2.1% | 69.4 |
| Beta-3 | 7.2% | 96.6 |
| Beta-4 | 89.4% | 191.6 |
| 伽玛7 | 6.1% | 284.3 |
| 伽玛14 | 81.2% | 364.5 |
| 伽玛18 | 7.1% | 637.0 |
外部辐射
碘化物I 131的比γ射线常数为4.26×10 -13 C·m 2 ·kg -1 ·MBq -1 ·s -1 (2.2 R·cm 2 / mCi·hr)。碘化物I 131的铅(Pb)的第一半值厚度为0.27厘米。表5中显示了由插入各种厚度的Pb导致的碘化物I 131发射的辐射的相对衰减的值范围。例如,使用2.59 cm的Pb将使外部辐射暴露降低一个因子大约1,000。
屏蔽层厚度 | 衰减系数 |
| 0.27 | 0.5 |
| 0.56 | 0.25 |
| 0.99 | 10 -1 |
| 2.59 | 10 -2 |
| 4.53 | 10 -3 |
为了校正碘I 131的物理衰减,标定时间后在选定的时间间隔内保留的馏分如表6所示。
| *校准时间 | |||||
| 天 | 剩余分数 | 天 | 剩余分数 | 天 | 剩余分数 |
| 0 * | 1.000 | 11 | .388 | 22 | .151 |
| 1个 | .918 | 12 | .356 | 23 | .138 |
| 2 | .842 | 13 | .327 | 24 | .127 |
| 3 | .773 | 14 | .300 | 25 | .116 |
| 4 | .709 | 15 | .275 | 26 | .107 |
| 5 | .651 | 16 | .253 | 27 | .098 |
| 6 | .597 | 17 | .232 | 28 | .090 |
| 7 | .548 | 18岁 | .213 | 29 | .083 |
| 8 | .503 | 19 | .195 | 30 | .076 |
| 9 | .461 | 20 | .179 | ||
| 10 | .423 | 21 | .164 | ||
i3odine Max-临床药理学
作用机理
碘化物钠转运蛋白(NIS)蛋白质在甲状腺滤泡细胞中积极转运碘化物。碘化物在卵泡细胞中的浓度高达血浆中的50倍。碘化物被甲状腺过氧化物酶代谢氧化为碘(I + ),后者再碘化甲状腺球蛋白的酪氨酸残基(三碘化或四碘化酪氨酸)。 I 131的β发射负责治疗效果。
药效学
尚未在临床试验中探讨碘化物I 131暴露程度与药理作用之间的关系。
药代动力学
吸收性
口服碘化钠I 131后,在最初的60分钟内全身吸收了90%的碘化物I 131放射性。
分配
吸收后,I 131分布在细胞外空间内。它由碘化钠共转运蛋白(NIS)主动转运,并与甲状腺球蛋白结合,导致甲状腺中积累。在甲状腺功能亢进症和甲状腺肿中,甲状腺对碘的摄取通常会增加,而在甲状腺功能减退症中碘会减少。碘化物I 131还会在胃,脉络丛,唾液腺,乳房,肝脏,胆囊和肾脏中积聚。
消除
代谢
在甲状腺滤泡细胞中,碘化物通过甲状腺过氧化物酶的作用被氧化成碘(I + ),碘再碘化甲状腺球蛋白的酪氨酸残基。
排泄
碘化钠I 131从尿液和粪便中排出。尿排泄的正常范围是所用剂量的37%至75%,随患者的甲状腺和肾功能而异。粪便排泄约10%。
供应/存储和处理方式
供应方式
I 3 odine MAX TM提供1、2、3和5 mL透明玻璃V型瓶,2和5 mL血清瓶。客户在校准时根据客户订单指定的强度是18.5至129.5 GBq / mL(500至3500 mCi / mL)。
| NDC代码 | 尺寸/类型容器 |
| 69208-001-15 | 1 mL V型瓶 |
| 69208-001-25 | 2 mL V型瓶 |
| 69208-001-35 | 3 mL V型瓶 |
| 69208-001-55 | 5 mL V型瓶 |
| 69208-001-60 | 2 mL血清小瓶 |
| 69208-001-70 | 5 mL血清小瓶 |
每个I 3 odine MAX TM货件至少提供一箱包含2个泡罩包装的胶囊。每个泡罩包装包括5个空的#1胶囊和5个填充的#2胶囊,其中包含约300 mg无水磷酸氢二钠作为吸收缓冲液。
存储
I 3 odine MAX TM应存储在2°C至25°C(36°F至77°F)之间。碘化钠I 131的存储和处置应符合政府授权使用此放射性核素的政府机构的适当规定。
分配完所有碘化钠I 131溶液或将其过期后,丢弃未使用的胶囊。每一批新的I 3 odine MAX TM都会提供新的硬明胶胶囊泡罩包装。
经核监管委员会或协议国相关监管机构许可,该放射性药物已获许可使用。
病人咨询信息
辐射安全注意事项[请参阅警告和注意事项(5.7)] 。
回顾描述患者咨询过程重要组成部分的最新专业协会指南和出版物,并讨论将对患者的无意辐射暴露降至最低的措施。
胎儿毒性[见禁忌症(4),警告和注意事项(5.4)和在特定人群中的使用(8.1,8.3)]。
- 告知女性患者胎儿风险。
- 劝告有生殖潜力的雌性和雄性在使用碘化钠I 131治疗期间以及最后一剂后至少6个月内使用有效的避孕方法。
- 建议女性患者在已知或怀疑怀孕的情况下联系其医疗保健提供者。
哺乳期
•指示妇女在服用碘化钠I 131前至少6周停止哺乳和抽乳[见禁忌症(4),警告和注意事项(5.5)和在特定人群中使用(8.2)]。
对生育的影响
•指教雌性和用于与HICON®治疗生育力受损的潜在的繁殖潜力的男性[见警告和注意事项(5.6),并使用在特殊人群(8.3)]。
由制造:
国际同位素公司,爱达荷州爱达荷州83401
主要显示面板
碘化物I-131溶液即时容器标签




| i3odine MaxTM 碘化钠i-131胶囊和溶液溶液的制备试剂盒 | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| 贴标机-国际同位素公司(933155509) |
| 注册人-国际同位素公司(933155509) |
| 成立时间 | |||
| 名称 | 地址 | ID / FEI | 运作方式 |
| 国际同位素公司 | 933155509 | 制造(69208-001),分析(69208-001) | |
注意:本文档包含有关碘化钠i-131的副作用信息。此页面上列出的某些剂型可能不适用于商标名称i3odine Max。
适用于碘化钠-i-131:复方散剂,口服胶囊,口服液
心血管的
心血管副作用包括胸痛和心动过速。 [参考]
皮肤科
皮肤病副作用包括皮肤瘙痒,皮疹和荨麻疹。 [参考]
内分泌
内分泌副作用包括急性甲状腺危象。 [参考]
胃肠道
胃肠道副作用包括恶心和呕吐。 [参考]
血液学
血液学副作用包括血液异常,白细胞减少症,血小板减少症,造血系统抑制和贫血。 [参考]
本地
局部副作用包括颈部压痛和肿胀,吞咽疼痛,喉咙痛和咳嗽(通常在治疗后第三天左右)。 [参考]
肿瘤的
肿瘤副作用包括急性白血病。 [参考]
其他
其他副作用包括头发暂时变薄(可能在治疗后2至3个月发生),染色体异常,放射病和死亡。 [参考]
参考文献
1.“产品信息。碘化钠-1-131(碘化钠-I-131)。”密苏里州圣路易斯的Mallinckrodt Medical Inc.
2. Saha GB。 “核药学基础知识。第四版。”纽约,纽约:Springer-Verlag(1998):
某些副作用可能没有报道。您可以将其报告给FDA。
推荐剂量和用法
个性化治疗
口服碘化钠I 131胶囊或溶液的建议剂量取决于甲状腺的摄取量以及腺体的大小。甲状腺吸收和大小应在治疗之前由医生确定,并且可能对计算要给予个体患者的治疗剂量有用。
甲亢的治疗
建议口服剂量为148至370 MBq(4至10 mCi)。有毒的结节性甲状腺肿可能需要更大剂量。
甲状腺癌的治疗
建议口服剂量为1100至3700 MBq(30至100 mCi)。对于随后的转移灶消融,推荐的口服剂量为3700至7400 MBq(100至200 mCi)。
稀释和制备说明
碘化钠I 131稀溶液的制备
- 使用产品瓶标签上的校准日期和放射性核素浓度,计算所需的体积,以MBq或mCi表示所需的剂量。
- 使用屏蔽注射器除去所需的体积。
- 使用屏蔽注射器将所需体积转移至适当屏蔽的接收瓶中。
- 将稀释液添加到接收瓶中,以产生所需体积的最终剂量。
- 推荐的稀释剂是纯水,其中含有0.2%的硫代硫酸钠作为还原剂。不应使用酸性稀释剂,因为它们可能导致pH值降至7.5以下并刺激碘I-131氢碘酸挥发。
- 将剂量放在一个有遮盖的容器中,用吸管给病人服用
碘化钠I 131胶囊的制备
- I 3 odine MAX TM每次准备的胶囊剂量包括一个大明胶胶囊和一个小明胶胶囊。每个大胶囊是空的,每个小胶囊包含约300 mg无水磷酸氢二钠作为吸收缓冲液。
- 使用产品瓶标签上的校准日期和放射性核素浓度,计算所需的体积,以MBq或mCi表示所需的剂量。
- 如下所示,通过将胶囊分成两部分来打开I 3 odine MAX TM随附的一个大胶囊:
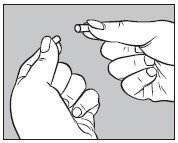
- 如下图所示,将I 3 odine MAX TM随附的未打开的小胶囊插入空的大胶囊的下半部分:
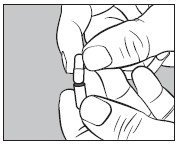
- 使用适当的注射器,从小瓶中取出所需体积的碘化氢I 131溶液(最大150微升),如下所示:
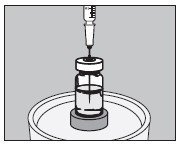
- 如下图所示,从顶部注入小胶囊的中心:
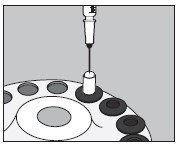
- 将大胶囊的上半部滑到下半部,以完全覆盖小胶囊,然后轻轻向下推直至锁定,如下图所示:
- 给药前立即在合适的放射性校准系统中测量患者剂量。
- 可以将准备好的胶囊存放在合适的聚丙烯容器中,并在7天内放入铅锅中直至使用。
辐射剂量法
- 与甲状腺摄取碘化物I 131相关的生物动力学模型和辐射剂量分布取决于饮食中摄取的稳定碘化物和假定甲状腺激素的正常产生。表1显示了成年人的平均摄取百分比范围(73.7千克参考模型)。表1不能用于治疗计划。
- 对于在激素产生中被碘化物吸收所阻断的甲状腺,碘化物I 131的有效半衰期约为1.4小时;对于“低”至“高”摄取,I 131的有效半衰期约为80至90小时。
| ||||
| 成人口服活性碘盐I 131的吸收剂量(mGy / MBq)(73.7 kg参考模型) | ||||
| 器官 | 甲状腺对I 131的摄取(施用的活性%A 0 ) 口服后24小时 | |||
甲状腺受阻 | 低摄取† | 中等吸收† | 高摄取† | |
| 肾上腺 | 0.044 | 0.051 | 0.055 | 0.059 |
| 骨表面 | 0.030 | 0.089 | 0.12 | 0.16 |
| 脑 | 0.021 | 0.093 | 0.13 | 0.17 |
| 乳房 | 0.020 | 0.038 | 0.048 | 0.058 |
| 胆囊壁 | 0.037 | 0.043 | 0.046 | 0.049 |
| 胃肠道 | ||||
| 食管 | 0.024 | 0.10 | 0.14 | 0.19 |
| 胃壁 | 0.87 | 0.77 | 0.71 | 0.66 |
| 小肠壁 | 0.035 | 0.033 | 0.032 | 0.032 |
| 结肠壁 | 0.14 | 0.14 | 0.14 | 0.14 |
| (大肠壁上方) | 0.12 | 0.12 | 0.12 | 0.12 |
| (下大肠壁降低) | 0.17 | 0.17 | 0.17 | 0.16 |
| 心墙 | 0.062 | 0.089 | 0.10 | 0.12 |
| 肾脏 | 0.27 | 0.27 | 0.27 | 0.27 |
| 肝 | 0.050 | 0.093 | 0.12 | 0.14 |
| 肺 | 0.053 | 0.10 | 0.13 | 0.15 |
| 肌肉 | 0.026 | 0.084 | 0.12 | 0.15 |
| 卵巢 | 0.038 | 0.037 | 0.036 | 0.035 |
| 胰腺 | 0.060 | 0.064 | 0.066 | 0.068 |
| 红骨髓 | 0.031 | 0.072 | 0.095 | 0.12 |
| 唾液腺 | 0.27 | 0.22 | 0.19 | 0.16 |
| 皮肤 | 0.019 | 0.043 | 0.057 | 0.071 |
| 脾 | 0.064 | 0.069 | 0.072 | 0.075 |
| 睾丸 | 0.025 | 0.024 | 0.023 | 0.22 |
| 胸腺 | 0.024 | 0.10 | 0.14 | 0.19 |
| 甲状腺 | 2.2 | 280‡ | 430‡ | 580‡ |
| 膀胱壁 | 0.54 | 0.45 | 0.39 | 0.34 |
| 子宫 | 0.045 | 0.042 | 0.040 | 0.038 |
| 其余器官 | 0.029 | 0.084 | 0.11 | 0.15 |
| 每次活动的有效剂量(mSv / MBq) | 0.28 | 14‡ | 22‡ | 29‡ |
1适应症和用途
I 3 odine MAX TM用于治疗甲状腺功能亢进症和部分甲状腺癌。
i3odine Max剂量和用法
辐射安全
- I 3 odine MAX TM是放射性药物。采取适当的安全措施以尽量减少对患者和医护人员的辐射暴露[请参阅警告和注意事项(5.7) ] :
- 仅由在安全使用和处理放射性物质方面经过特殊培训和经验合格,并且其经验和培训已经得到授权许可使用放射性药物的适当政府机构批准的医生或在其指导下使用。
- 在操作和管理产品时,请使用防水手套。
- 在产品的使用寿命内保持足够的屏蔽。
- 给药前立即用合适的放射性校准系统测量患者剂量。
重要管理说明
- 请勿将I 3 odine MAX TM随附的浓碘化钠I 131溶液直接施用于患者。浓碘化碘131溶液必须在给药前稀释并制备[见剂量和给药方法(2.4) ] 。
- 用药前要对有生殖能力的女性进行妊娠试验,以验证是否没有妊娠[见禁忌症(4)和在特定人群中的使用( 8.1,8.3 )] 。
- 指导患者在给药前至少2小时和给药后2小时禁食,以确保吸收。
- 指导患者在施用碘化钠I 131之前和之后进行水合,并经常排空以增强尿液对未被甲状腺吸收的放射性碘的清除[请参阅警告和注意事项(5.2) ] 。
- 指导患者在服用放射性碘前两周保持低碘饮食,并在摄取或成像过程中持续几天[见警告和注意事项(5.8)和药物相互作用(7) ] 。
- 指导患者在服用碘化氢I 131前三天停止抗甲状腺治疗[见警告和注意事项(5.8)和药物相互作用(7) ] 。
- 对于有肾功能不全病史的患者,请评估肾功能以制定治疗计划并考虑剂量测定法[请参见在特定人群中使用(8.6) ] 。
- 在治疗后的一个月内获得全血细胞计数。如果患者出现白细胞减少症或血小板减少症,则应使用剂量测定法确定安全的碘化钠I 131活性,同时向骨髓输送少于2 Gy的葡萄糖[见警告和注意事项(5.2) ] 。
推荐剂量和用法
个性化治疗
口服碘化钠I 131胶囊或溶液的建议剂量取决于甲状腺的摄取量以及腺体的大小。甲状腺吸收和大小应在治疗之前由医生确定,并且可能对计算要给予个体患者的治疗剂量有用。
甲亢的治疗
建议口服剂量为148至370 MBq(4至10 mCi)。有毒的结节性甲状腺肿可能需要更大剂量。
甲状腺癌的治疗
建议口服剂量为1100至3700 MBq(30至100 mCi)。对于随后的转移灶消融,推荐的口服剂量为3700至7400 MBq(100至200 mCi)。
稀释和制备说明
碘化钠I 131稀溶液的制备
- 使用产品瓶标签上的校准日期和放射性核素浓度,计算所需的体积,以MBq或mCi表示所需的剂量。
- 使用屏蔽注射器除去所需的体积。
- 使用屏蔽注射器将所需体积转移至适当屏蔽的接收瓶中。
- 将稀释液添加到接收瓶中,以产生所需体积的最终剂量。
- 推荐的稀释剂是纯水,其中含有0.2%的硫代硫酸钠作为还原剂。不应使用酸性稀释剂,因为它们可能导致pH值降至7.5以下并刺激碘I-131氢碘酸挥发。
- 将剂量放在一个有遮盖的容器中,用吸管给病人服用
碘化钠I 131胶囊的制备
- I 3 odine MAX TM每次准备的胶囊剂量包括一个大明胶胶囊和一个小明胶胶囊。每个大胶囊是空的,每个小胶囊包含约300 mg无水磷酸氢二钠作为吸收缓冲液。
- 使用产品瓶标签上的校准日期和放射性核素浓度,计算所需的体积,以MBq或mCi表示所需的剂量。
- 如下所示,通过将胶囊分成两部分来打开I 3 odine MAX TM随附的一个大胶囊:

- 如下图所示,将I 3 odine MAX TM随附的未打开的小胶囊插入空的大胶囊的下半部分:

- 使用适当的注射器,从小瓶中取出所需体积的碘化氢I 131溶液(最大150微升),如下所示:

- 如下图所示,从顶部注入小胶囊的中心:

- 将大胶囊的上半部滑到下半部,以完全覆盖小胶囊,然后轻轻向下推直至锁定,如下图所示:

- 给药前立即在合适的放射性校准系统中测量患者剂量。
- 可以将准备好的胶囊存放在合适的聚丙烯容器中,并在7天内放入铅锅中直至使用。
辐射剂量法
- 与甲状腺摄取碘化物I 131相关的生物动力学模型和辐射剂量分布取决于饮食中摄取的稳定碘化物和假定甲状腺激素的正常产生。表1显示了成年人的平均摄取百分比范围(73.7千克参考模型)。表1不能用于治疗计划。
- 对于在激素产生中被碘化物吸收所阻断的甲状腺,碘化物I 131的有效半衰期约为1.4小时;对于“低”至“高”摄取,I 131的有效半衰期约为80至90小时。
| ||||
| 成人口服活性碘盐I 131的吸收剂量(mGy / MBq)(73.7 kg参考模型) | ||||
| 器官 | 甲状腺对I 131的摄取(施用的活性%A 0 ) 口服后24小时 | |||
甲状腺受阻 | 摄入量低† | 中等摄入量† | 摄取量高† | |
| 肾上腺 | 0.044 | 0.051 | 0.055 | 0.059 |
| 骨表面 | 0.030 | 0.089 | 0.12 | 0.16 |
| 脑 | 0.021 | 0.093 | 0.13 | 0.17 |
| 乳房 | 0.020 | 0.038 | 0.048 | 0.058 |
| 胆囊壁 | 0.037 | 0.043 | 0.046 | 0.049 |
| 胃肠道 | ||||
| 食管 | 0.024 | 0.10 | 0.14 | 0.19 |
| 胃壁 | 0.87 | 0.77 | 0.71 | 0.66 |
| 小肠壁 | 0.035 | 0.033 | 0.032 | 0.032 |
| 结肠壁 | 0.14 | 0.14 | 0.14 | 0.14 |
| (大肠壁上方) | 0.12 | 0.12 | 0.12 | 0.12 |
| (下大肠壁降低) | 0.17 | 0.17 | 0.17 | 0.16 |
| 心墙 | 0.062 | 0.089 | 0.10 | 0.12 |
| 肾脏 | 0.27 | 0.27 | 0.27 | 0.27 |
| 肝 | 0.050 | 0.093 | 0.12 | 0.14 |
| 肺 | 0.053 | 0.10 | 0.13 | 0.15 |
| 肌肉 | 0.026 | 0.084 | 0.12 | 0.15 |
| 卵巢 | 0.038 | 0.037 | 0.036 | 0.035 |
| 胰腺 | 0.060 | 0.064 | 0.066 | 0.068 |
| 红骨髓 | 0.031 | 0.072 | 0.095 | 0.12 |
| 唾液腺 | 0.27 | 0.22 | 0.19 | 0.16 |
| 皮肤 | 0.019 | 0.043 | 0.057 | 0.071 |
| 脾 | 0.064 | 0.069 | 0.072 | 0.075 |
| 睾丸 | 0.025 | 0.024 | 0.023 | 0.22 |
| 胸腺 | 0.024 | 0.10 | 0.14 | 0.19 |
| 甲状腺 | 2.2 | 280 ‡ | 430 ‡ | 580 ‡ |
| 膀胱壁 | 0.54 | 0.45 | 0.39 | 0.34 |
| 子宫 | 0.045 | 0.042 | 0.040 | 0.038 |
| 其余器官 | 0.029 | 0.084 | 0.11 | 0.15 |
| 每次活动的有效剂量(mSv / MBq) | 0.28 | 14 ‡ | 22 ‡ | 29 ‡ |
剂型和优势
I 3 odine MAX TM可按客户订购的体积提供,强度范围为校准时间的18.5-129.5 GBq / mL(500-3500 mCi / mL)。每个I 3 odine MAX TM试剂盒均包含一个容器的碘化钠I-131溶液和两个或多个装有明胶胶囊的泡罩包装。每个泡罩包装包含5#1空明胶胶囊和5#2明胶胶囊,其中填充了约300 mg磷酸氢二钠无水。提供大的空明胶胶囊和小明胶胶囊,其中包含约300 mg无水磷酸氢二钠作为吸收缓冲液,以及碘化钠I-131溶液,用于制备治疗性的碘化钠I 131胶囊。
禁忌症
I 3 odine MAX TM禁忌症:
- 呕吐和腹泻的患者[见警告和注意事项(5.7) ] 。
- 怀孕[请参阅警告和注意事项(5.4) ,请参见在特定人群中使用(8.1) ] 。
- 泌乳[见警告和注意事项(5.5) ] 。
- 同时接受抗甲状腺治疗的患者[参见警告和注意事项(5.1)和药物相互作用(7) ] 。
警告和注意事项
放射诱发的甲状腺炎
碘化钠I 131可能导致甲状腺炎并释放甲状腺激素,这可能加重甲状腺功能亢进症和甲毒性心脏病[见不良反应(6) ] 。在治疗甲状腺功能亢进症时,请考虑使用抗甲状腺药物进行预处理以帮助消耗甲状腺激素。服用碘化氢I 131前三天停止抗甲状腺治疗[见药物相互作用(7) ] 。考虑在治疗前或治疗后使用β受体阻滞剂,以最大程度地降低甲状腺功能亢进和甲状腺风暴的风险。
甲状腺炎可能引起腺体肿大,导致颈部压痛和肿胀,吞咽疼痛,喉咙痛和咳嗽;碘化钠I 131服用后大约第三天会发生。考虑使用止痛药或消炎药进行治疗。
辐射诱发的毒性
碘化物I 131可能引起辐射诱导的毒性[请参阅不良反应(6) ] :
- 剂量依赖性死亡(骨髓抑制,恶性肿瘤)。
- 剂量依赖性的造血抑制表现为碘化钠I 131给药后3-5周出现的短暂性血小板减少症或中性粒细胞减少症,可能导致感染或出血的敏感性增加。
- 唾液腺毒性:涎腺炎,口干症。
- 泪腺毒性:结膜炎,干眼症和泪溢。
在治疗后的一个月内获得全血细胞计数。如果患者显示出白细胞减少症或血小板减少症,则应使用剂量测定法确定安全的碘化钠I 131活性,同时向骨髓输送少于2 Gy的碘。
建议服用碘化氢I 131后保持一周水合,并通过唾液分泌刺激唾液流动(例如无糖糖果或口香糖,毛果芸香碱和抗坏血酸),以减少唾液腺的辐射暴露。
建议患者在服用放射性碘后经常排空以增强排泄。
过敏反应
接受碘化钠I 131的患者可能会发生包括过敏反应在内的超敏反应。尽管碘不被认为是过敏原,但与胶囊的赋形剂或化学成分(如硫代硫酸钠)有关的超敏反应也可能发生。获取并记录过敏史,尤其是亚硫酸盐过敏。紧急复苏设备和人员应立即可用[见不良反应(6) ] 。
胎儿毒性
I 3 odine MAX TM在怀孕期间是禁忌的,因为碘化钠I 131穿过胎盘,胎儿暴露可导致新生儿甲状腺功能减退。公开文献中的多个报道描述了在子宫内暴露于碘化钠I 131后新生儿的甲状腺功能减退。一些新生儿甲状腺功能减退的病例很严重且不可逆。验证有生育能力的女性的怀孕状况开始HICON®治疗之前。建议女性和有生育能力男性的用HICON®治疗期间使用有效的避孕方法和最后一次给药后至少六个月[见特殊人群中使用(8.1 , 8.3) ]。
哺乳期增加对乳房组织的辐射暴露
HICON®在哺乳期妇女是禁忌的,因为碘化钠通过乳房组织与泌乳在碘化钠同向转运体的表达增加的I 131倍的浓缩物在乳房。文献描述了停止母乳喂养后5-32周,乳腺组织中放射性碘的摄入量达到中度至明显。建议哺乳期妇女在服用碘化钠I 131之前至少6周停止母乳喂养,以便有足够的时间发生内卷,并避免乳房组织中碘化钠I 131的浓度过高。考虑服用抑制泌乳的药物。在给予碘化钠I 131之前应考虑进行诊断闪烁显像,以评估乳房组织对摄取的持久性。如果在产后服用碘化钠I 131,则哺乳期的母亲不应母乳喂养婴儿[见特殊人群的使用(8.2) ] 。
短暂性不育
有报道称,碘化钠I 131治疗后,男性的睾丸功能出现暂时性剂量相关性损害,女性短暂性卵巢功能不全。考虑预期将接受累积碘化钠I 131剂量大于19,000 MBq(520 mCi)的男性的精子储备[请参见在特定人群中使用(8.3) ] 。
辐射风险
家庭联络
指导患者按照接受HICON®,以尽量减少其他人或环境的辐射污染后辐射的安全防范措施。患者应避免与他人特别是孕妇和儿童密切接触,并注意避免体液污染他人或环境。
患者和医疗保健提供者
HICON®有助于患者的整体长期累积的辐射暴露,这是与癌症风险增加有关。遵循安全处理和管理,以最大程度地减少对患者和医疗保健提供者的辐射暴露。
治疗效果降低的风险
某些食物或药物可能会改变碘化钠I 131在甲状腺的吸收,并降低其有效性。最近摄入任何形式的稳定碘化物,或使用甲状腺或抗甲状腺药物可能会减少甲状腺对碘化钠I 131的摄取[见药物相互作用(7) ] 。
不良反应
以下和标签中其他地方描述了以下严重不良反应:
- 辐射诱发的甲状腺炎[请参阅警告和注意事项(5.1) ] 。
- 辐射引起的毒性[请参阅警告和注意事项(5.2) ]。
- 过敏反应[请参阅警告和注意事项(5.3) ]。
- 胎儿毒性[见警告和注意事项(5.4) ,在特定人群中使用(8.1) ]。
- 哺乳期增加对乳房组织的辐射暴露[见警告和注意事项(5.5) ,在特定人群中使用(8.2) ]。
- 短暂性不育[请参阅警告和注意事项(5.6) ,在特定人群中使用(8.3) ]。
- 辐射暴露[请参阅警告和注意事项(5.7) ]。
在碘化钠I 131的批准后使用期间,已经确认了以下不良反应。由于这些反应是由不确定大小的人群自愿报告的,因此,始终无法可靠地估计其发生频率或建立与药物暴露的因果关系。
- 胃肠道疾病:涎腺炎,唾液腺功能障碍,恶心,呕吐,胃炎。
- 心脏疾病:胸痛,心动过速。
- 皮肤和皮下组织疾病:瘙痒,皮疹,荨麻疹。
- 内分泌失调:甲状腺功能低下,甲状腺功能亢进,甲状腺毒性危机,甲状旁腺功能低下
- 一般疾病和给药部位状况:甲状腺局部肿胀或碘化物致癌部位。
- 血液和淋巴疾病包括死亡:骨髓抑制,贫血,白细胞减少症,血小板减少症和血液异常。
- 良性,恶性和未指明的肿瘤(包括囊肿和息肉):急性白血病,实体癌。
- 眼部疾病:泪腺功能障碍。
- 先天性,家族性和遗传性疾病:先天性甲状腺功能减退症,染色体异常。
- 免疫系统疾病:支气管痉挛。
- 神经系统疾病:头痛,*脑水肿。
- 呼吸,胸和纵隔疾病:**放射性肺炎,**肺纤维化。
*碘化物-avid脑转移患者
**有碘化物-avid肺转移的患者
药物相互作用
- 骨髓抑制剂的同时使用可能会由于使用大剂量碘化钠I 131引起的造血系统抑制作用增强[见警告和注意事项(5.2 )] 。
- 许多药物和含碘化物的食物会干扰甲状腺中放射性碘化物的积累。在使用碘化钠I 131之前,回顾患者的病史,当前的药物治疗和最近的诊断测试[参见警告和注意事项(5.8) ] 。
- 建议患者在服用放射性碘前两周保持低碘饮食,并在摄取或成像过程中持续几天,并在接受表2所示程序之前停止服用以下产品。
| 药物种类 | 建议提款时间 |
| 亚硫酰胺药物 (例如,丙基硫氧嘧啶,甲巯咪唑,卡巴咪唑) | 3天 |
| 含碘的多种维生素 | 10天 |
| 天然或合成甲状腺激素 三碘甲状腺素 甲状腺素 | 2周 4个星期 |
| 含碘化物的食物:加碘盐,乳制品,蛋黄,海鲜,火鸡和肝脏 | 2周 |
| 海带,琼脂,角叉菜胶,Lugol溶液 | 3周 |
| 碘化钾饱和溶液 | 3周 |
| 局部碘化物 (例如,手术皮肤准备) | 3周 |
| 静脉造影剂 水溶性 亲脂的 | 2个月 6个月 |
| 胺碘酮 | 6个月 |
在特定人群中的使用
怀孕
风险摘要
I 3 odine MAX TM在怀孕期间是禁忌的,因为胎儿暴露会导致新生儿甲状腺功能减退症,在某些情况下是严重且不可逆的。来自公开文献的数据描述了胎儿暴露后甲状腺异常。包括甲状腺发育不全和甲状腺功能减退(参见数据)。尚未进行动物生殖研究。
临床考虑。
胎儿/新生儿不良反应
暴露于碘化钠I 131的胎儿会发展为新生儿甲状腺功能减退症。子宫内暴露于碘I 131后,新生儿甲状腺功能减退症的诊断延迟会导致严重的后遗症,例如智力下降和骨龄延迟。监测任何在子宫内暴露于碘化钠I 131后出生的婴儿的甲状腺功能。
数据
人数据
碘化钠I 131穿过胎盘,胎儿的甲状腺在妊娠的第10-12周开始开始浓缩碘化物。在孕期4-26周内,孕妇以333 – 8325 MBq(9 – 225 mCi)的剂量暴露于碘化氢I 131的文献报道中,最常见的不良结局是甲状腺功能低下的婴儿和儿童。
哺乳期
风险摘要
在哺乳期禁用I 3 odine MAX TM ,因为在哺乳期I 131会通过乳腺组织中碘化钠同向转运体的表达增加而集中在乳房中[请参阅警告和注意事项(5.5) ] 。如果在产后服用碘化钠I 131,则哺乳期的母亲不应母乳喂养。另外,为了使吸收到乳腺组织的辐射剂量最小,在服用碘化钠I 131之前,应至少停止哺乳和吸乳至少6周(见数据)。妇女可能会随着另一个孩子的出生而进行母乳喂养。
通过母乳暴露于碘I 131的婴儿有发生甲状腺功能低下的风险,因为碘I 131分布在母乳中,其浓度可能等于或大于母体血浆中的浓度(参见数据)。
数据
人数据
有限的公开文献描述了碘化钠I 131转移到母乳中和母乳喂养的婴儿甲状腺吸收的情况。给药后36-48小时在母乳中检测到的碘化钠I 131的量为注射剂量的1-27%(注射剂量在1.1 – 5143 MBq之间)。
生殖潜力的男性和女性
由于胎儿甲状腺功能低下的风险,I 3 odine MAX TM禁用于妊娠[见在特定人群中使用(8.1) ] 。
验孕
在有生育能力的女性中进行妊娠试验,并在开始治疗前验证是否没有妊娠[见剂量和用法(2.2) ,警告和注意事项(5.4) ]。
避孕
建议有生育潜力的雌性和雄性在使用碘化钠I-131的治疗期间以及最后一次服用碘化钠I-131的至少六个月后使用有效的避孕方法。
不孕症
女性
碘化钠I 131处理可能会影响生育能力。碘化钠I 131治疗后,女性出现短暂性闭经和卵巢功能不全。文献描述了用累积剂量为1000 – 59,000 MBq(27 – 1594 mCi)的碘化钠I 131治疗的女性中短暂的月经周期不规则,包括闭经和卵巢衰竭的报道。
雄性
碘化钠I 131处理可能会影响生育能力。讨论预期将接受高累积剂量碘化钠I 131的男性的精子储备。碘化钠I 131治疗后,睾丸功能的短暂剂量相关损伤已有报道。文献描述了使用碘化氢I 131剂量为370 MBq – 22,000 MBq(10 – 595 mCi)处理的男性的报告,这些基因导致睾丸功能暂时受损(包括生精)。永久性损伤的累积剂量范围从19,000-29,000 MBq(520-800 mCi)不等。
儿科用
尚未确定在儿科患者中的安全性和有效性。儿科患者因辐射暴露而终生罹患恶性肿瘤的风险增加
老人用
临床经验尚未发现老年患者与年轻患者相比安全性或有效性存在差异。然而,肾功能受损的患者中,老年患者更容易出现肾功能下降,而放射线暴露的可能性更大[参见《特殊人群的使用》(8.6) ,《临床药理学》(12.3) ]。
肾功能不全
碘化物I 131主要通过肾脏排泄。肾功能损害会降低碘化钠I 131的排泄,并增加辐射暴露量和辐射毒性风险。对于有肾功能不全病史的患者,请评估肾功能以制定治疗计划并考虑剂量。碘化物I 131是可透析的。血液透析可用于减少全身辐射暴露[见临床药理学(12.3) ]。
过量
如果暴露于放射剂量的碘化钠I 131超过预期的治疗剂量,则应提供一般支持治疗,促进频繁排尿,监测骨髓和甲状腺的抑制作用。考虑在暴露后4到6个小时内立即给予甲状腺阻断剂(例如碘化钾(KI)或高氯酸盐)。评估使用甲状腺阻断剂对碘化钠I 131治疗失败的风险的益处。如果甲状腺功能减退,建议适当的替代疗法。
i3odine Max说明
I 3 odine MAX TM是放射性治疗剂,可提供碘化钠I 131的浓缩溶液,其放射性浓度范围为18.5-129.5 GBq / mL(500-3500 mCi / mL)。每毫升浓缩溶液均包含标记量的碘化钠I 131溶液,该溶液在0.05M氢氧化钠中配制,并加入0.02M硫代硫酸钠作为稳定剂。碘化钠I 131溶液的pH值大于7.5。
带有I 3 odine MAX TM的浓碘化钠I 131溶液用于制备口服强度不等的碘化钠I 131胶囊或碘化钠I 131溶液,用于口服治疗。
碘化钠I 131溶液的化学名称为Na 131 I,分子量为153.99。用于制备碘化钠I 131胶囊最终剂型的硬明胶胶囊包含约300 mg无水磷酸氢二钠USP作为吸收缓冲液。
物理特性
碘I-131通过β发射和相关的γ发射而衰减,物理半衰期为8.04天。主要辐射排放列于表4。
| 辐射 | 平均百分比 解体 | 平均能量 (keV) |
| Beta-1 | 2.1% | 69.4 |
| Beta-3 | 7.2% | 96.6 |
| Beta-4 | 89.4% | 191.6 |
| 伽玛7 | 6.1% | 284.3 |
| 伽玛14 | 81.2% | 364.5 |
| 伽玛18 | 7.1% | 637.0 |
外部辐射
碘化物I 131的比γ射线常数为4.26×10 -13 C·m 2 ·kg -1 ·MBq -1 ·s -1 (2.2 R·cm 2 / mCi·hr)。碘化物I 131的铅(Pb)的第一半值厚度为0.27厘米。表5中显示了由插入各种厚度的Pb导致的碘化物I 131发射的辐射的相对衰减的值范围。例如,使用2.59 cm的Pb将使外部辐射暴露降低一个因子大约1,000。
屏蔽层厚度 | 衰减系数 |
| 0.27 | 0.5 |
| 0.56 | 0.25 |
| 0.99 | 10 -1 |
| 2.59 | 10 -2 |
| 4.53 | 10 -3 |
为了校正碘I 131的物理衰减,标定时间后在选定的时间间隔内保留的馏分如表6所示。
| *校准时间 | |||||
| 天 | 剩余分数 | 天 | 剩余分数 | 天 | 剩余分数 |
| 0 * | 1.000 | 11 | .388 | 22 | .151 |
| 1个 | .918 | 12 | .356 | 23 | .138 |
| 2 | .842 | 13 | .327 | 24 | .127 |
| 3 | .773 | 14 | .300 | 25 | .116 |
| 4 | .709 | 15 | .275 | 26 | .107 |
| 5 | .651 | 16 | .253 | 27 | .098 |
| 6 | .597 | 17 | .232 | 28 | .090 |
| 7 | .548 | 18岁 | .213 | 29 | .083 |
| 8 | .503 | 19 | .195 | 30 | .076 |
| 9 | .461 | 20 | .179 | ||
| 10 | .423 | 21 | .164 | ||
i3odine Max-临床药理学
作用机理
碘化物钠转运蛋白(NIS)蛋白质在甲状腺滤泡细胞中积极转运碘化物。碘化物在卵泡细胞中的浓度高达血浆中的50倍。碘化物被甲状腺过氧化物酶代谢氧化为碘(I + ),后者再碘化甲状腺球蛋白的酪氨酸残基(三碘化或四碘化酪氨酸)。 I 131的β发射负责治疗效果。
药效学
尚未在临床试验中探讨碘化物I 131暴露程度与药理作用之间的关系。
药代动力学
吸收性
口服碘化钠I 131后,在最初的60分钟内全身吸收了90%的碘化物I 131放射性。
分配
吸收后,I 131分布在细胞外空间内。它由碘化钠共转运蛋白(NIS)主动转运,并与甲状腺球蛋白结合,导致甲状腺中积累。在甲状腺功能亢进症和甲状腺肿中,甲状腺对碘的摄取通常会增加,而在甲状腺功能减退症中碘会减少。碘化物I 131还会在胃,脉络丛,唾液腺,乳房,肝脏,胆囊和肾脏中积聚。
消除
代谢
在甲状腺滤泡细胞中,碘化物通过甲状腺过氧化物酶的作用被氧化成碘(I + ),碘再碘化甲状腺球蛋白的酪氨酸残基。
排泄
碘化钠I 131从尿液和粪便中排出。尿排泄的正常范围是所用剂量的37%至75%,随患者的甲状腺和肾功能而异。粪便排泄约10%。
供应/存储和处理方式
供应方式
I 3 odine MAX TM提供1、2、3和5 mL透明玻璃V型瓶,2和5 mL血清瓶。客户在校准时根据客户订单指定的强度是18.5至129.5 GBq / mL(500至3500 mCi / mL)。
| NDC代码 | 尺寸/类型容器 |
| 69208-001-15 | 1 mL V型瓶 |
| 69208-001-25 | 2 mL V型瓶 |
| 69208-001-35 | 3 mL V型瓶 |
| 69208-001-55 | 5 mL V型瓶 |
| 69208-001-60 | 2 mL血清小瓶 |
| 69208-001-70 | 5 mL血清小瓶 |
每个I 3 odine MAX TM货件至少提供一箱包含2个泡罩包装的胶囊。每个泡罩包装包括5个空的#1胶囊和5个填充的#2胶囊,其中包含约300 mg无水磷酸氢二钠作为吸收缓冲液。
存储
I 3 odine MAX TM应存储在2°C至25°C(36°F至77°F)之间。碘化钠I 131的存储和处置应符合政府授权使用此放射性核素的政府机构的适当规定。
分配完所有碘化钠I 131溶液或将其过期后,丢弃未使用的胶囊。每一批新的I 3 odine MAX TM都会提供新的硬明胶胶囊泡罩包装。
经核监管委员会或协议国相关监管机构许可,该放射性药物已获许可使用。
病人咨询信息
辐射安全注意事项[请参阅警告和注意事项(5.7) ] 。
回顾描述患者咨询过程重要组成部分的最新专业协会指南和出版物,并讨论将对患者的无意辐射暴露降至最低的措施。
胎儿毒性[参见禁忌症(4) ,警告和注意事项(5.4)和在特定人群中的使用( 8.1、8.3) ]。
- 告知女性患者胎儿风险。
- 劝告有生殖潜力的雌性和雄性在使用碘化钠I 131治疗期间以及最后一剂后至少6个月内使用有效的避孕方法。
- 建议女性患者在已知或怀疑怀孕的情况下联系其医疗保健提供者。
哺乳期
•指示妇女在服用碘化钠I 131前至少6周停止哺乳和抽乳[见禁忌症(4) ,警告和注意事项(5.5)和在特定人群中的使用(8.2) ]。
对生育的影响
•指教雌性和用于与HICON®治疗生育力受损的潜在的繁殖潜力的男性[见警告和注意事项(5.6)和使用在特定人群(8.3) ]。
由制造:
国际同位素公司,爱达荷州爱达荷州83401
主要显示面板
碘化物I-131溶液即时容器标签




| i3odine MaxTM 碘化钠i-131胶囊和溶液溶液的制备试剂盒 | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| 贴标机-国际同位素公司(933155509) |
| 注册人-国际同位素公司(933155509) |
已知总共有163种药物与i3odine Max(碘化钠-i-131)相互作用。
检查互动最常检查的互动查看i3odine Max(碘化钠-i-131)与以下药物的相互作用报告。
I3odine Max(碘化钠-i-131)酒精/食物的相互作用i3odine Max(碘化钠-i-131)与酒精/食物有2种相互作用 I3odine Max(碘化钠-i-131)疾病相互作用与i3odine Max(碘化钠-i-131)有2种疾病相互作用,包括:
药物相互作用分类
药物状态
美国日本医生 Heather Benjamin MD经验:11-20年  Heather Benjamin MD经验:11-20年  Suzanne Reitz MD经验:11-20年  Heather Miske DO经验:11-20年  Heather Miske DO经验:11-20年  渡邊剛经验:21年以上  宮崎総一郎 中部大学特聘教授经验:21年以上  百村伸一 教授经验:21年以上  村上和成 教授经验:21年以上  中山秀章 教授经验:21年以上 临床试验
| |||||||||||









