获取国外抒情诗CR药品价格,使用等信息,最快 24 小时回馈
抒情诗CR
抒情诗CR
什么是Lyrica CR?
Lyrica CR是一种抗癫痫药,也称为抗惊厥药。它通过减缓大脑中引起癫痫发作的冲动而起作用。这种药物还会影响大脑中的化学物质,这些化学物质会在整个神经系统中传递疼痛信号。
Lyrica CR用于治疗由纤维肌痛引起的疼痛或糖尿病患者(糖尿病性神经病),带状疱疹(带状疱疹后神经痛)或脊髓损伤引起的神经痛。
Lyrica CR还可以与其他药物一起使用,以治疗至少1个月大的成人和儿童的部分发作。
Lyrica CR也可用于本用药指南中未列出的目的。
重要信息
Lyrica CR会引起严重的过敏反应。如果您的皮肤上有荨麻疹或水疱,呼吸困难或脸,嘴或喉咙肿胀,请停止服用Lyrica CR,并寻求紧急医疗救助。
有些人在服用Lyrica CR时有自杀的念头。随时注意情绪或症状的变化。向您的医生报告任何新的或恶化的症状。
如果您患有糖尿病或心脏疾病,则在服用Lyrica CR时如果体重增加或手或脚肿胀,请致电医生。
即使感觉良好,也不要突然停止使用Lyrica CR。突然停止可能导致戒断症状。
在服药之前
如果您对Lyrica CR过敏,则不要使用它。
告诉医生您是否曾经:
肺部疾病,例如慢性阻塞性肺疾病(COPD);
情绪障碍,沮丧或自杀念头;
心脏问题(尤其是充血性心力衰竭);
出血性疾病或血液中血小板含量低;
肾脏疾病(或正在透析);
糖尿病(除非您服用Lyrica CR来治疗糖尿病性神经病);
药物或酒精成瘾;要么
严重的过敏反应(血管性水肿)。
没有医疗建议,请勿给孩子服用这种药。
未批准Lyrica CR被18岁以下的任何人用于治疗由纤维肌痛,糖尿病,带状疱疹或脊髓损伤引起的神经痛。
小于1个月大的人未批准Lyrica CR发作。
有些人在服用Lyrica CR时有自杀的念头。您的医生将需要定期检查您的进度。您的家人或其他护理人员也应警惕您的情绪或症状的变化。
控制妊娠期间的癫痫发作非常重要,癫痫发作可能会损害母亲和婴儿。未经医生的建议,请勿开始或停止服用Lyrica CR,并在怀孕时立即告诉医生。
如果您怀孕了,您的名字可能会在怀孕登记簿上列出,以追踪普瑞巴林对婴儿的影响。
Lyrica CR可以减少精子数量,并可能影响男性的生育能力(您生孩子的能力)。在动物研究中,该药物还导致使用该药物治疗的雄性后代的先天缺陷。但是,尚不清楚这些作用是否会在人类中发生。向您的医生询问您的风险。
使用Lyrica CR时请勿母乳喂养。
我应该如何服用Lyrica CR?
遵循处方标签上的所有说明,并阅读所有用药指南或说明表。您的医生可能偶尔会改变您的剂量。完全按照指示使用药物。
每天在同一时间服药,带或不带食物。
吞服整个延长释放片,不要压碎,咀嚼或弄碎它。
仔细测量药水。请使用提供的剂量注射器,或使用药物剂量测量设备(而不是厨房勺子)。
如果症状没有改善或变得更糟,请致电医生。
即使感觉良好,也不要突然停止使用Lyrica CR 。突然停止可能导致癫痫发作增加或不愉快的戒断症状。在完全停止之前,请遵照医生的指示,逐渐减少剂量至少1周。
万一发生紧急情况,请佩戴或携带医疗证明,以使他人知道您服用了癫痫药。
请在室温下存放,远离湿气,热量和光线。
如果我错过剂量怎么办?
请尽快服药,但如果快到下一次服药的时间了,请跳过错过的剂量。不要一次服用两剂。
如果我服药过量怎么办?
寻求紧急医疗护理或致电1-800-222-1222,拨打毒药帮助热线。
服用Lyrica CR时应该避免什么?
避免喝酒。它可能会增加普瑞巴林的某些副作用。
除非您知道Lyrica CR将如何影响您,否则请避免驾驶或危险活动。您的反应可能会受到损害。
Lyrica CR副作用
Lyrica CR会引起严重的过敏反应。如果您患有以下疾病,请停止服用该药物并获得紧急医疗帮助:荨麻疹或皮肤上起水泡;呼吸困难;脸,嘴唇,舌头或喉咙肿胀。
向医生报告任何新的或恶化的症状,例如:情绪或行为改变,沮丧,焦虑,惊恐发作,入睡困难,或者如果您感到冲动,易怒,烦躁,敌对,激进,躁动,躁动,精神亢奋(精神上或身体上) ,或有自杀或伤害自己的想法。
如果您有以下情况,请立即致电您的医生:
呼吸弱或浅
蓝色的皮肤,嘴唇,手指和脚趾;
混乱,极度嗜睡或虚弱;
视力问题;
皮肤溃疡(如果您患有糖尿病);
容易瘀伤,异常出血;
手或脚肿胀,体重迅速增加(尤其是在患有糖尿病或心脏病的情况下);要么
无法解释的肌肉疼痛,压痛或无力(特别是如果您还发烧或感觉不适)。
Lyrica CR可能导致危及生命的呼吸问题。如果您的呼吸缓慢,停顿较长,嘴唇呈蓝色,或者您难以醒来,则照顾您的人应寻求紧急医疗救助。老年人或患有COPD的人可能更容易出现呼吸问题。
如果您患有糖尿病,请立即告诉医生您是否有新疮或其他皮肤问题。
常见的副作用可能包括:
头晕,嗜睡;
手脚肿胀;
难以集中精力;
食欲增加;
体重增加;
口干;要么
模糊的视野。
这不是副作用的完整列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
哪些其他药物会影响Lyrica CR?
将Lyrica CR与其他会延缓呼吸的药物一起使用会导致危险的副作用或死亡。在使用阿片类药物,安眠药,感冒药或抗过敏药,肌肉松弛药或抗焦虑药或癫痫药之前,请先咨询医生。
告诉您的医生您所有其他药物的信息,尤其是:
口服糖尿病药物-吡格列酮,罗格列酮;要么
ACE抑制剂-贝那普利,卡托普利,依那普利,福辛普利,赖诺普利,莫西普利,培哚普利,奎那普利,雷米普利或trandolapril。
此列表不完整。其他药物可能会影响Lyrica CR,包括处方药和非处方药,维生素和草药产品。此处未列出所有可能的药物相互作用。
版权所有1996-2018 Cerner Multum,Inc.版本:9.01。
注意:本文档包含有关普瑞巴林的副作用信息。此页面上列出的某些剂型可能不适用于商标名称Lyrica CR。
对于消费者
适用于普瑞巴林:口服胶囊,口服液,口服片剂缓释
需要立即就医的副作用
普瑞巴林(Lyrica CR中包含的活性成分)及其所需的作用可能会引起一些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用普瑞巴林时,如果有下列任何副作用,请立即与医生联系:
不常见
- 胸痛
- 冷汗
- 凉爽,白皙的皮肤
- 咳嗽产生粘液
- 呼吸困难或劳累
- 肌肉疼痛,抽搐或抽搐或无力
- 嘈杂的呼吸
- 癫痫发作
- 胸闷
罕见
- 皮肤起泡,脱皮或松弛
- 脸,手臂,手,小腿或脚肿胀或肿胀
- 发冷
- 咳嗽
- 腹泻
- 吞咽困难
- 头晕
- 快速的心跳
- 荨麻疹,瘙痒,皮疹
- 关节或肌肉疼痛
- 眼睑或眼睛,面部,嘴唇或舌头周围浮肿或肿胀
- 皮肤病变为红色,中心常为紫色
- 眼睛发红
- 咽喉痛
- 口腔或嘴唇上的疮,溃疡或白斑
- 异常疲倦或虚弱
发病率未知
- 嘴唇,指甲或皮肤发蓝
- 不规则,快速或缓慢或呼吸浅
- 意识丧失
- 恶心
- 严重便秘
- 胃痉挛或疼痛
- 呕吐
不需要立即就医的副作用
普瑞巴林可能会出现一些副作用,通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 误伤
- 模糊的视野
- 手,手臂,脚或腿有灼痛,刺痛,麻木或疼痛感
- 步行和平衡变化
- 笨拙
- 混乱
- 排便困难
- 说话困难
- 双重视野
- 口干
- 事实无法改变的错误信念
- 发热
- 头痛
- 嘶哑
- 食欲增加
- 缺乏协调
- 记忆力减退
- 下背部或侧面疼痛
- 排尿困难或困难
- 缺乏洞察力和判断力
- 记忆或言语问题
- 体重快速增加
- 针脚的感觉
- 颤抖
- 嗜睡
- 刺痛
- 颤抖或其他肌肉控制或协调问题
- 难以识别物体
- 麻烦的思想和计划
- 不稳定的步行
- 异常嗜睡
- 体重异常增加或减少
不常见
- 焦虑
- 腹胀或饱胀感
- 视力下降或改变
- 萧条
- 胃或肠中过量的空气或气体
- 眼疾
- 错误或异常的幸福感
- 普遍感到不适或生病
- 饥饿加剧
- 食欲不振
- 失去膀胱控制
- 力量或精力的损失
- 紧张
- 噩梦
- 疼痛
- 通过气体
- 肌肉的节奏运动
- 流鼻涕
- 发抖
- 言语不清
- 出汗
- 睡眠困难
- 抽搐
- 眼球运动不受控制
发病率未知
- 乳房增大
- 男性和女性乳房肿胀或乳房酸痛
对于医疗保健专业人员
适用于普瑞巴林:口服胶囊,口服液,口服片剂缓释
一般
该药物最常见的不良反应是头晕,嗜睡,口干,浮肿,视力模糊,体重增加和“思维异常”(主要是集中注意力的困难)。在儿科患者中,最常报告的事件包括体重增加和食欲增加。 [参考]
神经系统
在接受这种药物治疗部分发作的小儿患者中,据报道有21%的药物治疗患者和14%的安慰剂患者出现嗜睡,高剂量时更常发生。嗜睡包括嗜睡,呆滞和失眠的相关术语。
因脊髓损伤而接受中枢神经性疼痛治疗的患者中枢神经系统不良反应(尤其是嗜睡症)的发生率增加。这可能是由于伴随药物的加和作用。
上市后有服用普瑞巴林(Lyrica CR中的活性成分)和其他中枢神经系统抑制药的患者呼吸衰竭和昏迷的报道。 [参考]
很常见(10%或更多):头晕(最高37%),嗜睡(最高25%)
常见(1%至10%):神经病,共济失调,眩晕,不协调,震颤,步态异常,头痛,语言障碍,抽搐
罕见(0.1%至1%):晕厥,木僵,肌阵挛,精神运动亢进,运动障碍,头晕姿势,意图震颤,眼球震颤,反射不足,感觉过敏,烧灼感,老龄,不适
稀有(少于0.1%):抽搐,妄想症,运动减退,运动障碍,休克,环周感觉异常,构音障碍,痛觉过敏,运动亢进,运动减退,肌张力低下,肌阵挛,神经痛小脑综合征,齿轮刚度,昏迷,昏迷,肌张力障碍,肌张力障碍,肌张力障碍,格林-巴利综合征,痛觉过敏,颅内高压,斜颈,三头肌,周围神经炎
上市后报告:昏迷[参考]
心血管的
很常见(10%或更多):周围水肿(高达12%)
常见(1%至10%):胸痛
罕见(0.1%至1%):低血压,高血压,潮热,潮红,周围寒冷,心力衰竭,体位性低血压,晕厥
罕见(少于0.1%):ST抑郁,心室纤颤
未报告频率:PR间隔延长[参考]
在成年患者的对照临床试验中,据报道接受这种药物的患者中有6%出现外周水肿,而安慰剂组为2%。药物治疗组和安慰剂组分别有0.5%和0.2%的患者因周围水肿而退出。
临床试验ECG数据的分析表明,当剂量大于或等于300 mg / day时,平均PR间隔增加3至6毫秒。亚组分析未发现基线PR延长患者或服用其他PR延长药物的患者PR延长风险增加,尽管该研究中的患者人数不足以得出明确的结论。 [参考]
精神科
常见(1%至10%):精神错乱,欣快感,健忘症,神经质,烦躁不安,神志不清,失眠,性欲降低,注意力不集中,焦虑,人格解体,木僵,思维异常
罕见(0.1%至1%):认知障碍,精神障碍,梦境异常,躁动,冷漠,失语,幻觉,敌意
稀有(小于0.1%):妄想,妄想,躁狂反应,偏执反应,人格障碍,精神病性抑郁症,精神分裂症反应,睡眠障碍,抑制作用[参考]
过敏症
罕见(0.1%至1%):过敏
稀有(0.01%至0.1%):过敏反应,过敏反应[参考]
皮肤科
血管性水肿的症状包括面部,口部(舌,嘴唇和牙龈)和颈部(喉部和喉部)肿胀。也有报告说,危及生命的血管性水肿伴呼吸困难,需要紧急治疗。有这些症状的患者应立即停止治疗。如果先前有血管性水肿发作的患者使用这种药物,建议谨慎使用。服用其他与血管性水肿有关的药物(例如,血管紧张素转化酶抑制剂[ACE抑制剂])的患者可能会增加患血管性水肿的风险。 [参考]
常见(1%至10%):瘀斑,瘙痒
罕见(0.1%至1%):血管性水肿,皮疹丘疹,荨麻疹,多汗症,脓肿,蜂窝织炎,脱发,皮肤干燥,湿疹,多毛症,皮肤溃疡,荨麻疹,膀胱巩膜皮疹
罕见(少于0.1%):史蒂文斯·约翰逊综合征,冷汗,血管性水肿,剥脱性皮炎,苔藓样皮炎,黑变病,指甲病,上皮疹,紫癜性皮疹,脓疱疹,皮肤萎缩,皮肤坏死,皮肤结节,皮下结节[Ref ]
胃肠道
常见(1%至10%):口干,便秘,恶心,呕吐,腹泻,肠胃气胀,腹胀,肠胃炎
罕见(0.1%至1%):胃食管反流病,唾液分泌过多,口腔感觉减退,胆囊炎,胆石症,结肠炎,吞咽困难,食道炎,胃炎,胃肠道出血,黑便,口溃疡,胰腺炎,直肠出血,舌头水肿
罕见(少于0.1%):腹水,肉芽肿
上市后报告:降低胃肠道下部功能事件(例如肠梗阻,麻痹性肠梗阻,便秘) [参考]
当与可能产生便秘的药物(如阿片类药物)合用时,上市后的胃肠道功能降低事件减少的报道。 [参考]
泌尿生殖
常见(1%至10%):尿失禁,勃起功能障碍,阳ot,尿频,尿失禁
罕见(0.1%至1%):性功能障碍,射精延迟,痛经,乳房疼痛,性高潮,白蛋白尿,尿痛,血尿,肾结石,白带,月经过多,出血性,少尿,尿retention留,尿液异常,射精异常闭经,痛经,肾结石,月经过多,子宫出血,少尿
稀有(小于0.1%):乳腺分泌物,乳房增大,妇科病,骨盆痛,龟头炎,膀胱肿瘤,宫颈炎,性交困难,附睾炎,肾小球炎,卵巢疾病[参考]
血液学
罕见(0.1%至1%):中性粒细胞减少,血肌酸磷酸激酶增加,丙氨酸氨基转移酶增加,天冬氨酸氨基转移酶增加,血小板计数减少,血肌酐增加,血钾减少,深部血栓性静脉炎
稀有(少于0.1%):白细胞数量减少,贫血,嗜酸性粒细胞增多,低色素性贫血,白细胞增多,白细胞减少,淋巴结病,血小板减少
罕见(0.01%至0.1%):骨髓纤维化,红细胞增多症,凝血酶原减少,紫癜[参考]
免疫学的
非常常见(10%或更多):感染(高达14%)
常见(1%至10%):流感综合征[参考]
肌肉骨骼
常见(1%至10%):重症肌无力,肌肉痉挛,关节痛,背痛,四肢疼痛,颈痉挛,腿抽筋
罕见(0.1%至1%):关节肿胀,肌痛,肌肉抽搐,颈部疼痛,肌肉僵硬,颈部僵硬,关节病
罕见(少于0.1%):横纹肌溶解症,软骨营养不良,广泛性痉挛[参考]
眼科
很常见(10%或更多):视野变化(13%)
常见(1%至10%):视力模糊,视力异常,复视,结膜炎
罕见(0.1%至1%):周围视力丧失,视觉障碍,眼睛肿胀,视野缺损,视力降低,眼痛,弱视,光敏,光敏反应,干眼,流泪增加,眼刺激,视网膜血管疾病,住宿异常,睑缘炎,干眼症,眼出血,听觉过敏,畏光,视网膜水肿
稀有(0.01%至0.1%):视力减退,角膜炎,骨质疏松症,视深度感知改变,瞳孔散大,斜视,视亮度,虹膜异位症,失明,角膜溃疡,眼球突出症,眼外瘫痪,虹膜炎,角膜炎,角膜结膜炎,瞳孔缩小,瞳孔散大,夜盲症,眼肌麻痹,视神经萎缩,乳头水肿,妄想症,上睑下垂,葡萄膜炎[参考]
其他
常见(1%至10%):乏力,意外伤害,面部浮肿,疼痛,中耳炎,耳鸣
罕见(少于0.1%至1%):全身水肿,疼痛,发热,发冷,口渴
稀有(0.01%至0.1%):腹膜后纤维化,视网膜血管疾病,味觉减退,味觉变态
未报告频率:快速停药后的戒断作用[参考]
一些患者报告了突然/快速停药后的戒断作用。这些症状包括失眠,恶心,头痛,焦虑,多汗症和腹泻。 [参考]
呼吸道
常见(1%至10%):呼吸困难,支气管炎,鼻咽炎
罕见(0.1%至1%):鼻出血,咳嗽,鼻塞,鼻炎,打s,鼻干燥
罕见(小于0.1%):肺水肿,喉咙紧绷,呼吸暂停,肺不张,细支气管炎,打ic,喉炎,肺纤维化,打哈欠
上市后报告:呼吸衰竭[参考]
有上市后报告服用普瑞巴林和其他中枢神经系统抑制药的患者出现呼吸衰竭和昏迷。 [参考]
新陈代谢
常见(1%至10%):体重增加,浮肿,低血糖,食欲增加
罕见(0.1%至1%):体重减轻,血糖升高
稀有(0.01%至0.1%):葡萄糖耐量下降,尿酸结晶性[参考]
肝的
罕见(0.1%至1%):肾炎
罕见(0.01%至0.1%):急性肾衰竭,肾盂肾炎[参考]
内分泌
上市后报告:男性乳房发育,乳房增大
参考文献
1.“产品信息。Lyrica(普瑞巴林)。”辉瑞美国制药集团,纽约,纽约。
2. Cerner Multum,Inc.“英国产品特性摘要”。 00
3. Cerner Multum,Inc.“澳大利亚产品信息”。 00
某些副作用可能没有报道。您可以将其报告给FDA。
带状疱疹后神经痛
根据患者的反应和耐受性,开始以每天一次165 mg的剂量开始给药,并在1周内增加到每天330 mg的剂量。
每天接受330 mg一次治疗2至4周后仍未获得足够缓解疼痛并且能够耐受LYRICA CR的患者,每天一次可接受高达660 mg的治疗。鉴于剂量依赖性不良反应和因不良反应引起的更高的治疗中断率,330 mg /天以上的剂量应仅用于那些持续疼痛且每天耐受330 mg的患者。 LYRICA CR的最大推荐剂量为每天660 mg。
从LYRICA胶囊或口服溶液转换为LYRICA CR
在转换之日从LYRICA转换为LYRICA CR时,请指示患者按处方服用早晨剂量的LYRICA,并在晚餐后开始LYRICA CR治疗。
| LYRICA每日总剂量 (每日2至3次) | LYRICA CR剂量 (每天一次) |
|---|---|
| |
| 每天75毫克 | 82.5毫克/天 |
| 150毫克/每天 | 165毫克/天 |
| 每天225毫克 | 247.5毫克/天* |
| 300毫克/每天 | 330毫克/天 |
| 450毫克/每天 | 495毫克/天† |
| 600毫克/每天 | 660毫克/天‡ |
肾功能不全的患者
对于肌酐清除率(CLcr)低于30 mL / min或正在进行血液透析的患者,不建议使用LYRICA CR。这些患者应接受LYRICA治疗。
考虑到剂量依赖性不良反应,并且由于普瑞巴林主要通过肾脏排泄而消除,因此应调整肾功能减退患者的剂量。如表2所示,以肾功能不全患者为基础进行剂量调整。如表2所示。要使用剂量表,需要以毫升/分钟为单位估算患者的血肌酐(CRcr)。可以使用Cockcroft和Gault方程通过血清肌酐(mg / dL)测定来估算以毫升/分钟为单位的CLcr:
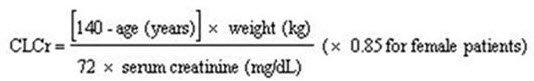
接下来,对于肾功能正常(CLcr大于或等于60 mL / min)的患者,请参考“剂量和给药”部分,根据指征确定推荐的每日总剂量。然后参考表2确定相应的肾脏调整剂量。
(例如:对于一名肾功能正常[CLcr大于或等于60 mL / min]的患者,开始LYRICA CR治疗带状疱疹后神经痛的患者,每天服用普瑞巴林165 mg /天。因此,患有肾功能不全的肾功能不全患者50 mL / min的CLcr每天将接受82.5 mg的剂量。)
| 肌酐清除率(CLcr) (毫升/分钟) | LYRICA CR每日总剂量 (毫克/天) | 剂量方案 | |||
|---|---|---|---|---|---|
| |||||
| 大于或等于60 | 165 | 330 | 495 * | 660† | 一天一次 |
| 30-60 | 82.5 | 165 | 247.5‡ | 330 | 一天一次 |
| 少于30 /血液透析 | LYRICA的剂量 | ||||
Lyrica CR的适应症和用法
Lyrica CR适用于以下方面的管理:
- 与糖尿病性周围神经病变相关的神经性疼痛
- 带状疱疹后神经痛
尚未确定Lyrica CR的疗效是否可用于治疗纤维肌痛或作为部分发作的成年患者的辅助治疗。
Lyrica CR剂量和给药
重要剂量和管理说明
晚餐后,应每天一次施用Lyrica CR。
Lyrica CR应该整个吞下,并且不能被分裂,压碎或咀嚼。
停用Lyrica CR时,请在至少1周的时间内逐渐缩小。
指导患者,如果他们错过了晚饭后服用Lyrica CR的剂量,则应在睡前零食后服用常规剂量的Lyrica CR。如果他们错过就寝前服用Lyrica CR的剂量,则应在早饭后服用常规剂量的Lyrica CR。如果他们错过了早饭后服用Lyrica CR的剂量,那么他们应该在晚饭后当晚的通常时间服用他们通常的Lyrica CR [请参阅患者咨询信息(17) ] 。
糖尿病性周围神经病变伴有神经性疼痛
根据患者的反应和耐受性,开始以每天一次165 mg的剂量开始给药,并在1周内增加到每天330 mg的剂量。 Lyrica CR的最大推荐剂量为每天330毫克。
尽管以600毫克/天的剂量对LYRICA进行了研究,但没有证据表明该剂量可带来更大的益处,并且该剂量的耐受性较差。鉴于LYRICA的剂量依赖性不良反应,对于Lyrica CR,不建议以330 mg / day以上的剂量进行治疗。
带状疱疹后神经痛
根据患者的反应和耐受性,开始以每天一次165 mg的剂量开始给药,并在1周内增加到每天330 mg的剂量。
每天接受330 mg一次治疗2至4周后仍未获得足够缓解疼痛且能够耐受Lyrica CR的患者,每天最多可接受660 mg的治疗。鉴于剂量依赖性不良反应和因不良反应引起的更高的治疗中断率,330 mg /天以上的剂量应仅用于那些持续疼痛且每天耐受330 mg的患者。 Lyrica CR的最大建议剂量是每天一次660 mg。
从LYRICA胶囊或口服溶液转换为Lyrica CR
在转换之日从LYRICA转换为Lyrica CR时,请指示患者按处方服用早晨剂量的LYRICA,并在晚餐后开始进行Lyrica CR治疗。
| LYRICA每日总剂量 (每日2至3次) | Lyrica CR剂量 (每天一次) |
|---|---|
| |
| 每天75毫克 | 82.5毫克/天 |
| 150毫克/每天 | 165毫克/天 |
| 每天225毫克 | 247.5毫克/天* |
| 300毫克/每天 | 330毫克/天 |
| 450毫克/每天 | 495毫克/天† |
| 600毫克/每天 | 660毫克/天‡ |
肾功能不全的患者
对于肌酐清除率(CLcr)低于30 mL / min或正在进行血液透析的患者,不建议使用Lyrica CR。这些患者应接受LYRICA治疗。
考虑到剂量依赖性不良反应,并且由于普瑞巴林主要通过肾脏排泄而消除,因此应调整肾功能减退患者的剂量。如表2所示,以肾功能不全患者为基础进行剂量调整。如表2所示。要使用剂量表,需要以毫升/分钟为单位估算患者的血肌酐(CRcr)。可以使用Cockcroft和Gault方程通过血清肌酐(mg / dL)测定来估算以毫升/分钟为单位的CLcr:

接下来,对于肾功能正常(CLcr大于或等于60 mL / min)的患者,请参考“剂量和给药”部分,根据指征确定推荐的每日总剂量。然后参考表2确定相应的肾脏调整剂量。
(例如:对于肾功能正常[CLcr大于或等于60 mL / min]的疱疹后神经痛患者,采用Lyrica CR治疗的患者每天接受普瑞巴林165 mg /天的单剂量治疗。因此,患有肾功能不全的肾功能不全患者50 mL / min的CLcr每天将接受82.5 mg的剂量。)
| 肌酐清除率(CLcr) (毫升/分钟) | Lyrica CR总每日剂量 (毫克/天) | 剂量方案 | |||
|---|---|---|---|---|---|
| |||||
| 大于或等于60 | 165 | 330 | 495 * | 660 † | 一天一次 |
| 30-60 | 82.5 | 165 | 247.5 • | 330 | 一天一次 |
| 少于30 /血液透析 | LYRICA的剂量 | ||||
剂型和优势
延长释放片:82.5 mg,165 mg和330 mg [请参见说明(11)以及如何提供/存储和处置(16) ] 。
| Lyrica CR片 | |
|---|---|
| 片剂强度(毫克) | 平板电脑说明 |
| 82.5毫克 | 浅蓝色薄膜包衣杏仁形片剂,一侧压有辉瑞,另一侧压有PGN 82.5 |
| 165毫克 | 米色,薄膜包衣,杏仁状片剂,一侧压有辉瑞,另一侧压有PGN 165 |
| 330毫克 | 玫瑰薄膜衣杏仁状压片,一侧压有辉瑞,另一侧压有PGN 330 |
禁忌症
已知对普瑞巴林或其任何成分过敏的患者禁用Lyrica CR。接受普瑞巴林治疗的患者发生了血管性水肿和超敏反应[见警告和注意事项( 5.1,5.2) ,不良反应(6) ] 。
警告和注意事项
血管性水肿
LYRICA的初始和慢性治疗期间,有上市后患者血管性水肿的报道。具体症状包括面部,口腔(舌头,嘴唇和牙龈)和颈部(喉咙和喉咙)肿胀。有报告说,危及生命的血管性水肿伴有呼吸困难,需要紧急治疗。有这些症状的患者应立即停用Lyrica CR。
对先前有血管水肿发作的患者处方Lyrica CR时要谨慎。此外,正在服用其他与血管性水肿有关的药物(例如,血管紧张素转换酶抑制剂[ACE-inhibitors])的患者可能会增加患血管性水肿的风险。
过敏反应
LYRICA治疗开始后不久就有患者出现超敏反应的上市后报道。不良反应包括皮肤发红,水泡,荨麻疹,皮疹,呼吸困难和喘息。有这些症状的患者应立即停用Lyrica CR。
自杀行为和观念
抗癫痫药(AED)包括普瑞巴林(Lyrica CR中的活性成分),会增加服用这些药物用于任何适应症的患者发生自杀念头或行为的风险。监测接受任何AED治疗的患者是否有抑郁症,自杀念头或行为和/或情绪或行为异常变化的出现或恶化的迹象。
对199种安慰剂对照的11种不同AED的临床试验(单一疗法和辅助疗法)的汇总分析显示,随机分配到其中一种AED的患者发生自杀的风险约为两倍(调整后相对风险1.8,95%CI:1.2,2.7)。与随机接受安慰剂的患者相比。在这些中位治疗时间为12周的试验中,在27,863例接受AED治疗的患者中,自杀行为或意念的估计发生率为0.43%,而在1,029例接受安慰剂治疗的患者中,自杀行为或意念的发生率为0.24%,增加了约每530名接受治疗的患者有自杀念头或行为。在试验中,接受药物治疗的患者中有四种自杀,而在接受安慰剂治疗的患者中没有自杀,但是数量太少,无法得出有关药物对自杀影响的任何结论。
最早在开始使用AED进行药物治疗后一周,就观察到AED产生自杀念头或行为的风险增加,并且在评估的治疗期间一直存在。由于分析中包含的大多数试验都没有超过24周,因此无法评估自杀想法或行为的风险超过24周。
在所分析的数据中,自杀想法或行为的风险在药物之间通常是一致的。发现具有不同作用机制且适应症范围广泛的AED会增加患病风险,这表明该风险适用于用于任何适应症的所有AED。在所分析的临床试验中,该风险在年龄(5-100岁)之间没有显着差异。
表3通过指示显示了所有评估的AED的绝对和相对风险。
| 适应症 | 安慰剂患者每1000名患者发生事件 | 每1000名患者中发生事件的药物患者 | 相对风险:药物患者事件的发生率/安慰剂患者的发生率 | 风险差异:每1000名患者中发生事件的新增药物患者 |
|---|---|---|---|---|
| 癫痫 | 1.0 | 3.4 | 3.5 | 2.4 |
| 精神科 | 5.7 | 8.5 | 1.5 | 2.9 |
| 其他 | 1.0 | 1.8 | 1.9 | 0.9 |
| 总 | 2.4 | 4.3 | 1.8 | 1.9 |
在癫痫症的临床试验中,自杀想法或行为的相对风险高于在精神病或其他疾病的临床试验中,但对于癫痫症和精神病指征,绝对风险差异相似。
任何考虑开Lyrica CR处方的人都必须在自杀念头或行为的风险与未治疗疾病的风险之间取得平衡。处方AED的许多其他疾病本身与发病率和死亡率以及自杀念头和行为的风险增加有关。如果在治疗期间出现自杀念头和行为,则处方者需要考虑在任何给定患者中这些症状的出现是否与所治疗的疾病有关。
告知患者,其护理人员和家人,Lyrica CR可能会增加自杀念头和行为的风险,并建议他们需要警惕抑郁症的症状和体征的出现或恶化,情绪或行为的任何异常变化,或自杀念头,行为或关于自我伤害的念头的出现。立即向医疗保健提供者报告所关注的行为。
周围水肿
抒情CR治疗可能会导致周围水肿。在对没有临床意义的心脏或外周血管疾病的患者进行的短期试验中,外周水肿与心血管并发症(例如高血压或充血性心力衰竭)之间没有明显的关联。周围水肿与实验室改变无关,提示肾脏或肝功能恶化。
在针对疼痛指征的对照临床试验中,单盲期接受Lyrica CR的患者外周水肿的发生率为患者的5.3%。在针对疼痛指征的对照临床试验中,在单盲阶段,有0.8%的Lyrica CR患者因周围水肿而退出。
与单独服用两种药物的患者相比,同时服用LYRICA和噻唑烷二酮抗糖尿病药的患者观察到更高的体重增加和外周水肿发生率。总体安全性数据库中使用噻唑烷二酮类抗糖尿病药的大多数患者都是与糖尿病周围神经病相关的疼痛研究的参与者。在该人群中,仅使用噻唑烷二酮类抗糖尿病药的患者中有3%(2/60)发生外周水肿,仅使用LYRICA治疗的患者中有8%(69/859)和19%(23/120)接受LYRICA和噻唑烷二酮类抗糖尿病药治疗的患者同样,仅噻唑烷二酮类药物的患者中有0%(0/60)体重增加。仅使用LYRICA的患者中有4%(35/859);两种药物的患者占7.5%(9/120)。
由于噻唑烷二酮类抗糖尿病药会导致体重增加和/或体液retention留,可能加剧或导致心力衰竭,因此,在与Lyrica CR和这些药物合用时,应监测患者是否出现水肿。
由于有关纽约心脏协会(NYHA)III级或IV级心脏状态的充血性心力衰竭患者的数据有限,因此在使用Lyrica CR时应监测这些患者的充血性心力衰竭症状。
头晕目眩
Lyrica CR可能导致头晕和嗜睡。告知患者Lyrica CR相关的头晕和嗜睡可能会削弱他们执行驾驶或操作机械等任务的能力。将Lyrica CR与其他中枢神经系统(CNS)抑制剂同时使用可能会加剧这些作用[参见药物相互作用(7) ] 。
在Lyrica CR对照疼痛指示试验中,单盲期有24%的Lyrica CR治疗患者出现头晕。接受Lyrica CR治疗的患者中有15.8%经历了嗜睡。头晕和嗜睡通常在Lyrica CR治疗开始后不久开始,并在较高剂量下更频繁地出现。在对照研究的单盲阶段,头晕和嗜睡是最常导致戒断的不良反应(分别为2.4%,1.2%)。在短期,对照研究中报告了这些不良反应的接受LYRICA治疗的患者中,头晕持续到30%最后一次服用,嗜睡持续到42%患者最后一次服用。
体重增加
Lyrica CR治疗可能会导致体重增加。在针对疼痛指征的Lyrica CR对照试验中,单盲期有4%的Lyrica CR治疗的患者出现体重增加。在双盲阶段,观察到3.7%的Lyrica CR治疗患者和1%的安慰剂治疗患者出现了体重增加的不良事件。
在长达14周的LYRICA对照临床试验中,在9%的LYRICA治疗患者和2%的安慰剂治疗患者中观察到比基线体重增加7%或更多。由于体重增加,很少有接受LYRICA治疗的患者(0.3%)退出对照试验。在LYRICA研究中,相关的体重增加与普瑞巴林剂量和暴露时间有关,但似乎与基线BMI,性别或年龄无关。体重增加不仅限于水肿患者[见警告和注意事项(5.4) ] 。
尽管在LYRICA的短期对照研究中体重增加与临床上重要的血压变化无关,但与普瑞巴林相关的体重增加对心血管的长期影响尚不清楚。
在糖尿病患者中,接受LYRICA治疗的患者平均增加了1.6 kg(范围:-16至16 kg),而安慰剂患者平均增加了0.3 kg(范围:-10至9 kg)。在接受LYRICA治疗至少2年的333名糖尿病患者中,平均体重增加了5.2 kg。
虽然尚未系统评估普瑞巴林相关体重增加对血糖控制的影响,但在糖尿病患者的对照和长期开放标签临床试验中,LYRICA治疗似乎与血糖控制丧失无关(如HbA 1C )。
与突然或快速停产有关的风险
Lyrica CR突然或快速停药后,一些患者报告症状,包括失眠,恶心,头痛,焦虑和腹泻。如果迅速停用Lyrica CR,癫痫发作患者服用Lyrica CR止痛可能会增加癫痫发作频率。逐渐减少Taper Lyrica CR至少要持续1周,而不是突然停药。尚未确定Lyrica CR作为成人发作部分发作的辅助治疗的疗效。
致瘤潜力
在普瑞巴林的标准临床前体内寿命期致癌性研究中,在2种不同的小鼠品系中发现了血管肉瘤的意外高发生率[参见非临床毒理学(13.1) ] 。这一发现的临床意义尚不清楚。 LYRICA上市前开发期间的临床经验无法直接评估其在人类中诱发肿瘤的潜力。
在对包括12个年龄大于12岁的患者的6396个患者年的暴露量的各种患者群体进行的临床研究中,有57位患者报告了新的或恶化的肿瘤。如果不了解未经普瑞巴林治疗的相似人群的背景发生率和复发情况,就不可能知道这些人群中的发生率是否受到治疗的影响。
眼科作用
在针对疼痛指征的对照研究中,在单盲期接受Lyrica CR治疗的患者中有4.8%的患者报告视力模糊,在大多数持续给药的情况下均可以解决。少于1%的患者因视力相关事件(主要是视力模糊)而中断了Lyrica CR治疗。此外,与未接受安慰剂治疗的患者相比,接受Lyrica CR治疗的患者中有0.7%的患者在双盲阶段视力模糊。
在普瑞巴林的上市前开发中进行了预先计划的眼科检查,包括视力测试,正式视野测试和扩大的眼底镜检查,对3600多名患者进行了测试。在这些患者中,LYRICA治疗的患者和安慰剂治疗的患者的视力降低了7%。在13%的LYRICA治疗组和12%的安慰剂治疗组中发现了视野变化。在2%的LYRICA治疗组和2%的安慰剂治疗组患者中观察到眼底镜改变。
尽管眼科检查结果的临床意义尚不清楚,但如果视力发生变化,请告知患者并通知医生。如果视觉障碍持续存在,请考虑进一步评估。考虑对已经常规监测眼部疾病的患者进行更频繁的评估。
肌酸激酶升高
LYRICA治疗与肌酸激酶升高有关。 LYRICA治疗患者的肌酸激酶从基线到最大值的平均变化为60 U / L,安慰剂患者为28 U / L。在多个患者群体的所有对照试验中,使用LYRICA的患者中有1.5%的患者和安慰剂患者中的0.7%的肌酸激酶值至少是正常上限的3倍。在上市前临床试验中,三名接受LYRICA治疗的受试者发生了横纹肌溶解事件。尚未完全了解这些肌病事件与LYRICA之间的关系,因为这些病例已记录了可能引起或促成这些事件的因素。指导患者及时报告无法解释的肌肉疼痛,压痛或无力,特别是如果这些肌肉症状伴有不适或发烧时。如果诊断或怀疑肌病或发生肌酸激酶水平显着升高,请停止使用Lyrica CR治疗。
血小板数减少
Lyrica CR和LYRICA治疗均与血小板计数降低有关。在针对疼痛指征的对照研究的双盲阶段,接受Lyrica CR治疗的患者的血小板计数中值相对于基线的变化为11×10 3 / mm 3 (对于PHN人群)和14×10 3 / mm 3 ( FM人群),而安慰剂治疗的患者为1×10 3 / mm 3 (两个人群)。与安慰剂患者的11×10 3 / µL相比,接受LYRICA治疗的患者的血小板计数平均最大降低20×10 3 / µL。在对照试验的整个数据库中,有2%的安慰剂患者和3%的LYRICA患者经历了潜在的临床意义上的血小板显着下降,这被定义为低于基线值20%,并且低于150×10 3 / µL。一位接受LYRICA治疗的受试者出现了严重的血小板减少症,血小板计数低于20×10 3 / µL。在随机对照试验中,LYRICA或Lyrica CR与出血相关不良反应的增加无关。
PR间隔延长
LYRICA治疗与PR间隔延长有关。在临床试验心电图数据分析中,普瑞巴林剂量大于或等于300 mg / day时,平均PR间隔增加3-6毫秒。这种平均变化差异与PR增加的风险相比基线高出不超过25%,治疗PR大于200毫秒的受试者增加的百分比或第二或第三次不良反应的风险增加无关度房室传导阻滞。
亚组分析未发现基线PR延长患者或服用其他PR延长药物的患者PR延长风险增加。但是,由于这些类别的患者数量有限,因此不能认为这些分析是确定的。
不良反应
标签上其他地方描述了以下不良反应:
- 血管性水肿[请参阅警告和注意事项(5.1) ]
- 过敏反应[请参阅警告和注意事项(5.2) ]
- 自杀行为和想法([请参阅警告和注意事项(5.3) ]
- 周围水肿[请参阅警告和注意事项(5.4) ]
- 头晕和嗜睡[请参阅警告和注意事项(5.5) ]
- 体重增加[请参阅警告和注意事项(5.6) ]
- 眼科影响[请参阅警告和注意事项(5.9) ]
- 肌酸激酶升高[见警告和注意事项(5.10) ]
- 血小板计数减少[请参阅警告和注意事项(5.11) ]
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
在带状疱疹后神经痛和纤维肌痛患者中进行了两项随机安慰剂对照临床试验,其中共有1242例患者接受了Lyrica CR。两项研究均为随机戒断设计,其中为期6周的单盲剂量优化阶段,随后为13周的双盲阶段。导致大于或等于0.3%的患者退出单盲研究阶段的最常见不良事件是头晕,嗜睡,周围水肿,疲劳,视力模糊和体重增加。 64%的患者在单盲阶段经历了不良事件,最常见的不良事件发生在大于或等于4%的患者中,包括头晕,嗜睡,头痛,疲劳,周围水肿,恶心,视力模糊,口干,体重增加。
带状疱疹后神经痛的对照研究
不良反应导致停药
在带状疱疹后神经痛患者的一项临床试验中,在Lyrica CR治疗的患者中,有8.9%的患者由于不良反应而在单盲期过早停药。因不良反应而停药的最常见原因是头晕(2.1%),嗜睡(0.87%)和周围水肿(0.50%)。
最常见的不良反应
表4列出了无论是否因果关系,在不考虑研究阶段的情况下,接受Lyrica CR的带状疱疹后神经痛患者中大于或等于1%的所有不良反应。
| 系统器官分类 首选条款 | 单盲相 | 双盲相 | |
|---|---|---|---|
| 抒情诗CR [N = 801] n(%) | 抒情诗CR [N = 208] n(%) | 安慰剂 [N = 205] n(%) | |
| |||
| 耳朵和迷宫疾病 | |||
| 眩晕 | 31(3.9) | 2(1.0) | 1(0.5) |
| 眼疾 | |||
| 视力模糊 | 30(3.7) | 1(0.5) | 0 |
| 复视 | 8(1.0) | 1(0.5) | 0 |
| 胃肠道疾病 | |||
| 口干 | 30(3.7) | 1(0.5) | 0 |
| 恶心 | 24(3.0) | 7(3.4) | 0 |
| 便秘 | 22(2.7) | 0 | 0 |
| 腹泻 | 11(1.4) | 2(1.0) | 1(0.5) |
| 呕吐 | 9(1.1) | 3(1.4) | 1(0.5) |
| 一般疾病和给药部位情况 | |||
| 周围水肿 | 39(4.9) | 8(3.8) | 1(0.5) |
| 疲劳 | 31(3.9) | 3(1.4) | 2(1.0) |
| 浮肿 | 3(0.4) | 3(1.4) | 0 |
| 感染和侵扰 | |||
| 鼻咽炎 | 12(1.5) | 3(1.4) | 0 |
| 尿路感染 | 11(1.4) | 3(1.4) | 1(0.5) |
| 支气管炎 | 4(0.5) | 3(1.4) | 2(1.0) |
| 呼吸道感染病毒 | 3(0.4) | 3(1.4) | 1(0.5) |
| 鼻窦炎 | 3(0.4) | 2(1.0) | 0 |
| 胃肠炎病毒 | 2(0.2) | 2(1.0) | 0 |
| 调查 | |||
| 体重增加 | 20(2.5) | 8(3.8) | 2(1.0) |
| 丙氨酸转氨酶增加 | 2(0.2) | 3(1.4) | 0 |
| 天冬氨酸转氨酶增加 | 2(0.2) | 2(1.0) | 0 |
| 肌肉骨骼和结缔组织疾病 | |||
| 关节痛 | 6(0.7) | 2(1.0) | 1(0.5) |
| 关节肿胀 | 0 | 4(1.9) | 0 |
| 神经系统疾病 | |||
| 头晕 | 137(17.1) | 7(3.4) | 1(0.5) |
| 嗜睡 | 91(11.4) | 1(0.5) | 0 |
| 头痛 | 31(3.9) | 4(1.9) | 1(0.5) |
| 平衡障碍 | 21(2.6) | 1(0.5) | 0 |
| 生殖系统和乳房疾病 | |||
| 勃起功能障碍 | 2(0.6) | 1(1.4) | 0 |
| 呼吸,胸和纵隔疾病 | |||
| 咳嗽 | 2(0.2) | 2(1.0) | 1(0.5) |
| 皮肤和皮下组织疾病 | |||
| 皮肤炎接触 | 0 | 2(1.0) | 0 |
LYRICA和Lyrica CR在临床研究中观察到的其他不良反应
除了在带状疱疹后神经痛的对照研究中报告使用Lyrica CR的不良反应外,在所有临床研究中,使用LYRICA和Lyrica CR治疗的患者还报告了以下不良反应。此清单不包括上面已经列出的那些不良反应。不良反应按系统器官类别分类,并按照以下定义按频率递减的顺序列出:频繁的不良反应是指至少1/100患者中1次或多次发生的不良反应。不良反应很少发生在1/100至1/1000患者中;罕见的反应是少于1/1000的患者中发生的反应。具有重要临床意义的不良反应在“警告和注意事项”部分(5)中进行了描述。
心脏疾病-罕见:心Pal,深部血栓性静脉炎,心力衰竭,低血压,体位性低血压,视网膜血管疾病,晕厥;罕见:心脏衰竭,心动过速
眼疾–罕见:牙周水肿
胃肠道疾病–频繁:食欲增加;罕见:腹胀,腹痛,吞咽困难,胰腺炎,舌头水肿
一般疾病–频繁:发烧;不常见:胸痛,面部浮肿;稀有:面部疼痛,粘膜干燥
血液和淋巴系统疾病-频繁:瘀斑;罕见:贫血,嗜酸性粒细胞增多症,低色素性贫血,白细胞增多症,白细胞减少症,淋巴结病,血小板减少症;罕见:骨髓纤维化,红细胞增多症,凝血酶原减少,紫癜,血小板增多症
感染和侵染-罕见:中耳炎,肺炎
研究–稀有:存在葡萄糖尿,脂肪酶增加,中性粒细胞计数增加,蛋白尿
代谢和营养失调–罕见:葡萄糖耐量降低,尿酸盐结晶
肌肉骨骼和结缔组织疾病–常见:腿抽筋,肌痛,肌无力;罕见:关节僵硬;稀有:球骨痛,肌无力
神经系统疾病-常见:焦虑症,人格解体,高渗症,感觉不足,性欲减退,眼球震颤,感觉异常,镇静,木僵,抽搐;罕见:协调异常,梦境异常,躁动,健忘症,情感淡漠,失语症,周围感觉异常,认知障碍,构音障碍,消化不良,幻觉,敌意,痛觉过敏,过敏症,运动亢进,运动减退,低钾血症,性欲减退,肌无力,睡眠障碍,肌阵挛相位节律紊乱;罕见:成瘾,意识状态改变,运动迟缓,小脑综合症,钝齿轮僵硬,昏迷,Deli妄,妄想,意识水平低下,自主神经发育障碍,运动障碍,肌张力障碍,脑病,锥体外系综合征,精神运动亢进,心理运动技能受损
精神病–罕见:易怒
呼吸系统疾病-罕见:肺水肿
皮肤疾病–常见:瘙痒;稀有:史蒂文斯-约翰逊综合症
特殊感觉–频繁:结膜炎,耳鸣
泌尿生殖系统疾病-常见:性欲减退,阳Imp,尿频,尿失禁;罕见:射精异常,蛋白尿,排尿困难,血尿,肾结石,白带,肾炎,少尿,尿retention留
LYRICA的售后经验
在LYRICA的批准后使用过程中,确认了以下不良反应。这些不良反应未在上面列出,并且数据不足以支持对其发生率的估计或确定因果关系。该列表按字母顺序排列:乳房增大,女性乳房发育。
上市后也有服用普瑞巴林和其他中枢神经系统抑制药的患者呼吸衰竭和昏迷的报道。此外,有上市后报道,当LYRICA与可能产生便秘的药物(如阿片类镇痛药)合用时,与下消化道功能降低(例如,肠梗阻,麻痹性肠梗阻,便秘)有关的事件。
药物相互作用
由于普瑞巴林主要在尿液中原样排泄,在人体中代谢可忽略不计(少于代谢产物中尿液中回收剂量的2%),并且不与血浆蛋白结合,因此其药代动力学不太可能受其他药物通过代谢的影响相互作用或蛋白质结合置换。体外研究表明,普瑞巴林不太可能参与显着的药代动力学药物相互作用[见临床药理学(12) ] 。
Lyrica CR与其他药物共同给药的相互作用尚未得到系统评价。促红细胞生成素红霉素与Lyrica CR的共同给药并未导致Lyrica CR药代动力学的任何临床重要改变[见临床药理学(12) ] 。
LYRICA还进行了其他研究。 LYRICA与卡马西平,加巴喷丁,拉莫三嗪,口服避孕药,苯巴比妥,苯妥英钠,托吡酯和丙戊酸之间未发现药代动力学相互作用。 Lyrica CR预计会发生类似的药代动力学相互作用缺乏。
药效学
尽管未发现有药代动力学相互作用,但与LYRICA和乙醇,劳拉西m或羟考酮相比,当LYRICA与这些药物合用时,对认知和总体运动功能产生了累加作用。在LYRICA的研究中,没有发现对呼吸系统有重要临床意义的影响。
在特定人群中的使用
怀孕
怀孕暴露登记
有一个怀孕暴露注册表可以监视怀孕期间接受普瑞巴林治疗的妇女的妊娠结局。为了提供有关宫内暴露于Lyrica CR的影响的信息,建议医师建议服用Lyrica CR的怀孕患者参加北美抗癫痫药物(NAAED)怀孕登记。可以通过拨打免费电话1-888-233-2334来完成,并且必须由患者自己完成。有关注册表的信息也可以在网站http://www.aedpregnancyregistry.org/上找到。
风险摘要
Lyrica CR尚无针对孕妇的充分且对照良好的研究。
然而,在动物繁殖研究中,在器官发生期间口服普瑞巴林的大鼠和兔子的后代中,观察到胎儿结构异常和其他发育毒性的发生率增加,包括骨骼畸形,骨化迟缓和胎儿体重降低,剂量为在660 mg / day的最大推荐剂量(MRD)下,血浆普瑞巴林暴露量(AUC)大于或等于人体暴露量的18倍[参见数据] 。在一项动物发育研究中,在孕期和哺乳期服用普瑞巴林的大鼠后代中观察到了致死性,生长迟缓以及神经和生殖系统功能受损。发育毒性的无效剂量约为人类在MRD暴露量的两倍。对于所指示的人群,主要出生缺陷和流产的背景风险尚不清楚。但是,在美国一般人群中,主要的先天性缺陷的背景风险为临床公认的妊娠的2–4%,流产为15–20%。建议孕妇注意胎儿的潜在危险。
数据
动物资料
在整个器官发生期间,给怀孕的大鼠口服普瑞巴林(500、1250或2500 mg / kg)口服时,归因于骨化异常晚期(法律和鼻腔和缝线过早融合)的特定颅骨改变的发生率大于或大于等于1250 mg / kg,并且在所有剂量下骨骼变化和骨化延迟的发生率均增加。最高剂量可使胎儿体重下降。在这项研究中,低剂量与血浆暴露(AUC)有关,在MRD为660 mg / day时,血浆暴露(AUC)约为人暴露的18倍。没有建立大鼠胚胎-胎儿发育毒性的无效剂量。
在整个器官发生期间,给怀孕的兔子口服普瑞巴林(250、500或1250 mg / kg)时,在最高剂量下观察到胎儿体重下降,骨骼畸形,内脏变异和骨化延迟的发生率增加。兔子发育毒性的无效剂量(500 mg / kg)与血浆中MRD暴露量的17倍有关。
在一项研究中,在雌性大鼠的整个妊娠和哺乳期服用普瑞巴林(50、100、250、1250或2500 mg / kg)的研究中,子代的生长减慢到大于或等于100 mg / kg时,子代的存活率降低了大于或等于250 mg / kg。剂量大于或等于1250 mg / kg时,对后代存活的影响明显,大剂量垫料中的死亡率为100%。当后代作为成年测试时,发现神经行为异常(听觉惊吓反应减少)大于或等于250 mg / kg,而生殖功能障碍(生育力和产仔数减少)则为1250 mg / kg。对大鼠产前和产后发育毒性的无影响剂量(50 mg / kg)产生的血浆暴露约为人在MRD处暴露的2倍。
在大鼠的产前产后研究中,普瑞巴林延长了妊娠并导致难产,其暴露量大于或等于MRD处人均暴露量(AUC (0-24) 123 µg∙hr / mL)的50倍。
哺乳期
风险摘要
在哺乳期妇女的牛奶中检测到少量的普瑞巴林。一项针对哺乳期妇女的药代动力学研究发现,母乳中普瑞巴林的平均稳态浓度约为母体血浆中普瑞巴林浓度的76%。母乳中普瑞巴林的婴儿平均每日估计剂量(假设平均牛奶消耗量为150 mL / kg /天)为0.31 mg / kg /天,以mg / kg为基础,大约为母体剂量的7% [请参见数据] 。该研究未评估普瑞巴林对产奶量的影响或普瑞巴林对母乳喂养婴儿的影响。
根据动物研究,通过普瑞巴林经母乳喂养母乳喂养的婴儿有致癌性的潜在风险[见非临床毒理学(13.1) ] 。大于12岁的患者可获得的临床研究数据并未就普瑞巴林潜在致癌性的风险提供明确的结论[见警告和注意事项(5.8) ] 。由于存在致瘤性的潜在风险,因此在Lyrica CR治疗期间不建议母乳喂养。
数据
一项针对十名产后至少12周的哺乳期妇女的药代动力学研究评估了血浆和母乳中普瑞巴林的浓度。每12小时给予LYRICA 150 mg口服胶囊(每日300 mg),共4剂。在母乳中检测到普瑞巴林的平均稳态浓度约为母体血浆中普瑞巴林浓度的76%。母乳中普瑞巴林的婴儿平均每日估计剂量(假设平均牛奶消耗量为150 mL / kg /天)为0.31 mg / kg /天,以mg / kg计,这约为母体剂量的7%。该研究没有评估普瑞巴林对牛奶生产的影响。婴儿在给药期间未接受母乳,因此未评估普瑞巴林对母乳喂养婴儿的影响。
生殖潜力的男性和女性
不孕症
雄性
对精子发生的影响
在一项随机,双盲,安慰剂对照的非劣效性研究中,评估普瑞巴林对精子特征的影响,健康的男性受试者每日接受剂量达600 mg普瑞巴林(n = 111)或安慰剂(n = 109) for 13 weeks (1 complete sperm cycle) followed by a 13-week washout period (off-drug). A total of 65 subjects in the pregabalin group (59%) and 62 subjects in the placebo group (57%) were included in the per protocol (PP) population. These subjects took study drug for at least 8 weeks, had appropriate timing of semen collections and did not have any significant protocol violations. Among these subjects, approximately 9% of the pregabalin group (6/65) vs. 3% in the placebo group (2/62) had greater than or equal to 50% reduction in mean sperm concentrations from baseline at Week 26 (the primary endpoint). The difference between pregabalin and placebo was within the pre-specified non-inferiority margin of 20%. There were no adverse effects of pregabalin on sperm morphology, sperm motility, serum FSH or serum testosterone levels as compared to placebo. In subjects in the PP population with greater than or equal to 50% reduction in sperm concentration from baseline, sperm concentrations were no longer reduced by greater than or equal to 50% in any affected subject after an additional 3 months off-drug. In 1 subject, however, subsequent semen analyses demonstrated reductions from baseline of greater than or equal to 50% at 9 and 12 months off-drug. The clinical relevance of these data is unknown.
In the animal fertility study with pregabalin in male rats, adverse reproductive and developmental effects were observed [see Nonclinical Toxicology (13.1) ].
儿科用
The safety and effectiveness of Lyrica CR in pediatric patients have not been established.
幼兽毒性数据
In studies in which pregabalin (50 to 500 mg/kg) was orally administered to young rats from early in the postnatal period (Postnatal Day 7) through sexual maturity, neurobehavioral abnormalities (deficits in learning and memory, altered locomotor activity, decreased auditory startle responding and habituation) and reproductive impairment (delayed sexual maturation and decreased fertility in males and females) were observed at doses greater than or equal to 50 mg/kg. The neurobehavioral changes of acoustic startle persisted at greater than or equal to 250 mg/kg and locomotor activity and water maze performance at greater than or equal to 500 mg/kg in animals tested after cessation of dosing and, thus, were considered to represent long-term effects. The low effect dose for developmental neurotoxicity and reproductive impairment in juvenile rats (50 mg/kg) was associated with a plasma pregabalin exposure (AUC) approximately equal to human exposure at the maximum recommended dose of 660 mg/day. A no-effect dose was not established.
老人用
In controlled clinical studies of LYRICA in neuropathic pain associated with diabetic peripheral neuropathy, 246 patients were 65 to 74 years of age, and 73 patients were 75 years of age or older.
In controlled clinical studies of LYRICA in neuropathic pain associated with postherpetic neuralgia, 282 patients were 65 to 74 years of age, and 379 patients were 75 years of age or older.
In the Lyrica CR neuropathic pain associated with postherpetic neuralgia study, 422 patients 65 years of age and older received pregabalin.
No overall differences in safety and effectiveness were observed between these patients and younger patients, and other reported clinical experience has not identified differences in responses between the elderly and younger patients, but greater sensitivity of some older individuals cannot be ruled out.
Pregabalin is known to be substantially excreted by the kidney, and the risk of adverse reactions to this drug may be greater in patients with impaired renal function.由于老年患者更容易出现肾功能下降,因此应谨慎选择剂量,这对监测肾功能可能有用。 See Dosage and Administration (2.5) for recommendations for dosing in patients with renal impairment .
药物滥用和依赖性
受控物质
Lyrica CR contains pregabalin, a Schedule V controlled substance.
滥用
In a study of recreational users (N=15) of sedative/hypnotic drugs, including alcohol, LYRICA (450 mg, single dose) received subjective ratings of "good drug effect," "high" and "liking" to a degree that was similar to diazepam (30 mg, single dose). In controlled clinical studies in over 5500 patients, 4% of LYRICA-treated patients and 1% of placebo-treated patients overall reported euphoria as an adverse reaction, though in some patient populations studied, this reporting rate was higher and ranged from 1 to 12%.
Carefully evaluate all patients treated with Lyrica CR for history of drug abuse and observe them for signs of Lyrica CR misuse or abuse (eg, development of tolerance, dose escalation, drug-seeking behavior).
依存关系
In clinical studies, following abrupt or rapid discontinuation of Lyrica CR, some patients reported symptoms including insomnia, nausea, headache diarrhea, or anxiety [see Warnings and Precautions (5.7) ] , consistent with physical dependence. In the postmarketing experience with LYRICA, in addition to these reported symptoms there have also been reported cases of hyperhidrosis.
过量
Signs, Symptoms and Laboratory Findings of Acute Overdosage in Humans
There is limited experience with overdose of pregabalin. The highest reported accidental overdose of LYRICA during the clinical development program was 8000 mg, and there were no notable clinical consequences.
Treatment or Management of Overdose
There is no specific antidote for overdose with pregabalin. If indicated, elimination of unabsorbed drug may be attempted by emesis or gastric lavage; observe usual precautions to maintain the airway. General supportive care of the patient is indicated including monitoring of vital signs and observation of the clinical status of the patient. Contact a Certified Poison Control Center for up-to-date information on the management of overdose with pregabalin.
Although hemodialysis has not been performed in the few known cases of overdose, it may be indicated by the patient's clinical state or in patients with significant renal impairment. Standard hemodialysis procedures result in significant clearance of pregabalin (approximately 50% in 4 hours).
已知共有265种药物与Lyrica CR(普瑞巴林)相互作用。
- 24种主要药物相互作用
- 240种中等程度的药物相互作用
- 1次药物相互作用
检查互动
最常检查的互动
查看Lyrica CR(普瑞巴林)与下列药物的相互作用报告。
- 氨氯地平
- 阿托伐他汀
- 巴氯芬
- 环苯扎林
- mb(度洛西汀)
- 度洛西汀
- 加巴喷丁
- 布洛芬
- 左甲状腺素
- 赖诺普利
- 二甲双胍
- 奥美拉唑
- 羟考酮
- 普萘洛尔
- 雷尼替丁
- 舍曲林
- 替扎尼定
- 托吡酯
- 曲马多
- 维生素D3(胆钙化固醇)
Lyrica CR(普瑞巴林)酒精/食物相互作用
Lyrica CR(普瑞巴林)与酒精/食物有1种相互作用
抒情CR(普瑞巴林)疾病相互作用
与Lyrica CR(普瑞巴林)有5种疾病相互作用,包括:
- 自杀倾向
- 血管性水肿
- 肌酸激酶升高
- 周围性水肿
- PR间隔延长
药物相互作用分类
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义最小。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 潜在的滥用
- 审批历史 FDA的药物史
美国日本医生

Heather Benjamin MD

Suzanne Reitz MD

Heather Miske DO

Bert Hepner DO

Gregory Aaen MD

渡邊剛

宮崎総一郎 中部大学特聘教授

百村伸一 教授

村上和成 教授
