获取国外意象药品价格,使用等信息,最快 24 小时回馈
意象
意象
什么是Imlygic?
Imlygic(talimogene laherparepvec)是一种癌症药物,会影响人体免疫系统的作用,帮助人体产生“抗肿瘤”反应。
Imlygic是1型单纯疱疹病毒(引起普通唇疱疹的病毒)的基因改造弱型。
Imlygic用于治疗一种称为黑色素瘤的癌症,当它在皮肤或淋巴腺中时。
重要信息
遵循药品标签和包装上的所有说明。告诉您的每个医疗保健提供者所有您的医疗状况,过敏和您使用的所有药物。
在服药之前
意外暴露于Imlygic中的病毒可能会导致您出现疱疹病毒感染的症状。但是,不治疗黑色素瘤会使癌症发展并扩散到身体的其他部位。黑色素瘤进展后很难治疗,这种癌症可能是致命的。与您的医生谈谈使用Imlygic的风险和益处。
如果您对talimogene laherparepvec过敏,或者如果:
您的免疫系统较弱(由疾病或使用某些药物引起);要么
你怀孕了。
为确保Imlygic对您安全,请告知您的医生是否患有:
唇疱疹或生殖器疱疹;
血液癌(白血病);
骨髓癌(骨髓瘤);
艾滋病毒或艾滋病;要么
自身免疫性疾病,例如类风湿性关节炎,狼疮或牛皮癣。
告诉医生您家中是否有人怀孕或免疫系统较弱。
Talimogene laherparepvec可能会伤害未出生的婴儿或导致先天缺陷。如果您怀孕,请勿使用Imlygic,如果您怀孕,请立即告诉医生。如果在使用Imlygic时出现疱疹病毒感染的症状,则该病毒可能在分娩时传播给您的婴儿。
使用Imlygic时,请采取有效的节育措施以防止怀孕。在治疗结束后,按照医生的指示进行预防怀孕的时间。
使用Imlygic进行母乳喂养可能并不安全。向您的医生询问任何风险。
如何给予Ilygic?
Imlygic直接注射到皮肤上的肿瘤或皮肤下的淋巴结中。医护人员会给您注射。
通常每2周或直到您的肿瘤消失,才服用Imlygic。前两次注射Imlygic通常间隔3周。
您的护理提供者将采取特殊的预防措施,以避免将这种药物涂在身体的其他部位。如果该药物不慎沾到皮肤上,请用肥皂和温水彻底清洗。
Imlygic中包含的病毒是单纯疱疹病毒的一种弱形式,可以传播到身体的其他部位。仔细按照医生的指示进行有关注射Imlygic的身体护理。
注射后至少1周,用密闭且防水的绷带覆盖治疗区域。如果排水或渗水,您可能需要将治疗区域覆盖1周以上。
经常更换敷料,以保持治疗区域清洁。
清洁治疗区域或换上新绷带时,请戴乳胶手套。将用过的手套和绷带放在密封的塑料袋中,然后扔到垃圾桶中。
Imlygic中的病毒也可能传播到与您有密切联系的其他人。避免靠近生病或感染的人。避免亲吻任何有口腔溃疡或唇疱疹的人(有时称为发烧水疱)。同时避免靠近孕妇。
停止使用Imlygic后,如果您有任何新的皮肤病灶或淋巴腺肿瘤的迹象,请致电医生。
剂量信息
黑色素瘤通常的成年剂量-转移性:
初始剂量:
-通过病灶内注射,每毫升最多含10(6)[100万]噬菌斑形成单位(PFU)的浓度为4 mL。
-应首先注射最大的病灶。
-应根据病变大小优先考虑剩余病变。
第二剂量:
-初次治疗后3周,通过病灶内注射以每毫升10(8)[1亿] PFU的浓度最多4 mL。
-自初始治疗以来出现的新病变应首先注射。
-应根据病变大小优先考虑剩余病变。
所有后续处理(包括重新初始化):
-在先前治疗后2周内,通过病灶内注射,以每毫升10(8)[1亿] PFU的浓度最多4 mL。
-自先前治疗以来出现的新病变应首先注射。
-应根据病变大小优先考虑剩余病变。
最大剂量:对于所有合并的病灶,每次治疗就诊的总注射量不应超过4 mL。
治疗时间:
-每次治疗就诊:应当注射病灶,直到达到最大注射量或治疗完所有可注射病灶为止。
-完整的治疗过程:至少6个月,除非需要其他治疗或直到没有可注射的病变为止。
评论:
注射量应基于病变大小(聚集在一起的病变应视为单个病变):
-大于5厘米:最大4毫升
-大于2.5厘米至5厘米:最大2毫升
-大于1.5厘米至2.5厘米:最多1毫升
-大于0.5厘米至1.5厘米:最多0.5毫升
-0.5厘米以下:最大0.1毫升
使用:初次手术后复发的黑色素瘤患者的局部不可切除的皮肤,皮下和淋巴结病变的局部治疗。
如果我错过剂量怎么办?
如果您错过了注射预约,请致电医生。
如果我服药过量怎么办?
由于Imlygic由医疗专业人员在医疗环境中提供,因此服用过量的可能性不大。
服用Imlygic时应避免什么?
避免触摸或刮擦注射该药物的区域。
Imlygic中包含的病毒可以进入体液(尿液,粪便,呕吐物,精液)。避免让体液接触到手或其他无法清洁的表面。做爱时务必使用乳胶避孕套。在清理病人的体液,处理受污染的垃圾或衣物或更换尿布时,护理人员应戴上橡胶手套。摘下手套前后都要洗手。与其他衣物分开洗涤脏衣服和亚麻布。
在Imlygic治疗结束后,请遵照医生的指示,保持多长时间使用这些预防措施。
毒副作用
如果您对Imlygic有过敏反应迹象,请寻求紧急医疗帮助。呼吸困难;脸,嘴唇,舌头或喉咙肿胀。
如果您有任何迹象表明您正在感染单纯疱疹病毒,请立即致电医生,例如:
刺痛,灼痛或疼痛(尤其是您的嘴或生殖器周围);
手臂或腿无力或抽筋,有时伴有灼痛;
眼痛,结s或引流,视物模糊(您的眼睛可能对光更敏感);
混乱,严重嗜睡;要么
在手指或耳朵上,口腔或生殖器周围形成水泡。
如果您有以下情况,也请致电您的医生:
任何无法治愈的皮肤病变;要么
注射部位发红,肿胀,发热,渗血或皮肤变化。
常见的Imlygic副作用可能包括:
发烧,发冷,流感样症状;
感觉累了;
恶心;要么
注射药物的疼痛。
这不是完整的副作用列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响Imlygic?
告诉您的医生您目前使用的所有药物,以及在接受Imlygic治疗期间开始或停止使用的任何药物,尤其是:
治疗疱疹的药物(阿昔洛韦,伐昔洛韦或其他);要么
削弱免疫系统的药物(例如抗癌药,类固醇和防止器官移植排斥的药物)。
此列表不完整。其他药物可能与talimogene laherparepvec相互作用,包括处方药和非处方药,维生素和草药产品。本用药指南中并未列出所有可能的药物相互作用。
版权所有1996-2020 Cerner Multum,Inc.版本:2.01。
注意:本文档包含有关talimogene laherparepvec的副作用信息。此页面上列出的某些剂型可能不适用于品牌名称Imlygic。
对于消费者
适用于talimogene laherparepvec:注射悬浮液
需要立即就医的副作用
talimogene laherparepvec(Imlygic中包含的活性成分)及其所需的作用可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用talimogene laherparepvec时,如果出现以下任何副作用,请立即与您的医生或护士联系:
比较普遍;普遍上
- 寒意
- 咳嗽
- 腹泻
- 发热
- 普遍感到不适或生病
- 头痛
- 关节痛
- 食欲不振
- 肌肉酸痛
- 恶心
- 注射部位疼痛
- 流鼻涕
- 发抖
- 咽喉痛
- 出汗
- 睡眠困难
- 异常疲倦或虚弱
- 呕吐
发病率未知
- 皮肤破裂,尤其与蓝黑色变色,肿胀或液体排出有关
- 灼伤或刺痛皮肤
- 嘴唇,鼻子,眼睛或生殖器上疼痛的唇疱疹或水泡
不需要立即就医的副作用
他莫昔芬可能会产生一些副作用,通常不需要医治。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 腹部或胃痛
- 排便困难(凳子)
- 移动困难
- 头晕
- 肌肉疼痛或僵硬
- 手臂或腿部疼痛
- 减肥
对于医疗保健专业人员
适用于talimogene laherparepvec:可注射混悬液
一般
-最常报告(25%或更多)的药物不良反应为疲劳,发冷,发热,恶心,流感样疾病和注射部位疼痛。
-在治疗期间的任何时间都可能发生发热,发冷和类似流感的疾病,但在头3个月中更为频繁。
-大多数不良反应为轻度或中度,一般在72小时内消失。
-蜂窝组织炎是最常见的3级或更高的不良反应。 [参考]
其他
非常常见(10%或更高):疲劳(50.3%),畏寒(48.6%),发热(42.8%),类流感疾病(30.5%),注射部位疼痛(27.7%)
常见(1%至10%):体重减轻
未报告频率:疱疹感染,注射部位并发症(蜂窝组织炎,全身细菌感染,愈合不良) [参考]
胃肠道
非常常见(10%或更高):恶心(35.6%),呕吐(21.2%),腹泻(18.8%),便秘(11.6%)
常见(1%至10%):腹痛
未报告频率:口腔疱疹[参考]
神经系统
很常见(10%或更多):头痛(18.8%)
常见(1%至10%):头晕[参考]
肌肉骨骼
非常常见(10%或更多):肌痛(17.5%),关节痛(17.1%),四肢疼痛(16.4%) [参考]
免疫学的
未报告的频率:免疫介导的事件(肾小球肾炎,血管炎,肺炎,牛皮癣,白癜风) [参考]
肿瘤的
未报告频率:浆细胞瘤[参考]
呼吸道
常见(1%至10%):口咽痛[Ref]
新陈代谢
常见(1%至10%):重量减轻[参考]
参考文献
1.“产品信息。Imlygic(talimogene laherparepvec)。”美国安进(Amgen USA),千橡市,CA。
某些副作用可能没有报道。您可以将其报告给FDA。
行政
请按照以下步骤对患者使用IMLYGIC:
预我njection
1.用酒精棉签清洁病变和周围区域,然后使其干燥。
2.必要时用局部或局部麻醉剂治疗注射部位。不要将麻醉剂直接注入病变部位。在病变周围注射麻醉剂。
注射
1.将IMLYGIC病变内注射到可见,可触及或可通过超声引导检测到的皮肤,皮下和/或淋巴结病变中。使用单个插入点,沿多条轨迹注射IMLYGIC,直到针的径向范围允许在病变内实现均匀而完全的分散。如果病变大于针的径向范围,则可以使用多个插入点。
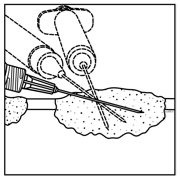
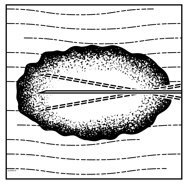
2.向后拉动针头,不离开病变部位,将IMLYGIC均匀而完整地注入病变部位。在注射剩余剂量的IMLYGIC时,根据需要将针头多次重定向。继续直至全剂量均匀完全分散。
3.拔出针头时,将其从病变处缓慢撤出,以免IMLYGIC在插入点泄漏。
4.对于要注射的其他病变,重复预注射步骤1-2和注射步骤1-3。
5.每当从病变处完全移出针头时,以及每次注射不同的病变时,都应使用新针头。
注射后
- 用无菌纱布对注射部位施加压力至少30秒。
- 用酒精擦拭注射部位和周围区域。
- 更换手套,并用吸收垫和干燥的闭塞敷料覆盖注入的病灶。
- 用酒精擦拭闭塞敷料的外部。
- 建议患者:
- 每次治疗后至少要保持注射部位覆盖第一周,如果注射部位渗出或渗出,则应保持更长的时间。
- 如果敷料掉落,请更换。
1适应症和用途
Imlygic是一种经过基因改造的溶瘤病毒疗法,用于局部治疗初次手术后复发的黑色素瘤患者无法切除的皮肤,皮下和淋巴结病变。
使用的局限性:尚未证明Imlygic可以改善整体生存率或对内脏转移有影响。
2剂量和给药
仅用于病灶内注射。不要静脉内给药。
剂量
通过注入可见,可触摸或可通过超声引导检测到的皮肤,皮下和/或淋巴结病变来施用Imlygic。
每次使用1 mL的小瓶时,Imlygic均以两种不同的剂量强度提供:
- 每毫升10 6 (一百万)个噬菌斑形成单位(PFU)(浅绿色帽) –仅用于初始剂量
- 每毫升10 8 (亿)PFU(皇家蓝盖) –用于所有后续剂量
推荐剂量和时间表
对于所有合并的病灶,每次治疗访视的总注射量不应超过4 mL。在每次治疗访视时或整个治疗过程中可能无法注入所有病变。先前注射和/或未注射的病变可以在随后的治疗就诊时注射。初始推荐剂量为4 mL Imlygic,浓度为10 6 每毫升(100万)PFU。推荐的后续剂量最高为4 mL Imlygic,浓度为10 8 (亿)PFU / mL。表1列出了Imlygic的推荐给药时间表。
| 治疗 | 治疗我nterval | 最大I njection V olume元T reatme N t个 V ISIT(所有病灶组合) | 剂量小号trength | 大号esions的优先要我njected |
| 初始 | – | 4毫升 | 10 6 (100万) 每毫升PFU |
|
| 第二 | 初始治疗后3周 | 4毫升 | 10 8 (亿) 每毫升PFU |
|
| 所有后续处理(包括重新初始化) | 先前治疗后2周 | 4毫升 | 10 8 (亿) 每毫升PFU |
|
剂量体积测定(每个病灶)
使用表2确定每个病变的Imlygic注射量。
| 病变大小 (最长尺寸) | 注射量 |
| > 5厘米 | 高达4 mL |
| > 2.5厘米至5厘米 | 高达2 mL |
| > 1.5厘米至2.5厘米 | 高达1 mL |
| > 0.5厘米至1.5厘米 | 最高0.5毫升 |
| ≤0.5厘米 | 高达0.1 mL |
当病变聚集在一起时,根据表2将它们作为单个病变注射。
除非需要其他治疗或直到没有可治疗的可注射病变,否则继续进行Imgic治疗至少6个月。
如果完全反应后出现新的不可切除的皮肤,皮下或淋巴结病变,请重新开始Imlygic治疗。
准备和处理
免疫力低下或怀孕的医疗保健提供者不得准备或使用Imlygic,也不应直接与已治疗患者的Imlygic注射部位,敷料或体液接触[请参阅警告和注意事项( 5.1 )] 。
避免意外暴露于Imlygic,并遵循以下有关Imlygic的制备,施用和处理的说明:
- 在准备或服用Imlygic时,请穿戴个人防护设备(防护服或实验服,安全眼镜或面罩和手套)。
- 避免意外暴露于Imlygic,尤其是与皮肤,眼睛和粘膜接触。
○处理前,请覆盖所有裸露的伤口。
○如果意外职业接触(例如,溅到眼睛或粘膜上),请用清水冲洗至少15分钟。
○如果皮肤破裂或针刺破,请用肥皂和水和/或消毒剂彻底清洁患处。 - 清洁可能与Imlygic接触的所有表面,并用杀虫剂(例如1%次氯酸钠或70%异丙醇)处理所有Imlygic溢出物,并使用吸收性材料吸干。
- 将可能与Imlygic接触的所有材料(例如,小瓶,注射器,针头,棉纱布,手套,口罩或敷料)作为生物危害性废物处理。
- 建议患者将用过的敷料和清洁材料放入密封的塑料袋中,然后处理生活垃圾。
解冻小瓶
1.确定注射所需的总体积,最多4毫升[参见剂量和用法( 2.1 )] 。
2.在室温[20º至25ºC(68º至77ºF)]处解冻冷冻的Imlygic样品瓶,直到Imlygic变为液态(约30分钟)。请勿将小瓶暴露在较高温度下。解冻期间,将小瓶放在原始纸箱中。
3.轻轻旋转。不要摇动。
4.解冻后,立即施用Imlygic或将其保存在其原始的小瓶和纸箱中,如下:
•解冻的Imlygic在2°C(36°F)到25°C(77°F)的温度下保存在其原始小瓶和纸箱中避光保存的稳定时间为表3中指定的时间。表3中指定的存储时间。
•解冻后,不可将其冷冻。丢弃保存时间长于表3中指定时间的已解冻的小瓶中的Imlygic。
| 10 6 (100万)PFU / mL | 10 8 (亿)PFU / mL | |
| 2°C至8°C(36°F至46°F) | 24小时 | 1周(7天) |
| 最高25°C(77°F) | 12小时 | 24小时 |
5.准备无菌注射器和针头。可以使用可拆卸的18-26G针头或不可拆卸的22-26G针头针头(可最大程度地减少滞留量)来进行Imgic撤药,并且可以使用可拆卸或不可拆卸的22-26G的针头针头进行注射。建议使用小剂量注射器(例如0.5 mL胰岛素注射器)以更好地控制注射。
6.使用无菌技术,取下小瓶盖,然后将产品从小瓶中抽出到注射器中,注意总体积。在将产品装入注射器时,避免产生气溶胶,并使用生物安全柜(如果有)。
行政
请按照以下步骤对患者使用Imlygic:
预我njection
1.用酒精棉签清洁病变和周围区域,然后使其干燥。
2.必要时用局部或局部麻醉剂治疗注射部位。不要将麻醉剂直接注入病变部位。在病变周围注射麻醉剂。
注射
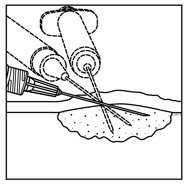
1.向皮肤内,皮下和/或淋巴结内病灶内注射Imlygic皮损,这些病变在超声引导下可见,可触及或可检测到。使用单个插入点,沿多条轨迹注射Imlygic,直至针的径向范围允许在病变内实现均匀而完全的分散。如果病变大于针的径向范围,则可以使用多个插入点。



2.通过向后拉动针头而不离开病变部位,在病变部位均匀,完全地注射Imlygic。在注射其余剂量的Imlygic时,根据需要将针头多次重定向。继续直至全剂量均匀完全分散。
3.拔出针头时,应将其从病变处缓慢抽出,以免Imlygic在插入点泄漏。
4.对于要注射的其他病变,重复预注射步骤1-2和注射步骤1-3。
5.每当从病变处完全移出针头时,以及每次注射不同的病变时,都应使用新针头。
注射后
- 用无菌纱布对注射部位施加压力至少30秒。
- 用酒精擦拭注射部位和周围区域。
- 更换手套,并用吸收垫和干燥的闭塞敷料覆盖注入的病灶。
- 用酒精擦拭闭塞敷料的外部。
- 建议患者:
- 每次治疗后至少要保持注射部位覆盖第一周,如果注射部位渗出或渗出,则应保持更长的时间。
- 如果敷料掉落,请更换。
3剂型和强度
- 仅初始剂量:在1 mL一次性小瓶中,每mL溶液中10 6 (100万)PFU(浅绿色的盖子)
- 后续剂量:在1 mL一次性使用的小瓶中,每mL溶液10 8 (亿)PFU(皇家蓝盖)
4禁忌症
免疫功能低下的患者
Imlygic是一种活的减毒单纯疱疹病毒,可能会在免疫功能低下的患者中造成威胁生命的弥漫性疱疹感染。请勿对免疫功能低下的患者施用Imlygic,包括具有原发性或获得性免疫缺陷状态,白血病,淋巴瘤,艾滋病或其他人类免疫缺陷病毒感染的临床表现的患者,以及接受免疫抑制治疗的患者[请参阅非临床毒理学( 13.2 )] 。
孕妇
不要对孕妇使用Imlygic。
5警告和注意事项
意外暴露于意境
意外接触可能导致传染性和疱疹感染的传播。据报道,在医护人员准备和使用Imlygic期间意外针刺和溅到眼睛上。
医疗保健提供者,密切接触者(家庭成员,照料者,性伴侣或同床的人),孕妇和新生儿应避免直接接触已治疗患者的注射病灶,敷料或体液[见剂量和用法( 2.2 )] 。免疫力低下或怀孕的医疗保健提供者不得准备或使用Imlygic。
护理人员在协助患者使用或更换闭塞敷料时应戴防护手套,并遵守安全注意事项,以处理用过的敷料,手套和清洁材料[见剂量和用法( 2.2 ) ] 。
万一意外接触Imlygic,接触者应使用肥皂,水和/或消毒剂彻底清洁患处。如果出现疱疹感染的体征或症状,接触者应联系其医疗保健提供者以进行适当的治疗[见警告和注意事项( 5.2 )] 。
患者应避免触摸或刮擦注射部位或其闭塞敷料,因为这样做可能会导致Imlygic意外转移到身体的其他部位。
疱疹感染
在临床研究中,据报道,Imlygic治疗的患者出现疱疹感染(包括唇疱疹和疱疹性角膜炎)。免疫功能低下的患者也可能发生传播性疱疹感染[见禁忌症( 4.1 )] 。
发生可疑疱疹样病变的患者应遵循标准的卫生习惯,以防止病毒传播。怀疑患有疱疹感染的患者或密切接触者也应联系其医疗保健提供者以评估病变。怀疑带状疱疹病变应通过1-855-Imlygic(1-855-465-9442)报告给Amgen;患者或密切接触者可以选择进行后续检查以进一步表征感染。
Imlygic对阿昔洛韦敏感。阿昔洛韦或其他抗病毒药物可能会干扰Imlygic的有效性。因此,在服用抗病毒药物治疗疱疹感染之前,请考虑Imlygic治疗的风险和益处。
注射部位并发症
Imlygic治疗期间可能会发生肿瘤组织坏死或溃疡。在临床研究中已经报道了蜂窝组织炎和全身性细菌感染。建议仔细的伤口护理和感染预防措施,特别是如果组织坏死导致开放性伤口时。
在临床研究中,已经报道了注射部位愈合不良。具有潜在危险因素(例如,注射部位先前的放射线或血管形成不良区域的病变)的患者,imlygic可能会增加治愈受损的风险。 Imlygic注射后6个月,由于感染的伤口未愈合,一名患者的下肢被截肢。在Imlygic治疗之前,已通过外科手术和放射线对该伤口区域进行了治疗,并且先前有伤口并发症。
如果持续感染或注射部位愈合延迟,请在继续使用Imlygic治疗之前考虑Imlygic的风险和益处。
免疫介导的事件
精神不振可能导致免疫介导的事件。在临床研究中,Imlygic治疗的患者已报告了免疫介导的事件,包括肾小球肾炎,血管炎,肺炎,牛皮癣恶化和白癜风。
在患有潜在的自身免疫性疾病的患者开始治疗之前或在发生免疫介导的事件的患者继续治疗之前,请考虑Imlygic的风险和益处。
注射部位的浆细胞瘤
在临床研究中,据报导,在患有闷烧性多发性骨髓瘤的患者中施用Imlygic后,在注射部位附近出现浆细胞瘤。
考虑在多发性骨髓瘤或在治疗过程中浆细胞瘤发展的患者中,Imlygic的风险和益处。
阻塞性气道疾病
经Imlygic治疗后有气道阻塞性疾病的报道。在靠近主要气道注射病变时要小心。
6不良反应
在Imlygic治疗的患者中,最常报告的药物不良反应(≥25%)为疲劳,发冷,发热,恶心,流感样疾病和注射部位疼痛。
标签的另一部分将详细讨论以下不良反应:
- 疱疹感染[请参阅警告和注意事项( 5.2 )]
- 注射部位并发症[请参阅警告和注意事项( 5.3 )]
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物的临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
在419名患者中,以开放标签,随机方式接受了至少1剂Imlygic(n = 292)或皮下施用的粒细胞-巨噬细胞集落刺激因子(GM-CSF)(n = 127)的患者,评估了Imlygic的安全性。 IIIB,IIIC和IV期黑色素瘤患者的临床研究被认为不能手术切除[见临床研究( 14 )] 。 Imlygic的中位暴露时间为23周(5.3个月)。 26名患者暴露于Imlygic至少1年。
报告的大多数不良反应为轻度或中度,一般可在72小时内解决。最常见的3级或更高级别的不良反应是蜂窝织炎[请参阅警告和注意事项( 5.3 )] 。
在Imlygic治疗期间,任何时候都可能发生发热,发冷和类似流感的疾病,但在治疗的前3个月中更为频繁。
下表4列出了在临床研究中,与GM-CSF组相比,Imlygic组不良反应的发生率为5%或更高[见临床研究( 14 )] 。
| 意象 ( n = 292) | 通用脑脊液 ( n = 127) | |||
| 不良反应 | 任何等级 n(%) | 3年级 n(%) | 任何等级 n(%) | 3年级 n(%) |
| 一般疾病和给药部位情况 | ||||
| 疲劳 | 147(50.3) | 6(2.1) | 46(36.2) | 1(<1) |
| 寒意 | 142(48.6) | 11(8.7) | ||
| 发热 | 125(42.8) | 11(8.7) | ||
| 流感样疾病 | 89(30.5) | 2(<1) | 19(15.0) | |
| 注射部位疼痛 | 81(27.7) | 2(<1) | 8(6.3) | |
| 胃肠道疾病 | ||||
| 恶心 | 104(35.6) | 1(<1) | 25(19.7) | |
| 呕吐 | 62(21.2) | 5(1.7) | 12(9.5) | |
| 腹泻 | 55(18.8) | 1(<1) | 14(11.0) | |
| 便秘 | 34(11.6) | 8(6.3) | 1(<1) | |
| 腹痛 | 26(8.9) | 2(<1) | 3(2.4) | |
| 肌肉骨骼和结缔组织疾病 | ||||
| 肌痛 | 51(17.5) | 1(<1) | 7(5.5) | |
| 关节痛 | 50(17.1) | 2(<1) | 11(8.7) | |
| 四肢疼痛 | 48(16.4) | 4(1.4) | 12(9.5) | 1(<1) |
| 神经系统疾病 | ||||
| 头痛 | 55(18.8) | 2(<1) | 12(9.5) | |
| 头晕 | 28(9.6) | 4(3.2) | ||
| 呼吸,胸和纵隔疾病 | ||||
| 口咽痛 | 17(5.8) | 1(<1) | ||
| 调查 | ||||
| 体重减轻 | 17(5.8) | 1(<1) | 1(<1) | |
在开放标签,随机研究中与Imlygic相关的其他不良反应包括皮疹,皮炎,肾小球肾炎,白癜风,牛皮癣恶化,蜂窝组织炎,肺炎,血管炎,疱疹性角膜炎,阻塞性气道疾病,注射部位的浆细胞瘤,深静脉血栓形成和口腔疱疹。
7药物相互作用
Imlygic对阿昔洛韦敏感。阿昔洛韦或其他抗疱疹病毒药可能会干扰Imlygic的有效性。尚未使用Imlygic进行药物相互作用研究。
8在特定人群中的使用
怀孕
风险摘要
尚未在孕妇中进行Imlygic的充分且对照良好的研究。在怀孕小鼠中进行的一项研究未观察到对胚胎胎儿发育的影响。研究的设计限制了动物数据在人类中的应用[参见数据]。
在美国普通人群中,临床公认的怀孕中主要先天缺陷和流产的估计背景风险分别为2-4%和15-20%。
临床注意事项
如果患者在服用Imlygic期间怀孕,则应告知患者对胎儿和新生儿的潜在危害。应该建议有生育能力的妇女在Imlygic治疗期间使用有效的避孕方法来预防怀孕。
如果孕妇感染了野生型1型单纯疱疹病毒(HSV-1)(原发或再激活),则该病毒可能会穿过胎盘屏障,并且在分娩时由于病毒脱落而有传播的危险。 。如果胎儿或新生儿感染了野生型疱疹感染,野生型HSV-1感染会引起严重的不良反应,包括多器官衰竭和死亡。尽管迄今为止尚无关于孕妇中伊马氏菌感染的临床数据,但如果伊马氏菌以同样的方式起作用,则可能对胎儿或新生儿产生风险。
数据
动物资料
当在器官形成过程中向免疫能力强的小鼠静脉内施用Imlygic剂量达每公斤4 x 10 8 (4亿)PFU时(与PFU相比,高60倍),未观察到对胚胎胎儿发育的影响最大临床剂量)。合并胎儿血液中的Ilygic DNA水平等于或低于分析检测水平。研究设计的局限性包括:1)施用在小鼠中没有生物活性的表达Imgic的人类粒细胞-巨噬细胞集落刺激因子(huGM-CSF); 2)妊娠小鼠静脉内给药后Imlygic的未知胎盘动力学; 3)基于体重的从动物到人的Imlygic剂量推断的未知意义。
哺乳期
风险摘要
没有关于母乳中Imlygic的存在,对母乳喂养婴儿的影响或对牛奶产量的影响的信息。应当考虑母乳喂养对发育和健康的好处,以及母亲对Imlygic的临床需求以及Imlygic或潜在母体状况对母乳喂养婴儿的任何潜在不良影响。
临床注意事项
由于在人乳中可以发现药品,因此应该决定是停止护理还是在护理期间停止Imlygic。
生殖潜力的男性和女性
没有进行非临床或临床研究来评估Imlygic对生育力的影响。
儿科用
在儿科患者中,Imlygic的安全性和有效性尚未确定。
老人用
在临床研究中,老年患者(≥65岁)和年轻患者之间没有观察到安全性或疗效的总体差异。
肾功能不全
尚未进行临床研究来评估肾功能不全对Imlygic药代动力学的影响。
肝功能不全
尚未进行临床研究来评估肝功能损害对Imlygic药代动力学的影响。
10过量
没有过量使用Imlygic的临床经验。在临床研究中,每2周以每毫升10 8 (1亿)PFU的剂量强度(最大累积剂量为222.5 x 10 8 PFU)最多给药4 mL,没有证据显示剂量限制毒性。尚未确定可以安全使用的Imlygic的最大剂量。如果怀疑过量,应对症治疗,并根据需要采取支持措施[见警告和注意事项( 5 )] 。
11说明
Imlygic(talimogene laherparepvec)是用于病灶内注射的无菌混悬液。 Imlygic是一种活的减毒HSV-1,已通过基因修饰表达huGM-CSF。 Imlygic的亲本病毒是主要的分离株,随后使用重组方法对其进行了改造,导致基因缺失和插入。
每管含有1种毫升Imlygic的交付量在每毫升任一1×10 6(100万)PFU或1×10 8(100元)PFU每毫升的浓度和以下赋形剂:磷酸氢二钠二水合物(15.4毫克) ,二水合磷酸二氢钠(2.44 mg),氯化钠(8.5 mg),肌醇(40 mg),山梨糖醇(20 mg)和注射用水。
每毫升Imlygic小瓶10 6 (100万)PFU含有从冷冻状态融化后的澄清至半透明液体。每毫升Imlygic小瓶10 8 (1亿)PFU含有从冷冻状态融化后的半透明至不透明液体。每个小瓶中的液体可能包含白色,可见,形状各异的含病毒颗粒。
每个小瓶的Imlygic还可能含有VERO细胞的残留成分,包括DNA和蛋白质以及痕量的胎牛血清。
该产品不含防腐剂。
12临床药理学
作用机理
Imlygic已经过基因修饰,可以在肿瘤中复制并产生免疫刺激蛋白GM-CSF。 Imlygic导致肿瘤溶解,然后释放肿瘤来源的抗原,这些抗原与病毒衍生的GM-CSF一起可促进抗肿瘤免疫反应。但是,确切的作用机理尚不清楚。
药代动力学
生物分布(体内)和病毒脱落(排泄/分泌)
使用定量聚合酶链反应(qPCR)分析确定各种组织和分泌物中的合子病毒DNA水平。注射部位和一些潜在的疱疹性病变处的Imgic感染性也使用病毒感染性测定法进行了定量。
非临床数据
在小鼠中重复进行肿瘤内给药后,主要在肿瘤,血液,脾脏,淋巴结,肝脏,心脏和肾脏中检测到了Imlygic DNA。在骨髓,眼睛,泪腺,鼻粘膜或粪便中未检测到合子DNA。在注射的肿瘤中发现了最高水平的Imlygic DNA。在最后一次施用Imlygic后的84天内,在注射的肿瘤中发现了Imlygic DNA,在14天内的血液样品中发现了Imlygic DNA。
临床资料
在一项临床研究中调查了病灶内施用的Imlygic的生物分布和脱落情况,该临床研究测量了血液,尿液,注射部位,闭塞敷料,口腔粘膜,肛门生殖器区域和疑似疱疹性病变中的Imlygic DNA。在治疗期间收集闭塞敷料样品。在治疗过程中以及治疗结束后长达30天的时间采集血液和尿液样本。在治疗过程中以及治疗结束后长达60天的时间内收集注射部位,口腔粘膜和生殖器区域的样品。每当患者经历可疑疱疹起源的病变时,均会收集可疑的疱疹病变样品。如果针对Imlygic DNA的qPCR测试呈阳性,则进行TCID 50分析以测量病毒感染性。在60例黑素瘤谁收到Imlygic内注射的剂量和安排相同临床研究[见临床研究( 14 )],数据表明,Imlygic DNA研究(见表5)中存在于所有的站点。 。
| 体液/部位 | 治疗期间具有可检测DNA的患者(n = 60) |
| 注射部位 | 60(100%) |
| 血液 | 59(98%) |
| 尿 | 19(32%) |
| 注射部位 | 60(100%) |
| 包扎敷料 | 48(80%) |
| 口腔粘膜 | 8(13%) |
| 肛门生殖器区域 | 5(共26个) a |
| a对于肛门生殖器区域,检查了26例患者。 | |
在治疗的第2周期中,血液,尿液,注射部位和闭塞敷料的样本和具有Imlygic DNA的受试者比例最高。口腔粘膜治疗的第一周期最高;生殖器区域的第1和第2周期最高。在治疗结束后30天,血液,尿液,口腔粘膜和肛门生殖器区域可检测到Imlygic DNA的患者中,没有样品可检测到Imlygic DNA。对于注射病变中可检测到DNA的患者,治疗结束后60天没有样品可检测到Imlygic DNA。
在研究期间的任何时间,在19名怀疑患有疱疹起源病变的患者中,共有3名存在Imlygic DNA。在研究期间检测到具有Imlygic DNA的可疑疱疹起源病变的三名受试者中,未向任何可疑病变注射Imlygic。具有可疑的疱疹起源的Imlygic DNA病变的受试者均未扩散病变或接受抗病毒治疗,且这些事件为非严重性,持续16天至4个月。数据表明,Imlygic可能会在治疗的患者中引起疱疹性病变。
除了存在Imlygic DNA之外,还对来自注射部位,闭塞敷料,口腔粘膜,肛门生殖器区域和疑似疱疹性病变的Imlygic DNA呈阳性的样品进行了病毒活性测定。在闭塞敷料,口腔粘膜,生殖器区域和疑似疱疹性病变的样品中未检测到病毒活性。在研究的多个时间点,有7名(11%)的患者在注射部位检测到感染性Imlygic病毒;在第2周期后或治疗结束后,没有样品的病毒感染性呈阳性。
13毒理学
动物毒理学和/或药理学
以每公斤2 x 10 8 (2亿)PFU(建议的最大临床剂量的30倍,根据体重推断)重复进行肿瘤内给药对免疫功能正常的小鼠没有任何不良影响。严重的联合免疫缺陷(SCID)小鼠以最大建议临床剂量的30倍剂量多次重复瘤内注射Imlygic进行全身性病毒感染(胃肠道,肾上腺,皮肤,胰岛胰岛细胞中病毒包涵体或坏死) ,眼睛,松果体和大脑)。
14临床研究
在多中心,开放标签,随机临床研究中,对IIIB,IIIC和IV期黑色素瘤患者(经手术不可切除)评估了皮内注射GM-CSF与皮内注射GM-CSF相比,病灶内注射的安全性和有效性。将Imlygic注射到皮肤,皮下或淋巴结黑色素瘤病变中,而不将其注入内脏病变。允许先前对黑色素瘤的全身治疗。患有活动性脑转移,骨转移,广泛的内脏疾病,原发性眼或粘膜黑色素瘤,免疫抑制证据或接受全身性抗疱疹药治疗的患者均排除在研究范围之外。
该研究包括250名男性(57%)和186名女性(43%)。平均年龄为63岁(范围:22至94)。大多数患者(98%)是白人。百分之七十(70%)的患者东部合作肿瘤学组(ECOG)基线状态为零。 70%(70%)的患者患有IV期疾病(27%M1a; 21%M1b; 22%M1c),30%患有III期疾病。 53%(53%)的患者已接受过黑素瘤的既往治疗(除手术,辅助治疗或放射治疗外或在手术,辅助治疗或放射治疗之外),还有58%的患者在基线时对野生型HSV-1呈血清阳性。
共有436名患者被随机分配接受Imlygic(n = 295)或GM-CSF(n = 141)。在第1天通过病灶内注射以初始浓度10 6 (1百万)PFU / mL施用Imlygic,然后在第21天及其后每2周以一定剂量以10 8 (1亿)PFU / mL的初始浓度给药每次访问最多4毫升。 GM-CSF以28天的周期皮下给药,即每天125 µg / m 2,持续14天,然后连续14天不给予GM-CSF。
患者将接受治疗至少6个月,或者直到没有可注射的病变为止。在此期间,尽管现有病灶增大和/或新病灶发展,治疗仍可继续进行,除非患者出现无法忍受的毒性反应或研究者认为这符合患者的最大利益。停止治疗或接受其他黑色素瘤治疗。在治疗6个月后,患者将继续治疗直至12个月,直到临床相关的疾病进展(即,研究者认为与表现状态下降和/或替代疗法相关的疾病进展)为止。在开始治疗后12个月出现反应的患者可以继续治疗长达6个月,除非没有剩余的可注射病变或疾病进展。随访所有患者的生存状态至少36个月。
主要疗效结果是持久缓解率(DRR),定义为持续至少维持6个月的完全缓解(CR)或部分缓解(PR)的患者百分比。根据修改的世界卫生组织(WHO)响应标准确定肿瘤响应,以使出现新病灶或现有病灶进展的患者继续治疗,并在以后评估肿瘤反应。
在整个研究人群中,Imlygic组的DRR为16.3%,GM-CSF组的DRR为2.1%。未经调整的相对风险为7.6(95%CI:2.4,24.1),p值<0.0001。 Imlygic组的中位反应时间为4.1个月(范围:1.2至16.7)。
Imlygic和GM-CSF组之间的总生存期(OS)没有统计学上的显着差异。在整个研究人群中,Imlygic组的OS中位数为22.9个月,而GM-CSF组的OS为19.0个月(p = 0.116)。
16供应/存储和处理方式
供应方式
- Imlygic以无菌冷冻悬浮液的形式提供在一次性使用的,带有氯丁基弹性体塞子,铝密封和聚丙烯盖的环状烯烃聚合物(COP)塑料树脂小瓶中,有两种不同的显示方式:
|
 |
| 要么 |
|
 |
- 每个样品瓶包含1 mL的最小可回收体积。
- 样品瓶盖用颜色编码:
- 每毫升10 6 (100万)PFU为浅绿色(NDC 55513-078-01)。
- 每毫升10 8 (1亿)PFU为宝蓝色(NDC 55513-079-01)。
- 每毫升10 6 (100万)PFU为浅绿色(NDC 55513-078-01)。
储存和处理
- 在-90°C至-70°C(-130°F至-94°F)下储存和运输Imlygic。
- 保护Imlygic避光。
- 将Imlygic储存在纸箱中,直到使用。
- 服用前立即解冻Imlygic [参见 DOS AG电子和管理 ( 2.2 ) ] 。
- 不要画Imlygic入注射器中,直到前立即给予[见该做什么AG电子和给药方法( 2.2 )]。
17患者咨询信息
建议患者和/或密切联系:
- 阅读FDA批准的患者标签(《用药指南》 )。
- 请按照以下说明预防病毒传播[请参阅警告和注意事项( 5.1 )] :
○避免直接接触患者的注射部位,敷料或体液。
○换药时要戴手套。
○避免触摸或刮擦注射部位。
○每次治疗后至少要在第一周内遮盖注射部位,如果注射部位渗出或渗出,则应保持更长的时间。如果敷料掉落,请更换。
○将用过的敷料和清洁材料放入生活垃圾中,放在密封的塑料袋中。 - 有生育能力的女性患者应使用有效的避孕方法,以在使用Imlygic治疗期间预防怀孕[请参阅禁忌症( 4.2 ) 和在特定人群中的使用( 8.1 )] 。
- 怀孕或免疫力低下的近距离接触者不得更换敷料或清洁注射部位[见警告和注意事项( 5.1 )] 。
- 万一意外暴露于Imlygic,请用肥皂和水和/或消毒剂清洁暴露区域。怀疑患有疱疹感染的患者或密切接触者应联系其医疗保健提供者以评估病变。怀疑带状疱疹病变应通过1-855-Imlygic(1-855-465-9442)报告给Amgen;患者或密切接触者可以选择进行后续检查以进一步鉴定感染[见警告和注意事项( 5.1 )和( 5.2 )] 。
Imlygic®(talimogene laherparepvec)
由制造:
安进公司的子公司BioVex,Inc.
安进中心大道一号
千橡市,加利福尼亚州91320-1799
专利:http://pat.amgen.com/Imlygic/
©2019 Amgen Inc.保留所有权利。
v5
用药指南
Imlygic®(IMM-LY-JIK)
(talimogene laherparepvec)
在开始使用Imlygic治疗之前以及每次Imlygic治疗之前,请阅读《用药指南》。可能有新的信息。 This Medication Guide does not tell you everything about Imlygic. Talk with your healthcare provider if you have any questions about treatment with Imlygic.
What is Imlygic?
Imlygic is a prescription medicine used to treat a type of cancer called melanoma when it is on your skin or in your lymph glands. Imlygic is a weakened form of Herpes Simplex Virus Type 1, which is commonly called the cold sore virus. Your healthcare provider will inject Imlygic directly into your tumor(s).
Imlygic may not help you live longer and may not shrink cancer in your organs (for example, lung or liver).
Who should not get Imlygic?
You should not get Imlygic if you are pregnant or have a weakened immune system (for example, an immune deficiency, blood or bone marrow cancer, steroid use, or HIV/AIDS).
What should I tell my healthcare provider before I get Imlygic?
Before getting Imlygic, tell your healthcare provider if you:
- Are taking steroids or other medicines that suppress your immune system.
- Are taking antiviral medicines to treat or prevent herpes, such as acyclovir.
- Have or ever had medical conditions such as:
○ HIV infection or AIDS.
○ Blood or bone marrow cancer.
○ Autoimmune disease.
○ Other medical conditions that can weaken your immune system. - Have close contact with someone who has a weakened immune system or is pregnant.
- Are pregnant or plan to become pregnant.
○ Imlygic may harm your unborn baby.
○ You should not become pregnant during treatment with Imlygic.
○ Talk to your healthcare provider about effective birth control methods. - 正在母乳喂养或计划母乳喂养。
告诉您的医护人员您服用的所有药物,包括处方药和非处方药,维生素和草药补品。 Imlygic may affect the way other medicines work and other medicines may affect how Imlygic works.
How is Imlygic given?
Your healthcare provider will inject Imlygic directly into your tumor(s) with a needle and syringe. You will get a second treatment 3 weeks after the first treatment. After that, you will get treatments every 2 weeks for as long as you have tumor(s). You can get treated for 6 months or longer.
Your healthcare provider will decide which tumor(s) to inject and may not inject every one.
It is important to care for the treatment sites properly so that Imlygic does not spread to other people. Your healthcare provider will show you how to do this.
What should I avoid while getting Imlygic?
Imlygic virus can spread to other areas of your body or to your close contacts (household members, caregivers, sex partners, or persons sharing the same bed).
Do the following to avoid spreading Imlygic to other areas of your body or to your close contacts:
- Avoid direct contact between your treatment sites, dressings, or body fluids and close contacts (for example, use condoms when engaging in sexual activity, avoid kissing close contacts if either has an open mouth sore).
- Wear gloves while putting on or changing your dressings.
- Keep treatment sites covered with airtight and watertight dressings for at least 1 week after each treatment (or longer if the treatment site is weeping or oozing).
- If the dressing comes loose or falls off, replace it right away with a clean dressing.
- Place all used dressings and cleaning materials in a sealed plastic bag and throw them away in the garbage.
- Do not touch or scratch the treatment sites.
What are possible side effects of Imlygic?
The most common side effects of Imlygic include:
- Tiredness
- 寒意
- 发热
- 恶心
- Flu-like symptoms
- Pain at treatment site
Tell your doctor right away if you get any of these signs and symptoms of herpes infection:
- Pain, burning, or tingling in a blister around the mouth or genitals or on the fingers or ears
- Eye pain, light sensitivity, discharge from the eyes, or blurry vision
- Weakness in arms or legs
- Extreme drowsiness (feeling sleepy)
- Mental confusion
If you think you have a herpes infection, inform your healthcare provider. You or your healthcare provider should call Amgen at 1-855-Imlygic (1-855-465-9442) for follow-up testing if needed.
These are not all the possible side effects of Imlygic. Your healthcare provider can give you more detailed information. Tell your healthcare provider if you have any side effects that bother you or that do not go away.您可以通过1-800-FDA-1088向FDA报告副作用。
What are the ingredients in Imlygic?
Active ingredient: talimogene laherparepvec
Inactive ingredients: di-sodium hydrogen phosphate dihydrate, sodium dihydrogen phosphate dihydrate, sodium chloride, myo-inositol, sorbitol, and water for injection
This Medication Guide summarizes the most important information about Imlygic.如果您需要更多信息,请与您的医疗保健提供者联系。 You can ask your healthcare provider for information about Imlygic that was written for healthcare professionals.
本药物指南已获得美国食品和药物管理局的批准。
Imlygic ® (talimogene laherparepvec)
由制造:
BioVex, Inc., a subsidiary of Amgen Inc.
One Amgen Center Drive
Thousand Oaks, California 91320-1799
Patent: http://pat.amgen.com/Imlygic/
©2017 Amgen Inc. All rights reserved.
Revised:03/2017
v2
Principal Display Panel
10 6 PFU/mL Single Use Vial
NDC 55513-078-01
Amgen ®
他莫替丁
Imlygic ®
10 6 Plaque Forming Units (PFU) per mL
10 6 PFU/mL
For Intralesional Injection Only
Suspension for Injection
No Preservative
Store at -90°C to -70°C (-130°F to -94°F).避光。
See package insert for full prescribing information and instructions for dosage and administration
仅接收

Principal Display Panel
10
已知总共有212种药物与Imlygic(talimogene laherparepvec)相互作用。
- 207种主要药物相互作用
- 5种适度的药物相互作用
检查互动
最常检查的互动
查看Imlygic(talimogene laherparepvec)与以下药物的相互作用报告。
- 阿立普(多奈哌齐)
- Banzel(rufinamide)
- Baraclude(恩替卡韦)
- mb(度洛西汀)
- 地氟康(氟康唑)
- Imbruvica(依鲁替尼)
- 依兰(硫唑嘌呤)
- Isentress(raltegravir)
- Jadenu洒(deferasirox)
- Keytruda(派姆单抗)
- 咪达唑仑
- Natrecor(奈西利肽)
- 波马来斯特(pomalidomide)
- 拉维奇(甘油丁酸甘油酯)
- Sporanox(伊曲康唑)
- Sprycel(达沙替尼)
- 斯替加(regorafenib)
- Stribild(cobicistat / elvitegravir /恩曲他滨/替诺福韦)
- azine嗪(氯丙嗪)
- 替西卡(替比夫定)
- Videx(二danosine)
Imlygic(talimogene laherparepvec)疾病相互作用
与Imlygic(talimogene laherparepvec)有4种疾病相互作用,包括:
- 免疫功能低下
- 免疫缺陷
- 自身免疫性疾病
- 多发性骨髓瘤
药物相互作用分类
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
美国日本医生

Heather Benjamin MD

Heather Benjamin MD

Heather Miske DO

Heather Miske DO

Bert Hepner DO

村上和成 教授

中山秀章 教授

村田朗

溝上裕士 医院教授

山内広平
临床试验
- tnfalpha和白介素2编码溶瘤腺病毒倾斜度倾斜-123在TIL治疗晚期黑色素瘤(Tunintil)期间
- 移植前黑色素瘤(MPG)
- 用64cu-dota-ecl1i成像CCR2受体,头颈部癌
- 新诊断的胶质母细胞瘤患者的Selinexor(KPT-330)与替莫唑胺和放射治疗结合
- 使用EPA防止结直肠癌的预防(准备)
- 对患有晚期恶性肿瘤受试者的牛thotinib的研究
- 研究APG-2575作为单一药物或与其他治疗剂的CLL/SLL相结合
- 在医疗保健索赔中复制声明糖尿病试验
- 一项研究通过与溶瘤蒸发病毒Pelareorep诱导转移性乳腺癌的炎症表型来评估总体反应率的研究
- CD19嵌合抗原受体(CAR)T细胞,用于具有复发或难治性B细胞恶性肿瘤的成年人