获取国外神经元药品价格,使用等信息,最快 24 小时回馈
神经元
什么是神经素?
Neurontin(加巴喷丁)是一种抗癫痫药,也称为抗惊厥药。它会影响与癫痫发作和某些类型的疼痛有关的化学物质和神经。
Neurontin在成人中用于治疗由疱疹病毒或带状疱疹(带状疱疹)引起的神经性疼痛(神经痛)。
Neurontin还用于治疗至少3岁的成人和儿童的癫痫发作。
仅使用您的医生处方的加巴喷丁的品牌和形式。每次获得笔芯时都要检查药物,以确保您收到正确的表格。
重要信息
即使感觉良好,也不要突然停止使用Neurontin。
加巴喷丁可引起危及生命的呼吸问题,尤其是在老年人或患有COPD的人群中。如果呼吸非常缓慢,请寻求紧急医疗救助。
有些人在服用Neurontin时有自杀或行为改变的想法。随时注意情绪或症状的变化。向您的医生报告任何新的或恶化的症状。
除非您知道这种药会如何影响您,否则请避免驾驶或危险活动。头晕或嗜睡会导致跌倒,事故或严重伤害。
在服药之前
如果您对加巴喷丁过敏,则不应使用Neurontin。
为了确保Neurontin对您安全,请告诉您的医生是否曾经:
肺部疾病,例如慢性阻塞性肺疾病(COPD);
肾脏疾病(或正在透析);
糖尿病;
抑郁,情绪低落或自杀的思想或行为;
吸毒
癫痫发作(除非您服用Neurontin治疗癫痫发作);
肝病;
心脏病;要么
(适用于RLS患者),如果您是白天卧铺或夜班。
有些人在服用这种药时有自杀的念头。服用Neurontin的儿童可能会有行为改变。随时注意情绪或症状的变化。向您的医生报告任何新的或恶化的症状。
目前尚不清楚这种药物是否会伤害未出生的婴儿。告诉医生您是否怀孕或计划怀孕。
控制妊娠期间的癫痫发作非常重要,癫痫发作可能会损害母亲和婴儿。未经医生的建议,请勿开始或停止服用Neurontin引起癫痫发作,如果怀孕,请立即告诉医生。
使用这种药物母乳喂养可能并不安全。向您的医生询问任何风险。
我应该如何服用Neurontin?
完全按照医生的处方服用Neurontin。遵循处方标签上的所有指示。不要以更大或更小的量服用该药,也不要服用超过建议的时间。
如果您的医生改变了您的加巴喷丁的品牌,强度或类型,您的剂量需求可能会改变。如果您对在药房收到的新型加巴喷丁有任何疑问,请咨询您的药剂师。
Neurontin可以带或不带食物一起服用。
如果您摔坏了平板电脑而只服用其中一半,则在下次服用时再服用另一半。任何破裂的平板电脑都应尽快或在几天内使用。
吞下整个胶囊或片剂,不要压碎,咀嚼,弄碎或打开它。
仔细测量药水。请使用提供的剂量注射器,或使用药物剂量测量设备(而不是厨房勺子)。
即使感觉良好,也不要突然停止使用Neurontin。突然停止可能会增加癫痫发作。遵循医生关于减少剂量的指示。
万一发生紧急情况,佩戴或携带医疗证明以告知他人您患有癫痫病。
在某些医学检查中,这种药物可能导致异常结果。告诉任何治疗您的医生您正在使用Neurontin。
将Neurontin片剂和胶囊剂在室温下避光避湿。
将药液存放在冰箱中。不要冻结。
神经素剂量信息
通常用于癫痫的成人剂量:
初始剂量:第一天口服300 mg,第二天每天2次口服300 mg,然后第三天每天3次口服300 mg
维持剂量:每天300至600毫克,每日3次
最大剂量:每天3600 mg口服(分3次服用)
-每天3次时间表中的两次给药之间的最长间隔不应超过12小时
评论:
-可以带或不带食物一起服用。
-破损计分片的28天内未使用的半片应丢弃。
用途:辅助疗法用于部分发作和不伴继发性全身性发作的治疗
带状疱疹后神经痛的常规成人剂量:
-初始剂量:第一天口服300 mg,第二天每天2次口服300 mg,然后第三天每天3次口服300 mg
-根据需要滴定以减轻疼痛
-最大剂量:每天1800毫克(每天600毫克,口服3次)
评论:
-可以带或不带食物一起服用。
-破损计分片的28天内未使用的半片应丢弃。
癫痫病的常用儿科剂量:
少于3年:不推荐
大于或等于3且小于12年:
起始剂量:10到15 mg / kg /天,分3剂
有效剂量:在大约3天的时间内通过向上滴定达到; 5岁及以上患者的有效剂量为25至35 mg / kg /天,分次服用(每天3次)。 3岁和4岁小儿患者的有效剂量为40 mg / kg /天,分次服用(每天3次)。加巴喷丁可以胶囊,片剂或这些制剂的组合形式给药。在长期的临床研究中,耐受高达50 mg / kg / day的剂量。两次给药之间的最大时间间隔不应超过12小时。
大于12年:
-初始剂量:第一天口服300 mg,第二天每天2次口服300 mg,然后第三天每天3次口服300 mg
-维持剂量:900到1800毫克,分3剂口服;剂量可以增加到1800毫克/天。在长期临床研究中,耐受高达2400 mg / day的剂量。 3600毫克/天的剂量也已在较短时间内施用于少数患者,并且耐受性良好。一天三度的两次给药之间的最长间隔时间不应超过12小时。
用途:辅助疗法用于治疗3岁及3岁以上的部分发作性癫痫,伴或不伴继发性泛发
如果我错过剂量怎么办?
请尽快服药,但如果快到下一次服药的时间了,请跳过错过的剂量。不要一次服用两剂。
如果我服药过量怎么办?
寻求紧急医疗护理或致电1-800-222-1222,拨打毒药帮助热线。
服用Neurontin时应避免什么?
除非您知道这种药会如何影响您,否则请避免驾驶或危险活动。您的反应可能会受到损害。头晕或嗜睡会导致跌倒,事故或严重伤害。
避免在服用Neurontin之前或之后2小时内服用抗酸药。抗酸剂会使您的身体更难吸收加巴喷丁。
服用Neurontin时避免饮酒。
Neurontin副作用
如果您对Neurontin有过敏反应迹象,请寻求紧急医疗帮助。呼吸困难;脸,嘴唇,舌头或喉咙肿胀。
如果您有严重的药物反应会影响身体的许多部位,请寻求治疗。症状可能包括:皮疹,发烧,腺体肿胀,肌肉疼痛,严重虚弱,不寻常的瘀伤,上腹部疼痛或皮肤或眼睛发黄。
向医生报告任何新的或恶化的症状,例如:情绪或行为改变,焦虑,惊恐发作,睡眠困难,或者如果您感到冲动,烦躁,躁动,敌对,攻击性,躁动,躁动不安,(精神上或身体上)活跃,沮丧,或有自杀或伤害自己的想法。
如果您有以下情况,请立即致电您的医生:
呼吸弱或浅
蓝色的皮肤,嘴唇,手指和脚趾;
混乱,极度嗜睡或虚弱;
平衡或肌肉运动问题;
不寻常或非自愿的眼球运动;要么
癫痫发作增加。
加巴喷丁可能引起致命的呼吸问题。如果您的呼吸缓慢,停顿较长,嘴唇呈蓝色,或者您难以醒来,则照顾您的人应寻求紧急医疗救助。在老年人或患有COPD的人中,呼吸问题更可能发生。
服用Neurontin的儿童更有可能出现某些副作用。如果服用这种药物的孩子有以下任何副作用,请与您的医生联系:
行为改变;
记忆问题;
难以集中精力;要么
表现不安,敌对或好斗。
常见的Neurontin副作用可能包括:
头痛;
头晕,嗜睡,疲倦;
平衡或眼睛移动问题;要么
(儿童)发烧,恶心,呕吐。
这不是副作用的完整列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响Neurontin?
将Neurontin与其他会延缓呼吸的药物一起使用会导致危险的副作用或死亡。在使用阿片类药物,安眠药,感冒药或抗过敏药,肌肉松弛药或抗焦虑药或癫痫药之前,请先咨询医生。
其他药物可能与加巴喷丁相互作用,包括处方药和非处方药,维生素和草药产品。告诉您的医生您目前所有的药物以及您开始或停止使用的任何药物。
版权所有1996-2020 Cerner Multum,Inc.版本:16.01。
注意:本文档包含有关加巴喷丁的副作用信息。此页面上列出的某些剂型可能不适用于品牌名称Neurontin。
综上所述
Neurontin的常见副作用包括:共济失调,头晕,嗜睡,疲劳,发烧,眼球震颤和病毒感染。其他副作用包括:视力模糊,复视,周围水肿,震颤,弱视和口干症。有关不良影响的完整列表,请参见下文。
对于消费者
适用于加巴喷丁:口服胶囊,口服液,口服混悬剂,口服片剂
需要立即就医的副作用
加巴喷丁(神经毒素中的活性成分)及其所需的作用可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用加巴喷丁时,如果有下列任何副作用,请立即咨询医生:
比较普遍;普遍上
- 笨拙或不稳定
- 连续,不受控制,前后或滚动的眼球运动
多见于儿童
- 攻击性行为或其他行为问题
- 焦虑
- 集中问题和学校表现的变化
- 哭了
- 萧条
- 错误的幸福感
- 过度活跃或身体运动增加
- 快速变化的心情
- 反应太快,太情绪化或反应过度
- 躁动
- 可疑或不信任
不常见
- 黑色柏油凳
- 胸痛
- 发冷
- 咳嗽
- 抑郁,烦躁或其他情绪或精神变化
- 发热
- 记忆力减退
- 手臂或腿部疼痛或肿胀
- 排尿困难或困难
- 气促
- 咽喉痛
- 嘴唇或嘴中的疮,溃疡或白斑
- 腺体肿胀
- 异常出血或瘀伤
- 异常疲倦或虚弱
发病率未知
- 腹部或胃痛
- 皮肤起泡,脱皮或松弛
- 黏土色凳子
- 昏迷
- 混乱
- 抽搐
- 黑尿
- 尿量减少
- 腹泻
- 头晕
- 快速或不规则心跳
- 头痛
- 口渴
- 瘙痒或皮疹
- 关节痛
- 面部,眼睑,嘴唇,舌头,喉咙,手,腿,脚或性器官上的大型蜂巢状肿胀
- 食欲不振
- 肌肉疼痛或疼痛
- 恶心
- 皮肤病变为红色,中心常为紫色
- 眼睛发红
- 难闻的呼吸异味
- 吐血
- 眼睛或皮肤发黄
不需要立即就医的副作用
加巴喷丁可能会发生一些副作用,通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 模糊的视野
- 感冒或流感样症状
- 妄想
- 痴呆
- 嘶哑
- 力量不足或丧失
- 下背部或侧面疼痛
- 手,脚或小腿肿胀
- 颤抖或颤抖
少见或罕见
- 误伤
- 食欲增加
- 背疼
- 肿胀或饱满的感觉
- 身体疼痛或疼痛
- 眼睛灼热,干燥或发痒
- 视力改变
- 步行和平衡变化
- 笨拙或不稳定
- 拥塞
- 便秘
- 咳嗽产生粘液
- 性欲或能力下降
- 呼吸困难
- 口腔或喉咙干燥
- 耳痛
- 胃或肠中过量的空气或气体
- 过度流泪
- 眼药水
- 感到头晕,头晕或头晕
- 温暖或热的感觉
- 潮红,皮肤干燥
- 皮肤潮红或发红,尤其是在脸部和颈部
- 尿频
- 水果味的气味
- 视力受损
- 不协调
- 饥饿加剧
- 对疼痛的敏感性增加
- 触摸灵敏度更高
- 口渴
- 消化不良
- 耳朵里有噪音
- 擦去皮肤后的疼痛,发红,皮疹,肿胀或出血
- 通过气体
- 耳朵发红或肿胀
- 发红,疼痛,眼睛,眼睑或眼睑内层肿胀
- 流鼻涕
- 打喷嚏
- 出汗
- 脖子上的腺体肿胀
- 胸闷
- 手脚发麻
- 睡眠困难
- 吞咽麻烦
- 麻烦思考
- 抽搐
- 无法解释的体重减轻
- 声音变化
- 呕吐
- 虚弱或力量丧失
- 体重增加
对于医疗保健专业人员
适用于加巴喷丁:复方散剂,口服胶囊剂,口服溶液剂,口服片剂,缓释口服片剂
心血管的
常见(1%至10%):周围水肿,血管舒张,高血压
罕见(少于0.1%):房颤,心力衰竭,心肌梗塞,脑血管意外,心室前收缩,心动过缓,房性早搏,心包磨擦,心脏传导阻滞,心包积液,心包炎
上市后报告:心脏骤停,胸痛,心慌,心动过速[参考]
皮肤科
常见(1%至10%):磨损,面部浮肿,紫癜,皮疹,瘙痒,痤疮
罕见(0.1%至1%):脱发,湿疹,皮肤干燥,出汗增多,荨麻疹,多毛症,皮脂溢,囊肿,单纯疱疹
罕见(少于0.1%):史蒂文斯-约翰逊综合征,血管性水肿,多形性红斑,皮疹(有嗜酸性粒细胞增多和全身症状),带状疱疹,皮肤变色,皮肤丘疹,光敏性反应,牛皮癣,脱皮,脱皮,浸渍,皮肤结节,皮下结节,黑色素沉着,皮肤坏死,局部肿胀
未报告频率:DRESS /多器官超敏反应[参考]
内分泌
罕见(少于0.1%):甲状腺功能亢进,甲状腺功能减退,甲状腺肿,雌激素过多症,卵巢衰竭,附睾炎,类丘疹样出现[参考]
胃肠道
常见(1%至10%):腹泻,口干或咽干,便秘,恶心,呕吐,消化不良,牙齿异常,牙龈炎,腹痛,肠胃气胀
罕见(0.1%至1%):舌炎,牙龈出血,口渴,口腔炎,流涎增加,肠胃炎,痔疮,血便,粪便失禁
稀有(少于0.1%):胰腺炎,吞咽困难,勃起,胰腺炎,消化性溃疡,结肠炎,口腔水泡,牙齿变色,Perlèche,唾液腺肿大,嘴唇出血,食道炎,食管裂孔疝,呕血,直肠炎,肠易激综合征,直肠出血,食道痉挛
未报告频率:脱水[参考]
一般
与使用这种药物相关的最常见的不良反应是头晕,嗜睡和周围性水肿。 [参考]
泌尿生殖
常见(1%至10%):大小便失禁,阳imp
罕见(0.1%至1%):血尿,排尿困难,尿频,膀胱炎,尿retention留,阴道出血,闭经,痛经,月经过多
未报告频率:乳房肥大,女性乳房发育,性功能障碍(包括性欲改变,射精障碍和性欲减退) [参考]
血液学
常见(1%至10%):白细胞减少症,紫癜
罕见(0.1%至1%):贫血,淋巴结肿大
稀有(小于0.1%):血小板减少症,血小板性静脉炎,白细胞增多,淋巴细胞增多,出血时间增加
未报告频率:血肌酸磷酸激酶升高,凝血功能障碍[参考]
肝的
罕见(少于0.1%):肝炎,黄疸,肝功能检查升高SGOT(AST),SGPT(ALT)和胆红素,肝肿大,肝毒性[参考]
过敏症
非常罕见(少于0.01%):过敏症候群,具有各种表现的全身反应,包括发烧,皮疹,肝炎,淋巴结病,嗜酸性粒细胞增多,有时还包括其他体征和症状[参考]
新陈代谢
常见(1%至10%):体重增加,高血糖
上市后报告:低钠血症[参考]
肌肉骨骼
常见(1%至10%):背痛,关节痛,肌痛,抽搐
罕见(0.1%至1%):肌腱炎,关节炎,关节僵硬,关节肿胀
未报告频率:横纹肌溶解,肌阵挛
上市后报道:肌酸激酶升高,横纹肌溶解[参考]
神经系统
非常常见(10%或更多):嗜睡(21%),头晕(17%),共济失调(13%)
常见(1%至10%):步态异常,不协调,神经痛,震颤,构音障碍,运动亢进,癫痫发作,构音障碍,感觉异常,感觉异常,协调异常,反射增加/减少/缺失,眩晕
罕见(少于1%):运动减退
稀有(小于0.1%):运动障碍(例如,胆脂症,运动障碍,肌张力障碍),意识丧失
未报告频率:停药导致癫痫发作/癫痫持续状态
上市后报告:运动障碍[参考]
眼科
常见(1%至10%):弱视,结膜炎,复视,眼球震颤
罕见(0.1%至1%):白内障,干眼,眼痛,视野缺损,畏光,双侧或单侧上睑下垂,眼出血,大麦芽肿,眼睛抽搐
稀有(小于0.1%):眼睛瘙痒,异常适应,眼睛聚焦问题,水汪汪的眼睛,视网膜病变,青光眼,虹膜炎,角膜疾病,泪功能障碍,眼球退化,失明,视网膜变性,瞳孔缩小,脉络膜视网膜炎,斜视[参考]
肿瘤的
罕见(0.1%至1%):乳腺癌
罕见(小于0.1%):非霍奇金淋巴瘤[Ref]
其他
非常常见(10%或更多):疲劳(11%),发烧(11%)
常见(1%至10%):乏力,意外伤害,中耳炎,震颤,疼痛
稀有(0.01%至0.1%):耳鸣
非常罕见(少于0.01%):癫痫患者突然死亡原因不明
未报告频率:梦游,戒断症状,听力下降,耳痛,耳鸣,内耳感染,中耳炎,味觉下降,异味,耳朵丰满,耳鼓穿孔,对噪音的敏感性,咽鼓管功能障碍,外耳道炎,异味,迷路炎[参考]
精神科
常见(1%至10%):思维异常,健忘,抑郁,敌对,困惑,情绪不稳定,焦虑,神经质,失眠
罕见(0.1%至1%):精神障碍
稀有(小于0.1%):幻觉
未报告频率:自杀行为和观念,轻躁狂[参考]
肾的
罕见(小于0.1%):急性肾衰竭[参考]
呼吸道
常见(1%至10%):咽炎,呼吸困难,咳嗽,支气管炎,呼吸道感染,鼻炎
罕见(少于0.1%):肺血栓形成,肺栓塞
未报告频率:假群体,声音嘶哑[参考]
参考文献
1.“产品信息。神经抑素(加巴喷丁)。”新泽西州莫里斯平原的帕克·戴维斯(Parke-Davis)。
2. Cerner Multum,Inc.“英国产品特性摘要”。 00
3. Cerner Multum,Inc.“澳大利亚产品信息”。 00
4. Sahin S,Comert A,Akin O,Ayalp S,Karsidag S“目前的抗癫痫药突然发作药物:病例报告和替代治疗方法。”临床神经药学杂志31(2008):93-6
5. Gidal BE,Maly MM,Nemire RE和Haley K“体重增加和加巴喷丁治疗”。 Ann Pharmacother 29(1995):1048
6.Lasso-de-la-Vega MC,Zapater P,Such J,Perez-Mateo M,Horga JF“加巴喷丁相关的肝毒性”。美国胃肠病杂志96(2001):3460-2
7. Ragucci MV,Cohen JM“加巴喷丁诱发的超敏反应综合征”。临床神经药学杂志24(2001):103-5
8. Zhang C,Glenn DG,Bell WL,O'donovan CA“加巴喷丁诱发的终末期肾脏疾病中的肌阵挛”。癫痫症46(2005):156-158
9.美国,加巴喷丁研究组5号报告“加巴喷丁作为难治性部分性癫痫的附加疗法:一项双盲,安慰剂对照,平行组研究”。神经病学43(1993):2292-8
10. Pittenger C,Desan PH:“滥用加巴喷丁,撤离加巴喷丁后出现del妄。” J临床精神病学68(2007):483-4
11. Crawford P,Ghadiali E,R巷,Blumhardt L,Chadwick D“加巴喷丁是一种抗癫痫药。 J Neurol Neurosurg Psychiatry 50(1987):682-6
12. Reeves AL,So EL,Sharbrough FW,Krahn LE“与使用加巴喷丁有关的运动障碍”。癫痫症37(1996):988-90
13. Tallian KB,Nahata MC,Lo W,Tsao CY“加巴喷丁与小儿癫痫发作患者的攻击行为有关。”癫痫症37(1996):501-2
14.短C,库克L“加巴喷丁诱发的低躁狂症”。 Br J Psychiatry 166(1995):679-80
15. Silvia RJ,Spitznas AL“加巴喷丁相关的肾功能变化:两个病例报告”。 J临床心理药学杂志27(2007):118-119
某些副作用可能没有报道。您可以将其报告给FDA。
儿科患者年龄3至11岁
起始剂量范围为10毫克/千克/天至15毫克/千克/天,分为三个剂量,建议的维持剂量通过约3天的向上滴定达到。 NEURONTIN在3至4岁患者中的建议维持剂量为40 mg / kg /天,分为三剂。 NEURONTIN在5至11岁患者中的推荐维持剂量为25 mg / kg /天至35 mg / kg /天,分三剂服用。 NEURONTIN可以口服溶液剂,胶囊剂或片剂或这些制剂的组合形式给药。在长期的临床研究中,耐受高达50 mg / kg / day的剂量。两次给药之间的最大时间间隔不应超过12小时。
肾功能不全患者的剂量调整
建议对12岁及12岁以上肾功能不全或接受血液透析的患者进行剂量调整(有关每种适应症的有效剂量,请参见上述剂量建议):
| TID =一天三次; BID =每天两次; QD =单日剂量 | ||||||
| ||||||
| 肾功能肌酐清除率 (毫升/分钟) | 每日总剂量范围 (毫克/天) | 剂量方案 (毫克) | ||||
| ≥60 | 900至3600 | 300 TID | 400 TID | 600 TID | 800 TID | 1200 TID |
| > 30至59 | 400至1400 | 200出价 | 300出价 | 400出价 | 500买入 | 700出价 |
| > 15至29 | 200至700 | 200 QD | 300 QD | 400 QD | 500 QD | 700 QD |
| 15 * | 100至300 | 100 QD | 125 QD | 150 QD | 200 QD | 300 QD |
| 血液透析后补充剂量(毫克)† | ||||||
| 血液透析 | 125† | 150† | 200† | 250† | 350† | |
肌酐清除率(CLCr)在门诊患者中很难测量。对于肾功能稳定的患者,可使用Cockcroft和Gault方程合理地估算肌酐清除率:
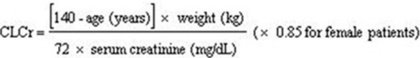
尚未研究在12岁以下肾功能受损的患者中使用NEURONTIN的方法。
老年人用量
由于老年患者更有可能肾功能下降,因此应谨慎选择剂量,并应根据这些患者的肌酐清除率值调整剂量。
行政资讯
含或不含食物的口服NEURONTIN。
NEURONTIN胶囊应用水完全吞咽。
告知患者,如果将计分后的600毫克或800毫克NEURONTIN片剂分开服用半片,则应服用未使用的半片作为下一剂。分片后28天内未使用的半片应丢弃。
如果减少,中断或用替代药物替代NEURONTIN剂量,则应在至少1周内逐步进行(开处方者可以酌情决定更长的时间)。
神经元的适应症和用法
加巴®的适应症为:
- 成人带状疱疹后遗神经痛的治疗
- 在3岁及以上癫痫的成人和儿童患者中,辅助治疗可用于部分发作和不伴继发性泛发
神经素剂量和给药
带状疱疹后神经痛的剂量
对于患有带状疱疹后神经痛的成人,可以在第1天以300 mg单次剂量,第2天以600 mg /天(每天两次300 mg)和第3天以900 mg /天(每天300 mg 3次)开始服用Neurontin。一天)。随后可以根据需要将剂量调整为1800毫克/天(600毫克,一天3次)以减轻疼痛。在临床研究中,在1800 mg /天至3600 mg /天的剂量范围内证明了疗效,并且在整个剂量范围内具有可比的作用。但是,在这些临床研究中,未证明使用大于1800 mg /天的剂量具有额外的益处。
癫痫发作部分发作的剂量
12岁以上的患者
起始剂量为每天三次300毫克。推荐的Neurontin维持剂量为每天300毫克至600毫克,每天三次。长期临床研究中耐受高达2400 mg / day的剂量。 3600毫克/天的剂量也已在较短时间内施用于少数患者,并且耐受性良好。每天三次使用300毫克或400毫克胶囊或600毫克或800毫克片剂服用Neurontin。两次给药之间的最长时间不应超过12小时。
儿科患者年龄3至11岁
起始剂量范围为10毫克/千克/天至15毫克/千克/天,分为三个剂量,建议的维持剂量通过约3天的向上滴定达到。建议的3至4岁患者的Neurontin维持剂量为40 mg / kg /天,分为三个剂量。 5至11岁患者的Neurontin推荐维持剂量为25 mg / kg /天至35 mg / kg /天,分三剂服用。 Neurontin可以口服溶液,胶囊或片剂形式使用,也可以组合使用这些制剂。在长期的临床研究中,耐受高达50 mg / kg / day的剂量。两次给药之间的最大时间间隔不应超过12小时。
肾功能不全患者的剂量调整
建议对12岁及12岁以上肾功能不全或接受血液透析的患者进行剂量调整(有关每种适应症的有效剂量,请参见上述剂量建议):
| TID =一天三次; BID =每天两次; QD =单日剂量 | ||||||
| ||||||
| 肾功能肌酐清除率 (毫升/分钟) | 每日总剂量范围 (毫克/天) | 剂量方案 (毫克) | ||||
| ≥60 | 900至3600 | 300 TID | 400 TID | 600 TID | 800 TID | 1200 TID |
| > 30至59 | 400至1400 | 200出价 | 300出价 | 400出价 | 500买入 | 700出价 |
| > 15至29 | 200至700 | 200 QD | 300 QD | 400 QD | 500 QD | 700 QD |
| 15 * | 100至300 | 100 QD | 125 QD | 150 QD | 200 QD | 300 QD |
| 血液透析后补充剂量(毫克) † | ||||||
| 血液透析 | 125 † | 150 † | 200 † | 250 † | 350 † | |
肌酐清除率(CLCr)在门诊患者中很难测量。对于肾功能稳定的患者,可使用Cockcroft和Gault方程合理地估算肌酐清除率:

尚未研究在12岁以下肾功能受损的患者中使用Neurontin的方法。
老年人用量
由于老年患者更有可能肾功能下降,因此应谨慎选择剂量,并应根据这些患者的肌酐清除率值调整剂量。
行政资讯
进食或不进食可口服Neurontin。
Neurontin胶囊应与水一起吞下。
告知患者,如果将计分的600毫克或800毫克Neurontin片剂分开服用半片,则应服用未使用的半片作为下一剂。分片后28天内未使用的半片应丢弃。
如果减少,中止或用替代药物替代Neurontin剂量,则应在至少1周内逐步进行(开处方者可以酌情决定更长的时间)。
剂型和优势
胶囊
- 100 mg:白色硬明胶胶囊,身体上印有“ PD”,瓶盖上印有“ Neurontin / 100 mg”
- 300毫克:黄色硬明胶胶囊,身体上印有“ PD”,瓶盖上印有“ Neurontin / 300 mg”
- 400毫克:橙色硬质明胶胶囊,身体上印有“ PD”,瓶盖上印有“ Neurontin / 400 mg”
平板电脑
- 600毫克:白色椭圆膜衣刻痕片,一侧刻有“ NT”和“ 16”
- 800毫克:白色椭圆膜包衣的刻痕片,一侧刻有“ NT”和“ 26”
口服液
- 每5毫升250毫克(每毫升50毫克),透明无色至微黄色溶液
禁忌症
已证明对药物或其成分过敏的患者禁用神经痛素。
警告和注意事项
嗜酸性粒细胞增多和全身症状(DRESS)/多器官超敏反应的药物反应
Neurontin引起了与嗜酸性粒细胞增多和全身症状(DRESS)的药物反应,也称为多器官超敏反应。其中一些反应是致命的或威胁生命的。 DRESS通常(尽管不是唯一)表现为发烧,皮疹和/或淋巴结病,并伴有其他器官系统受累,例如肝炎,肾炎,血液学异常,心肌炎或有时类似于急性病毒感染的肌炎。嗜酸性粒细胞增多症经常存在。该疾病的表达是可变的,可能涉及此处未提及的其他器官系统。
重要的是要注意,即使皮疹不明显,也可能出现过敏的早期表现,例如发烧或淋巴结肿大。如果出现此类征兆或症状,应立即对患者进行评估。如果无法确定其他迹象或症状的病因,则应停用Neurontin。
过敏反应和血管性水肿
在首次给药后或治疗期间的任何时间,神经元素都会引起过敏反应和血管性水肿。报告病例的体征和症状包括呼吸困难,嘴唇,喉咙和舌头肿胀以及需要紧急治疗的低血压。如果患者出现过敏反应或血管性水肿的体征或症状,应指导患者停用Neurontin并立即就医。
对驾驶和操作重型机械的影响
服用Neurontin的患者在获得足够的经验以评估Neurontin是否会损害其驾驶能力之前,不应开车。使用加巴喷丁的前药(加巴喷丁enacarbil片,延长释放)进行的驾驶性能研究表明,加巴喷丁可能会导致严重的驾驶障碍。处方者和患者应意识到,患者评估自己的驾驶能力的能力以及评估由Neurontin引起的嗜睡程度的能力可能是不完善的。开始使用Neurontin治疗后驾驶障碍的持续时间未知。损害是否与嗜睡[见警告和注意事项(5.4) ]或神经抑素的其他作用有关尚不清楚。
此外,由于Neurontin会引起嗜睡和头晕[请参阅警告和注意事项(5.4) ] ,因此,建议患者在获得足够的Neurontin经验以评估Neurontin是否削弱其执行此类任务的能力之前,不要操作复杂的器械。
嗜睡/镇静和头晕
在接受每天高达1800 mg剂量Neurontin的12岁以上患者的对照癫痫试验中,据报道,与安慰剂相比,Neurontin患者的嗜睡,头昏和共济失调发生率更高:即,药物治疗组和安慰剂治疗组分别为19%安慰剂用于失眠的患者占9%,药物占17%,晕眩占安慰剂的7%,共济失调,药物占13%,安慰剂占6%。在这些试验中,嗜睡,共济失调和疲劳是导致12岁以上患者停用Neurontin的常见不良反应,其中这些事件的停用分别为1.2%,0.8%和0.6%。
在接受带状疱疹后神经痛患者的对照试验中,据报道,接受神经痛肽治疗的患者每天嗜睡和头晕的发生率均高于安慰剂,最高剂量为3600 mg:即,接受神经痛肽治疗的患者为21%,而剂量为5安慰剂治疗的患者中有90%的人有嗜睡感,而神经元素治疗的患者中有28%的人晕眩,而安慰剂治疗的患者中有8%的头晕。头晕和嗜睡是导致Neurontin停用的最常见不良反应。
当Neurontin与其他具有镇静作用的药物一起使用时,由于潜在的协同作用,应仔细观察患者的中枢神经系统(CNS)抑郁症迹象,例如嗜睡和镇静作用。此外,需要同时使用吗啡治疗的患者,加巴喷丁的浓度可能会升高,并且可能需要调整剂量[见药物相互作用(7.2) ] 。
退出突然发作,癫痫持续状态
抗癫痫药不应突然停药,因为可能会增加癫痫发作的频率。
在大于12岁的患者进行的安慰剂对照癫痫研究中,接受Neurontin的患者发生癫痫持续状态的发生率为0.6%(543例中的3例),而接受安慰剂的患者为5%(378例中的2例)。在所有癫痫研究(对照和非对照)中,使用Neurontin治疗的2074位年龄> 12岁的患者中,有31位(1.5%)患有癫痫持续状态。其中,有14例患者在治疗前或使用其他药物时没有癫痫持续状态病史。由于没有足够的历史数据,因此无法说与未使用Neurontin治疗的类似人群相比,使用Neurontin治疗是否与癫痫持续状态发生率更高或更低有关。
自杀行为和观念
包括Neurontin在内的抗癫痫药(AED)会增加服用这些药物用于任何适应症的患者发生自杀念头或行为的风险。应监测接受任何AED治疗的任何适应症患者的抑郁症,自杀念头或行为和/或情绪或行为的任何异常变化的出现或恶化。
对199种安慰剂对照的11种不同AED的临床试验(单一疗法和辅助疗法)的汇总分析显示,随机分配到其中一种AED的患者发生自杀的风险约为两倍(调整后相对风险1.8,95%CI:1.2,2.7)。与随机接受安慰剂的患者相比。在这些中位治疗时间为12周的试验中,在27,863例接受AED治疗的患者中,自杀行为或意念的估计发生率为0.43%,相比之下,在1,029例接受安慰剂治疗的患者中,自杀行为或意念的发生率为0.24%,增加了约一倍。每530名接受治疗的患者有自杀念头或行为。在试验中,接受药物治疗的患者中有四种自杀,而在接受安慰剂治疗的患者中没有自杀,但是数量太少,无法得出有关药物对自杀影响的任何结论。
最早在开始使用AED进行药物治疗后一周,就观察到AED产生自杀念头或行为的风险增加,并且一直持续到所评估的治疗期间。因为分析中包括的大多数试验都没有超过24周,所以无法评估24周后有自杀念头或行为的风险。
在所分析的数据中,自杀想法或行为的风险在药物之间通常是一致的。发现不同作用机制的AED和跨一系列适应症增加的风险提示,该风险适用于任何适应症的所有AED。在所分析的临床试验中,该风险在年龄(5-100岁)之间没有显着差异。表2通过指示显示了所有评估的AED的绝对和相对风险。
| 适应症 | 安慰剂患者,每1000名患者发生事件 | 每1000名患者发生事件的药物患者 | 相对风险:药物患者事件的发生率/安慰剂患者的发生率 | 风险差异:每1,000名患者中发生事件的新增药物患者 |
|---|---|---|---|---|
| 癫痫 | 1.0 | 3.4 | 3.5 | 2.4 |
| 精神科 | 5.7 | 8.5 | 1.5 | 2.9 |
| 其他 | 1.0 | 1.8 | 1.9 | 0.9 |
| 总 | 2.4 | 4.3 | 1.8 | 1.9 |
在癫痫症的临床试验中,自杀想法或行为的相对风险高于在精神病或其他疾病的临床试验中,但对于癫痫症和精神病指征,绝对风险差异相似。
任何考虑开处方Neurontin或任何其他AED的人都必须在自杀念头或行为的风险与未经治疗的疾病的风险之间取得平衡。开具AED的癫痫病和许多其他疾病本身与发病率和死亡率以及自杀念头和行为的风险增加有关。如果在治疗期间出现自杀念头和行为,则处方者需要考虑在任何给定患者中这些症状的出现是否与所治疗的疾病有关。
应告知患者,其护理人员和家属,AED会增加自杀念头和行为的风险,并应告知需要警惕抑郁症的迹象和症状的出现或恶化,情绪或行为的任何异常变化,或自杀念头,行为或关于自我伤害的念头的出现。关注的行为应立即报告给医疗保健提供者。
呼吸抑制
从病例报告,人体研究和动物研究中可以看出,加巴喷丁与中枢神经系统抑制剂(包括阿片类药物)合用时或在潜在的呼吸功能障碍时,会伴有严重,威胁生命或致命的呼吸抑制。当决定将Neurontin与另一种CNS抑制剂(尤其是阿片类药物)共同开处方,或将Neurontin开给有潜在呼吸障碍的患者开处方时,请监测患者的呼吸抑制和镇静症状,并考虑以低剂量开始使用Neurontin。呼吸抑制的管理可能包括严密观察,支持措施以及中枢神经系统抑制剂(包括神经抑素)的减少或停用。
神经精神病学不良反应(3至12岁的小儿患者)
加巴喷丁在3至12岁的小儿癫痫患者中的使用与中枢神经系统相关的不良反应的发生有关。其中最重要的几类可分为以下几类:1)情绪不稳(主要是行为问题),2)敌对行为,包括攻击性行为,3)思维障碍,包括注意力不集中和学校成绩的变化,以及4)运动过度(主要是躁动和多动)。在加巴喷丁治疗的患者中,大多数反应的强度为轻度至中度。
在3至12岁小儿患者的对照临床癫痫试验中,这些不良反应的发生率是:情绪不稳6%(加巴喷丁治疗的患者)对1.3%(安慰剂治疗的患者);敌意为5.2%和1.3%;运动亢进4.7%对2.9%;和思想障碍1.7%对0%。其中一种反应是敌意的报道,被认为是严重的。加巴喷丁治疗中断的患者中有1.3%的患者报告有情绪不稳和运动亢进,而0.9%的加巴喷丁治疗的患者中有敌意和思想障碍。一名接受安慰剂治疗的患者(0.4%)由于情绪不稳而退出。
致瘤潜力
在一项口服致癌性研究中,加巴喷丁增加了大鼠胰腺腺泡细胞肿瘤的发生率[见非临床毒理学(13.1) ] 。这一发现的临床意义尚不清楚。加巴喷丁上市前的发展过程中的临床经验没有提供直接的方法来评估其在人体内诱发肿瘤的潜力。
在癫痫辅助治疗的临床研究中,> 12岁的患者中有2,085病人-年的暴露,据报道有10名患者出现新肿瘤(2例乳腺癌,3例脑,2例肺,1例肾上腺,1例非霍奇金淋巴瘤,1例)。原位子宫内膜癌),和预先存在的肿瘤中或长达2年以下加巴停药11例(9脑,乳腺1,前列腺1)恶化。如果不了解在未使用Neurontin治疗的相似人群中的背景发病率和复发情况,就不可能知道该队列中的发病率是否受到治疗的影响。
癫痫患者猝死原因不明
在Neurontin的上市前开发过程中,记录了2203名用Neurontin治疗的癫痫患者(2103患者-暴露年)中的8例突然和无法解释的死亡。
其中一些可能代表与癫痫发作有关的死亡,其中未观察到癫痫发作,例如在晚上。这表示每患者年0.0038例死亡。尽管该比率超出了按年龄和性别匹配的健康人群的预期比率,但仍在未接受Neurontin的癫痫患者突然无法解释的猝死发生率的估计范围之内(从癫痫普通人群的0.0005到癫痫患者的0.003)。与Neurontin计划相似的临床试验人群,对于难治性癫痫患者为0.005)。因此,这些数字是否令人放心还是需要进一步关注,取决于报告给Neurontin队列的人群的可比性以及所提供估计的准确性。
不良反应
其他部分将详细讨论以下严重不良反应:
- 嗜酸性粒细胞增多和全身症状(DRESS)/多器官超敏反应的药物反应[请参阅警告和注意事项(5.1) ]
- 过敏反应和血管性水肿[请参阅警告和注意事项(5.2) ]
- 嗜睡/镇静和头晕[请参阅警告和注意事项(5.4) ]
- 退出突然发作,癫痫持续状态[请参阅警告和注意事项(5.5) ]
- 自杀行为和想法[请参阅警告和注意事项(5.6) ]
- 呼吸抑制[请参阅警告和注意事项(5.7) ]
- 神经精神病学不良反应(3至12岁的儿童患者) [请参阅警告和注意事项(5.8) ]
- 癫痫患者猝死原因不明[请参阅警告和注意事项(5.10) ]
临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
带状疱疹后神经痛
在成年人中,使用神经调节素最常见的不良反应是头晕,嗜睡和周围水肿,在安慰剂治疗的患者中未见到。
在带状疱疹后神经痛的2项对照试验中,由于不良反应,接受Neurontin的336名患者中有16%接受安慰剂的227名患者中有9%终止治疗。在用Neurontin治疗的患者中,最经常导致戒断的不良反应是头晕,嗜睡和恶心。
表3列出了在至少1%接受安慰剂对照试验的接受Neurontin治疗的带疱疹后神经痛的患者中发生的不良反应,在数值上,Neurontin组的发生率高于安慰剂组。
| 神经元 N = 336 % | 安慰剂 N = 227 % | |
|---|---|---|
| ||
| 身体整体 | ||
| 虚弱 | 6 | 5 |
| 感染 | 5 | 4 |
| 误伤 | 3 | 1个 |
| 消化系统 | ||
| 腹泻 | 6 | 3 |
| 口干 | 5 | 1个 |
| 便秘 | 4 | 2 |
| 恶心 | 4 | 3 |
| 呕吐 | 3 | 2 |
| 代谢和营养失调 | ||
| 周围水肿 | 8 | 2 |
| 体重增加 | 2 | 0 |
| 高血糖症 | 1个 | 0 |
| 神经系统 | ||
| 头晕 | 28 | 8 |
| 嗜睡 | 21 | 5 |
| 共济失调 | 3 | 0 |
| 思维异常 | 3 | 0 |
| 步态异常 | 2 | 0 |
| 不协调 | 2 | 0 |
| 呼吸系统 | ||
| 咽炎 | 1个 | 0 |
| 特殊感官 | ||
| 弱视* | 3 | 1个 |
| 结膜炎 | 1个 | 0 |
| 复视 | 1个 | 0 |
| 中耳炎 | 1个 | 0 |
在超过1%的患者中,但在安慰剂组中,其他反应同样或更频繁,包括疼痛,震颤,神经痛,背痛,消化不良,呼吸困难和流感综合征。
男女在不良反应的类型和发生率方面没有临床上的重要差异。由于很少有人报告种族是白人以外的种族,因此没有足够的数据支持关于种族不良反应分布的陈述。
癫痫伴部分发作(辅助治疗)
在大于12岁的患者中,使用Neurontin联合其他抗癫痫药最常见的不良反应是嗜睡,头晕,共济失调,疲劳和眼球震颤,在安慰剂治疗的患者中未见到。
在安慰剂治疗的患者中,Neurontin联合其他抗癫痫药物在3至12岁的儿童患者中最常见的不良反应是病毒感染,发烧,恶心和/或呕吐,嗜睡和敌对行为[见警告和注意事项(5.8) ] 。
在上市前临床试验中接受Neurontin的2074名12岁以上患者中,约7%和449名3至12岁的儿科患者中,约有7%因不良反应而中止治疗。在12岁以上的患者中最常与戒断相关的不良反应是嗜睡(1.2%),共济失调(0.8%),疲劳(0.6%),恶心和/或呕吐(0.6%)和头晕(0.6%) 。小儿患者最常与戒断相关的不良反应是情绪不稳(1.6%),敌意(1.3%)和运动亢进(1.1%)。
表4列出了在至少12%的接受Neurontin治疗的癫痫患者中发生的不良反应,这些患者参加了安慰剂对照试验,在数字上更常见于Neurontin组,发生于12岁以上。在这些研究中,将Neurontin或安慰剂添加到患者当前的抗癫痫药物治疗中。
| 神经元* N = 543 % | 安慰剂* N = 378 % | |
|---|---|---|
| ||
| 身体整体 | ||
| 疲劳 | 11 | 5 |
| 体重增加 | 3 | 2 |
| 背疼 | 2 | 1个 |
| 周围水肿 | 2 | 1个 |
| 心血管的 | ||
| 血管扩张 | 1个 | 0 |
| 消化系统 | ||
| 消化不良 | 2 | 1个 |
| 口干或咽干 | 2 | 1个 |
| 便秘 | 2 | 1个 |
| 牙齿异常 | 2 | 0 |
| 神经系统 | ||
| 嗜睡 | 19 | 9 |
| 头晕 | 17 | 7 |
| 共济失调 | 13 | 6 |
| 眼球震颤 | 8 | 4 |
| 震颤 | 7 | 3 |
| 构音障碍 | 2 | 1个 |
| 健忘症 | 2 | 0 |
| 萧条 | 2 | 1个 |
| 思维异常 | 2 | 1个 |
| 异常协调 | 1个 | 0 |
| 呼吸系统 | ||
| 咽炎 | 3 | 2 |
| 咳嗽 | 2 | 1个 |
| 皮肤和附属物 | ||
| 磨损 | 1个 | 0 |
| 泌尿生殖系统 | ||
| 阳 | 2 | 1个 |
| 特殊感官 | ||
| 复视 | 6 | 2 |
| 弱视† | 4 | 1个 |
在用Neurontin治疗的患者中发生的不良反应的发生率至少为10%,嗜睡和共济失调似乎表现出积极的剂量反应关系。
在用Neurontin治疗的男性和女性中,不良反应的总体发生率和不良反应的类型相似。在用Neurontin或安慰剂治疗的患者中,不良反应的发生率随年龄的增长而略有增加。由于在安慰剂对照研究中只有3%的患者(28/921)被确定为非白人(黑人或其他),因此没有足够的数据支持有关种族不良反应分布的陈述。
表5列出了在至少2%接受Neurontin治疗的患者中发生的不良反应,年龄在3至12岁之间,患有癫痫症的患者参加了安慰剂对照试验,并且在数字上在Neurontin组中更为常见。
| 神经元* N = 119 % | 安慰剂* N = 128 % | |
|---|---|---|
| ||
| 身体整体 | ||
| 病毒感染 | 11 | 3 |
| 发热 | 10 | 3 |
| 体重增加 | 3 | 1个 |
| 疲劳 | 3 | 2 |
| 消化系统 | ||
| 恶心和/或呕吐 | 8 | 7 |
| 神经系统 | ||
| 嗜睡 | 8 | 5 |
| 敌意 | 8 | 2 |
| 情绪不稳定 | 4 | 2 |
| 头晕 | 3 | 2 |
| 运动亢进 | 3 | 1个 |
| 呼吸系统 | ||
| 支气管炎 | 3 | 1个 |
| 呼吸道感染 | 3 | 1个 |
超过2%的3至12岁小儿患者但在安慰剂组中发生的其他反应相同或更频繁,包括:咽炎,上呼吸道感染,头痛,鼻炎,抽搐,腹泻,厌食,咳嗽和中耳炎。
上市后经验
在上市后使用Neurontin的过程中,已经确认了以下不良反应。由于这些反应是从不确定大小的人群中自愿报告的,因此并非总是能够可靠地估计其发生频率或建立与药物暴露的因果关系。
肝胆疾病:黄疸
研究:肌酸激酶升高,肝功能检查升高
代谢和营养失调:低钠血症
肌肉骨骼和结缔组织疾病:横纹肌溶解
神经系统疾病:运动障碍
精神疾病:躁动
生殖系统和乳房疾病:乳房增大,性欲变化,射精障碍和性欲减退
皮肤和皮下组织疾病:血管性水肿[参见警告和注意事项(5.2) ] ,大疱性天疱疮,多形性红斑,史蒂文斯-约翰逊综合征。
上市后有报道称服用神经毒蛋白联合阿片类药物或其他中枢神经系统抑制剂或处于潜在的呼吸功能障碍的患者会危及生命或致命的呼吸抑制[见警告和注意事项(5.7) ] 。
加巴喷丁突然停药后也有不良反应。最常报告的反应是焦虑,失眠,恶心,疼痛和出汗。
药物相互作用
其他抗癫痫药
加巴喷丁没有明显的代谢,也不会干扰常用的抗癫痫药的代谢[见临床药理学(12.3) ] 。
阿片类药物
氢可酮
Neurontin与氢可酮的共同给药可降低氢可酮的暴露[见临床药理学(12.3) ]。当服用氢可酮的患者开始或停止使用Neurontin时,应考虑氢可酮暴露和效果改变的可能性。
吗啡
加巴喷丁与吗啡合用时,应观察患者中枢神经系统抑制的征兆,例如嗜睡,镇静和呼吸抑制[见临床药理学(12.3) ] 。
Maalox®(氢氧化铝,氢氧化镁)
加巴喷丁的平均生物利用度降低约20%,同时使用含有镁和铝的氢氧化物抗酸剂(抗酸药®)的。建议在服用Maalox后至少2小时服用加巴喷丁[见临床药理学(12.3) ] 。
药物/实验室测试的相互作用
因为假阳性读数的报道与埃姆斯的N- MULTISTIX SG®为加巴喷丁时,加入到其它抗癫痫药物尿蛋白试纸测试,推荐的更具体的磺基水杨酸沉淀过程来确定尿蛋白的存在。
在特定人群中的使用
怀孕
怀孕暴露登记
有一个怀孕暴露注册表可以监视怀孕期间接触抗癫痫药物(AED)(例如Neurontin)的妇女的怀孕结局。通过拨打免费电话1-888-233-2334或访问http://www.aedpregnancyregistry.org/,鼓励怀孕期间服用Neurontin的妇女加入北美抗癫痫药物(NAAED)怀孕登记系统。
风险摘要
没有足够的数据说明与孕妇使用Neurontin有关的发育风险。在小鼠,大鼠和兔子的非临床研究中,当加巴喷丁以与临床使用的剂量相同或更低的剂量给药于妊娠动物时,具有发育毒性(胎儿骨骼和内脏异常增加,胚胎胎儿死亡率增加) [见数据]。
在美国普通人群中,临床公认的怀孕中主要先天缺陷和流产的估计背景风险分别为2%至4%和15%至20%。对于所指出的人群,主要出生缺陷和流产的背景风险尚不清楚。
数据
动物资料
当怀孕的小鼠在器官发生期间接受加巴喷丁的口服剂量(500、1000或3000 mg / kg /天)时,在两个最高剂量下观察到胚胎胎儿毒性(骨骼变异发生率增加)。小鼠胚胎胎儿发育毒性的无效剂量(500 mg / kg /天)小于人体表面积(mg / m 2 )的最大推荐人剂量(MRHD)3600 mg。
在大鼠在怀孕期间口服加巴喷丁(500至2000 mg / kg /天)的研究中,在所有剂量下均观察到对后代发育的不利影响(输尿管和/或肾积水的发生率增加)。以mg / m 2为基础,所测试的最低剂量类似于MRHD。
当怀孕的兔子在器官发生期间接受加巴喷丁治疗后,在所有测试剂量(60、300或1500 mg / kg)下,观察到的胚胎胎儿死亡率均增加。以mg / m 2为基础,测试的最低剂量小于MRHD。
在一项发表的研究中,加巴喷丁(400 mg / kg /天)在出生后的第一个星期(即啮齿动物的突触形成时期)(对应于人类妊娠的最后三个月)通过腹膜内注射给予新生小鼠。加巴喷丁引起完整小鼠大脑中神经元突触形成的明显减少,以及在突触修复小鼠模型中异常的神经元突触形成。加巴喷丁已显示出在体外干扰电压激活钙通道(参与神经元突触形成的受体)的α2δ亚基的活性。这些发现的临床意义尚不清楚。
哺乳期
风险摘要
加巴喷丁口服后分泌在人乳中。对母乳喂养婴儿和产奶量的影响尚不清楚。应当考虑母乳喂养的发育和健康益处,以及母亲对Neurontin的临床需求以及Neurontin或潜在母体疾病对母乳喂养婴儿的任何潜在不利影响。
儿科用
尚未确定Neurontin在儿科患者带状疱疹后神经痛治疗中的安全性和有效性。
尚未确定在3岁以下的小儿部分发作中作为辅助疗法的安全性和有效性[见临床研究(14.2) ] 。
老人用
在带状疱疹后神经痛患者的对照临床试验中,用Neurontin治疗的患者总数为336,其中102(30%)位为65-74岁,168(50%)位为75岁及以上。与接受相同剂量的年轻患者相比,在75岁及以上的患者中有更大的治疗效果。由于加巴喷丁几乎完全被肾脏排泄所消除,因此在≥75岁的患者中观察到更大的治疗效果可能是由于给定剂量的加巴喷丁暴露量增加而导致的,这是由年龄相关的肾功能下降引起的。但是,不能排除其他因素。各个年龄段的不良反应类型和发生率相似,除了周围水肿和共济失调(随着年龄的增长,发生率趋于增加)。
Neurontin在癫痫症中的临床研究没有包括足够多的65岁及以上的受试者,以确定他们对年轻受试者的反应是否不同。其他报告的临床经验尚未发现老年患者和年轻患者在反应方面的差异。一般而言,老年患者的剂量选择应谨慎,通常从给药范围的低端开始,这反映出肝,肾或心脏功能下降以及伴随疾病或其他药物治疗的频率更高。
已知该药物基本上被肾脏排泄,并且在肾功能受损的患者中对该药物产生毒性反应的风险可能更大。由于老年患者更容易出现肾功能下降,因此应谨慎选择剂量,并应根据这些患者的肌酐清除率值调整剂量[见剂量和给药方法(2.4) ,不良反应(6)和临床[药理学(12.3) ] 。
肾功能不全
在肾功能不全的成年患者中必须调整剂量[见剂量和给药方法(2.3)和临床药理学(12.3) ] 。尚未对有肾功能不全的小儿患者进行研究。
进行血液透析的患者需要调整剂量[参见剂量和用法(2.3)和临床药理学(12.3) ] 。
药物滥用和依赖性
受控物质
加巴喷丁不是预定的药物。
滥用
加巴喷丁对苯二氮卓,阿片(μ,δ或kappa)或大麻素1受体位点没有亲和力。少数上市后案例报告了加巴喷丁滥用和滥用。这些人服用未经批准的加巴喷丁剂量要高于建议剂量。这些报告中描述的大多数人都有多物质滥用史,或曾使用加巴喷丁缓解从其他物质中撤药的症状。处方加巴喷丁时,应仔细评估患者的药物滥用史,并观察他们是否滥用或滥用加巴喷丁的体征和症状(例如,耐受性的发展,自我剂量的升高和寻求药物的行为)。
依存关系
很少有上市后的报告,称个体在停用高于建议剂量的加巴喷丁(用于治疗未获批准的疾病)后不久出现戒断症状。这些症状包括突然停药加巴喷丁后出现的激动,迷失方向和困惑,重新开始加巴喷丁后即消失。这些人中的大多数都有多物质滥用史或曾用加巴喷丁缓解从其他物质中撤出的症状。加巴喷丁的依赖性和滥用潜力尚未在人体研究中进行评估。
过量
动物的急性毒性迹象包括共济失调,呼吸困难,上睑下垂,镇静,机能减退或兴奋。
急性口服过量的神经毒素已有报道。症状包括双眼视力,震颤,言语不清,嗜睡,精神状态改变,头晕,嗜睡和腹泻。已有报道称过量使用Neurontin会导致致命的呼吸抑制,单独或与其他CNS抑制剂联用。
加巴喷丁可以通过血液透析去除。
如果发生过度暴露,请致电1-800-222-1222与您的毒物控制中心联系。
神经素描述
Neurontin胶囊,片剂和口服溶液中的有效成分是加巴喷丁,其化学名称为1-(氨基甲基)环己烷乙酸。
加巴喷丁的分子式为C 9 H 17 NO 2 ,分子量为171.24。加巴喷丁的结构式为:

加巴喷丁是白色至类白色结晶固体,pK a1为3.7,pK a2为10.7。它可自由溶于水以及碱性和酸性水溶液。 pH 7.4时分配系数(正辛醇/0.05M磷酸盐缓冲液)的对数为–1.25。
每个Neurontin胶囊均含有100 mg,300 mg或400 mg加巴喷丁和以下非活性成分:乳糖,玉米淀粉,滑石粉,明胶,二氧化钛,FD&C蓝色2号,黄色氧化铁(仅300 mg和400 mg),和红色氧化铁(仅400毫克)。
每个Neurontin片剂包含600 mg或800 mg加巴喷丁和以下非活性成分:泊洛沙姆407,共聚维酮,玉米淀粉,硬脂酸镁,羟丙基纤维素,滑石粉和小烛树蜡
Neurontin口服溶液每5毫升中含有250毫克的加巴喷丁(每毫升50毫克)和以下非活性成分:甘油,木糖醇,纯净水和人工凉爽的草莓茴香味。
Neurontin-临床药理学
作用机理
加巴喷丁产生镇痛和抗癫痫作用的确切机制尚不清楚。加巴喷丁在结构上与神经递质γ-氨基丁酸(GABA)有关,但对GABA结合,摄取或降解没有影响。体外研究表明,加巴喷丁与电压激活钙通道的α2δ亚基具有高亲和力。然而,这种结合与加巴喷丁的治疗作用之间的关系尚不清楚。
药代动力学
加巴喷丁给药后的所有药理作用归因于母体化合物的活性。加巴喷丁在人体内没有明显代谢。
口服生物利用度
加巴喷丁的生物利用度与剂量不成比例。即,随着剂量增加,生物利用度降低。加巴喷丁在900、1200、2400、3600和4800毫克/天的剂量下分3次服用,其生物利用度分别约为60%,47%,34%,33%和27%。食物对加巴喷丁的吸收速率和吸收程度影响很小(AUC和C max增加14%)。
分配
少于3%的加巴喷丁循环结合血浆蛋白。加巴喷丁150 mg静脉内给药后的表观分布体积为58±6 L(平均±SD)。在癫痫患者中,脑脊液中加巴喷丁的稳态剂量(C min )约为相应血浆浓度的20%。
消除
加巴喷丁作为未改变的药物通过肾脏排泄从体循环中消除。加巴喷丁在人体内没有明显代谢。
加巴喷丁消除半衰期为5到7小时,并且不受剂量或多次给药后的影响。加巴喷丁消除速率常数,血浆清除率和肾脏清除率与肌酐清除率成正比。在老年患者和肾功能受损的患者中,加巴喷丁的血浆清除率降低。加巴喷丁可以通过血液透析从血浆中去除。
特定人群
年龄
在20-80岁的受试者中研究了年龄的影响。加巴喷丁的表观口腔清除率(CL / F)随着年龄的增加而降低,从30岁以下的人约225 mL / min降至70岁以上的人约125 mL / min。肾脏清除率(CLr)和根据体表面积调整的CLr也随着年龄的增长而下降;然而,加巴喷丁的肾脏清除率随年龄的下降在很大程度上可以归因于肾功能的下降。 [参见剂量和用法(2.4)和在特定人群中的使用(8.5) ] 。
性别
尽管尚未进行正式的研究来比较加巴喷丁在男性和女性中的药代动力学,但看来男性和女性的药代动力学参数相似,并且没有明显的性别差异。
种族
尚未研究由于种族引起的药代动力学差异。由于加巴喷丁主要通过肾脏排泄,并且肌酐清除率没有重要的种族差异,因此无法预期种族引起的药代动力学差异。
小儿科
在约10 mg / kg的剂量下,在1个月至12岁之间的48位儿科受试者中确定了加巴喷丁的药代动力学。整个年龄段的血浆血浆峰值相似,并且在给药后2至3小时内出现。通常,在1个月至<5岁之间的儿科受试者的暴露(AUC)比在5岁以上的人群中降低了约30%。因此,在幼儿中,按体重归一化的口腔清除率较高。加巴喷丁的表观口腔清除率与肌酐清除率成正比。加巴喷丁消除半衰期平均为4.7小时,在所研究的各个年龄段中相似。
在1个月至13岁之间的253名儿科患者中进行了群体药代动力学分析。患者每天接受3次,剂量为10至65 mg / kg /天。表观口腔清除率(CL / F)与肌酐清除率成正比,这种关系在单剂量和稳态后相似。按体重归一化后,在5岁以下的儿童中观察到的口腔清除率值高于5岁以上的儿童。 <1岁以下婴儿的清除率差异很大。在5岁及以上的小儿患者中观察到的标准化CL / F值与单剂后在成人中观察到的值一致。在整个年龄范围内,按体重归一化后的口腔分布体积是恒定的。
These pharmacokinetic data indicate that the effective daily dose in pediatric patients with epilepsy ages 3 and 4 years should be 40 mg/kg/day to achieve average plasma concentrations similar to those achieved in patients 5 years of age and older receiving gabapentin at 30 mg/kg/day [see Dosage and Administration (2.2) ] .
Adult Patients with Renal Impairment
Subjects (N=60) with renal impai
1.工作原理
- Neurontin是加巴喷丁的品牌(商标)名称。 Neurontin可用于治疗某些癫痫发作或减轻神经痛。
- 专家不确定加巴喷丁的确切作用,但研究表明加巴喷丁与电压门控钙通道上的特定位点(称为α2-δ位点)牢固结合。这种作用被认为是缓解神经痛和降低癫痫发作风险的机制。
- Neurontin属于抗惊厥药。
2.优势
- 除其他药物外,还可用于减少部分发作性癫痫发作的成人和三岁及以上儿童的癫痫发作频率。
- 可用于治疗带状疱疹后神经痛(带状疱疹感染后持续的神经痛)。
- Neurontin可以加巴喷丁的名称作为通用名获得。但是,并非所有的仿制药都可以与某些品牌的加巴喷丁互换使用。
3.缺点
如果您的年龄在18至60岁之间,不服用其他药物或没有其他医疗状况,则您更可能会遇到的副作用包括:
- 头晕,嗜睡,疲倦,发烧和眼球震颤(眼睛的快速和不可控制的运动)是一些较常见的副作用。
- 当用于治疗3至12岁儿童的癫痫病时,可能会导致行为问题,敌意或攻击性或思想障碍。
- 其他副作用可能包括视力模糊,弱视(懒惰的眼睛),口干,周围水肿(脚和手中的液体滞留),震颤,性功能障碍和胃肠道疾病。
- 最好慢慢滴定,以减少副作用的风险;但是,这可能会延迟效果的发作。
- 与其他抗惊厥药类似,神经元可能会增加患抑郁症和自杀念头的风险,尤其是在24岁以下的年轻人中。
- 当突然停止时,神经素已与停药综合征相关。症状包括焦虑,失眠,恶心,疼痛和出汗。应在医生的建议下慢慢将其逐渐缩小。
- 在肾脏疾病中需要减少Neurontin的剂量。
- 极少数情况下可能会发生超敏反应。症状可能包括发烧,皮疹,淋巴结肿大,面部特征肿胀或嗓子肿。
- 可能与其他一些药物相互作用,包括抗酸剂,氢可酮,吗啡和其他引起镇静或头晕的药物。在某些尿蛋白测试中也可能导致假阳性结果。
- 有一些关于神经元滥用和滥用的报道,特别是在有吸毒史的人中。警惕这种可能性。
- 由于作用时间短,神经元每天需要服用三遍。
- 仅对部分发作性癫痫有效,对其他类型的癫痫发作无效。
注意:一般而言,老年人或儿童,患有某些疾病(例如肝脏或肾脏问题,心脏病,糖尿病,癫痫发作)的人或服用其他药物的人更有可能出现更大范围的副作用。有关所有副作用的完整列表,请单击此处。
4.底线
Neurontin可用于治疗部分发作性癫痫和神经痛,但可能引起头昏或嗜睡。
5.秘诀
- 可以带或不带食物一起服用。整个吞服胶囊。请勿与抗酸剂(如Maalox或Gaviscon)同时服用Neurontin。分开给药至少两个小时。完全按照医生的指示服用,未经医生的建议不要增加或减少剂量。
- 如果Neurontin使您昏昏欲睡或损害您的判断力,请避免操作机械,驾驶或执行需要精神警觉的任务。
- Neurontin片剂经过评分,可以减半。未使用的半片应作为下一剂服用,或在破裂后28天内使用。
- 对于每天3次的给药时间表,两次给药之间的时间不得超过12小时。
- 由于不同的给药要求,请勿将Neurontin替代加巴喷丁的Gralise品牌。
- Neurontin的副作用,例如头晕或嗜睡,可能会增加您跌倒的风险。如果可能的话,请除去可能掉落的危险物(例如地毯松动),并在爬楼梯时要小心。
- 如果您的情绪有任何恶化或有任何自杀念头,请与您的医生联系。
- 不要在没有医生建议的情况下停止服用Neurontin,因为它可能会引起戒断反应(症状包括躁动,神志不清,混乱)。当需要终止Neurontin的时间时,您的医生会告诉您如何逐渐减少它。
- 如果在服用Neurontin时出现皮疹,发烧,呼吸困难或面部肿胀,请寻求紧急医疗建议。
6.响应和有效性
- 口服后2至3小时,神经元的浓度达到峰值,其作用持续5至7小时。可能需要几周的时间才能观察到神经痛或癫痫发作频率的减轻。
- 每天需要三剂(肾脏疾病除外)。
7.互动
与Neurontin相互作用的药物可能会降低其作用,影响其作用时间,增加副作用或与Neurontin一起使用时的作用较小。两种药物之间的相互作用并不总是意味着您必须停止服用其中一种药物。但是,有时确实如此。与您的医生谈谈应如何管理药物相互作用。
可能与Neurontin相互作用的常见药物包括:
- 抗酸剂,例如含有铝和镁的抗酸剂
- 抗焦虑药,例如地西epa,劳拉西m和氟尼西epa
- 抗抑郁药,例如阿米替林,西酞普兰,氟西汀,帕罗西汀
- 抗组胺药,如扑尔敏,异丙嗪
- 抗精神病药,例如阿立哌唑,氯丙嗪,氟哌啶醇
- 丁丙诺啡
- 麻醉性止痛药,例如羟考酮和吗啡
- 丙氧芬
- 镇静剂或安眠药
- 曲马多。
酒精可能会使神经毒素的嗜睡和头晕等副作用恶化。
请注意,该列表并不全面,仅包括可能与Neurontin相互作用的常用药物。您应参考Neurontin的处方信息以获取完整的相互作用列表。
参考文献
Neurontin(加巴喷丁)[包装说明书]。修订04/2020。辉瑞公司的Parke-Davis Div。https://www.drugs.com/pro/neurontin.html
版权所有1996-2020 Drugs.com。修订日期:2020年11月5日。
已知总共有222种药物与Neurontin(加巴喷丁)相互作用。
- 24种主要药物相互作用
- 188种中等程度的药物相互作用
- 10种次要药物相互作用
检查互动
最常检查的互动
查看Neurontin(加巴喷丁)和以下所列药物的相互作用报告。
- Adderall(苯丙胺/右旋苯丙胺)
- Aleve(萘普生)
- 安必恩(zolpidem)
- 阿司匹林
- 阿提万(劳拉西m)
- 巴氯芬
- Benadryl(苯海拉明)
- mb(度洛西汀)
- Excedrin(对乙酰氨基酚/阿司匹林/咖啡因)
- Flexeril(环苯扎林)
- 氢可酮
- 布洛芬
- 克罗诺平(氯硝西am)
- Lasix(速尿)
- 立普妥(阿托伐他汀)
- 赖诺普利
- 抒情诗(普瑞巴林)
- 二甲双胍
- Norco(对乙酰氨基酚/氢可酮)
- 奥美拉唑
- 羟考酮
- Percocet(对乙酰氨基酚/羟考酮)
- 强的松
- Prilosec(奥美拉唑)
- Suboxone(丁丙诺啡/纳洛酮)
- 拟甲状腺素(左甲状腺素)
- Topamax(托吡酯)
- 曲马多
- 曲马多
- 曲唑酮
- 维生素D3(胆钙化固醇)
- Xanax(阿普唑仑)
- Zoloft(舍曲林)
神经元(加巴喷丁)酒精/食物相互作用
与Neurontin(加巴喷丁)有1种酒精/食物相互作用
神经素(加巴喷丁)疾病相互作用
与Neurontin(加巴喷丁)共有3种疾病相互作用,包括:
- 肾功能不全
- 自杀倾向
- 血液透析
药物相互作用分类
| 具有高度临床意义。避免组合;互动的风险大于收益。 | |
| 具有中等临床意义。通常避免组合;仅在特殊情况下使用。 | |
| 临床意义不大。降低风险;评估风险并考虑使用替代药物,采取措施规避相互作用风险和/或制定监测计划。 | |
| 没有可用的互动信息。 |
药物状态
- 可用性 仅处方
- 怀孕和哺乳 现有风险数据
- CSA时间表* 不是管制药物
- 审批历史 FDA于1993年批准
美国日本医生

Heather Benjamin MD

Suzanne Reitz MD

Heather Miske DO

Bert Hepner DO

Gregory Aaen MD

宮崎総一郎 中部大学特聘教授

百村伸一 教授

村上和成 教授

中山秀章 教授

