获取国外万塔斯药品价格,使用等信息,最快 24 小时回馈
万塔斯
万塔斯
什么是万塔斯?
Vantas(histrelin)是激素的一种人为形式,可调节体内的许多过程。 Histrelin会过度刺激人体自身产生的某些激素,从而导致该激素暂时关闭。
Vantas植入物用于治疗男性前列腺癌的症状。
Vantas仅治疗前列腺癌的症状,但不治疗癌症本身。
重要信息
万塔可引起副作用,例如哭泣的咒语,愤怒,攻击性和不安或烦躁。如果您有任何新的或恶化的精神问题,请致电您的医生。
接受Vantas植入物之前,请告知您的医生是否排尿疼痛或困难,糖尿病,心脏病,冠状动脉疾病,肝病,心脏病发作或中风的历史,骨质疏松症或影响脊柱的疾病。
如果您有严重的副作用,例如严重的麻木或双腿或双脚发麻,肌肉无力,平衡或协调性问题,膀胱或肠管失去控制,排尿比平时少或多,突然麻木或严重的头痛,言语或视力问题,口渴或排尿增加,饥饿过度或胸痛扩散到手臂或肩膀。
Vantas植入物通常放置12个月,然后取出。您的医生将在那时确定您是否需要接受另一种植入物来治疗您的症状。
在我收到这种药之前
如果您对组蛋白或类似的激素药物过敏,例如亮丙瑞林(Lupron,Eligard,Viadur),纳法瑞林(Synarel)或加那利克斯(Antagon),则不应使用Vantas植入物。
Vantas不应在妇女或儿童中使用。
如果您怀孕,请勿使用Vantas。它可能会伤害未出生的婴儿或引起流产。使用有效的节育措施防止怀孕,如果您怀孕了,请立即告诉医生。
Vantas不应在妇女或儿童中使用。
为确保Vantas对您安全,请告知您的医生是否曾经:
膀胱阻塞或其他排尿问题;
糖尿病;
心脏问题,心脏病发作或中风;
长期QT综合征(在您或家人中);
骨矿物质密度低(骨质疏松症);要么
一种影响您的脊椎的疾病。
使用Vantas进行母乳喂养可能并不安全。向您的医生询问任何风险。
Vantas未被18岁以下的任何人使用。
Vantas如何给予?
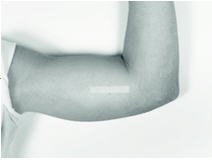
Vantas植入上臂内侧皮肤下的微小植入物中。您将在诊所或医生办公室接受这种植入物,并进行较小的外科手术。
最好将植入物放到您的非优势手臂(如果您是右手的话,则请放在您的左手臂)上。确保告诉您的医生您最常使用哪只手臂。
仰卧时,手臂将弯曲,肘部放置,并在插入植入物时保持不动。您的上臂皮肤将用麻木药治疗,以防止您在插入过程中感到疼痛。一旦手臂麻木,您的医生将用手术刀在要插入植入物的地方切一个小切口。
使用特殊工具插入Vantas植入物,该工具通过皮肤上的切口将植入物推入到位。注入植入物并移除插入工具后,医生将可以感觉到手臂,以确保正确放置了植入物。
皮肤上的切口可能被缝线或手术条封闭。请按照医生的指示进行护理,并保持绷带和清洁直至完全愈合。保持手臂干燥至少24小时。
您很可能能够通过皮肤感觉到植入物,但不会引起疼痛或不适。
通常将Vantas植入物放置12个月,然后必须通过手术切口将其移除。不要试图自己取出植入物。您的医生将确定您是否需要其他植入物以继续治疗。
如果在植入植入物的地方疼痛,肿胀,压痛,发痒,刺痛,淤青或发红,或者植入物通过皮肤或掉落,请致电医生。
为确保此药对您的病情有所帮助,您可能需要经常进行血液检查。您的血液检查将帮助您的医生确定使用Vantas治疗您的时间。
在某些医学检查中,组蛋白会导致异常结果。告诉任何治疗您的医生您正在使用这种药物。
Vantas剂量信息
成人前列腺癌的常用剂量:
在上臂内侧皮下插入一枚50 mg植入物
治疗持续时间:12个月后应去除植入物。
注释:为了继续治疗,可能会在移除植入物时插入另一个植入物。
采用:
晚期前列腺癌的姑息治疗
如果我错过剂量怎么办?
由于Vantas是由医疗专业人员提供的植入物,因此没有每日给药时间表。
植入物不应留在手臂上超过12个月。需要移开植入物时,请致电医生。
如果我服药过量怎么办?
由于Vantas植入物包含特定量的药物,因此您不太可能会服用过量。
接受Vantas植入物后应该避免什么?
植入植入物后至少7天,避免剧烈运动或过度举重。
万塔斯副作用
如果您对Vantas有过敏反应迹象,请寻求紧急医疗帮助。呼吸困难;脸,嘴唇,舌头或喉咙肿胀。
如果您有以下情况,请立即致电您的医生:
腿或脚骨疼痛,麻木或无力;
小便疼痛或排尿困难,尿液中有血液;
癫痫发作;要么
精神问题-哭泣的咒语,愤怒,攻击性,不安或烦躁。
常见的Vantas副作用可能包括:
便秘;
排尿问题; </ <p>
乳房肿胀; </ <p>
潮热; </ <p>
感到疲倦; </ <p>
勃起功能障碍(阳pot),睾丸大小减少;或</ <p>
植入物插入后疼痛,发红,瘀伤,肿胀或皮肤刺激。</ <p>
这不是副作用的完整列表,并且可能会发生其他副作用。打电话给您的医生,征求有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。
还有哪些其他药物会影响Vantas?
其他药物可能与组蛋白相互作用,包括处方药和非处方药,维生素和草药产品。告诉您的医生您目前所有的药物以及您开始或停止使用的任何药物。
版权所有1996-2020 Cerner Multum,Inc.版本:11.01。
注意:本文档包含有关组蛋白的副作用信息。此页面上列出的某些剂型可能不适用于Vantas品牌。
对于消费者
适用于组蛋白:皮下植入物
需要立即就医的副作用
连同其所需的作用,组蛋白(Vantas中包含的活性成分)可能会引起某些不良作用。尽管并非所有这些副作用都可能发生,但如果确实发生了,则可能需要医疗护理。
服用组蛋白时,请立即咨询医生或护士是否出现以下任何副作用:
罕见
- 尿血
- 尿频或尿量减少
- 口渴
- 食欲不振
- 下背部或侧面疼痛
- 恶心
- 面部,手指或小腿肿胀
- 呼吸困难
- 异常疲倦或虚弱
- 呕吐
- 体重增加
发病率未知
- 胃胀
- 黑尿
- 灰心
- 感到悲伤或空虚
- 易怒
- 浅色凳子
- 失去兴趣或愉悦
- 癫痫发作
- 肚子痛
- 麻烦集中
- 睡眠困难
- 眼睛或皮肤发黄
不需要立即就医的副作用
可能会发生组蛋白的某些副作用,通常不需要医疗。随着身体对药物的适应,这些副作用可能会在治疗期间消失。另外,您的医疗保健专业人员可能会告诉您一些预防或减少这些副作用的方法。
请咨询您的医疗保健专业人员,是否持续存在以下不良反应或令人讨厌,或者是否对这些副作用有任何疑问:
比较普遍;普遍上
- 减少睾丸大小
- 温暖的感觉
- 植入物放置在皮肤上的局部感染,刺激,疼痛,发红或肿胀
- 脸,脖子,手臂和上胸部发红
- 突然出汗
不常见
- 对性交的兴趣减少
- 排便困难
- 皮肤潮红或发红
- 头痛
- 无法勃起或勃起
- 性能力,欲望,动力或表现丧失
- 男性和女性乳房肿胀或乳房酸胀
- 异常温暖的皮肤
对于医疗保健专业人员
适用于组蛋白:皮下植入物,皮下套件
内分泌
常见(1%至10%):血糖升高,男性乳房发育
罕见(0.1%至1%):血液乳酸脱氢酶升高,血液睾丸激素升高
罕见(小于0.1%):垂体良性肿瘤
上市后报告:垂体中风[参考]
心血管的
非常常见(10%或更多):潮热(高达65.5%)
常见(1%至10%):脸红
罕见(0.1%至1%):血肿,周围水肿
罕见(少于0.1%):心pit,室性前收缩[参考]
本地
非常常见(10%或更多):植入/应用部位反应(高达51.1%)
常见(1%至10%):植入物/应用部位受伤,瘢痕loid,疤痕,与缝合相关的并发症,手术后疼痛
上市后报告:植入物断裂[参考]
植入物/应用部位的反应包括不适,淤青,酸痛,疼痛,压痛,刺痛,瘙痒,红斑,炎症,突出和肿胀。 [参考]
其他
常见(1%至10%):虚弱,疲劳
罕见(0.1%至1%):性功能障碍,乳房疼痛,乳房压痛,疼痛(加剧和非特异性),肿胀,发冷,青紫,不适
罕见(少于0.1%):伤口感染,疾病进展[参考]
精神科
常见(1%至10%):情绪变化,抑郁,性欲下降,失眠
罕见(0.1%至1%):烦躁[参考]
肌肉骨骼
常见(1%至10%):关节痛,四肢疼痛
罕见(0.1%至1%):背痛,肌肉痉挛,肌肉浸润,颈部疼痛,骨痛,肌肉抽搐,肌痛[参考]
皮肤科
常见(1%到10%):挫伤,hypotrichosis,hypertrichosis
罕见(0.1%至1%):盗汗,瘙痒,多汗症
稀有(小于0.1%):皮肤感染[参考]
胃肠道
普通(1%至10%):便秘
罕见(0.1%至1%):腹部不适,恶心[Ref]
泌尿生殖
常见(1%至10%):勃起功能障碍,睾丸萎缩,尿频,尿retention留
罕见(0.1%至1%):男性生殖器瘙痒,排尿困难,血尿,前列腺酸磷酸酶升高,输尿管支架阻塞,尿频
稀有(小于0.1%):痛经,月经过多,出血性[参考]
一般
Supprelin LA(R):
-最常见的不良反应涉及植入部位,包括瘀伤,疼痛,酸痛,红斑和肿胀。 [参考]
血液学
罕见(0.1%至1%):贫血[参考]
肝的
常见(1%至10%):肝病
罕见(0.1%至1%):天冬氨酸转氨酶升高
上市后报告:药物性肝损伤[参考]
免疫学的
罕见(少于0.1%):流感样疾病[参考]
新陈代谢
常见(1%至10%):体液retention留,高钙血症,高胆固醇血症,食物渴望,食欲增加,体重增加,体重减轻[参考]
神经系统
常见(1%至10%):头晕,头痛
罕见(0.1%至1%):震颤,嗜睡
稀有(少于0.1%):偏头痛
上市后报告:癫痫发作/抽搐[参考]
肾的
常见(1%至10%):肾功能受损
罕见(0.1%至1%):肾衰竭,肾结石病,肌酐清除率降低[参考]
呼吸道
常见(1%至10%):运动性呼吸困难
稀有(小于0.1%):实心[参考]
参考文献
1.“产品信息。Vantas(histrelin)。”马萨诸塞州列克星敦市的Endo Pharmaceuticals(以前是Indevus Pharmaceuticals Inc)。
2.“产品信息。SupprelinLA(组蛋白)。”马萨诸塞州列克星敦市的Endo Pharmaceuticals(以前是Indevus Pharmaceuticals Inc)。
某些副作用可能没有报道。您可以将其报告给FDA。
防腐剂
用局部消毒剂擦拭插入区域,然后用提供的带孔的无菌场悬垂布覆盖,以使开口位于插入部位上方(为清楚起见,以下图像未显示悬垂物)。

麻药
所采用的麻醉方法(即局部麻醉,清醒镇静,全身麻醉)由医护人员自行决定。
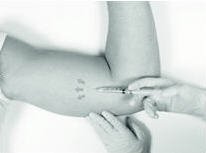
如果选择局部麻醉:已提供了局部麻醉药(例如,盐酸利多卡因1%和肾上腺素或盐酸利多卡因1%)(注意,小瓶的外部不是无菌的)和注射用的无菌皮下注射针头。确定对麻醉剂没有已知过敏反应后,将麻醉剂注入皮下组织,从计划的切口部位开始,然后沿预期的皮下插入路径渗透,直至植入物的长度(略大于一英寸) 。
3.加载插入工具
无菌插入工具包括一个固定在可伸缩斜角插管上的固定手柄,将植入物放置在其腔室内用于皮下插入。在完全伸出的插管内部,直至黑色标记的水平,是一个固定的活塞,植入物位于该活塞上。在插入过程的最后一步中,将使用滑动机构(绿色按钮)将套管缩回手柄中,从而使植入物暴露并保留在皮下组织中。

初次握住无菌插入工具时,请确认套管已完全伸出。通过检查绿色收回按钮的位置来验证这一点。该按钮应一直朝距离插管最远,距手柄最远的位置锁定。

可以使用无菌手套或提供的无菌蚊帐夹拾取植入物。避免弯曲或挤压植入物。请注意,在冷藏存储后,植入物可能会从其药瓶中稍微弯曲和/或部分变平。
为了使植入物在装入工具之前更加对称,可以在手指和拇指之间滚动植入物几次(使用无菌手套)。
手动或使用蚊帐将植入物插入“插入工具”的插管中。将植入物插入套管时,请勿强行插入植入物。如果感觉到阻力,则应移除植入物,并根据需要进行手动操作或滚动,然后将其重新插入套管中。

要么
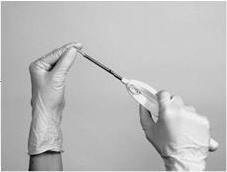
完全插入后,植入物将放置在套管内,以便在套管的斜角端仅可见植入物的尖端。
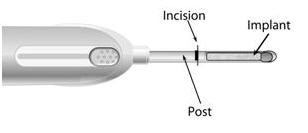
4.切开
使用提供的无菌手术刀,横切手臂的长轴切开一个切口,切口的大小应足以将套管的孔插入皮下组织。
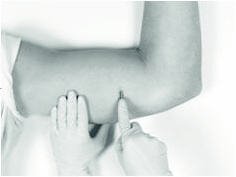
5.插入植入物
如果首先通过使用负载的插入工具的套管或无菌止血钳或等效的手术工具沿麻醉剂路径沿着皮下沿皮下切开钝性解剖来创建植入物的“口袋”,则插入可能会更容易。
确保在口袋制作和插入过程中始终明显抬高皮肤(称为帐篷),以确保植入物正确放置在皮下(“在皮肤下”)。请注意,“插入工具”的插管,或用于创建口袋的任何工具,均不应输入肌肉组织。植入物的深度插入不会影响VANTAS的性能,但可能会在以后移除植入物时造成困难。
如果使用已加载的插入工具的插管来制作袋,请小心地将插管的尖端插入切口中并穿过皮下组织,同时沿插管的长度明显抬高皮肤,但不要超过该距离。套管上刻有黑线。在将工具插入或推进切入过程中,请勿压下工具上的绿色缩进按钮。
将工具向后拉,几乎拉到套管的斜角,然后再次向前推进工具,使套管完全重新进入口袋,但不要超过刻有黑色线条的距离。确保立即将插入路径置于皮下。
如果使用其他工具制作袋,现在将包含植入物的插入工具的已插入套管穿过切口,直至刻有黑色线条。
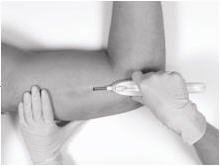
小心地将拇指移至绿色收回按钮时,将插入工具保持在适当的位置,使底座靠着患者的手臂。按下按钮以释放锁定机构,然后将按钮向手柄方向滑动,直到其停止,同时将插入工具的主体固定在适当的位置。
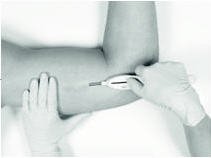
缩回按钮会使插管从切口中退出,从而将植入物留在皮下组织中。一旦开始回收过程,请勿进一步处理插管。同样,在按钮完全缩回或将植入物部分从切口中拉出之前,请勿撤回插入工具。退回完成后,即可完全撤回该工具。
注意:在插管缩回和撤回过程中,将压力施加到植入物上的皮肤会很有帮助,以确保植入物保留在皮下口袋中。
如果需要在插入过程中的任何时候重新开始该过程,请拔出插入工具,小心地从套管中拔出植入物,并将工具上的缩回按钮重置到最前面的位置。在将植入物重新装入“插入工具”之前,请检查植入物,然后重新开始。
植入物的位置应通过触诊确认。请注意,正确放置的植入物的尖端可能无法通过切口看到。
植入后,用无菌纱布垫短暂覆盖该部位,并施加压力以确保止血。
6.闭合切口
要关闭切口,可以使用可吸收的缝合线和/或提供的无菌粘合手术带。为了提高胶条的粘合性,可以在涂胶条之前在皮肤上涂抹安息香tin防腐剂(已提供)并使其干燥。
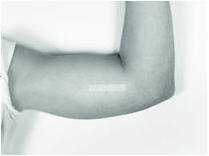
关闭后,用无菌纱布垫覆盖切口部位,并用提供的绷带固定敷料。
请向患者提供患者信息单张,其中包括有关植入物的信息以及正确护理插入部位的说明。
拆卸程序
治疗12个月后应清除VANTAS。随同新的VANTAS植入物一起提供的植入工具包中提供了大部分用于移除植入物的必需用品,包括局麻药和无菌蚊帐夹。请注意,植入套件应仅在20°C至25°C(68°F至77°F)的温度下保存[请参见USP控制的室温]。有关更多说明,请参见上面的插入过程。
切除VANTAS植入物是一项外科手术。必须使用无菌手套和无菌技术以最大程度地减少感染机会。
1.设置无菌区
使用适当的无菌技术,将植入物去除程序所需的植入工具包中的无菌组件从其包装中小心分配到所提供的无菌野外悬垂布(非开孔)上。请注意,包装盒和所有包装(包括小瓶的表面)均未经灭菌,应远离无菌田布。
2.准备患者和现场
患者应背对身体,放置植入物的手臂应弯曲或伸出,以便医生可以轻松触及上臂的内部。用枕头支撑手臂可以帮助患者更轻松地保持姿势。
首先应通过触诊上臂的内侧面在上一年的切口附近找到要去除的植入物。
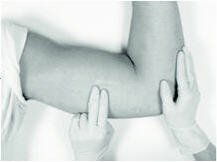
通常,先前的植入物很容易触诊。如果植入物难以定位,则可以使用超声。如果超声无法定位植入物,则可以使用其他成像技术(例如CT或MRI)定位(不建议使用平片,因为植入物不是不透射线的)。
防腐剂
用局部防腐剂擦拭先前植入物上方和周围的区域。用提供的开窗的无菌场装饰布覆盖该区域,以使该孔位于先前的插入位置上(为清楚起见,以下图像未显示该装饰布)。
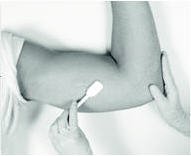
麻药
所采用的麻醉方法(即局部麻醉,清醒镇静,全身麻醉)由医护人员自行决定。
如果选择局部麻醉:已提供了局部麻醉药(例如,盐酸利多卡因1%和肾上腺素或盐酸利多卡因1%)(注意,小瓶的外部不是无菌的)和注射用的无菌皮下注射针头。确定对麻醉剂没有已知过敏反应后,在预期切口的部位(先前植入物的部位)及其周围将麻醉剂注入皮下组织。
3.进行切口并取出植入物
使用提供的无菌手术刀,切开一个足以允许轻松移除植入物的尺寸的切口,如果要插入新的植入物,则其大小应足以容纳所提供的插入工具的插管孔。
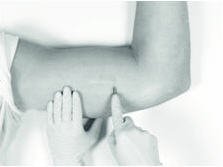
通常,植入物的尖端将通过切口可见,可能被假性组织囊覆盖。为了便于取出植入物,可能需要用最小的手指通过切口触诊植入物的头部,尤其是在不容易看到植入物的头部的情况下。此外,您可能需要向下推动植入物的远端,并朝切口“向前按摩”。
小心地刻痕假囊以露出植入物的聚合物尖端。将提供的无菌蚊子夹插入假胶囊中形成的孔中并通过打开该夹来扩张可能是有益的。扩大假囊的开口可简化植入物的取出。
用无菌蚊子夹轻轻但牢固地抓住植入物并拔出植入物。
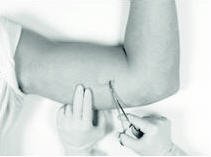
以适当的方式处理植入物,并像对待其他生物废物一样对其进行处理。
用无菌纱布垫短暂覆盖该部位,并施加压力以确保止血。
如果要插入新的植入物,请参阅上面提供的“插入程序”说明。请注意,您可以将新的植入物插入与取出的植入物相同的“口袋”中,或者在同一臂或对侧臂的不同位置进行新切口。
如果不想插入新的植入物,请继续关闭切口。
4.闭合切口
要关闭切口,可以使用可吸收的缝合线和/或提供的无菌粘合手术带。要提高胶条的粘合性,可以在涂胶条之前在皮肤上涂抹安息香in防腐剂(已提供)并使其干燥。
关闭后,用无菌纱布垫覆盖切口部位,并用提供的绷带固定敷料。
万塔的适应症和用法
Vantas用于晚期前列腺癌的姑息治疗。
万塔剂量和给药
2.1推荐剂量
Vantas的推荐剂量是一次植入,持续12个月。每个植入物均包含50毫克醋酸组蛋白,以递送41毫克组蛋白。将植入物皮下插入上臂内侧,并在激素治疗12个月内连续释放组蛋白(50 mcg /天)。治疗12个月后应清除Vantas(植入物被设计为允许释放几周的Histrelin,以允许灵活的医疗预约)。在移除植入物时,可以插入另一个植入物以继续治疗。
2.2建议的植入物插入和取出步骤
该过程部分旨在为Vantas的插入和移除提供指导。
可以使用以下插入步骤进行新植入物的插入。如果必须先移除以前的Vantas植入物,请参阅下面的“移除程序”说明。
插入程序
插入植入物所需的许多用品,包括插入工具和局麻药,都在与植入物一同运输的单独的植入工具包中提供。请注意,植入物在其密封的小瓶,小袋和纸箱中必须冷藏(2°C至8°C),直到手术需要为止。一旦从冷藏箱中取出,装有植入物的小瓶(仍在未打开的袋子和纸箱中)可以在室温下放置7天(如果需要),然后再使用。如果在此期间未使用,则可以再次对包装好的植入物进行适当的冷藏,直到纸箱上的失效日期为止。
注意:植入工具包只能在20°C至25°C(68°F至77°F)的温度下保存[请参阅USP控制的室温]。
插入Vantas植入物是一项外科手术。必须使用无菌手套和无菌技术以最大程度地减少感染机会。
1.设置无菌区
使用适当的无菌技术,将插入过程所需的植入工具包的无菌组件(包括插入工具)小心地从其包装中分配到所提供的无菌田间窗帘(非开孔)上。请注意,包装盒和所有包装(包括小瓶的表面)均未经灭菌,应远离无菌田布。
植入瓶要等到插入之前才打开。通过移开金属带打开小瓶,然后小心地将无菌内容物(植入物和无菌盐水)倒入无菌田布上。然后可以使用无菌手套或所提供的无菌蚊帐夹来处理植入物。避免弯曲或夹住植入物。
2.准备患者和插入部位
病人应仰卧,理想情况下,最不用的手臂(例如,惯用右手的左臂)弯曲或伸展,以使医生可以轻松触及上臂的内部。用枕头支撑手臂可以帮助患者更轻松地保持姿势。建议的皮下插入最佳部位大约在肩膀和肘部之间的一半处,与二头肌和三头肌之间的折痕一致。

防腐剂
用局部消毒剂擦拭插入区域,然后用提供的带孔的无菌场悬垂布覆盖,以使开口位于插入部位上方(为清楚起见,以下图像未显示悬垂物)。

麻药
所采用的麻醉方法(即局部麻醉,清醒镇静,全身麻醉)由医护人员自行决定。

如果选择局部麻醉:已提供了局部麻醉药(例如,盐酸利多卡因1%和肾上腺素或盐酸利多卡因1%)(注意,小瓶的外部不是无菌的)和注射用的无菌皮下注射针头。确定对麻醉剂没有已知过敏反应后,将麻醉剂注入皮下组织,从计划的切口部位开始,然后沿预期的皮下插入路径渗透,直至植入物的长度(略大于一英寸) 。
3.加载插入工具
无菌插入工具包括一个固定在可伸缩斜角插管上的固定手柄,将植入物放置在其腔室内用于皮下插入。在完全伸出的插管内部,直至黑色标记的水平,是一个固定的活塞,植入物位于该活塞上。在插入过程的最后一步中,将使用滑动机构(绿色按钮)将套管缩回手柄中,从而使植入物暴露并保留在皮下组织中。

初次握住无菌插入工具时,请确认套管已完全伸出。通过检查绿色收回按钮的位置来验证这一点。该按钮应一直朝距离插管最远,距手柄最远的位置锁定。

可以使用无菌手套或提供的无菌蚊帐夹拾取植入物。避免弯曲或挤压植入物。请注意,在冷藏存储后,植入物可能会从其药瓶中稍微弯曲和/或部分变平。
为了使植入物在装入工具之前更加对称,可以在手指和拇指之间滚动植入物几次(使用无菌手套)。
手动或使用蚊帐将植入物插入“插入工具”的插管中。将植入物插入套管时,请勿强行插入植入物。如果感觉到阻力,则应移除植入物,并根据需要进行手动操作或滚动,然后将其重新插入套管中。

要么

完全插入后,植入物将放置在套管内,以便在套管的斜角端仅可见植入物的尖端。

4.切开
使用提供的无菌手术刀,横切手臂的长轴切开一个切口,切口的大小应足以将套管的孔插入皮下组织。

5.插入植入物
如果首先通过使用负载的插入工具的套管或无菌止血钳或等效的手术工具沿麻醉剂路径沿着皮下沿皮下切开钝性解剖来创建植入物的“口袋”,则插入可能会更容易。
确保在口袋制作和插入过程中始终明显抬高皮肤(称为帐篷),以确保植入物正确放置在皮下(“在皮肤下”)。请注意,“插入工具”的插管,或用于创建口袋的任何工具,均不应输入肌肉组织。植入物的深度插入不会影响Vantas的性能,但可能会在以后移除植入物时造成困难。
如果使用已加载的插入工具的插管来制作袋,请小心地将插管的尖端插入切口中并穿过皮下组织,同时沿插管的长度明显抬高皮肤,但不要超过该距离。套管上刻有黑线。在将工具插入或推进切入过程中,请勿压下工具上的绿色缩进按钮。
将工具向后拉,几乎拉到套管的斜角,然后再次向前推进工具,使套管完全重新进入口袋,但不要超过刻有黑色线条的距离。确保立即将插入路径置于皮下。
如果使用其他工具制作袋,现在将包含植入物的插入工具的已插入套管穿过切口,直至刻有黑色线条。

小心地将拇指移至绿色收回按钮时,将插入工具保持在适当的位置,使底座靠着患者的手臂。按下按钮以释放锁定机构,然后将按钮向手柄方向滑动,直到其停止,同时将插入工具的主体固定在适当的位置。

缩回按钮会使插管从切口中退出,从而将植入物留在皮下组织中。一旦开始回收过程,请勿进一步处理插管。同样,在按钮完全缩回或将植入物部分从切口中拉出之前,请勿撤回插入工具。退回完成后,即可完全撤回该工具。
注意:在插管缩回和撤回过程中,将压力施加到植入物上的皮肤会很有帮助,以确保植入物保留在皮下口袋中。
如果需要在插入过程中的任何时候重新开始该过程,请拔出插入工具,小心地从套管中拔出植入物,并将工具上的缩回按钮重置到最前面的位置。在将植入物重新装入“插入工具”之前,请检查植入物,然后重新开始。
植入物的位置应通过触诊确认。请注意,正确放置的植入物的尖端可能无法通过切口看到。
植入后,用无菌纱布垫短暂覆盖该部位,并施加压力以确保止血。
6.闭合切口
要关闭切口,可以使用可吸收的缝合线和/或提供的无菌粘合手术带。要提高胶条的粘合性,可以在涂胶条之前在皮肤上涂抹安息香in防腐剂(已提供)并使其干燥。

关闭后,用无菌纱布垫覆盖切口部位,并用提供的绷带固定敷料。
请向患者提供患者信息单张,其中包括有关植入物的信息以及正确护理插入部位的说明。
拆卸程序
治疗12个月后应清除Vantas。移除植入物所需的大部分耗材,包括局麻药和无菌蚊帐夹,都随新的Vantas植入物一起提供在植入套件中。请注意,植入套件应仅在20°C至25°C(68°F至77°F)的温度下保存[请参见USP控制的室温]。有关更多说明,请参见上面的插入过程。
切除Vantas植入物是一项外科手术。必须使用无菌手套和无菌技术以最大程度地减少感染机会。
1.设置无菌区
使用适当的无菌技术,将植入物去除程序所需的植入工具包中的无菌组件从其包装中小心分配到所提供的无菌野外悬垂布(非开孔)上。请注意,包装盒和所有包装(包括小瓶的表面)均未经灭菌,应远离无菌田布。
2.准备患者和现场
患者应背对身体,放置植入物的手臂应弯曲或伸出,以便医生可以轻松触及上臂的内部。用枕头支撑手臂可以帮助患者更轻松地保持姿势。
首先应通过触诊上臂的内侧面在上一年的切口附近找到要去除的植入物。

通常,先前的植入物很容易触诊。如果植入物难以定位,则可以使用超声。如果超声无法定位植入物,则可以使用其他成像技术(例如CT或MRI)定位(不建议使用平片,因为植入物不是不透射线的)。
防腐剂
用局部防腐剂擦拭先前植入物上方和周围的区域。用提供的开窗的无菌场装饰布覆盖该区域,以使该孔位于先前的插入位置上(为清楚起见,以下图像未显示该装饰布)。

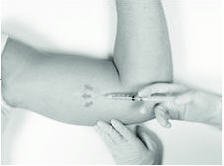
麻药
所采用的麻醉方法(即局部麻醉,清醒镇静,全身麻醉)由医护人员自行决定。

如果选择局部麻醉:已提供了局部麻醉药(例如,盐酸利多卡因1%和肾上腺素或盐酸利多卡因1%)(注意,小瓶的外部不是无菌的)和注射用的无菌皮下注射针头。确定对麻醉剂没有已知过敏反应后,在预期切口的部位(先前植入物的部位)及其周围将麻醉剂注入皮下组织。
3.进行切口并取出植入物
使用提供的无菌手术刀,切开一个足以允许轻松移除植入物的尺寸的切口,如果要插入新的植入物,则其大小应足以容纳所提供的插入工具的插管孔。

通常,植入物的尖端将通过切口可见,可能被假性组织囊覆盖。为了便于取出植入物,可能需要用最小的手指通过切口触诊植入物的头部,尤其是在不容易看到植入物的头部的情况下。此外,您可能需要向下推动植入物的远端,并朝切口“向前按摩”。
小心地刻痕假囊以露出植入物的聚合物尖端。将提供的无菌蚊子夹插入假胶囊中形成的孔中并通过打开该夹来扩张可能是有益的。扩大假囊的开口可简化植入物的取出。
用无菌蚊子夹轻轻但牢固地抓住植入物并拔出植入物。

以适当的方式处理植入物,并像对待其他生物废物一样对其进行处理。
用无菌纱布垫短暂覆盖该部位,并施加压力以确保止血。
如果要插入新的植入物,请参阅上面提供的“插入程序”说明。请注意,您可以将新的植入物插入与取出的植入物相同的“口袋”中,或者在同一臂或对侧臂的不同位置进行新切口。
如果不想插入新的植入物,请继续关闭切口。
4.闭合切口
要关闭切口,可以使用可吸收的缝合线和/或提供的无菌粘合手术带。要提高胶条的粘合性,可以在涂胶条之前在皮肤上涂抹安息香in防腐剂(已提供)并使其干燥。

关闭后,用无菌纱布垫覆盖切口部位,并用提供的绷带固定敷料。
剂型和优势
VANTAS®(组氨瑞林乙酸盐)植入物是无菌的,非生物可降解的,含有扩散控制的水凝胶聚合物储醋酸组氨瑞林,天然存在的促性腺素释放激素(GnRH)的合成九肽类似物。 Vantas旨在在12个月内每天释放约50 mcg乙酸组蛋白(相当于每天约41 mcg组蛋白)。
禁忌症
4.1超敏反应
对GnRH,GnRH激动剂类似物或Vantas中的任何成分过敏的患者禁用Vantas。在文献中已经报道了对合成的GnRH激动剂类似物的过敏反应。
4.2怀孕
对孕妇服用万塔可能会对胎儿造成伤害。 Vantas在已怀孕或可能怀孕的妇女中禁用。对胎儿死亡率的影响是这种药物引起的激素水平改变的预期结果。存在自然流产的可能。没有针对孕妇的充分且对照良好的研究。在非临床研究中,组蛋白具有致畸性和胎儿毒性。如果在怀孕期间使用该药物,或者如果患者在服用该药物时怀孕,则应告知患者对胎儿的潜在危害。 [请参阅在特定人群中使用( 8.1 )]。
警告和注意事项
5.1血清睾丸激素的短暂增加
Vantas在治疗的第一周内引起睾丸激素血清浓度的短暂升高。患者可能会出现症状加重或出现新症状,包括骨痛,神经病,血尿或输尿管或膀胱出口梗阻。
5.2脊髓压迫和尿路梗阻
用GnRH激动剂报道了可能导致麻痹的脊髓压迫和可能导致肾功能损害的输尿管阻塞的病例。在治疗的前几周内,应密切观察有转移性椎体病变和/或尿路阻塞的患者。
5.3难以找到或移除植入物
在所有合并的临床试验中,有8名患者未恢复植入物。对于其中两个[参见临床研究( 14 )] ,血清睾丸激素升高至cast割水平以上,并且植入物既不可触知也无法通过超声观察。据信这两个植入物在没有患者欣赏的情况下被挤出。在其他六个人中,血清睾丸激素保持在去势水平以下,但植入物不明显。没有进行进一步的诊断测试。这些患者中的一名接受了没有找到植入物的临床外科手术探查。
植入物植入是外科手术过程。建议仔细遵守推荐的植入物插入和取出程序[请参见剂量和用法( 2.2 )] ,以最大程度地减少并发症和排除种植体的可能性。此外,应指示患者在植入植入物后的7天内避免弄湿手臂24小时,以及在7天之内不要沉重举重或剧烈用力。
5.4高血糖和糖尿病
据报道,接受GnRH激动剂的男性发生高血糖症和罹患糖尿病的风险增加。高血糖症可能代表糖尿病患者的发展或糖尿病患者血糖控制的恶化。定期监测接受GnRH激动剂的患者的血糖和/或糖基化血红蛋白(HbA1c),并按照当前的实践进行管理,以治疗高血糖或糖尿病。
5.5心血管疾病
与男性使用GnRH激动剂有关的发生心肌梗塞,心脏猝死和中风的风险增加。根据报告的比值比,该风险似乎很低,在确定前列腺癌患者的治疗方法时应与心血管危险因素一起仔细评估。应监测接受GnRH激动剂的患者的症状和体征,提示心血管疾病的发展,并根据当前的临床实践进行管理。
5.6实验室测试
应通过定期测量睾丸激素和前列腺特异性抗原的血清浓度来监测对Vantas的反应,尤其是如果尚未实现对治疗的预期临床或生化反应时。
睾丸激素测定的结果取决于测定方法。建议了解测定方法的类型和精度,以做出适当的临床和治疗决策。
5.7对QT / QTc间隔的影响
雄激素剥夺疗法可能会延长QT / QTc间隔。提供者应考虑雄激素剥夺疗法的益处是否超过先天性长QT综合征,充血性心力衰竭,频繁的电解质异常以及服用已知延长QT间隔的药物的潜在风险。电解质异常应予以纠正。考虑定期监测心电图和电解质。
不良反应
6.1临床试验中的不良反应
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物在临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
在两项临床试验中,对171名前列腺癌患者进行了长达36个月的治疗,评估了Vantas的安全性。关键性研究(研究1)由138例患者组成,而另一项支持性研究(研究2)由33例患者组成。
与其他GnRH类似物一样,Vantas在治疗的第一周内引起血清睾丸激素浓度的短暂升高。因此,在治疗的最初几周内,患有椎骨转移和/或尿路阻塞或血尿的患者可能会加剧疾病的体征和症状。如果这些情况加重,可能会导致神经系统问题,例如下肢无力和/或感觉异常或泌尿症状恶化[见警告和注意事项( 5.1 )] 。
在最初插入植入物后的最初12个月中,在临床试验中,有171位患者中有8位植入物通过切口部位挤出(有关正确放置植入物,请参阅“推荐程序”)。
在关键性研究(研究1)中,对植入部位的反应进行了详细评估。在该研究的138例患者中,有19例(13.8%)经历了局部或插入部位反应。据报道,所有这些局部部位反应的严重程度均为轻度。大多数与最初插入或取出并插入新的植入物有关,并在植入物插入后的前两周内开始并解决。 4名患者(2.8%)持续反应。插入后头两周,另有4名(2.8%)患者出现应用部位反应。
植入物植入后的局部反应包括淤青(占患者的7.2%)和疼痛/酸痛/压痛(占患者的3.6%)。其他较少报道的反应包括红斑(占患者的2.8%)和肿胀(占患者的0.7%)。在这项研究中,两名患者发生了被描述为局部感染/炎症的事件,一名在口服抗生素治疗后得以缓解,另一名未经治疗。
插入后续植入物后的局部反应与首次插入后可见的反应相当。
在长达24个月的Vantas治疗期间的临床试验中,发生了以下可能或可能相关的全身不良事件,并报道了≥2%的患者(表1)。
| *抑制睾丸激素的预期药理作用。 ** 8例患者中有5例发生了轻度肾功能不全(定义为肌酐清除率≥30<60 mL / min),并在下次就诊时恢复到正常范围。 | ||
| 身体系统 | 不良事件 | 数(%) |
|---|---|---|
| 血管疾病 | 潮热* | 112(65.5%) |
| 一般性疾病 | 疲劳 体重增加 | 17(9.9%) 4(2.3%) |
| 皮肤和阑尾疾病 | 植入部位反应 | 10(5.8%) |
| 生殖系统和乳腺疾病 | 勃起功能障碍* 男性乳房发育* 睾丸萎缩* | 6(3.5%) 7(4.1%) 9(5.3%) |
| 精神病 | 失眠 性欲下降* | 5(2.9%) 4(2.3%) |
| 肾脏和泌尿系统疾病 | 肾功能不全** | 8(4.7%) |
| 胃肠道疾病 | 便秘 | 6(3.5%) |
| 神经系统疾病 | 头痛 | 5(2.9%) |
潮热是最常见的不良事件(占患者的65.5%)。就严重程度而言,2.3%的患者报告为严重潮热,25.4%的患者报告为中度潮热,37.7%的患者报告为轻度潮热。此外,在临床研究中使用Vantas的患者中,<2%的患者报告了以下可能或可能相关的全身不良事件。
- 血液和淋巴系统疾病:贫血
- 心脏疾病:心pit,室性早搏
- 胃肠道疾病:腹部不适,恶心
- 一般疾病:感冒,嗜睡,乏力,周围水肿,疼痛,疼痛加重,无力,体重减轻
- 肝胆疾病:肝病
- 损伤,中毒和手术并发症:支架阻塞
- 实验室检查:天冬氨酸转氨酶升高,血糖升高,血液乳酸脱氢酶升高,血液睾丸激素升高,肌酐清除率降低,前列腺酸性磷酸酶升高
- 代谢和营养障碍:食欲增加,体液fluid留,食物渴望,高钙血症,高胆固醇血症
- 肌肉骨骼和结缔组织疾病:关节痛,背痛,背痛加重,骨痛,肌肉抽搐,肌痛,颈部疼痛,四肢疼痛
- 神经系统疾病:头晕,震颤
- 精神疾病:抑郁,易怒
- 肾脏和泌尿系统疾病:肾结石,尿痛,血尿加重,肾功能衰竭加重,尿频,尿频加重,尿retention留
- 生殖系统和乳房疾病:乳房疼痛,乳房压痛,男性生殖器瘙痒,男性乳房发育症加重,性功能障碍
- 呼吸,胸和纵隔疾病:呼吸困难
- 皮肤和皮下组织疾病:挫伤,毛发不全,盗汗,瘙痒,出汗增多
- 血管疾病:潮红,血肿
- 骨密度的变化:在医学文献中,已经报道了进行睾丸切除术或接受GnRH激动剂类似物治疗的男性的骨密度降低。可以预料,男性长期去势会影响骨密度。
6.2上市后
在Vantas的批准后使用过程中,已发现以下不良反应。由于这些反应是从不确定大小的人群中自愿报告的,因此并非总是能够可靠地估计其发生频率或建立与药物暴露的因果关系。
垂体中风:已报告了促性腺激素释放激素激动剂给药后垂体中风(垂体梗死继发的临床综合征)病例。在大多数这些病例中,诊断为垂体腺瘤的大多数垂体中风病例均发生在最终剂量的2周内,有些则在第一小时内。在这些情况下,垂体中风表现为突然的头痛,呕吐,视觉改变,眼肌麻痹,精神状态改变,有时甚至是心血管衰竭。需要立即就医。
药物引起的肝损伤:据报道,与Vantas相关的严重肝损伤。去除Vantas植入物后,毒性可逆。
神经系统疾病:抽搐
药物相互作用
概述:未使用Vantas进行基于药代动力学的药物相互作用研究[请参见临床药理学( 12.3 )]。
药物实验室测试相互作用:用组蛋白治疗可抑制垂体-性腺系统。在组蛋白治疗期间和之后进行的垂体促性腺激素和性腺功能诊断测试结果可能会受到影响。
在特定人群中的使用
8.1怀孕
怀孕类别X。 [请参阅禁忌症( 4.2 )]
在怀孕或可能怀孕的女性中禁忌服用万塔斯。对孕妇服用万塔可能会对胎儿造成伤害。存在自然流产的可能。在整个妊娠期给予醋酸组蛋白后,在兔子中观察到主要胎儿异常,但在大鼠中未观察到。大鼠和兔子的胎儿死亡率增加,胎儿体重减少。这些对胎儿死亡率的影响是这种药物引起的激素水平改变的预期结果。如果在怀孕期间使用该药物,或者如果患者在服用该药物时怀孕,则应告知患者对胎儿的潜在危害。
8.3护理母亲
未将Vantas用于女性。尚不清楚该药物是否从人乳中排泄。由于许多药物会从人乳中排出,并且由于Vantas的哺乳婴儿可能会出现严重的不良反应,因此,应考虑该药物对母亲的重要性,决定是停止护理还是停止该药物。
8.4小儿使用
未将Vantas用于儿童患者。
过量
注射最高200 mcg / kg(大鼠,兔子)或2000 mcg / kg(小鼠)的醋酸组蛋白林不会引起全身毒性。这代表最大推荐人剂量10 mcg / kg /天的20到200倍。接受一,两或四颗Vantas植入物的患者的不良事件特征相似。
万塔说明
VANTAS®(组氨瑞林乙酸盐)植入物是无菌的,非生物可降解的,含有扩散控制的水凝胶聚合物储醋酸组氨瑞林,天然存在的促性腺素释放激素(GnRH)的合成九肽类似物。 Vantas旨在在12个月内每天释放约50 mcg乙酸组蛋白(相当于每天约41 mcg组蛋白)。
无菌的Vantas植入物看起来像一个细小的细管,由50 mg醋酸组蛋白丝状药物核心组成,位于3.5厘米x 3毫米的圆柱形水凝胶聚合物容器中(图A)。植入物可能会部分显示为完全充满,并且颜色会从灰白色变为浅棕色。核心内的颜色可能不均匀。
图A. Vantas种植体图(未按比例)

乙酸组蛋白的化学描述为:5-氧代-L-脯氨酰基-L-组氨酸-L-色氨酸-L-丝氨酰-L-酪氨酰基-Nt苄基-D-组氨酸-L-亮氨酰-L-精氨酸基-N-乙基-L -乙酸脯氨酰胺(盐)[C 66 H 86 N 18 O 12 (1.7-2.8摩尔)CH 3 COOH,(0.6-7.0摩尔)H 2 O],分子量为1443.70(或1323.50为组蛋白)。
醋酸组蛋白具有以下结构式:

药芯还包含非活性成分硬脂酸NF。水凝胶聚合物贮存器是由甲基丙烯酸2-羟乙酯,甲基丙烯酸2-羟丙酯,三羟甲基丙烷三甲基丙烯酸酯,安息香甲基醚,Perkadox-16和Triton X-100组成的亲水药筒。将每个植入物包装在装有2 mL无菌1.8%氯化钠溶液的玻璃小瓶中进行水合包装。植入物被灌注以在插入时立即释放药物。
一次性使用的无菌插入工具与植入物一起提供,可用于将植入物放置到上臂内侧的皮下组织中。插入工具装在无菌袋中,并且与植入工具中的植入物分开提供[请参见剂量和用法( 2.2 )] 。
Vantas-临床药理学
12.1行动机制
醋酸组蛋白是促性腺激素释放激素(GnRH)激动剂,以治疗剂量连续给药时,可作为促性腺激素分泌的有效抑制剂。动物和人类研究均表明,在最初的刺激阶段后,长期皮下注射醋酸组氨酸可降低垂体促性腺激素的反应性,进而导致睾丸类固醇生成减少。
在人类中,醋酸组蛋白的施用会导致黄体生成激素(LH)和促卵泡激素(FSH)的循环水平最初增加,导致性腺类固醇(男性中的睾丸激素和二氢睾丸激素)的浓度暂时升高;然而,由于垂体中GnRH受体的可逆下调和垂体促性腺激素的脱敏性,连续给予醋酸组蛋白会导致LH和FSH水平降低。在男性中,睾丸激素降低到去势水平。这些减少发生在开始治疗后的2至4周内。
口服醋酸组胺没有活性。
12.3药代动力学
吸收:在晚期前列腺癌患者(n = 17)中皮下插入一枚Vantas植入物后,中值12小时出现1.10±0.375 ng / mL的峰值血清浓度(平均值±SD)。皮下持续释放是明显的,因为在整个52周的给药过程中血清水平持续存在(见图1)。 52周治疗持续时间结束时的平均血清组蛋白浓度为0.13±0.065 ng / mL。当在52周后插入第二个植入物后测量组蛋白的血清浓度时,第二次植入后8周内观察到的血清浓度与第一次植入后的同期相当。在52周的给药期间内,从41种植入物中皮下药物释放的平均速率经测定残留药物含量为56.7±7.71 mcg /天。与健康男性志愿者的皮下推注剂量相比,具有正常肾脏和肝功能的前列腺癌患者中Vantas植入物的相对生物利用度为92%。在42名前列腺癌患者中,一次,两次或四次50 mg Vantas植入物(50、100或200 mg醋酸组蛋白)的血清组蛋白浓度与剂量成正比。
图1:插入第一和第二个Vantas植入物后17例患者的平均血清组蛋白浓度与时间曲线。 (请注意,在第二次植入后的最初96小时内,只有四名患者接受了密集的药代动力学采样。)

分布:在健康志愿者中皮下推注剂量(500 mcg)后,组蛋白的表观分布量为58.4±7.86L。体外测得的血浆中未结合药物的比例为29.5%±8.9%(平均值±SD)。
代谢:一项使用人肝细胞进行的体外药物代谢研究确定了C端脱烷基导致的单个组蛋白的代谢产物。水解产生的肽片段也可能是代谢产物。在健康志愿者中皮下推注剂量后,组蛋白的表观清除率为179±37.8 mL / min(平均值±SD),终末半衰期为3.92±1.01 hr(平均值±SD)。在17例前列腺癌患者中使用50 mg(作为醋酸组蛋白乙酸)Vantas植入后的表观清除率为174±56.5 mL / min(平均值±SD)。
排泄:未对Vantas植入物进行药物排泄研究。
特殊人群:
老年病学:在关键临床试验中研究的138例患者中,大多数(89.9%)为65岁以上。
儿科: Vantas不适用于儿科患者。 [参见在特定人群中的使用( 8.4 )] 。
种族:比较7位西班牙裔患者,30位黑人患者和77位白种人患者的血清组蛋白浓度,平均组蛋白浓度相似。
肾功能不全:比较42例轻至重度肾功能不全(CLcr:15-60 mL / min)的前列腺癌患者和92例无肾或肝功能不全的前列腺癌患者的平均血清组蛋白水平,这些患者的水平约高50%肾功能不全(0.392 ng / mL对0.264 ng / mL)。这些由于肾功能不全引起的暴露变化被认为与临床无关。因此,对于这些患者亚群,不保证药物剂量的改变。
肝功能不全:尚未充分研究肝功能不全对histrelin药代动力学的影响。
药物相互作用: Vantas未进行基于药代动力学的药物相互作用研究。
非临床毒理学
13.1致癌,诱变,生育力受损
在大鼠中以5、25或150 mcg / kg /天的剂量(以成人表面积65 mcg /天的剂量为基础,使用人体表面积比较,是人类暴露量的22倍)进行了2年的致癌性研究,在小鼠中进行了以20、200或2000 mcg / kg /天的剂量服用18个月(使用人体表面积比较,基于成人65 mcg /天的剂量,人体暴露量可达150倍)。如在其他GnRH激动剂中所见,醋酸组蛋白注射液的注射与激素反应性组织肿瘤的增加有关。大鼠垂体腺瘤明显增加。在治疗的雌性大鼠中,胰岛细胞腺瘤增加,而睾丸间质细胞瘤则与剂量无关(低剂量组中发病率最高)。在小鼠中,所有接受治疗的雌性小鼠的乳腺腺癌均显着增加。此外,高剂量雄性大鼠的胃乳头状瘤增加,而最大剂量的雌性小鼠的胃组织肉瘤增加。
尚未使用乙酸组蛋白进行致突变性研究。在一系列遗传毒性研究中,含或不含组蛋白的植入物的盐提取物均为阴性。在大鼠和猴子中,每天皮下注射醋酸组蛋白6个月,剂量最高为180 mcg / kg /天(最高27倍(大鼠)和54倍),已经进行了检查,以观察醋酸组蛋白的撤离后的生育能力的研究。 [猴子]使用人体表面积比较(基于人类每天65 mcg /天的剂量)进行成人临床暴露)。完全证明了生育抑制的可逆性。未研究过用醋酸组蛋白进行处理的父母的后代的发育和生殖性能。
临床研究
在一项开放标签,多中心,3期研究(研究1)中,用单只Vantas植入物治疗了138例前列腺癌患者,并进行了至少60周的评估。在这些患者中,有37例患有Jewett C期疾病,29例患有D期疾病,其余72例在针对局部疾病进行明确治疗后血清PSA升高或升高。血清睾丸激素水平被评估为主要疗效终点,以评估去势睾丸激素抑制的达到和维持,治疗成功定义为血清睾丸激素水平≤50 ng / dL。在第52周时,研究包括移除和插入新植入物的选项,并进行了另外52周的评估(“扩展期”)。共有120位患者完成了最初的52周治疗期。停药原因为:死亡(n = 6),疾病进展(n = 5),驱逐植入物(n = 3),临终关怀(n = 2)和患者要求/未给出具体原因(n = 2)。在成功完成52周治疗的120例患者中,有111例疗效可评估。总共113例患者接受了第一年植入物的去除和第二年植入物的插入,以进行另一年的治疗。
在17名患者的子集中,在首次植入后的第一周内测量了血清睾丸激素的浓度。在这17名患者中,平均血清睾丸激素浓度从基线时的376.4 ng / dL增加至第2天的530.5 ng / dL,然后在第2周降低至基线以下,并在第4周降低至50 ng / dL去势阈值以下(参见图2)。在整个治疗期间,该子集中的血清睾丸激素浓度保持在去势水平以下。
图2:所有PK患者的平均血清总睾丸激素浓度,n = 17。
(请注意,在该组中,采样是在插入Vantas之后的几分钟开始的。)

在总体治疗组(n = 138)中,基线时的平均血清睾丸激素为388.3 ng / dL。在首次评估睾丸激素时(在第1周结束时),平均血清睾丸激素浓度为382.8 ng / dL。在第2周,平均血清睾丸激素为92.2 ng / dL。在第4周时为15 ng / dL。在第52周时,最终平均睾丸激素浓度为14.3 ng / dL(见图3)。
图3.所有接受一种Vantas植入的患者(n = 138)的平均血清总睾丸激素浓度(+ SD)。 (请注意,在该组中,采样在第1周结束时开始。)

在138位接受植入物的患者中,有一位在第15天驱逐植入物时在第28天之前停药,另外三位在第28天就诊时未进行疗效评估。否则,在第28天,所有134名可评估的患者(100%)的血清睾丸激素被抑制到去势水平以下(≤50 ng / dL)。在第28天时,所有三名在第28天缺失值的患者在下次就诊时(第2天)被去势56)。
一旦达到或低于cast割水平(≤50 ng / dL)的血清睾丸激素浓度,研究中共有4名患者(3%)表现出突破性进展。在一名患者中,在第44周时报告了血清睾丸激素为63 ng / dL。在另一名患者中,在第40周时报告了血清睾丸激素为3340 ng / dL。此异常值可能与实验室检查错误有关。在两名患者中,血清睾丸激素升高至去势水平以上,植入物既无法触诊也无法通过超声观察。在第一位患者中,第8周的血清睾丸激素为669 ng / dL,第12周的血清睾丸激素为311 ng / dL。该患者报告了植入物插入后剧烈运动,并在插入部位形成了大sc。植入物可能已在患者不了解事件的情况下被驱逐。另一位患者在第22周在插入部位出现红斑,并接受口服抗生素治疗。在第26周时,无法触摸到植入物,也无法通过超声观察。在第34周时,血清睾丸激素上升至135 ng / dL。植入物可能已在患者不了解事件的情况下被驱逐。插入了新的植入物。
在完成52周治疗的120位患者中,共有115位患者在第52周进行了血清睾丸激素测定。其中,所有患者的血清睾丸激素≤50 ng / dL。在没有52周值的患者中,28割水平在第28天达到,并一直维持到52周,并且在52周后仍低于the割阈值。
在第52周之前过早停药的所有18名患者中,除一名(在第15天拔出种植体)外,在第28天达到了血清睾丸激素的cast割水平,并一直维持到停药时间,包括停药时间。
总共113例患者在移除第一个植入物后第二年就插入了新的植入物。在该组中,有68位患者在第二个植入物插入后的第2天或第3天和第7天进行了血清睾丸激素测定,以评估“慢性急性”现象。插入新植入物后,该组任何患者均未见血清睾丸激素急剧增加。
监测血清前列腺特异性抗原(PSA)作为第二终点。在开始使用Vantas治疗后,所有患者的血清PSA均较基线下降。 111名可评估患者中有103名在第24周时血清PSA降至正常范围内。
在进行关键性研究之前,对42例晚期前列腺癌患者进行了2期剂量范围研究。通过血清睾丸激素水平作为主要疗效终点评估疗效。患者接受1、2或4个植入物。使用2或4个植入物不会比单一植入物产生更多的抑制睾丸激素的好处。
供应/存储和处理方式
Vantas(NDC 67979-500-01)装在一个纸箱中,该纸箱包含2个内箱,一个用于Vantas植入物,另一个用于Vantas植入套件:
Vantas植入物包含50毫克的乙酸组蛋白。 Vantas植入纸箱包含一个用于冷藏运输的冷藏袋,以及一个装有琥珀色塑料袋的小纸箱。袋内是一个玻璃瓶,该瓶带有特氟隆涂层的塞子和一个铝质密封圈,其中将植入物溶于2 mL无菌的1.8%氯化钠溶液中。 (注意:3.5 mL样品瓶未完全充满盐水。)
收到后,将装有琥珀色塑料袋和玻璃小瓶(内部装有植入物)的小纸箱冷藏直到插入当天。植入瓶要等到插入之前才打开。
将冷藏的植入物在2°C至8°C(36°F至46°F)的温度下保存在未打开的玻璃小瓶中,并用无菌的1.8%氯化钠溶液包装,并包裹在琥珀色的塑料袋和纸箱中,直到提供有效日期为止。允许在25°C(77°F)下进行7天的游览。避光。不要冻结。
只能在室温下存放Vantas植入套件。
Vantas植入套件纸箱包含以下各一种(单独包装在无菌包装中):植入物插入工具,#15一次性手术刀,带18号针头的注射器,25号1.5英寸针头,SS蚊子夹,安息香tin剂,酒精棉签(2个包装),开窗的披巾,无窗的披巾,皮肤消毒棉签,纱布海绵,手术闭合带,可吸收的涂层缝合线,粘性绷带和局部麻醉剂(例如,利多卡因HCl为1%的肾上腺素或盐酸利多卡因为1%) 。
患者咨询信息
“See FDA-approved patient labeling (Patient Information)”
An information leaflet for patients is included with the product and should be given to the patient.
发行人:
远藤制药公司
宾夕法尼亚州马尔文,19355
Vantas ® is a registered trademark of Endo Pharmaceuticals Inc. or one of its affiliates.
©2019 Endo Pharmaceuticals Inc. All rights reserved.
Revised: 11/2019
Vantas ® (Van-tas)
(histrelin acetate) subcutaneous implant
Read the Patient Information that comes with Vantas before it is inserted and each time another Vantas is inserted.可能有新的信息。此信息不能代替您与医生讨论您的健康状况或治疗方法。
What is Vantas?
Vantas is a drug-delivery system that contains the medicine histrelin and is placed under the skin. It looks like a small, thin flexible tube. After it is placed under the skin, Vantas delivers histrelin to your body continuously for 12 months. Vantas may help relieve the symptoms of prostate cancer. Vantas is not a cure for prostate cancer.
Who should not use Vantas?
Do not use Vantas if you:
• are allergic to the medicine histrelin or other medicines called GnRH agonists.
• are a woman. Vantas has not been studied in women and is not for use in women. Vantas can harm the unborn baby in a woman
who is pregnant or may become pregnant. Vantas may cause a pregnant woman to lose her baby (miscarriage) if used while
pregnant.
Before using Vantas, tell your doctor about all the medicines you take, including prescription and non prescription medicines, vitamins and herbal supplements.
It is not known if Vantas and other medicines can affect each other.
How is Vantas used?
• Vantas is placed under the skin of the inside of your upper arm. Your doctor will numb your arm, make a small cut (incision), and then place Vantas under the skin. The cut will be closed with stitches and special surgical tape and covered with a bandage. Keep your arm clean and dry for 24 hours. Do not bathe or swim for 24 hours. Keep the bandage in place for a few days until the cut heals. Avoid heavy lifting and exercise for 7 days. Avoid bumping the site for a few days. Your doctor will give you complete instructions.
• After it is placed under the skin, Vantas will give your body histrelin for 12 months. After 12 months, Vantas must be removed. Your doctor may insert a new Vantas at this time to continue your treatment.
• Your doctor will do blood tests to check on your response to treatment with Vantas. For example, your doctor may check your prostate specific antigen (PSA) or testosterone levels.
What are the possible side effects of Vantas?
Vantas can cause an increase in testosterone during the first week after it is inserted. Your symptoms may get worse during the first few weeks of treatment. You may get new symptoms. Call your doctor right away if you:
- get new or worse bone pain
- get weakness or lose feeling in your legs
- have blood in your urine
- have trouble urinating or cannot urinate
Vantas can cause a loss in bone mineral density. Low bone mineral density can lead to thinning of the bones (oesteoporosis).
The most common side effects of Vantas are:
- 潮热
- 疲倦
- skin reactions at the implant insertion site
- testicles become smaller
- urination problems
- breasts become larger
- erectile dysfunction (impotence)
- 便秘
You may have some pain at the insertion site during and after Vantas is inserted and removed. You may get some bruising and redness at the site. These usually go away without treatment within 2 weeks. Call your doctor if you have unusual bleeding, redness or pain at the insertion site.
These are not all the side effects of Vantas.详情请咨询医生或药剂师。
What else do you need to know about Vantas?
Vantas can be expelled from your body through the original incision site. This occurs infrequently. You may actually notice the system being expelled, or rarely, the system may be expelled without your noticing it. If you believe Vantas has been expelled from your body, call your doctor. Also, remember to see your doctor for routine checks on your condition to ensure that Vantas is present and functioning in your body.
Vantas may be difficult to feel under your skin. If Vantas cannot be felt under your skin at the time for removal, your doctor may order special tests, such as ultrasound or CT scan, in order to locate it for removal.
General information about Vantas
This leaflet summarizes the most important information about Vantas.如果您想了解更多信息,请咨询您的医生。 You can ask your doctor or pharmacist for information about Vantas that is written for health professionals.
发行人:
远藤制药公司
宾夕法尼亚州马尔文,19355
Vantas ® is a registered trademark of Endo Pharmaceuticals Inc. or one of its affiliates.
©2019 Endo Pharmaceuticals Inc. All rights reserved.
修订日期:10/2019
Package Label – Principle Display Panel - Vial Label

Package Label – Principle Display Panel – Vial Carton

| Vantas histrelin acetate implant | |||||||||||||
| |||||||||||||
| |||||||||||||
药物状态
美国日本医生 Heather Benjamin MD经验:11-20年  Heather Benjamin MD经验:11-20年  Heather Miske DO经验:11-20年  Heather Miske DO经验:11-20年  Bert Hepner DO经验:11-20年  渡邊剛经验:21年以上  村上和成 教授经验:21年以上  中山秀章 教授经验:21年以上  村田朗经验:21年以上  溝上裕士 医院教授经验:21年以上 | |||||||||||||